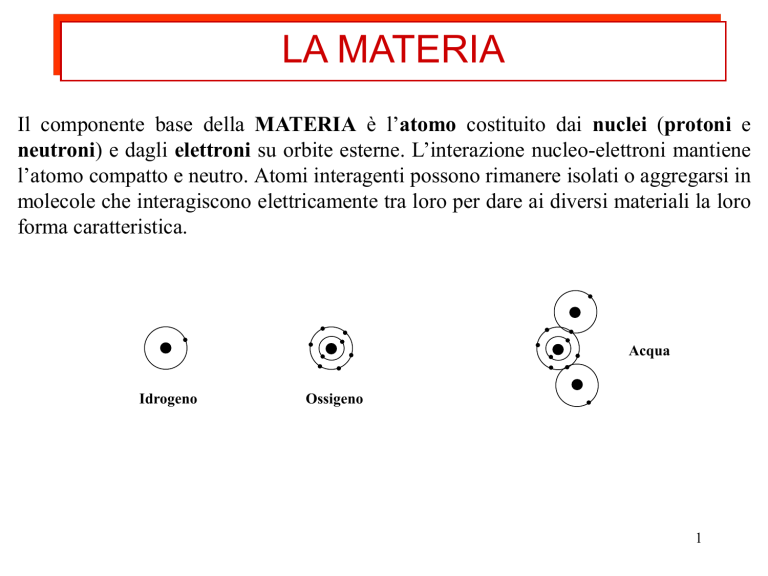
LA MATERIA
Il componente base della MATERIA è l’atomo costituito dai nuclei (protoni e
neutroni) e dagli elettroni su orbite esterne. L’interazione nucleo-elettroni mantiene
l’atomo compatto e neutro. Atomi interagenti possono rimanere isolati o aggregarsi in
molecole che interagiscono elettricamente tra loro per dare ai diversi materiali la loro
forma caratteristica.
Acqua
Idrogeno
Ossigeno
1
STATI DI AGGREGAZIONE
DELLA MATERIA
Solido: Il corpo ha volume e forma ben definiti
Liquido: Il corpo ha volume ben definito, ma assume la
m
r
=
= cost )
forma del recipiente che lo contiene (
V
Gassoso: il corpo occupa tutto lo spazio disponibile
Si dice fluido un corpo allo stato liquido o gassoso
2
STATI DI AGGREGAZIONE
DELLA MATERIA
Disposizione degli atomi in:
(a) un solido cristallino
(b) un liquido
(c) un gas
3
SOLIDI
Reticolo
cristallino
In un materiale solido gli atomi
e le molecole sono distribuiti
nello spazio in modo ordinato e
le forze di interazione si
oppongono
ad
ogni
cambiamento delle distanze
reciproche.
Ogni sollecitazione esterna
determina una deformazione e
forze di richiamo (elastiche)
che tendono a riportare gli
atomi nelle posizioni originali.
4
SFORZI E DEFORMAZIONI
Un solido può essere in equilibrio
statico anche se sottoposto a forze
(che tendono a deformarlo).
F
Lo sforzo è: =
S
S
L
L
F
u.d.m. nel S.I.: N m-2
Se si ha una variazione
lunghezza si può definire
deformazione:
di
la
L
=
L
5
Elasticità Dei Materiali Solidi
S
L
L
F
F
L
= =Y
= Y
S
L
Sforzo
Modulo di Young
Se, quando la
sollecitazione viene tolta
la dimensione del corpo
torna al valore iniziale,
si parla di elasticità
Deformazione
Sforzo= Mod.Young x Deformazione
6
Legge di Hooke
Sforzo
Per deformazioni di
piccola entità esiste una
proporzione diretta e
lineare tra sforzo e
deformazione
F
=
S
Rottura
L
=
L
Deformazione
= Y
Y= Modulo di Young (N/m2)
7
LEGGE DI HOOKE
La deformazione ha un
andamento lineare fino al
punto 1 poi una deformazione
plastica non reversibile fino al
punto 3 che è il punto di rottura
Se la deformazione è prodotta
da una forza crescente e varia
in modo proporzionale alla forza
si dice che il materiale segue la
legge di Hooke
Sforzo
Rottura
F
=
S
2
3
1
L
=
L
Deformazione
= Y
8
TRAZIONE E COMPRESSIONE
Molti materiali non omogenei hanno un comportamento diverso a
secondo che lo sforzo sia applicato in trazione o compressione.
S
l
l
S
l
F
F
l
=Y
S
l
F
l
9
I corpi con Y elevato si deformano meno; quelli con Y basso sono duttili. A
parità di sforzo applicato si deformano meno quelli con Y maggiore.
Il valore di Y è diverso per lo stesso materiale se si tratta di trazione o di
compressione. Es: le ossa hanno un Y=1.8 1010 N/m2 in trazione mentre il
valore si dimezza in compressione, le ossa cioè si deformano elasticamente
deformandosi di più e sopportando carichi più elevati in compressione rispetto
alla trazione.
Le ossa
Sforzo
Trabecole
Carico di
Rottura
Allungamento
Deformazione
Collagene
Compressione
Collagene
Trabecole
allungamento
compressione
Carico di
Rottura
10
FLESSIONE
Compressione
Trazione
Se il corpo è costituito da fibre parallele le superiori sono
sottoposte a compressione le inferiori a trazione, le centrali né
l’una né l’altra. Strati sottoposti a sforzi differenziali.
Un tubo e un cilindro pieno oppongono la stessa resistenza
11
TAGLIO E TORSIONE
F
S
F
F
R
Se la sollecitazione è applicata
tangenzialmente ad una
superficie, si parla di sforzo di
taglio: le superfici interne del
materiale tendono a scorrere le
une sulle altre
In torsione la parte più
vicina all’asse viene meno
sollecitata di quella esterna
L
12
Fratture Ossee
Frattura per compressione (urto)
Frattura per flessione
La contrazione muscolare contrasta
l’eccessiva flessione dell’osso.
La sollecitazione perpendicolare all’asse.
La rottura parte dalla parte in trazione
La contrazione muscolare ha il solo effetto
di mantenere l’osso in linea con il carico
ed evitare la flessione. Si ha per carichi alti e
la frattura è multipla. L’osso esplode
13
frantumandosi.
OSSO
Torsione: la sollecitazione è tangente all’asse.
La parte più vicina all’asse è meno sollecitata
per cui la rottura parte dall’esterno
Si rompe qui
La contrazione muscolare:
1) limita gli spostamenti
laterali e contrasta la
flessione 2) applica una
sollecitazione in
compressione che carica la
parte sollecitata in trazione
per evitare frattura
14
Elasticità delle Strutture Muscolari
MUSCOLO
Il muscolo si allunga
per trazione.
Per valori piccoli dello
sforzo l’allungamento
è lineare. Oltre un
certo sforzo gli
allungamenti crescono
rapidamente e si
arriva alla rottura.
15
Elasticità delle Strutture Muscolari
L’attivazione dello strato muscolare della parete vasale avviene per effetto del
sistema nervoso autonomo (simpatico) che cambia la pendenza della curva
rendendola più ripida inizialmente a maggiore deformabilità (compliance) e si
ripercuote sulla ampiezza del polso pressorio e sulla pressione arteriosa media.
Curva sforzo-deformazione
della parete arteriosa per
l’attivazione
contrattile
dello strato muscolare
interno alla parete vasale
Muscolo attivo
Muscolo passivo
16
VASI
I vasi sono composti da elastina (deformabile) e
collagene (rigido). Globalmente sono come la
gomma, si deforma per piccole sollecitazioni e per
grandi si irrigidisce
Strato endoteliale
Elastina
Strato muscolare
Tunica
Collagene
17
Elasticità delle Strutture Vascolari
Nel caso delle arterie la deformabilità diminuisce con l’età;
la ripetuta dilatazione determina la rottura dell’elastina.
Un fattore che determina la curva è l’attivazione contrattile
del muscolo circostante.
80
età
60
45
30
20
10
18
Sforzo-deformazione per i diversi materiali
=
Trazione
F
S
Vasi
70
40
10 anni
Acciaio
Compressione
Osso
= Y
Y = N2
m
r=Carico di rottura
19
FORZE INTERMOLECOLARI
Forza attrattiva Forza repulsiva
Le forze intermolecolari dipendono dalla reciproca
distanza, dell’ordine di 2 3 10-10 m.
r0 è di equilibrio
r> r0 genera forze
attrattive
r0
r1
r
r< r0 genera forze
repulsive
20
FLUIDI
Hanno forze intermolecolari deboli : le molecole possono muoversi
le une rispetto alle altre.
Si definisce densità del fluido
m
il rapporto tra la massa del fluido e il volume occupato: r =
V
Unità di misura nel S.I.: Kg/m3
Nel caso dei liquidi esistono forze di attrazione (Van Der Waals)
tra le molecole che le mantengono ravvicinate senza creare un
rigida struttura geometrica per cui non hanno una posizione fissa
nello spazio: il liquido ha un volume ben definito ma assume la
forma del recipiente e la densità è costante.
21
Nel caso dei gas le forze intermolecolari sono così deboli da
permettere lo spostamento libero di ogni particella per cui il gas
occupa tutto lo spazio disponibile e la densità non è costante.
Si può dire che le molecole del gas si muovono di moto rettilineo
fra un urto e l’altro.
Mole: è la quantità espressa in grammi di una sostanza uguale al
peso molecolare della sostanza. Es: una mole di O2 è costituita da
32 g di ossigeno.
Unità di misura nel S.I.: mol
In una mole è contenuto un numero di Avogadro di molecole:
NA= 6.02 1023 molecole/mole
22
STATO GASSOSO
Gas perfetto: insieme di molecole libere di muoversi in un
recipiente interagendo elasticamente e soggette
all’agitazione termica.
Si parla di energia cinetica media che è legata alla
temperatura.
I gas reali sono approssimabili a perfetti se rarefatti e a
temperatura ambiente.
23
I LIQUIDI
Le forze elettriche tra le molecole:
1.
Non sono tali da determinare un reticolo cristallino come nei solidi
2.
Sono sufficienti a mantenere le particelle a distanza costante e quindi il volume resta
definito e la densità costante
Se la temperatura del liquido:
1.
viene aumentata sopra un valore di soglia, i legami tra le molecole si spezzano e il
liquido diventa gas
2.
Viene diminuita sotto un limite definito, i legami si rafforzano e il liquido si
solidifica
Le temperature di transizione da una fase all’altra dipendono dal liquido e dalla
pressione esterna.
I tre parametri fondamentali di un liquido che ne definiscono il comportamento sono:
1.
la densità ρ
2.
la tensione superficiale τ
3.
la viscosità η
24
PRESSIONE
Si definisce pressione
il rapporto fra la
componente normale
della forza agente su
una superficie Fn e
l’area A della superficie
sulla quale la forza
agisce:
Fn
p=
A
Fn
F
A
25
UNITÀ DI MISURA DELLA
PRESSIONE
Unità di misura nel S.I.
1N
= 1Pa (Pascal)
2
1m
Unità di misura nel c.g.s.
1dina
= 1baria
2
1cm
5
1N 10 dine
dine
1 Pa = 2 = 4 2 = 10 2 = 10 barie
1m 10 cm
cm
26
PRESSIONE
I fluidi esercitano pressione in tutte le direzioni.
La pressione in un fluido
ad una data profondità è
la
stessa
in
ogni
direzione:
isotropia
della pressione. Quindi si
parla di pressione in un
punto generico P.
27
PRINCIPIO DI PASCAL
La pressione esercitata in un punto di un fluido si
trasmette inalterato in ogni punto di esso.
F2
F1
p1
A1
A2
p2
F1 F2
F2 A2
=
=
A1 A2
F1 A1
Dispositivo per l’amplificazione di forze (pressa idraulica)
28
PRESSIONE IDROSTATICA
La pressione in un punto del liquido in equilibrio è
uguale alla pressione esistente sulla superficie più
quella dovuta al peso della colonna di
liquido
sovrastante.
Forza agente = forza peso = mg
m = r V = rS h
h
S
p=
F mg r S h
=
=
g
S
S
S
p = r g h
29
LEGGE DI STEVINO
Condizioni di equilibrio:
i Fi = 0
1
p2 A = p1 A mg = p1 A rAhg
2
p2 = p1 rgh
m
dove r =
è la densità del fluido
V
30
CONSEGUENZE DELLA
LEGGE DI STEVINO
La pressione esercitata da una colonna di liquido
sulla sua base dipende dalla sua altezza, ma non
dipende dalla sezione.
h
mg rAhg
p=
=
= rhg
A
A
31
CONSEGUENZE DELLA
LEGGE DI STEVINO
PRINCIPIO DEI VASI COMUNICANTI
Poiché la pressione è uguale alla stessa profondità,
il liquido si dispone in recipienti comunicanti, ma di
varia forma, alla stessa altezza.
32
La pressione idrostatica dipende dalla profondità non dalla
forma del recipiente. Per misurare la pressione in una cavità
si può collegare la cavità con un trasduttore esterno
attraverso un tubo. Il trasduttore deve essere alla stessa
altezza della cavità.
Pressione
più bassa
catetere
Pressione più
alta
33
Nello sfigmomanometro a colonnina di mercurio la
pressione idrostatica della colonnina è equilibrata dalla
pressione che si vuole misurare. La corrispondenza fra
l’altezza della colonna di mercurio e la pressione che si
genera alla base dà la pressione
p
h
p1
r=13600 kg/m3 per Hg
La pressione generata da 1 mm di Hg è P= 1.36 104 9.8 10-3 = 133 Pa
Un cm di H2O genera: P= 103 9.8 10-2=98 Pa
34
PRINCIPIO DI ARCHIMEDE
Un corpo immerso in fluido è sottoposto ad una
forza, detta spinta di Archimede Sa:
• diretta verticalmente verso l’alto;
• di intensità uguale al peso del fluido spostato.
Sa
Sa
P=mg
FA=SA=r0Vg
P’=Sa
35
PRINCIPIO DI ARCHIMEDE
FP = m g
h1
m = r V = r S (h2 h1 )
FP = r g (h2 h1 ) S = V r g
h2
S
p1 = r 0 g h1
p2 = r 0 g h2
FA = ( p2 p1 ) S = r 0 g ( h2 h1 ) S = V r 0 g
F1 = p1 S
FA
FP FA = ( r r 0 ) g V
F2 = p2 S
36
PRESSIONE ATMOSFERICA
La pressione esercitata dall’atmosfera su tutti i corpi
immersi in essa è uguale, al livello della superficie
terrestre, alla pressione esercitata da una colonna di Hg
alta 760 mm.
Esperienza di Torricelli
pa = rgh
= 13590 9.8 0.76
100 kPa
37
UNITÀ DI MISURA
DELLA PRESSIONE
1 mmHg = pressione esercitata da una
colonna di mercurio alta 1 mm
1 cmH2O = pressione esercitata da una
colonna di acqua alta 1 cm
1 mmHg = 1.36 cmH2O
1 atm = 760 mmHg
1 atm 1.013 105 Pa = 106 barie
38
UNITÀ DI MISURA
DELLA PRESSIONE
39
PRESSIONE
Due colonne di fluidi diversi
esercitano la stessa
pressione se:
r1 g h1 = r2 g h2
Le altezze sono
inversamente proporzionali
alle densità:
r1 h2
=
r 2 h1
h1
h2
40
MISURATORI DI PRESSIONE
La differenza di pressione
fra due ambienti è
proporzionale al dislivello
nel tubo ad U:
p po = p = rgh
Manometro a tubo
aperto o differenziale
41
LA TENSIONE SUPERFICIALE
= Energia Potenziale per unità di superficie
Pi
Pe
= Lavoro =
area
N m
N
=
m2
m
Le molecole in superficie sentono solo le forze dovute alle molecole
interne. Il liquido è incomprimibile per cui in superficie le molecole si
comportano come se ci fosse una membrana elastica.
42
PRESSIONE E RAGGIO DI CURVATURA
Come dipende la pressione che si esercita sulla calotta sferica dal raggio
della calotta e dalla tensione superficiale
p V = S
4
4
p( ( R R )3 R 3 ) = (4 ( R R ) 2 4R 2 )
3
3
4
p(( R 3 3R 2 R 3R 2 R R 3 ) R 3 ) = 4 (( R 2 2 RR R 2 ) R 2 )
3
3R 2 R 3R 2 R R 3
2 RR R
P
p= pi-pe
p
2
p
3R 2 R 2 RR
3
2
Formula di Laplace
p=
R
R
R
43
R
TENSIONE SUPERFICIALE E ALVEOLI POLMONARI
Nei polmoni lo scambio gassoso
avviene attraverso gli alveoli che sono
collegati ai bronchi e sono rivestiti
internamente da uno strato di liquido.
Per riempire gli alveoli di aria si crea
una depressione intratoracica (Pe) con
il movimento delle costole e del
diaframma, in modo che la pressione
degli alveoli diventi come quella
atmosferica (Pa).
La depressione da generare deve
essere inversamente proporzionale al
raggio degli alveoli:
2
pa pe =
R
44
TENSIONE SUPERFICIALE E ALVEOLI POLMONARI
Ma gli alveoli nel polmone non
hanno tutti uguale grandezza e
quindi non potrebbero avere la
stessa pressione interna ed
esterna, uguale tensione della
parete e diverso raggio. Questo è
possibile grazie al liquido che
ricopre le pareti degli alveoli che
contiene un surfactante (un
sapone) che modifica la tensione.
La
tensione
varia
con
la
dimensione dell’alveolo e fa sì che
alveoli di diverso raggio possano
coesistere con identiche pressioni
interne ed esterne.
45
EMBOLIA GASSOSA
2
R=
p
p
p
p
p1< p
p
p
p=0
Se vengono iniettate bollicine nelle vene e/o arterie queste si
incuneano a livello precapillare e bloccano il circolo. Perchè?
La bolla arriva ad aver la forma di proiettile quando il suo
diametro è superiore al vaso: la pressione interna della bolla è
uguale a quella che genera il moto nel sangue; la deformazione
della superficie anteriore con diminuzione del raggio di curvatura
fa aumentare la pressione interna che diventa maggiore di quella
del sangue e quindi non permette a quest’ultimo di circolare e la
pressione a valle si annulla, per cui il moto di ferma.
46
Legge di Laplace per superfici elastiche
La
Legge di Laplace
mette in relazione la
pressione all’interno di
una cavità a parete
elastica con la tensione ed
i raggi di curvatura
“locali”. In questo caso la
pressione interna non è
dovuta
alla
tensione
elastica del liquido ma
alla deformazione elastica
della
parete
di
contenimento.
pe
pi
R1
R2
1
1
pi pe = ( )
R1 R2
47
Legge di Laplace
Normale
1
1
pi pe = ( )
R1 R2
Atleta
Scompenso
Nel caso del cuore la tensione contrattile τ della parete
determina la pressione interna che deve raggiungere un
valore adeguato (100mmHg). Quando per sport o
malattia il cuore si dilata e quindi R aumenta, per avere
la stessa pressione deve aumentare la tensione
contrattile. Nell’atleta questo si ottiene con
l’ispessimento della parete muscolare, nel caso di
malattia si deve aumentare la forza contrattile delle
singole fibre muscolari peggiorando la situazione da un
punto di vista meccanico e biochimico. (aumento del
consumo di ossigeno)
48
Rottura di un aneurisma
R1
1 = p R1
s
R2
2 = p R2
2 1
Dilatazione aneurismatica delle arterie
In questo caso la pressione endoarteriosa rimane costante e per
compensare l’aumento di diametro legato a traumi o degenerazioni, la
parete vasale subisce un aumento di tensione elastica τ con conseguente
assottigliamento della parete stessa fino alla rottura del vaso.
49
Effetti della Tensione Superficiale - Capillarità
Forze di coesione
La Capillarità è un fenomeno che
si manifesta quando un liquido
viene a contatto con altri materiali:
ad esempio l’umidità che risale i
muri, il comportamento del cotone
idrofilo. L’origine del fenomeno è
la differente forza di attrazione tra
le molecole dei diversi materiali.
Forze di coesione > Forze di adesione
Caso: Hg - Vetro Pulito
Forze di adesione
Forze di adesione > Forze di Coesione
Caso: H2O – Vetro Pulito
50
Innalzamento per capillarità
pa
h
pa
r
2 cos
h=
rgr
Legge di Jurin
51
Innalzamento per capillarità
52
MOTO IN UN LIQUIDO IDEALE
Nei liquidi reali c’è attrito interno, quindi viscosità.
I liquidi ideali sono considerati privi di viscosità e
incomprimibili.
Quindi la densità del liquido ideale è considerata
costante.
53
PORTATA DI UN CONDOTTO
Portata Q: volume di fluido che attraversa una sezione
del condotto nell’unità di tempo
S
V S vt
Q= =
= S v
t
t
Unità di misura nel S.I.
m3/s
54
Se il condotto non è a sezione costante attraverso S1 e
S2 le velocità avranno modulo v1 e v2 e le portate:
Q1 = S1v1
Q2 = S2v2
v2
v1
S1
S2
Se il condotto non è a sezione costante ma la portata è
costante le sezioni attraversate e le velocità sono
55
inversamente proporzionali. (Legge di continuità o di Castelli)
MOTO STAZIONARIO
In un moto stazionario:
• le caratteristiche del moto non dipendono dal tempo;
• la portata è costante in tutte le sezioni del condotto.
S1 v1 = S2 v2
S1
S2
La velocità è inversamente
proporzionale all’area della
sezione del condotto.
56
TEOREMA DI BERNOULLI
Il teorema di Bernoulli si applica ad un fluido ideale (incompressibile
e senza viscosità) in moto stazionario in un condotto a pareti rigide.
b) d)
a) c)
p2
v1
p
1
h1
v2
h2
1 2
1 2
rv1 rgh1 p1 = rv2 rgh2 p2
2
2
57
Su qualunque sezione del condotto:
1
r v2
2
↑
Pressione Cinetica
r gh
↑
Pressione Idrostatica
p
= cos t.
↑
Pressione Idraulica
Se moltiplico per il volume di liquido ottengo:
1
m v2
2
↑
Energia Cinetica
mgh
↑
Energia Potenziale
p V
= cos t.
↑
Energia di Pressione
58
In un t la quantità di liquido tra a) e c) è contenuta in b) e d).
Se v1 e v2 sono le velocità del liquido in a) e b)
rispettivamente, dopo t a) si è spostata di v1t e b) di v2t
e le masse di liquido spostato saranno uguali.
m = rV = rS1v1t = rS2v2t
Spostare il liquido implica lavoro. Ci sono 2 contributi: L1 e L2.
L1 è il contributo dovuto alla gravità per spostare la massa di
liquido da h1 a h2 :
L1 = mg(h1 h2 )
L2 è il lavoro fatto dalle forze legate alle pressioni p1 e p2 gli
spostamenti sono v1 t e v2 t :
L2 = p1S1v1t p2 S2v2 t =
m
r
p1 p2
59
Quindi il lavoro totale L è dato da L1+L2
L = mg h1 h2
m
r
p1 p2
Ma L è dato anche dalla variazione di energia cinetica
della massa di liquido quindi:
1
2
2
mg h1 h2 p1 p2 = m v2 v1
r
2
m
Raggruppando i termini con lo stesso indice si ha:
1 2
1 2
p1 rgh1 rv1 = p2 rgh2 rv2
2
2
60
CONSEGUENZE DEL
TEOREMA DI BERNOULLI (1)
Se il fluido è in quiete, si ricava la legge di Stevino
v1 = v 2 = 0
rgh1 p1 = rgh2 p2
p1 = p2 rg (h2 h1 )
61
CONSEGUENZE DEL
TEOREMA DI BERNOULLI (2)
S1v1 = S2v2
1 2
1 2
rv1 p1 = rv2 p2
2
2
Condotto orizzontale a sezione costante:
S1 = S2 v1 = v2 p1 = p2
Condotto orizzontale a sezione variabile:
S1 S2 v1 v2 p1 p2
S1 S2 v1 v2 p1 p2
62
CONSEGUENZE DEL
TEOREMA DI BERNOULLI (3)
In Fisiologia Cardiovascolare:
Stenosi: restringimento di un vaso sanguigno
Trasduttore U
S
S1 S2 p1 p2
Aorta
P2
S
P1
S1
Ventricolo
63
CONSEGUENZE DEL
TEOREMA DI BERNOULLI (4)
Aneurisma: allargamento di un vaso sanguigno
S1
p1
p2
S2
S1 S2 p1 p2
64
PRESSIONE SANGUIGNA
Si suppone il sangue un liquido ideale. Teorema di Bernoulli
1 2
1 2
1 2
pc rghc rvc = pt rght rvt = p p rgh p rv p
2
2
2
t
c
p
hc = ht = h p
Si suppone che la velocità del sangue sia la stessa:
vc = vt = v p
Allora anche la pressione è la stessa
65
La pressione idrostatica influenza molto il valore
della pressione sanguigna
c
t
ht = 0
h p = 120cm
hc = 50cm
p
pc rghc = pt = p p rgh p
pt = 100 mmHg
pc = 60 mmHg
p p = 185 mmHg
66
LIQUIDO REALE
In un liquido reale le pur limitate forze esistenti tra le
molecole di un liquido determinano una resistenza al
moto ed una dissipazione di energia.
Si introduce così il concetto di viscosità.
67
VISCOSITÀ
Viscosità: attrito interno fra le particelle del fluido che produce
un caratteristico profilo delle velocità (parabolico) in un
condotto. Non servirebbe una forza per mantenere in moto il
liquido perché l’energia cinetica si conserverebbe.
68
COEFFICIENTE DI VISCOSITÀ
Il coefficiente varia con la temperatura e con la
pressione: diminuisce all’aumentare della temperatura,
aumenta con la pressione. Rappresenta la forza di attrito
interno per unità di area e per gradiente unitario di
velocità.
v
S
v
FA = S
r
r+r
r
v+v
69
COEFFICIENTE DI VISCOSITÀ
Unità di misura di nel S.I.
η = kg m1 s1 = Pa s
Unità di misura di nel c.g.s.
η = g cm1 s1 = poise
1Pa s = 10 poise
Acqua a 20 °C: = 1 cpoise
Sangue a 37 °C: = 3 - 5 cpoise
70
MOTO LAMINARE
Non si conserva l’energia cinetica nel moto del liquido
reale per cui per avere un moto costante bisogna
applicare una forza. In un condotto la pressione
diminuisce fra i due estremi
Q
P1
P2
L
r
71
SANGUE
Nel sangue non dipende solo dalla temperatura e
pressione ma anche dalla composizione. Poiché man
mano che scorre perde la sua energia meccanica per
attrito, serve la pompa che fornisca energia.
Il sangue è un liquido non newtoniano (è newtoniano se
vale che è indipendente dalla velocità)
72
I Liquidi (moto laminare caduta di pressione)
Q
P1
P2
L
r
(P1 P2 ) r
Q=
8 L
4
Legge di Hagen- Poiseuille
L’effetto della viscosità si manifesta con moto
laminare e caduta di pressione lungo il condotto
(perdita di carico); il tutto è descritto come
“resistenza idraulica”.
8L
R= 4
r
73
Liquidi (Moto Vorticoso)
r
Quando il condotto che trasporta il liquido ha variazioni della
sezione si avrà cambiamento della velocità media e del proflo di
flusso: nei restringimenti si avrà aumento di velocità e profilo più
appuntito (“ soffi vascolari”)
Re
vc =
r r
vc è la velocità critica, al di sopra della quale
il moto da laminare diventa turbolento, Re è
il numero di Reynolds
74
SEDIMENTAZIONE
4
Fa = r 3 r 0 g Spinta Archimede
3
F
r0
Fa
F = 6r v
v
Forza peso
Forza di Stokes
r
r
4
Fp = r 3 r g
3
Fp
4 3
r g ( r r 0 ) = 6r v
3
2 r 2 g ( r r0 )
Velocità di sedimentazione v =
9
75
CENTRIFUGAZIONE
Per aumentare la velocità di sedimentazione si genera
una forza apparente che si sostituisce alla forza di
gravità e può essere variata a piacere: la forza centrifuga
R
Fc = m 2 R
2 r 2 2 R (r r 0 )
v=
9
76
VES: vel di eritrosedimentazione
2 r g ( r r0 )
v=
9
2
Nel caso di infezioni, nel plasma si formano
composti (fibrinogeno) che alterano la forza
di repulsione elettrica tra gli eritrociti: il
risultato è la formazione di corpuscoli più
grandi, che sedimentano più rapidamente.
77
Le Soluzioni
Si ha una soluzione quando un solido si dissolve all’interno di un liquido.
Se nella dissoluzione le molecole si dividono in ioni si ha una soluzione elettrolitica.
Soluto
Solvente
Soluzione
Concentrazione=Quantità di soluto / Quantità di solvente
Concentrazione Ponderale = massa del soluto / volume soluzione [mg/l]
Concentrazione Molare = moli di soluto / volume soluzione [n/l]
Frazione Molare
= moli di soluto / moli di solvente
[n1 /n2]
In medicina l’indicazione della concentrazione è importante per:
1. verificare il discostamento dal valore normale di una soluzione
(colesterolo HDL nel plasma mg/l )
2. Indicare la quantità di farmaco da iniettare al paziente (vitamina
100mg/ml
78
Le Soluzioni – Diffusione (1)
d
S
C4
C2
C1
C3
C2
Legge di Fick
C1
C C1
M
= k S 2
t
d
La diffusione è il processo di dissoluzione che separa le molecole del soluto e
le distribuisce nel solvente e dipende sia dal solvente che dal soluto con
movimento delle molecole di soluto dalle zone con bassa concentrazione a
79
quelle con alta.
Le Soluzioni – Diffusione (2)
Nella funzione polmonare vale la medesima legge dove l’ossigeno diffonde
nel sangue dall’interno degli alveoli attraverso la parete alveolare: in base
alla legge di Flick lo scambio di ossigeno dipende da:
1. La differenza di concentrazione di ossigeno tra alveolo e sangue
2. La superficie di scambio
3. Lo spessore della parete alveolare
Quindi per ossigenare il sangue si può:
1. Aumentare la concentrazione di ossigeno nell’aria inspirata dal paziente
2. Aumentare la superficie di scambio mantenendo una pressione più alta
all’interno degli alveoli.
80
Le Soluzioni - Diffusione di un gas in un liquido
Pi
C i = k Pi
Legge di Henry
k= indice di solubilità
Le molecole del gas si muovono libere e possono diffondere nel liquido dopo
averlo urtato ma intanto le molecole del gas disciolte posso fuoriuscire e
diffondersi nell’atmosfera gassosa. Il processo si stabilizza quando la
concentrazione del gas nel liquido raggiunge un valore proporzionale alla
pressione del gas nella zona di contatto (pressione parziale).
Anidride carbonica è molto solubile in acqua mentre l’Ossigeno molto poco.
81
Le Soluzioni - Osmosi
Membrana semipermeabile
h
C1
N1 N 2
RT
= rgh =
V1 V2
= (C1 C2 ) RT
C2
r
Osmolalità = i = C i RT
Solvente
Il solvente quindi si muove dal settore con minor concentrazione di soluto a
quello con maggior concentrazione provocando un aumento di livello del
settore a maggior concentrazione. Si ha equilibrio quando la pressione
idrostatica compensa la differenza di pressione generata dal soluto nei due
settori (pensando al soluto come un gas con diversa densità e quindi pressione).
L’osmosi avviene a livello di liquidi intra ed extracellulari e la membrana è
semipermeabile: la pressione osmotica totale dei diversi ioni dentro a fuori deve
82
portare ad un equilibrio senza svuotamento della cellula.
Il Calore e la Temperatura
Temperatura: percezione di “caldo” e di “freddo”.
Termometro: strumento che quantifica (numero) la percezione di caldo e di freddo
L
L = k (T T0 )
( Dilatazione )
___h
h V = k (T T0 ) ( Dilatazione volumetrica )
950K
( Cambio di colore )
450 K
680 K
83
Il Calore e la Temperatura
nRT
P = P0 r g h =
V
P(T)
-273
0
0°C
273
100
°C
373
K
84
T
Calore e Temperatura (Capacità Termica)
Q
T2 T1 =
m cs
m·cs= Capacità termica
Cs=Calore specifico =quantità di calore da cedere alla massa unitaria
di una sostanza per avere aumento di temperatura di un grado.
Caloria = quantità di calore necessario per elevare da 14,5 a 15,5 oC la
temperatura di un grammo di acqua distillata situata a livello del mare
(pressione di 1 atm). (1Cal=4186 Joule)
85
Meccanismi di trasferimento del calore
Conduzione
Q
S (T1 T2 )
=
t
L
T1
Legge di Fourier
S
T
2
L
Uno strato di grasso esterno (alto
spessore e bassa conducibilità termica)
è un ottimo isolante per molti
mammiferi.
Convezione
Q
= k S v (T1 T0 )
t
Formula di Newton
S
T1
v
k = coefficiente di conduttività esterna
T0
86
Meccanismi di trasferimento del calore
Irraggiamento
Q
4
= S T
t
Legge di Stefan
S S
T (K)
σ = cost. di Stefan = 5.67 10-8 W/m2 K4
ε = coefficiente di emissività
87
I GAS
Nel caso di sostanze gassose le forze di coesione interatomica ed
intermolecolare sono estremamente deboli e le particelle, nel loro moto
disordinato tendono ad occupare tutto lo spazio disponibile.
Gas
Per i gas rarefatti vale la “legge di stato”
p V = n R T
T
p
R=8.314472 J K-1 mol-1
n
V
Costante dei gas perfetti
88
Cambiamenti di stato (o di fase)
Liquido
Solido
Gas
T1
T2
T
T2
T1
t
Calore latente: quantità di calore necessaria per il
cambiamento di fase della unità di massa della sostanza (calore
latente di fusione del ghiaccio è 80cal/kg, quello di evaporazione per H20
bollente è 540cal/kg).
89
Teoria Cinetica dei Gas Perfetti (1)
T
p
V
p
V
Lo “Stato” del sistema è univocamente determinato dalla misura
dei valori delle Grandezze Fisiche (G.F.) macroscopiche p, V, T.
Quali relazioni esistono tra le G.F. macroscopiche
del sistema ed il comportamento delle singole
particelle? (Velocità, energia cinetica etc.)
90
Teoria Cinetica dei Gas Perfetti (4)
Temperatura ed energia cinetica delle particelle
1 2
3
( mv ) medio = k B T
2
2
N
T1
T3>T2>T1
T2
T3
kB = 1.38 10-23 J K-1
Energia
Al variare della temperatura l’energia media delle particelle del gas aumenta.
91
Mettiamo una pentola sul fornello…….
T
T
p
tempo
p
tempo
92
Teoria Cinetica dei Gas Perfetti (5)
E la Pressione?
p = rKT
La pressione può essere aumentata sia aumentando la
temperatura (aumentando l’energia media delle
particelle), sia aumentando la densità molecolare del gas.
93
Trasformazioni Termodinamiche
p
V
T
n
P
“Stato” del sistema
pV
T=
nR
pV = nRT
V
Trasformazione Termodinamica
p
B
A
V
94
Trasformazioni Termodinamiche (scambi energetici)
S
F = pS
F
p
dW = F dL = p S dL = p dV
dL
p
B
A
W = pdV
A
B
V
p
•
p=cost
→
B
A
•
p
•
T=cost
•B
Isobara
W = p·ΔV
V
Isoterma
V
W = ΔQ = p·ΔV, ΔE = 0
A
p •
A
•
↓
p
A
V=cost
•B
•
B
Isocora
W = 0, ΔQ = ΔE
V
Adiabatica
ΔQ = 0, ΔE = p·ΔV
95
V
Principi della Termodinamica
E
W
Un sistema termodinamico può scambiare
con l’ambiente calore e lavoro.
Q
1° Principio della termodinamica: Calore, lavoro ed energia interna di un sistema
termodinamico possono essere scambiati purché resti costante l’energia totale.
E=Q-W
2° Principio della Termodinamica: non è possibile costruire una macchina che
trasformi in lavoro tutto il calore prelevato da un corpo senza altri effetti.
96
Cicli termodinamici
E
W
p
Q
V
Ciclo termodinamico: sequenza di trasformazioni termodinamiche che riportano
il sistema allo stato iniziale. Il ciclo è finalizzato alla trasformazione di una parte
del calore scambiato in lavoro.
Rendimento del ciclo termodinamico: rapporto tra il calore ceduto al sistema
ed il lavoro prodotto dal sistema. Il rendimento è sempre minore di uno.
97
Ciclo Termodinamico di Carnot
Q1 T1
E
Q2
p
W
T2
A
Ciclo di CARNOT
T1
W
=
Q1
B
D
T2
C
V
98
L’Entropia (1)
T
p
V
A
p(V)
Sistema
B
Ambiente
V
Q
Sistema
Universo
TS
TA
E
E=Q-W
W
Ambiente
Siamo in grado di prevedere l’evoluzione del fenomeno?
99
L’Entropia (2)
Il secondo principio pone limitazioni alla trasformazione totale di calore in
lavoro, in quanto una parte di calore viene dispersa nell’ambiente con
progressivo aumento della T dell’Ambiente e quindi anche dell’Universo.
L’Entropia é una grandezza di stato di un sistema termodinamico e la sua
variazione può essere quantificata come rapporto tra il calore scambiato e la
temperatura alla quale è stato scambiato.
Q
S =
T
TA
Universo=Sistema+Ambiente
Q
TS
E
Sistema
S A =
Q
;
TA
S S =
Q
TS
SU = S S S A
W
Ambiente
Universo
SU ( Finale ) SU ( Iniziale )
100