Corso di Biologia Applicata
Scienze Infermieristiche
I anno
Dott.ssa Maria De Luca
TESTI CONSIGLIATI
Biologia cellulare e Genetica
Fantoni, Bozzaro, Del Sal, Ferrari, Tripodi
Parte Prima: Biologia Cellulare
Casa editrice: PICCIN
Biologia
Purves, Orians, Heller, Sadava
Casa Editrice: ZANICHELLI
Biomolecole nella cellula
Sostanze presenti nei tessuti viventi
Le cellule sono costruite sulla base delle stesse leggi
chimiche e fisiche operanti nel resto dell’universo.
La chimica della cellula è, in larga misura, la
chimica dei composti del carbonio
C
-valenza 4
-legami covalenti (E>40 kcal/mole)
-Struttura portante di numerose
macromolecole
-Catene lineari, ramificate e strutture ad
anello
Gruppi funzionali
importanti per gli esseri
viventi
I gruppi funzionali
conferiscono specifiche
proprietà alle molecole
Le catene laterali
possono variare e
vengono indicate come R
La chimica della vita è modellata sulle
caratteristiche di questo solvente
elettronegativo
Legame
a idrogeno
Dipolo
elettropositivo
1.L’acqua è una molecola polare e
tende ad associarsi con altre
molecole di acqua
2. I composti che sono solubili in acqua hanno una natura polare. Molecole
idrofiliche (cariche) e idrofobiche (prive di carica)
3. L’acqua è importante per regolare reazioni chimiche della cellula: idrolisi e
condensazione
Idrolisi e condensazione
(sintesi di macromolecole biologiche)
(demolizione di macromolecole biologiche)
Gli zuccheri
Zuccheri o glucidi o carboidrati
-Metabolismo
energia)
cellulare
(sono
-Forniscono scheletri carboniosi
costruzione di strutture biologiche
fonte
di
Gruppi funzionali
per la
-Gli zuccheri semplici, i monosaccaridi,
possono unirsi fra loro formando polimeri ad
alto peso molecolare, i polissacaridi.
-Catena di atomi di carbonio legati a
idrogeno e ossigeno (triosi, tetrosi, pentosi,
esosi ed eptosi)
Gruppo aldeidico
(COH)
gruppi
ossidrilici
steroisomeri
Chiralità: caratteristica dei
polimeri biologici di essere
formati da monomeri dello
stesso tipo ottico
polisaccaridi: D-glucosio
proteine: L-amminoacidi
Gruppo chetonico
(CO)
Gli zuccheri pentosi
catena lineare
conformazione ciclica
conformazione più
stabile, preferita da
monosaccaridi con più
di 4 atomi di carbonio
Gli zuccheri esosi
Monosaccaridi coinvolti nel metabolismo energetico di tutte le cellule (C6H12O6)
Disaccaridi
Polisaccaridi
Polisaccaride con funzione
di riserva energetica
sintetizzato nelle piante
Glicogeno polisaccaride
sintetizzato dagli animali.
Polisaccaridi
I lipidi
Acido grasso saturo: sono presenti
legami semplici della catena idrocarburica
- categoria eterogenea di
composti
- natura idrofobica: sono sostanze
apolari incapaci di formare legami
idrogeno con l’acqua.
- forniscono energia
- sono componenti base di
strutture cellulari
- sono messaggeri chimici
Acido grasso mono-insaturo: sono presenti
legami doppi della catena idrocarburica
I trigliceridi
esteri del glicerolo forniscono energia per le attività cellulari
Glicerolo
Alcol a tre atomi di carbonio
caratterizzata dal gruppo
ossidrilico (OH)
+
Acido grasso
Catena idrocarburica che
reca all’estremità un gruppo
carbossilico (COOH)
I trigliceridi di origine animale contengono più acidi grassi saturi (solidi a RT) di quelli
vegetali (in prevalenza liquidi).
In quelli saturi le catene possono avvicinarsi molto e impacchettarsi
I trigliceridi vengono immagazzinati nel tessuto adiposi e metabolizzati nei mitocondri
dove vengono ossidati ad anidride carbonica ed acqua rilasciando energia.
I fosfolipidi
costituiscono l’impalcatura della membrana cellulare
A differenza dei trigliceridi il terzo
gruppo alcolico è esterificato con una
molecola di acido fosforico a cui si
aggiunge spesso una molecola carica
come serina, colina o etanolammina
Natura duale (polare, non polare) che
in ambiente acquoso risulta nella
formazione di membrane.
I fosfolipidi e le membrane
Fluidità della membrana è
determinata dalla quantità di
acidi grassi saturi e insaturi (più
saturi = meno fluidità)
Gli sfingolipidi
catena idrocarburica
gruppo aminico
Nelle membrane ci sono
anche gli sfingolipidi che
hanno come molecola base
la sfingosina
Glicolipidi: lipidi+glucidi
coda idrofobica
testa idrofilica
gruppo fosfato
La regione contente gli
zuccheri è rivolta verso la
faccia esterna della membrana
Gli steroidi
idrocarburi ciclici derivati dal colesterolo
A temperature basse
aumenta la fluidità mentre
a temperature alte
impedisce che le
membrane diventino
troppo fluide.
Dal colesterolo derivano
anche gli ormoni steroidei
Impalcature base
Acidi nucleici
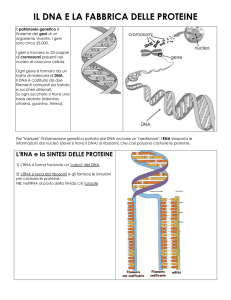
DNA, acido deossiribonucleico, è l’archivio dove è scritta e conservata
l’informazione genetica per la costruzione e il funzionamento delle singole cellule
dell’organismo vivente.
Nelle cellule eucariotiche il DNA risiede nel nucleo e piccoli organelli come mitocondri
e cloroplasti. Nei procarioti forma una struttura, nucleoide, libera nel citoplasma
RNA, acido ribonucleico, controlla il meccanismo di espressione dei geni ed è un
componente essenziale in diversi complessi macromolecolari che partecipano
all’elaborazione dei prodotti dei geni quali ad esempio ribosomi e spliceosomi
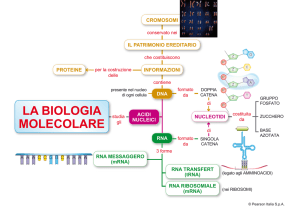
Acidi nucleici
-Gli acidi nucleici (DNA e RNA) sono costituiti da unità monomeriche di nucleotidi.
-I singoli nucleotidi sono uniti fra loro attraverso legami fosfodiestere che si formano tra
lo zucchero di un nucleotide e il fosfato del nucleotide successivo.
-La maggior parte delle molecole di RNA consistono di una sola catena
polinucleotidica;
-L’RNA è composto da ribonucleotidi, il DNA da deossiribonucleotidi;
-Le molecole di DNA sono a doppio filamento, con le due catene polinucleotidiche
tenute assieme da legami idrogeno che si formano tra le basi azotate. I due filamenti di
DNA hanno direzione opposta.
-Il DNA è una molecola puramente informazionale
-L’informazione è codificata nella sequenza delle basi presenti nei suoi filamenti
Gli acidi nucleici
DNA e RNA
Nucleotidi sono formati da:
-una base azotata
-uno zucchero pentoso
-uno o più molecole di acido
fosforico
Nucleotidi
Legame
estere
Legame
glicosidico
Un filamento
polinucleotidico
Un filamento di acido
nucleico è costituito da una
successione di quattro diversi
nucleotidi. Quindi c’è uno
scheletro zucchero-fosfato
costante e una sequenza di
basi variabile che costituisce
l’informazione
Struttura a doppia elica con i
filamenti orientati in modo
antiparallelo
Filamenti complementari
Struttura del DNA
Un gene è un tratto
di DNA in cui è
contenuta
l’informazione per
la sintesi di una
catena peptidica
RNA
DNA = archivio del patrimonio
genetico
RNA = molteplici funzioni e molte
molecole diverse
rRNA = RNA ribosomale (80%
dell’RNA totale)
Struttura a forcina
RNA
ribosomale
RNA transfer
Trasportano gli aminoacidi ai
ribosomi
Sono di piccole dimensioni
Circa 40 diversi
Struttura a trifoglio o ad L
RNA
• tRNA = RNA transfer = RNA di trasporto. Importante per il
trasporto degli amminoacidi durante la traduzione
• mRNA = RNA messaggero
• Piccoli RNA (citoplasmatici, nucleari, nucleolari): fanno parte di
strutture che partecipano a vari processi. Per esempio: particelle
ribonucleoproteiche deputate allo splicing (maturazione degli
RNA messaggeri), telomerasi per allungare l’estremità dei
cromosomi o piccoli RNA che controllano l’espressione genica
(miRNA)
Le proteine
• Tutte le funzioni delle cellule e degli organismi viventi hanno alla
base le proteine
• Molte proteine sono enzimi, cioè catalizzatori (acceleratori) di
reazioni chimiche cellulari
• Proteine strutturali formano il sostegno di cellule e tessuti
• Proteine segnale (ormoni,fattori di crescita, etc.) importanti per
la segnalazione
• Proteine di trasporto (emoglobina, transferrina, lipoproteine)
• Proteine regolatrici
Gli amminoacidi
Gli amminoacidi sono le unità costitutive delle proteine.
Contengono un gruppo amminico e un gruppo carbossilico
Venti tipi di amminoacidi, tra i molti esistenti in natura, vengono
utilizzati dalle cellule
Radicale variabile:
Idrofobico (9)
Polare non ionizzato (6)
Polare ionizzato (5)
Gli amminoacidi
Gli amminoacidi
Gruppo
solfidrilico
Gli amminoacidi
Legame
peptidico
Ponti disolfuro
Struttura delle proteine
• Struttura primaria: sequenza degli amminoacidi che
compongono una proteina
• Il legame peptidico è molto forte
• Nella catena polipeptidica ci sono due estremità: una ammino
(N) terminale e una carbossi (C) terminale
Struttura secondaria
Legami chimici deboli:
-Idrofobici
-elettrostatici (legami idrogeno)
Fasci paralleli
Struttura a spirale
La struttura secondaria di una
proteina è influenzata dalla natura
polare o idrofobica e dall’ingombro
sterico degli aminoacidi
Struttura terziaria
• La struttura terziaria è la configurazione
nello spazio di una catena peptidica
ripiegata
• La struttura terziaria è unica per ogni
sequenza amminoacidica (pur
contenendo elementi comuni) e
determina la funzione specifica di una
determinata proteina
Struttura terziaria
- Legami chimici deboli (versatilità)
- Legami covalenti, ponti di solfuro
(stabilizzano la struttura)
Struttura terziaria
La maggior parte delle proteine includono nelle loro strutture
terziarie sia elementi ad -elica che a -foglietti, ma esistono
anche proteine con solo elementi -elica o solo -foglietti.
Domini: molte proteine
contengono regioni con
conformazione molto simile.
Conform. simile=funzione simile
Struttura quaternaria
• Alcune proteine cellulari funzionano come complessi costituiti da
aggregazioni di più catene polipeptidiche, uguali o diverse. In questo
caso si parla di struttura quaternaria
• Minimo 2 catene polipetidiche ma possono essercene anche alcune
decine
• Ciascuna catena viene sintetizzata a partire da un gene specifico,
assume la propria struttura secondaria e terziaria prima di aggregarsi
con le altre nella struttura quaternaria.
L’impiego di più catene polipeptidiche permette di cumulare più funzioni
coordinate in una stessa proteina(es.RNA-polimerasi), o anche di ottenere
prestazioni nuove difficilmente raggiungibili con proteine monomeriche
(es. Emoglobina)
Struttura quaternaria
la struttura quaternaria
favorisce un graduale
rifornimento e rilascio
di ossigeno
Tre modi di rappresentare il lisozima
La denaturazione di una proteina consiste nella perdita
della struttura e dell’attività biologica
Le chaperonine (o chaperon molecolari) proteggono le proteine da
interazioni inappropriate e assistono il processo spontaneo di
ripiegamento delle proteine.
Reazioni chimiche, energia,
enzimi
una cellula ha bisogno continuo di energia per lo svolgimento
delle sue funzioni. Questa energia deve essere estratta
dall’ambiente circostante e può essere conservata
temporaneamente sotto forma di legami chimici
Reazioni esoergoniche ed
endoergoniche
L’insieme delle reazione
necessarie a produrre energia o
per la costruzione di nuove
molecole è definito
L’ATP come sorgente principale di energia
libera per la cellula
La cellula necessita di energia per regolare le
reazioni necessarie al suo funzionamento,
quali:
- produzione di lavoro meccanico
- trasporto attivo di ioni e molecole attraverso
la membrana plasmatica
-sintesi di molecole e macromolecole da
precursori semplici
legame fosfoanidridico
ossidazione sostanze nutrienti
intrappolano l’energia della luce
L’idrolisi dei legami fosfoanidridici
rilascia una grande quantità di
energia libera
I due prodotti ADP e AMP
possono essere riconvertiti in
ATP per mezzo dei processi
catabolici deputati all’estrazione
di energia
ATP:
trasportatore
universale di energia libera,
ha un contenuto di energia
maggiore di quello dell’ADP
e dell’AMP. L’idrolisi dell’ATP
libera questo eccesso di
energia.
- L’ unità trifosfato dell’ATP
ha 4 cariche negative che
tendono a respingersi
-l’ATP è meno stabile di ADP
e fosfato inorganico
I processi cellulari esoergonici liberano l’energia necessaria per
produrre ATP da ADP.
Accoppiamento
dell’idrolisi dell’ATP
a una reazione
endoergonica.
Reazioni chimiche
L’energia di attivazione dà inizio alle
reazioni chimiche. In una reazione
chimica lo stato iniziale stabile deve
divenire meno stabile prima che sia
possibile la trasformazione.
Enzima e substrato: proteina con attività catalitica contenente uno o più siti
in grado di legare un substrato
Gli enzimi
abbassano la
barriera
energetica
della reazione
catalizzata