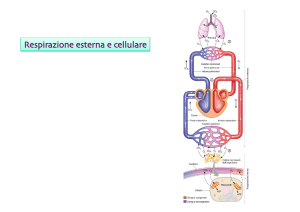
LA FISICA DELLA RESPIRAZIONE
Il FLUIDO.
LA POMPA.
IL CIRCUITO.
GLI SCAMBI RESPIRATORI.
LA FISICA DELLA RESPIRAZIONE
IL FLUIDO:
In questo caso il fluido che ci interessa è
un GAS, o meglio una MISCELA DI GAS.
Studieremo pertanto i gas più semplici
(GAS PERFETTI) e il modo con cui si
miscelano.
Vedremo poi le caratteristiche dalla
POMPA respiratoria, le caratteristiche
fisiologiche e patologiche dei volumi
respiratori e del CIRCUITO lungo cui
circola l’aria espirata.
Infine ci occuperemo degli SCAMBI
GASSOSI a livello degli alveoli polmonari
e nel circolo, e dei meccanismi di
TRASPORTO dei gas nel sangue.
RICHIAMI SUL GAS PERFETTO:
(molecole puntiformi e
non interagenti:con
buona approssimazione
TUTTI I GAS RAREFATTI!)
Studi sperimentali :
1) relazione PRESSIONE-VOLUME a temperatura ambiente
( T fissata):
rubinetto
Volume di aria Vo
Pressione atmosferica Po
Versando altro
mercurio (per
un’altezza h)
la nuova pressione
sarà P1=dgh +Po
E si osserverà una leggera risalita
del mercurio nel secondo braccio,
con relativa riduzione del volume
d’aria da Vo a V1.
Ripetendo più volte l’esperimento si vede che:
p
P V = cost
P1
Po
(legge di Boyle)
V1
Vo
V
Al variare della temperatura la legge resta valida, ma i valori numerici
si modificano: la ‘costante’ dipende dalla temperatura.
Se anziché tenere fissa la temperatura si tiene fissa la PRESSIONE,
lavorando ad esempio alla pressione atmosferica, è possibile studiare
la relazione tra volume e temperatura:
Righello graduato
termometro
Goccia di mercurio che separa
l’aria dall’ambiente
Palloncino in vetro riempito
d’aria
Leggendo lo spostamento della goccia sul righello graduato
si stima il volume V corrispondente alle diverse temperature t.
Detto Vo il volume misurato a to= °C, si ricava la legge:
V = Vo ( 1 + a t)
(prima legge di Guy-Lussac)
NB: 1) a risulta esser la stessa per TUTTI i gas, purchè sufficientemenet diluiti da essere ‘perfetti’:
a = 1/237.15 °C-1
2) Rappresentando su un grafico la legge:
V
-1/a
0
t (°C)
Alla temperatura t = -1/ a = -273.15 C il volume ‘sparisce’!
Ciò descrive sicuramente una situazione non-fisica.
Studiamo infine una trasformazione isocora:
t
p
La relazione tra pressione e temperatura risulta espressa dalla legge:
P= Po ( 1 + a t)
(seconda legge di Guy-Lussac)
dove ancora Po è la pressione corrispondente a t=0 °C,
a è la costante comune a tutti i gas e alla temperatura
t = - 1/ a la pressione ‘scompare’.
L’insieme di queste leggi permette di pervenire alla equazione
di sato dei gas perfetti.
Siano A (Po, Vo, to) e B (P, V, t) due configurazioni
del gas:
A-I:
P
V(I)= Vo( 1 + a t)
I
A
B
I-B:
V
P V = P(I) V(I) =
PoVo (1+ a t)
Con qualche manipolazione algebrica:
P V = Po Vo ( t + 273.15) /273.15
osservando ora che:
1) Vo si può esprimere come il prodotto nel numero n di moi del
gas e del volume vo occupato da una mole di gas a t=0 e p= 1atm
( vo = 22.4 l),
2) si può introdurre una nuova scala termometrica, detta di Kelvin,
per cui:
T (°K) = t(°C) + 273.15
(detta temperatura assoluta in quanto T=0 °K non è raggiungibile)
La quantità Po vo /273.15 = R = 8.31 J /mol °K viene definita
come costante universale dei gas, e l’equazione di stato viene
scritta nella forma:
PV=nRT
Questa legge vale naturalmente nell’approssimazione di ‘gas perfetto’,
e non può descrivere i cambiamenti di stato di un gas reale pressurizzato: per fare questo occorre considerare una relazione più complicata (legge di Van der Waals).
Diamo i numeri….
Una bombola di ossigeno alla pressione di 5 atm contiene
10 l di gas.
Quale sarà il volume disponibile per il paziente?
P V = P’ V’
V’ = P V / P’ = 5 atm 10 l / 1 atm = 50 l
MISCUGLI DI GAS e GAS IN SOLUZIONE NEI LIQUIDI
In caso di miscugli di gas, per valutare la
pressione totale p occorre considerare le diverse
componenti. Ammettiamo di avere ni moli del gas iesimo, con i=1,..N. La pressione totale del gas del
miscuglio sarà data dalla somma delle pressioni
parziali pi:
pi = ni R T / V.
Naturalmente, essendo V, R e T
gas del miscuglio:
uguali per tutti i
p i / p = ni / n
Se nel miscuglio gassoso è contenuto un vapore
saturo, alla somma delle pressioni parziali va
aggiunta quella del vapore saturo.
Diamo i numeri…...
ESEMPIO
L'aria secca è costituita da un miscuglio di O2
( 20% ) e N2 ( 80% ). Calcolare le pressioni
parziali. Fare lo stesso calcolo nel caso di aria
con unmidità relativa del 100% alla temperatura di
24 °C ( pressione di vapore = 22.4 mmHg ).
aria secca:
essendo p=760 mmHg
PO2 = 760 x 0.2 = 152 mmHg
PN2 = 760 x 0.8 = 608 mmHg
aria umida:
i conti vanno rifatti con
p= 760-22.4=737.6 mmHg
I gas sono solubili in un liquido in misura
diversa al variare della temperatura e della
pressione. La legge di Henry stabilisce che la
quantità di gas che si scioglie in un liquido è
proporzionale alla pressione parziale di quel gas
nello spazio sovrastante la superficie libera del
liquido. Tale legge viene comunemente espressa in
due forme diverse:
in termini di volume di gas i-esimo in condizioni
NTP ( 0 °C, 1 atm ) che si scioglie in 100 cm
cubi di liquido:
Vi = si pi
dove si è detto coefficiente di solubilità;
oppure in termini di concentrazione molare del gas
nel liquido:
Ci = ci pi
dove ci è la costante di solubilità.
Normalmente la quantità di gas che si discioglie nel sangue è insufficiente per garantirne l’ossigenazione, a meno che si respiri
ossigeno puro a pressione di parecchie atmosfere, raggiungendo
una pressione parziale di diverse migliaia di mmHg.
Benchè l’ossigeno a tali pressioni sia irritante e possa avvelenare
i sistemi enzimatici, l’OSSIGENO IPERBARICO viene talvolta
usato per periodi brevi nel trattamento dell’anossia, dell’avvelenamento da monossido di carbonio e per facilitare la chirurgia
cradiaca specie nei bambini.
LA POMPA E IL
CIRCUITO
L’aria penetra nel ns
apparato respiratorio
grazie alla contrazione
dei muscoli inspiratori.
L’espirazione è un
fenomeno passivo.
Nella respirazione si
compie lavoro contro le
resistenze viscose al
passaggio dell’aria
(AFCD)
e
contro le resistenze
elastiche della gabbia
toracica e del polmone
(AECF).
Il lavoro complessivo si
calcola come area nel
piano V-p (fare…)
Il Volume Corrente è di circa 500 ml, ma può essere forzato
fino ad un massimo, che corrisponde alla Capacità Vitale.
Diamo i numeri…
calcolare il numero di molecole di O2 introdotte nei polmoni in
un respiro del volume di 500 cm3. Si assuma che l’O2 nell’aria
sia ridotto dal 20% al 16% quando misurato in bocca.
n(aria)= p V / RT = 1 atm 0.5 l /0.082 atm l/°K 293 °K = 0.02
N = NA n(aria) 0.16 = 6 1023 0.02 0.16 = 2 1021
Dei 500 ml di aria inspirata, circa 350 giungono agli
ALVEOLI, che si possono raffigurare come un insieme
di ‘bolle’ che un sottile epitelio separa dai capillari
polmonari. La meccanica alveolare può essere descritta
dalla legge di Laplace:
Dp= 2 t/r
durante l’inspirazione r aumenta ma durante
l’espirazione, quando diminuisce il raggio, Dp aumenta e
pertanto il sistema alveolare tende al collasso.
.
Il collasso è evitato dalla corrispondente diminuzione di t
:
in espansione t vale 40 dyne/cm,
in implosione vale 4-8 dyne/cm
La diminuzione di t durante l’espirazione è dovuta al
surfactant (dipalmitoil-lecitina), la cui azione dipende
dalla concentrazione per unità di superficie.
La malattia delle membrane ialine nei neonati prematuri è
dovuta all’insufficiente formazione del surfactant.
RESPIRATORI ARTIFICIALI:
CAMERE RESPIRATORIE: contenitore a tenuta stagna in cui
viene posto il paziente (tranne il capo). La regolazione della
pressione nella camera induce l’abbassamento e l’innalzamento
ritmico simile ai movimenti respiratori, mengtre la pressione
nei polmoni rimane quella atmosferica.
RESPIRATORI A PRESSIONE POSITIVA: una pompa a
pressione positiva insuffla i polmoni immettendo periodicamente
aria (VPPI). L’espirazione avviene o permettendo la retrazione
passiva del pomone e della parete toracica oppure incorporando
nella pompa una fase a pressione negativa in modo che l’aria
espirata venga risucchiata fuori.
UN CASO LIMITE DI POMPA RESPIRATORIA VPPI E’
LA RESPIRAZIONE BOCCA A BOCCA.
Il ruolo giocato dalla pressione è importante anche in alcuni
contesti particolari.
Ad es, se ci si immerge in acqua a 10 m di profondità, la pressione
agente sul corpo vale 2 atm, e i gas nei polmoni vengono compressi
a metà del loro volume (ragione per cui prima dell’immersione si
iperventila…).
Diventa altresì impossibile respirare aria dalla superficie tramite un
tubo, a causa della pressione esercitata sul torace e sull’addome:
necessità di respiratori ad aria compressa.
Nell’autorespiratore l’aria arriva alla bocca alla pressione ambiente,
in modo da mantenere il normale gradiente di pressione tra polmoni
e l’esterno della parete toracica. Man mano che si scende si riduce la
percentuale di ossigeno (è sufficiente per mantenere la pressione parziale) e si sostituisce l’He all’ N perché meno tossico ad alte pressioni.
GLI SCAMBI
RESPIRATORI
GLI SCAMBI
Immaginiamo di separare un dato volume di gas
perfetto in due parti uguali con una parete ideale:
se le caratteristiche del gas sono uguali dalle due
parti, ci aspettiamo che ci sia un passaggio di
molecole da sin a dx e viceversa, e che in media
il numero di particelle che attraversa la parete
in un senso sia uguale a quello delle molecole
che passano in senso inverso: il flusso totale
netto è pari a 0.
La ragione per cui ciò avviene è semplice: le
molecole che passano da dx a sin in un certo tempo
saranno tutte quelle la cui velocità ha direzione e
grandezza sufficienti per attraversare la parete.
Considerando quelle nel verso opposto, poichè la
distribuzione è identica (ed isotropa) non c'è
ragione per cui il loro numero debba cambiare.
Se vogliamo avere un flusso netto occorre che
cambi qualcosa tra i due settori. Se , in
particolare, cambia la concentrazione delle
molecole:
c =
N / V
ecco che cambierà N dalle due parti:
necessariamente dovrà modificarsi
il valore delle
velocità delle molecole, e quindi la frazione di
particelle che ha velocità opportune per
attraversare il setto.
Ne discende che ci sarà un flusso netto dalla
parte in cui la concentrazione è maggiore a quella
in cui è minore fino a che non verrà ristabilito
l'equilibrio.
Questa osservazione sperimentale va sotto il nome
di Legge di Fick: il flusso J di particelle
attraverso un sezione ( definito
come numero di particelle per unità di superficie
per unità di tempo ) è proporzionale alla
differenza di concentrazione c a cavallo della
sezione:
J = -D grad c
D è detto coefficiente di diffusione libera.
Un altro modo per variare il flusso netto
attraverso la sezione consiste nel modificare la
pressione del gas dalle due parti, essendo infatti
la pressione p legata alla concentrazione c dalla
legge
c = p / R T
Diamo i numeri…..
Calcolare il numero di moli di glicerina che attraversano in un
s una membrana di acqua spessa 7.5 10-9 m e di area 102 cm2
quando la differenza di concentrazione è 10-1 micromoli/l.
Il coefficiente di diffusione vale 7.2 10-6 cm2 s-1.
J = n /t S = D dc/dx
n = D dc t S / dx =
(7.2 10-6 cm2 s-1 10-7moli/103 cm31 s 102 cm2) / 7.5 10-7cm =
0.96 10-7 moli
Le concentrazioni sono comunemente espresse in g/cm 3
, ma nelle applicazioni chimiche e biologiche si
utilizzano talvolta altre unità:
molalità = n. moli di soluto / kg di solvente
molarità = n. moli di soluto / l di soluzione
n.
frazione
moli di
molare = n. moli di soluto /
soluzione
SCAMBI GASSOSI NEGLI ALVEOLI E NEI TESSUTI
I processi di scambio che avvengono negli alveoli
si fondano sui fenomeni di filtrazione, basati
sulla diversa pressione parziale dei gas.
L'aria respirata viene umidificata e , giunta
negli alveoli, ha una composizione pari a:
CO2 = 5.6 % di aria secca
O2 = 14%
"
"
"
N2 = 80.4 %
"
"
tenendo presente che a 37 °C la pressione parziale
del vapor acqueo è di 47 mmHg.
ESEMPIO
Calcola le pressioni parziali dei vari gas in
condizioni di pressione normale ( 1 atm ). Esegui
lo stesso calcolo per un uomo che si trova in
cime al Monte Bianco ( p = 410 mmHg ).
Se ora consideriamo il sangue venoso che affluisce
ai capillari polmonari dobbiamo tenere presente i
seguenti fatti:
-O2 e CO2 non si trovano semplicemente disciolti
nel sangue, ma vengono trasportati in combinazione
con l'emoglobina e la carbossiemoglobina ,
- il livello di saturazione di questi 'veicoli'
dipende dalla pressione parziale dei gas secondo
curve caratteristiche, che tendono a mantenere
elevata la concentrazione di O2 anche in condizioni
sfavorevoli.
Misurando la percentuale di saturazione si è visto
che i valori ipici sono dell'ordine di :
p O2 = 40 mmHg
p CO2 = 46 mmHg
p N2 = 573 mmHg
Questo spiega come mai a livello alveolare il
sangue acquista O2 e perde CO2.
Analogamente si giustifica lo scambio a livello
tissutale, essendo:
liquido interstiziale:
capillari
p O2
p CO2
100
40
mmHg
"
30
50
L'azoto non svolge alcun ruolo negli scambi, ma
quando la sua pressone parziale è molto elevata e
viene abbassata di colpo può dare luogo ad embolie
gassose.
SCAMBI RESPIRATORI IN SITUAZIONI ‘ANOMALE’
Consideriamo un subacqueo immerso a 10 m di profondità,
dunque soggetto ad una pressione doppia.
Si noti che in queste condizioni le pressioni parziali dei gas respiratori
nei polmoni raddoppiano, dunque durante l’immersione l’ossigenazione del sangue è facilitata, mentre l’aumento della pressione
parziale di CO2 nei polmoni rispetto a quella nel sangue venoso
determinerà un passaggio inverso (ipercapnia, che può essere ridotta
al minimo iperventilando prima dell’immersione, cioè riducendo la
Pco2 nei polmoni).
Durante la risalita, specie se rapida, la pressione parziale dell’ossigeno
nei polmino decresce bruscamente, e si può avere diffusione dal sangue
ai polmoni, con conseguente anossia acuta e perdita di coscienza.
RUOLO DELL’AZOTO NELLA DECOMPRESSIONE
L’azoto, pur non essendo un gas respiratorio, gioca un ruolo
importante quando si passa da una elevata pressione alla
pressione atmosferica (es: subacqueo in risalita, cassoni,
camere iperbariche,..).
Se la decompressione è troppo rapida, l’azoto disciolto si
libera dalla soluzione e forma bolle che si localizzano nelle
articolazioni, midollo spinale,ecc con gravi esiti neurologici.
Occorre allora ‘ricomprimere’ e fare avvenire la decompressione
più lentamente.
I PROCESSI OSMOTICI
Quando si prendono in considerazione membrane
permeabili, ossia che permettono al soluto,
concentrato in misura diversa dalle due parti del
setto, di passare da parte a parte, si considerano
processi di diffusione. Esistono però in natura
delle membrane dette semipermeabili, che
consentono cioè il passaggio del solvente ma non
del soluto.
L'evoluzione verso una condizione di egual
concentrazione avviene in questo caso con un
movimento netto del soluto, che si muove verso le
regioni di maggior concentrazione per 'diluire' la
soluzione. Questo aumento di volume del
compartimento più concentrato, che determina un
innalzamento dh, fa sì che aumenti la pressione
idrostatica della quantità
=
d g dh.
Poichè questa è l'unica manifestazione misurabile
del fenomeno è invalso l'uso di parlare di
'pressione osmotica', e di misurarla in mmHg.
Poichè la pressione osmotica è proporzionale alla
concentrazione, e alla temperatura, vale una legge
analoga a quella dei gas perfetti ( legge di
van't Hoff ):
V = d n R T
dove d è il coefficiente di dissociazione
elettrolitica che vale 1 in assenza di ioni e 2
per ioni completamente dissociati.
La pressione osmotica viene talvolta misurata
anche in termini di osmolarità : una soluzione è
osmolare quando esercita una pressione osmotica
uguale a quella di una soluzione di una mole di
non-elettrolita disciolta in un litro d'acqua a T =
0 °C.
1 osmole = 22.4 atm
Così come una pressione responsabile di una
espansione compie lavoro, anche concentrare una
soluzione, ossia impedire la diluizione dovuta
all'osmosi, richiede energia: definito il lavoro
osmotico
dL =
dV
ed usando la legge di Van't Hof, si osserva che
il lavoro richiesto per ridurre una soluzione dal
volume V1 al volume V2 è pari a:
dL = d n R T ln (V1/V2)
Trattandosi di forze conservative, si può definire
un potenziale, detto potenziale chimico, in termini
del quale l'equilibrio equivale alla situazione
isopotenziale.
Per evitare fenomeni di emolisi i liquidi
introdotti nel torrente circolatorio devono essere
isotonici rispetto al plasma, ossia possedere la
medesima pressione osmotica.
Prepara le dosi per un litro di soluzione
fisiologica (ossia isotonica rispetto al plasma:
=0.31 osmolare) utilizzando separatamente le
seguenti sostanze:
SOSTANZA
PESO MOLECOLARE
d
NaCl
58.5 g
1.86
HCl
36.6
1.9
Na2SO4
142
2.22
Glucosio
180
1
Saccarosio
342
1
Esprimi le dosi in g/l.
Risolviamo ad es il primo caso:
c= / dRT = 0.31/1.86 mol/l;
m/V=PMc=58.5 0.167 = 9.75 g/l
Diamo i numeri…...
Calcolare il volume di ossigeno trasportato dall’emoglobina in
un’ora, considerando che al massimo della saturazione 1 g di Hb
contiene 1.34 ml di ossigeno , che normalmente il sangue
contiene 15 g di Hb ogni 100 ml e che ai tessuti giungono circa
200 l di sangue ossigenato all’ora.
V = 200 l 15 g/ 10-1 l 1.34 10-3 l = 40.2 l
2) La linfa contiene circa l’ 1% in peso di saccarosio (C12H22O11).
Se la temperatura è di 25 °C, calcolare di quanto risale la linfa
negli alberi a primavera.
PM = 12x12 + 22x1 + 11 x 16 = 342 uma
m/M=n PM/d V = 10-2 ---> n/V=10-2 d/PM
PO= n/V R T = d g h
dunque h = 10-2 d R T /(PM d g) = (10-2 8.31 298)/ (342 10-3 10)=
7.2 m