I recettori a sette
domini transmembrana
Alcuni argomenti trattati sono disponibili in formato
PowerPoint al seguente indirizzo web:
www.unipv.it/tslmra22
Forme di Signaling Cellulare
(A) ENDOCRINO
cellula endocrina
(B) PARACRINO
recettore
cellula
segnalatrice
ormone
cellule
bersaglio
mediatore
locale
Flusso sanguigno
cellula bersaglio
(C) NEUROCRINO
(D) CONTATTO-DIPENDENTE
sinapsi
neurone
cellula
segnalatrice
cellula
bersaglio
assone
corpo
cellulare
neurotrasmetttore
cellula
bersaglio
messaggero
legato alla
membrana
(A) Gli ormoni prodotti dalle ghiandole endocrine sono secreti nel flusso sanguigno e
possono essere distribuiti all’intero organismo. (B) I messaggeri paracrini sono rilasciati
dalle cellule nel mezzo extracellulare e possono diffondere e agire localmente. (C) I
segnali nervosi sono trasmessi lungo gli assoni a cellule bersaglio remote. (D) Il signaling
contatto-dipendente richiede che le cellule siano a contatto l’una con l’altra membrana
contro membrana. Le differenze cruciali tra le varie modalità riguardano la velocità e la
selettività con cui I segnali sono trasmessi alle cellule bersaglio.
Trasduzione del Segnale da Recettori di Superfice
fattore di
crescita
ormone
recettore accoppiato
a proteina G
via
dell’AMPc
via
dell’IP3
recettore
tirosin
chinasi
via del PI
3-kinasi
citochina
recettore per le
citochine
via delle
MAP kinasi
via del
JAK-STAT
Signalling mediante recettori
accoppiati a proteine G
recettore
G proteina
i q s t
effettore
canale
enzima
messaggero
intracellulare
Ca2+ cAMP
Regioni Idrofobiche e idrofiliche dei lipidi di membrana
Lipide di membrana
Idrofobico
Glicerofosfolipide
Diacilglicerolo
Alcool fosforilato
Sfingomielina
Ceramide
Fosforilcolina
Glicosfingolipide
Ceramide
Residui glucidici
Colesterolo
Anelli idrocarburici
Gruppo OH di C3
Glicerofosfolipide
Glicosfingolipide
Colesterolo
+
Idrofilico
=
Anfipatico
Lipidi di Membrana
semplice organizzazione di molecole anfipatiche
idrofilico
idrofobico
Lipidi di Membrana
Sezione di un bilayer di glicerofosfolipidi
Tutte le membrane biologiche sono bilayers lipidici
Le proteine conferiscono proprietà uniche a
ciascun tipo di membrana
Proteine Acilate e Prenilate
Acido palmitico
acido grasso legato mediante legame estere
a una Cys; aggiunto in fase post-traslazionale
Esempi: recettore per l’insulina
recettore beta-adrenergico
rodopsina
Acido miristico
acido grasso legato mediante legame amidico
a una Gly; aggiunto in fase co-traslazionale
Esempio: subunutà a di proteina G (membrana plasmatica)
Isoprenoide (farnesil;geranilgeranil)
Isoprenoide legato mediante
legame tioetere a una Cys vicina
all’estremità C-terminale; aggiunto
in fase post-traslazionale
Esempio: subunutà g di proteina G (membrana plasmatica)
Recettori accoppiati a proteine G (GPCR)
siti di glicosilazione
(legame tramite Asn)
extracell.
citosol
ancoraggio lipidico
siti di fosforilazione
I Recettori Accoppiati a Proteine G (GPCR) rappresentano una
famiglia di > 1000 membri strutturalmente correlati. Queste proteine
sono anche chiamate Recettori a 7 Domini Transmembrana.
Recettori Accoppiati a Proteine G
1. Hanno tutti 7 domini transmembrana
(ad es. rodopsina)
2. Ci sono circa 1000 GPCRs nel genoma.
(di molti di essi non si conosce ancora il ligando)
3. I singoli recettori rispondono a:
un neurotrasmettitore come la serotonina o la dopamina,
una piccola proteina (8-40 amminoacidi, un “peptide”) come le endorfine
uno stimolo olfattorio
la luce, nell’occhio
Struttura Generale dei Recettori a 7 DT
siti di glicosilazione
(legame tramite Asn)
extracell.
ancoraggio lipidico
dominio transmembrana
citosol
siti di fosforilazione
Caratteristiche generali dei GPCRs comprendono: domini
transmembrana ad a-elica, ancoraggio ai lipidi che ne stabilizza
la conformazione, siti di fosforilazione citosolici che ne regolano
l’attività, e siti di glicosilazione extracellulare che permettono
l’interazione con molecole extracellulari e altre cellule.
La Rodopsina è stato il primo membro della famiglia
dei recettori a 7 DT ad avere la sua struttura determinata
mediante cristallografia ai raggi-x
Rodopsina
PDB 1F88
Varie proteine interagiscono
con I GPCR o Recettori a 7-DT
per modularne l’attività
Gli effetti di queste interazioni includono alterata
affinità per il ligando, dimerizzazione del recettore
che può aumentarne o alterarne l’attività, alterata
localizzazione del recettore, ecc.
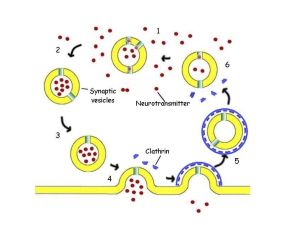
RUOLO DELLA b-ARRESTINA NELLA REGOLAZIONE
DEI RECETTORI ACCOPPIATI A G-PROTEINE
legame del
messaggero
fosforilazione
del recettore
interazione
con b-ARR
associazione con
CLATRINA
Formaazione
della vescicola
endocitosi
1.
Dopo un certo tempo che si è stabilito il legame dell’agonista al GPCR, una kinasi (GRK) fosforila
alcuni residui aminoacidici intracellulari del recettore;
2.
La fosforilazione porta a un disaccoppiamento del GPCR dalla G proteina (desensitizzazione) e
al reclutamento della b-arrestina;
3.
La b-arrestina a sua volta recluta molecole di clatrina;
4.
Le molecole di clatrina favoriscono la formazione di una cavità da cui originerà la vescicola
5.
La successiva endocitosi della vescicola provocherà l’internalizzazione del recettore.
Le Proprietà dell’Internalizzazione
definiscono due classi di GPCRs.
Nel caso dei recettori di classe A (b2Adre), l’interazione b-arrestina–GPCR
è transitoria, e la b-arrestina non si
localizza con i GPCR negli endosomi.
Per i recettori di classe B (Vaso2),
l’interazione b-arrestina–GPCR è più
stabile, e recettore e b–arrestina colocalizzano negli endosomi.
Recettore di
classe A
Recettore di
classe B
vasopr
adren
Traffico Cellulare della barr2-GFP con i
Recettori b2AR (adre) e V2R (vasopr)
Cellule HEK-293
Co-transfettate con un plasmide
contenente il cDNA per barr2-GFP e il cDNA
per ciscun recettore
Per visualizzare la barr2-GFP fluorescente
in cellule prima e dopo il trattamento con
agonista (10M Isoproterenol, 100nM AVP)
Assenza di agonista, la barr2-GFP era
omogeneamente distribuita nel
citoplasma delle cellule che esprimevano
b2AR o V2R. (0 min)
Aggiunta di agonista, viene promossa
la rapida redistribuzione dal citosol alla
membrana plasmatica. (2 min)
Una esposizione piu prolungata all’
agonista produceva una marcata
differenza nel traffico della barr2-GFP
(15 min):
b2AR : rimaneva nella membrana
plasmatica (A)
V2R : nell’arco di 2-3 min, finisce
nellevescicole endocitotiche (B)
adren
vasopr
Cellule HEK-293
Co-transfettate con barr2-GFP e ciascun recettore
Pre-marcate con rodamina-conj. Anticorpo
che marca I recettori
trattate per 15 min a 37C con l’agonista (10M
Isoproterenol, 100nM AVP)
visualizzazione al confocale del recettore (rosso) e
della barr2-GFP (verde) nelle stesse cellule.
Colocalizzazione (giallo) del recettore con la barr2-GFP
Colocalizzazione della
barr2-GFP con i Recettori
b2AR e V2R internalizzati
I recettori b2AR e V2R
reclutano barrestin con un
meccanismo comune durante le
fasi iniziali, ma poi c’è
divergenza. Il complesso
barrestin- b2AR si dissocia a
livello della membrana.
barrestin-V2AR viene
intenalizzato in vescicole
endocitotiche.
V2R : estesa colocalizzazione
b2AR : nessuna colocalizzazione
Recettori accoppiati a proteine G
Il neurotrasmettitore o
l’ormone si lega al recettore
Quanto veloce?
da 100 ms a 10 s
Quanto lontano?
probabilmente <1 m
Attiva una
G proteina
Effettore:
enzima o canale
esterno
interno
b g
a
a
GDP + Pi
Risposta
GTP
b g