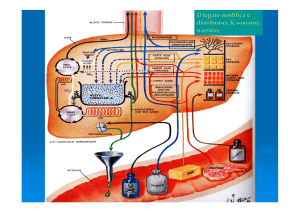
Fegato
• ghiandola esocrina
produce bile
• a secrezione interna
riversa nel torrente
circolatorio i prodotti del suo metabolismo
• regola la concentrazione dei costituenti plasmatici
• vi confluiscono i substrati nutrizionali elementari
assorbiti dall’intestino, o prodotti dal catabolismo
dei tessuti (glucosio, aminoacidi, acidi grassi)
Fegato
- adegua l’attività enzimatica alle variazione dei
substrati (flessibilità metabolica)
-elimina le sostanze non escrete dal rene
-trasforma le scorie metaboliche che i tessuti
producono
nuovi combustibili metabolici
composti destinati all’escrezione
- ha un ruolo fondamentale nel processo di
assorbimento degli acidi grassi a lunga catena
(secrezione biliare)
Principali funzioni
del fegato
(a) Deposito di
glicogeno che può
essere usato come
sorgente di
glucosio
plasmatico
(b) Controllo
dell’assorbimento
del glucosio
(c) Sintesi di acidi
grassi come forme
di deposito di
calorie in eccesso
(d) Metabolismo di
acidi grassi a
chetoni
(e) Deposito e
metabolismo di
vitamine
(f) Sintesi di proteine
plasmatiche
(g) Detossificazione
chimica di tossine
chimiche prodotte
endogenamente e
somministrate
esogenamente e
filtrazione
meccanica di
batteri
(h) Mantenimento del
normale equilibrio
idrosalino
(i) Secrezione della
bile
RUOLO METABOLICO DELLE
ULTRASTRUTTURE DELL’EPATOCITA
ACIDI BILIARI
glicina
taurina
Gli acidi glicocolico e taurocolico derivano dalla
coniugazione dell’acido colico rispettivamente con
glicina e taurina (analogamente per gli acidi
glicochenodesossicolico e taurochenodesossicolico).
Metabolismo dei sali biliari
colesterolo
ac. colico
ac. desossicolico
ac. chenodesossicolico
ac. litocolico
ac. solfolitocolico
ac. biliari primari
ac. chetolitocolico
ac. biliari secondari
ac.ursodesossicolico
ac. biliari terziari
COLESTEROLO
~50% del colesterolo è sintetizzato dal fegato
(l’altro ~50% dall’intestino)
Il 95% del colesterolo è presente nella bile in
forma non esterificata ed è mantenuto in
soluzione da micelle contenenti acidi biliari, e
lecitina.
METABOLISMO GLUCIDICO
L’attività glucostatica è la principale funzione del
fegato nel metabolismo glucidico
L’omeostasi glucidica si esplica con:
- immagazzinamento del glicogeno
- rilascio del glucoso dal glicogeno
- utilizzazione del glucoso (glicolisi, shunt esosomonofosfato)
- sintesi di glucoso (gluconeogenesi)
- conversione dei glucidi in acidi grassi
I monosaccaridi: (glucosio, fruttosio, mannosio, galattosio)
provenienti dal catabolismo intestinale dei
carboidrati giungono al fegato dove vengono fosforilati e
convertiti in glucosio ad opera di specifiche isomerasi.
La membrana cellulare epatica è permeabile al glucosio:
[glucosio]epatocita = [glucosio]plasmatica
il suo trasporto nell’epatocita è indipendente dall’insulina
viene fosforilato a glucosio 6-fosfato (G6-P)
dalla glucocinasi
(enzima stimolato dall’insulina)
Il G6-P non attraversa la membrana plasmatica
L’eccesso di glucosio epatico viene immaganazzinato come
glicogeno attraverso la via della glicogenosintesi
Entrata nella glicolisi di altri esosi
Questa via è prevalente ed è insulina-indipendente
Sia la galattocinasi che la fruttocinasi sono
presenti in quantità ridotta nel fegato fetale e
aumentano dopo la nascita
FRUTTOSIO
GALATTOSIO
MANNOSIO
Il mannosio è il prodotto di digestione
dei polisaccaridi e glicoproteine
Chimicamente è l’epimero in C2 del glucosio
Glicogeno
1/3
2/3
fegato (10 % del peso)
muscolo
Il glicogeno è un polimero di D-glucosio
con legami 1-4, ramificato con legami 1-6
ogni 10 unità di glucosio.
Nel muscolo e nel fegato ci sono diverse forme di glicogeno
MUSCOLO b particelle
particelle sferiche che contengono fino a
60.000 residui di glucoso
FEGATO a particelle
organelli cellulari:
Glicosomi
aggregati a rosetta di b particelle
contenenti anche una parte proteica
(pool enzimatico della glicogenosintesi,
della glicogenolisi e di regolazione)
GLICOGENO
Immagazzinare glucosio in forma polimerizzata
riduce lo stress osmotico cellulare
che si avrebbe con elevate concentrazioni di glucosio
Nella cellula epatica:
[glicogeno] = 10 nM
[glucosio] = 0.4 M
Glicogenosintesi
UDP-glucosio è il donatore di glucosio nella biosintesi di
glicogeno (legame 1-4)
La reazione è catalizzata dalla glicogeno sintetasi
e necessita di uno stampo di glicogeno preformato
Le ramificazioni 1-6 sono catalizzate dall’enzima
ramificante che lega porzioni della catena lineare a 1-4
con legami a 1-6 ogni ~ 10 unità di glucosio
FOSFOGLUCOMUTASI
UDP-glucosio pirofosforilasi
GLICOGENO SINTETASI
ENZIMA RAMIFICANTE
glicogeno sintetasi
attiva: non fosforilata
inattiva: fosforilata
glicogeno fosforilasi
attiva: fosforilata
inattiva: non fosforilata
La stimolazione ormonale di AMPc determina la
contemporanea attivazione della glicogenolisi e inattivazione
della glicogenosintesi
Il glicogeno epatico può essere sintetizzato anche
da composti intermedi della glicolisi:
acido piruvico
acido lattico (prodotto dal muscolo)
Il muscolo è incapace di utilizzare il lattato per
l’elevato rapporto NADH/NAD+
Ciclo di Cori
Il glicogeno epatico è sintetizzato anche da:
lipidi e fosfolipidi a partire dal glicerolo
proteine per deaminazione di aminoacidi
vie secondarie che diventano importanti in
condizioni di basso apporto di carboidrati
Glicogenolisi
La glucoso 6 -fosfatasi non è presente nel muscolo scheletrico
La fosforilasi epatica è ATP-indipendente
glicogenolisi
85%
glucosio -1P
15%
glucosio
GLICOGENO FOSFORILASI
ENZIMA DERAMIFICANTE
L’attivazione della fosforilasi b è sotto il
controllo ormonale.
Una riduzione della glicemia stimola le cellule a
di Langerhans del pancreas a secernere glucagone
La fosforilasi cinasi muscolare si differenzia da quella epatica
perché è stimolata da epinefrina
Nell’epatocita la fosforilasi a inibisce la glicogenosintesi
(inibendo la glicogeno sintetasi fosfatasi)
la isoforma muscolare no
CONTROLLO ORMONALE DEL METABOLISMO DEL GLICOGENO
GLICOGENOSI
Glycogen Storage Disease
Tipo
Enzima
Clinica
Glicogenosi
epatiche
Ia
glucoso-6-fosfatasi
Ib
glucoso-6-fosfato
translocasi
III
deramificante
IV
ramificante
cirrosi (frequente)
VI & IX
fosforilasi epatica &
fosforilasi cinasi
lieve ipoglicemia
glicogenosi
muscolari
II
a-glicosidasi lisosomiale
V
fosforilasi muscolare
VII
fosfofruttocinasi
grave ipoglicemia
“
(~10% di Ia)
cirrosi (rara)
Shunt dell’esosomonofosfato
(pentoso fosfato)
Via alternativa alla glicolisi del catabolismo di G6-P
Circa la metà del glucosio mobilizzato nel fegato
entra nella via del pentoso fosfato
via metabolica importante per il fegato
(tessuto adiposo, ghiandola mammaria, oligodendrociti,
corteccia surrenale, eritrociti)
ovvero
nei tessuti in grado di effettuare sintesi riduttive
Nel muscolo è assente
Funzioni della via del pentoso fosfato
principale
produzione di NADPH
potere riducente per le biosintesi di
acidi grassi e steroidi
produrre pentosi tra cui D-riboso
utilizzato per la sintesi di nucleotidi
degradazione ossidativa dei pentosi in
esosi che entrano nella glicolisi
3 G6-P + 6 NADP+ +3 H2O
2 F6-P + GA 3-P + 3 CO2 + 6 (NADPH +H+)
6 G6-P + 12 NADP+ +6 H2O
6 Ribuloso5-P + 6 CO2 + 12 (NADPH + H+)
transaldolasi,
transchetolasi,
gluconeogenesi
5 G6-P + Pi
5 G6-P + 6 CO2 + 12 (NADPH + H+) + Pi
G6-P + 12 NADP+ + 6 H2O
6 CO2 + 12 (NADPH + H+) + Pi
Relazione tra la glicolisi e la via del pentoso fosfato
l’eccesso di R5P viene convertito in intermedi glicolitici
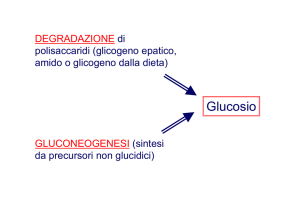
Gluconeogenesi
La gluconeogenesi è il processo di sintesi di glucosio a partire da
precursori non glucidici
Il cervello consuma 120 g
di glucosio al giorno
~ 300 g di glucidi
70 g sono presenti nel fegato
digiuno di 24 ore
deplezione quasi totale
delle riserve epatiche di glicogeno
Precursori glucogenetici
- Lattato e Piruvato
- Intermedi del ciclo di Krebs
- Gli scheletri carboniosi degli aminoacidi
(dopo deaminazione)
- Acidi grassi a catena dispari
ossalacetato
lisina e leucina sono gli unici aminoacidi
che non possono essere convertiti in ossalacetato
perché il loro catabolismo porta ad acetil-CoA
e negli animali non esiste una via metabolica:
Acetil-CoA
ossalacetato
Ciclo dell’acido citrico
Via del gliossilato
Alternate regulation of glycolysis involving PEP‐dependent PGAM1
phosphorylation. A proposed model for the glycolytic pathway from 3PG to
pyruvate that includes PEP‐dependent phosphorylation of PGAM1 is shown. PEP
donates its phosphate to PGAM1 resulting in pyruvate production and priming of
H11 on PGAM1.
Da piruvato a fosfoenolpiruvato
La conversione del piruvato in ossalacetato è la “strategia”
per aggirare l’ostacolo energetico della conversione del
piruvato in fosfoenolpiruvato termodinamicamente
svavorevole
trasporto del PEP e dell’ossalacetato
dal mitocondrio al citosol
Nel fegato l’attività della fosfofruttocinasi e
della fruttoso 1,6-bifosfatasi sono controllate dal
fruttoso 2,6 difosfato
METABOLISMO LIPIDICO
- digestione e assorbimento intestinale dei lipidi (secrezione
biliare)
- sintesi, trasformazione, demolizione, interconversione (di
trigliceridi e fosfolipidi)
Al fegato arrivano i lipidi assorbiti dall’intestino
(veicolati come chilomicroni), e quelli provenienti
dalle varie sedi di deposito come acidi grassi liberi, o
legati all’albumina o come complessi lipoproteici
BIOSINTESI DEGLI ACIDI GRASSI
nel fegato (diversamente dal tessuto adiposo) la
sorgente di carbonio per la sintesi degli acidi grassi
è il fruttosio e il lattato
lattico deidrogenasi
Acido Lattico
Acido Piruvico
piruvato deidrogenasi
Acido Piruvico
Acetil-CoA
Acetil-CoA
precursore principale
Il complesso enzimatico della bosintesi è nel citosol
La piruvato deidrogenasi è nel mitocondrio
Acetil-CoA è impermeabile alla membrana mitocondriale
piruvato deidrogenasi
Ac. Piruvico
Acetil-CoA
citrato sintetasi
Acetil-CoA
Ac. ossalacetico
Acido citrico
CITOSOL
citrato liasi
Acido citrico
Ac. Ossalacetico + Acetil-CoA
malico deidrogenasi
Ac. Ossalacetico
Ac. Malico
enzima malico
Ac. Malico
Ac. Piruvico
MITOCONDRIO
FORMAZIONE DEI CORPI CHETONICI
Il fegato sintetizza continuamente corpi chetonici
(ne è il principale produttore), che riversati in circolo
sono ulteriormente degradati e utilizzati dai vari
tessuti come substrati energetici alternativi al glucoso
Muscolo, rene, cuore, cervello, testicoli hanno
sistemi enzimatici in grado di utilizzare i corpi
chetonici per il loro metabolismo energetico.
METABOLISMO PROTEICO
Il fegato è il principale organo demolitore di aminoacidi
Ad eccezione della lisina e treonina tutti gli aa
vengono trans-aminati: trasferimento di un
gruppo aminico ad un chetoacido
I gruppi aminici degli aminoacidi entrano nel
mitocondrio prevalentemente come
acido glutammico
L’acido a-chetoglutarico
(il chetoacido corrispondente)
raccoglie anche gli ioni ammonio presenti nel
citoplasma svolgendo una funzione omeostatica
del glutammato
L’acido glutammico penetra nei mitocondri
cede l’NH2 all’ossalacetato con formazione
di aspartato (oppure essere deaminato)
Il processo è catalizzato da una transaminasi mitocondriale
GOT
CICLO DELL’UREA
Fegato
Reazioni di detossificazione
rimozione di sostanze endogene
ed esogene
processi di idrossilazione, ossidazione,
riduzione, e coniugazione
attenuazione tossicità, e aumentata
idrosolubilità
facilitata eliminazione con la bile e l’urina
Idrossilazioni
avvengono nel reticolo endoplasmatico
liscio
agente riducente: NADPH
citocromo P450
MECCANISMO:
P450 riduce O2
substrato
idrossilato
H20
SISTEMA ENZIMATICO
IDROSSILAZIONE
il substrato idrossilato può essere:
- eliminato come tale
- coniugato con acido glutammico o con SO4=
- sostituzione dell’ossidrile con glutatione
composti idrossilati
- alifatici
- aromatici
-contenenti zolfo
ESEMPI
-barbiturici
-anfetamine
-eroina
ormoni steroidei
OSSIDAZIONI
ossidoreduttasi pirimidiniche
localizzate nel citosol e mitocondri
alcool deidrogenasi
O
CH3CH2-OH
CH3C-H
etanolo
acetaldeide
aldeide deidrogenasi
O
O
R-C-H
R-C-OH
R = H, CH3
aldeide ossidasi
Metallo flavo-proteina (Fe, Mo, FAD)
Altri esempi di ossidazioni epatiche:
benzilamina
acido benzoico
deaminazione di amine primarie e secondarie
danno ossidativo
Prodotto intermedio del sistema ossigenasi-citocromo P450
O2 + 1
e-
H+
+
.
HO
H+
2
+O .
2
superossido
Per dismutazione o per opera della superossido dismutasi
O2 . + O2 . + 2H+
O2
O . + O . + 2H+
.O
O .+H O
.
+ OH + OH
2
2
2
2
2
+
2
O2
+
H2O2
H2O2
radicale idrossile
nei perossisomi epatici gli e- provenienti dalla
b-ossidazione degli acidi grassi sono trasferiti all’O2 con
formazione di H2O2, diversamente da quanto avviene nei
mitocondri, dove sono trasferiti alla catena respiratoria.
Eliminazione H2O2
- CATALASI
2H2O2
2H2O + O2
- GLUTATIONE PEROSSIDASI
2 GSH +H2O2
2 GSH +ROOH
GS-SG +2H2O
GS-SG + ROH +2H2O
Riduzioni
- gruppi NO2
NH2
- nitrobenzene
para-aminofenolo
ENZIMI EPATICI AD ATTIVITA’ RIDUTTASICA
NADPH-citocromo P450
Aldeide reduttasi (NADPH dipendenti)
Chetone reduttasi (NADPH dipendenti)
O
R-C-X
R-C-OH
X = H, CH3
Coniugazioni
acidi aromatici
con glicina
es:benzoico, salicilico
il gruppo NH2 della glicina reagisce con il COOH
formando amidi
fenoli
con H2SO4 (solfatazione) es:ormoni steroidei
con CH3 (metilazione) (S-adenilmetionina)
es: acido nicotinico, adrenalina, noradrenalina
con acido glucuronico (glucuronazione)
amine con acetili (acetilazione) (acetilCoA)
alcooli, acidi carbossilici
con acido glucuronico (glucuronazione)
es:ormoni steroidei
METABOLISMO
CH3CH2OH
80% dell’etanolo è metabolizzato dal
fegato
(2mmoli/g tessuto/min)
eliminato con le urine e l’aria espirata
3 enzimi citoplasmatici presenti nell’epatocita
catalizzano l’ossidazione ad acetaldeide:
-ALCOOL DEIDROGENASI
-CATALASI
-ALCOOL IDROSSILASI
ALCOOL DEIDROGENASI
quantitativamente è l’enzima principale
dimero (10 diversi isoenzimi) p.m. = 85 000
CH3CH2OH + NAD+
NADH + H+ + CH3CHO
essendo termodinamicamente sfavorita
l’ossidazione dell’etanolo è facilitata da:
- basse concentrazioni citopalsmatiche di NADH + H+
- una rapida rimozione di acetaldeide
CATALASI
Interviene quando [CH3CH2OH] > 20 mM
CH3CH2OH + H2O2
CH3CHO + 2H2O
svolge la duplice funzione di ossidazione
dell’etanolo e riduzione del perossido
l’acetaldeide formatasi può rigenerare H2O2
tramite l’azione dell’aldeide deidrogenasi
CH3CHO + H2O + O2
CH3COOH + H2O2
ALCOOL IDROSSILASI
Km > alcool deidrogenasi
CH3CH2OH + NADPH + H+ + O2
CH3CHO +NADP+ + 2H2O
assunzioni moderate di etanolo
alcool deidrogenasi metabolizza 100% etanolo
per elevati livelli di alcolemia
intervengono la catalasi e l’acool idrossilasi
L’ossidazione dell’etanolo ad acetaldeide
(termodinamicamente sfavorevole) è
facilitata dalla rimozione del prodotto di
reazione (legge d’azione di massa)
La rimozione avviene per ossidazione
dell’acetaldeide ad acido acetico per
mezzo dell’acetaldeide deidrogenasi
Il prodotto finale del metabolismo dell’etanolo è
l’acetato che in parte viene utilizzato dal CoA, e
in parte rilasciato nella circolazione venosa (1-2
mM), e da qui agli organi periferici dove è
metabolizzato
Principali alterazioni metaboliche
indotte dall’etanolo
•
NADH/NAD+
potenziale redox
citosolico epatociti più riducente
•
sintesi acidi grassi, trigliceridi,
chetogenesi, colesterologenesi
Rallentamento della
carbossilazione del piruvato e
della gluconeogenesi
•
•
•
lattato/piruvato
diminuita escrezione acido
urico (iperuricemia)
[AMP] epatico
velocità formazione e liberazione CO2
con riduzione del quoziente respiratorio
(inibizione ciclo di Krebs, ossidazione acidi grassi)