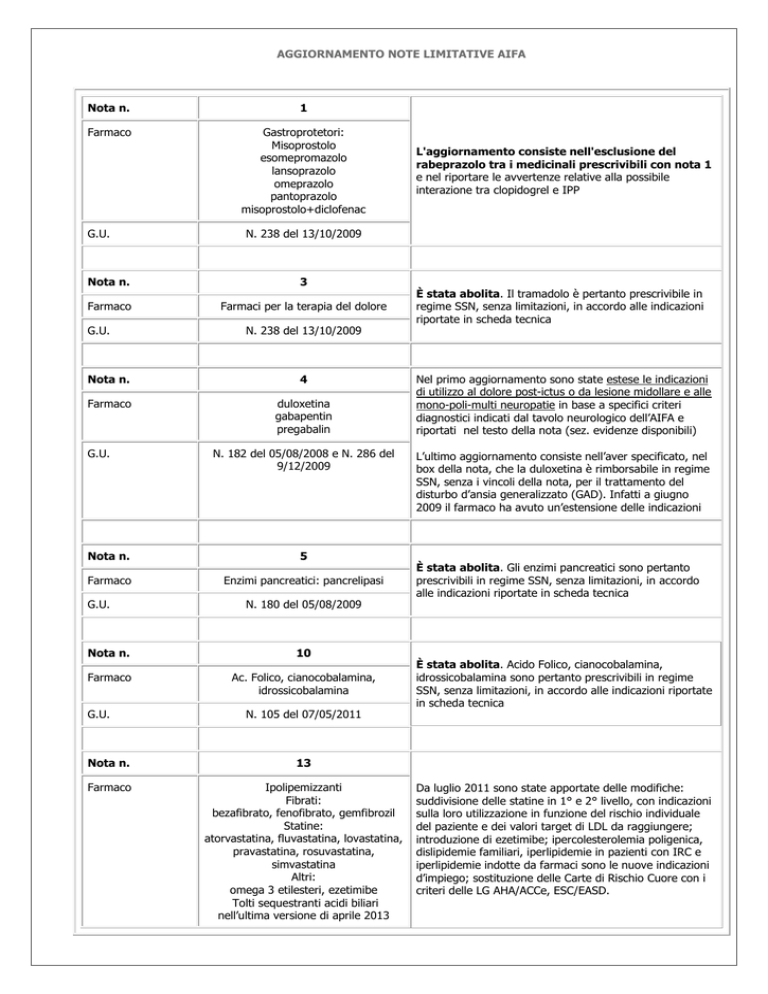
AGGIORNAMENTO NOTE LIMITATIVE AIFA
Nota n.
1
Farmaco
Gastroprotetori:
Misoprostolo
esomepromazolo
lansoprazolo
omeprazolo
pantoprazolo
misoprostolo+diclofenac
G.U.
N. 238 del 13/10/2009
Nota n.
3
Farmaco
Farmaci per la terapia del dolore
G.U.
N. 238 del 13/10/2009
Nota n.
4
Farmaco
duloxetina
gabapentin
pregabalin
G.U.
N. 182 del 05/08/2008 e N. 286 del
9/12/2009
Nota n.
5
Farmaco
Enzimi pancreatici: pancrelipasi
G.U.
N. 180 del 05/08/2009
Nota n.
10
Farmaco
Ac. Folico, cianocobalamina,
idrossicobalamina
G.U.
L'aggiornamento consiste nell'esclusione del
rabeprazolo tra i medicinali prescrivibili con nota 1
e nel riportare le avvertenze relative alla possibile
interazione tra clopidogrel e IPP
N. 105 del 07/05/2011
Nota n.
13
Farmaco
Ipolipemizzanti
Fibrati:
bezafibrato, fenofibrato, gemfibrozil
Statine:
atorvastatina, fluvastatina, lovastatina,
pravastatina, rosuvastatina,
simvastatina
Altri:
omega 3 etilesteri, ezetimibe
Tolti sequestranti acidi biliari
nell’ultima versione di aprile 2013
È stata abolita. Il tramadolo è pertanto prescrivibile in
regime SSN, senza limitazioni, in accordo alle indicazioni
riportate in scheda tecnica
Nel primo aggiornamento sono state estese le indicazioni
di utilizzo al dolore post-ictus o da lesione midollare e alle
mono-poli-multi neuropatie in base a specifici criteri
diagnostici indicati dal tavolo neurologico dell’AIFA e
riportati nel testo della nota (sez. evidenze disponibili)
L’ultimo aggiornamento consiste nell’aver specificato, nel
box della nota, che la duloxetina è rimborsabile in regime
SSN, senza i vincoli della nota, per il trattamento del
disturbo d’ansia generalizzato (GAD). Infatti a giugno
2009 il farmaco ha avuto un’estensione delle indicazioni
È stata abolita. Gli enzimi pancreatici sono pertanto
prescrivibili in regime SSN, senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
È stata abolita. Acido Folico, cianocobalamina,
idrossicobalamina sono pertanto prescrivibili in regime
SSN, senza limitazioni, in accordo alle indicazioni riportate
in scheda tecnica
Da luglio 2011 sono state apportate delle modifiche:
suddivisione delle statine in 1° e 2° livello, con indicazioni
sulla loro utilizzazione in funzione del rischio individuale
del paziente e dei valori target di LDL da raggiungere;
introduzione di ezetimibe; ipercolesterolemia poligenica,
dislipidemie familiari, iperlipidemie in pazienti con IRC e
iperlipidemie indotte da farmaci sono le nuove indicazioni
d’impiego; sostituzione delle Carte di Rischio Cuore con i
criteri delle LG AHA/ACCe, ESC/EASD.
Con il provvedimento di novembre 2012 sono state
reintrodotte le carte del rischio CV e non è più prevista la
suddivisione delle statine in primo e secondo livello.
Tra gli ipolipemizzanti sono stati introdotti anche i
sequestranti degli acidi biliari limitatamente al trattamento
di 3° livello nelle dislipidemie familiari
G.U.
N.
N.
N.
N.
N.
72 del 27/03/2007
163 del 15/07/2011
277 del 27/11/2012
83 del 9/04/2013
156 del 8/7/2014
La Determina AIFA 26 marzo 2013 ha apportato alcune
modifiche:
- nei livelli di rischio oltre a quello moderato, alto e molto
alto è stato inserito quello medio, per il quale il target
terapeutico è LDL <130 e il trattamento di 1° livello è la
modifica dello stile di vita per almeno 6 mesi, mentre
quello di 2° livello è rappresentato dall’assunzione di
statine, esclusa la rosuvastatina.
- Nelle tabelle riportanti i trattamenti di 1° livello per le
diverse patologie, sono state aggiunte a simvastatina,
pravastatina e atorvastatina, la fluvastatina e la
lovastatina.
- Sono state introdotte delle modifiche relative ai PUFA
N3:
- non sono più prescrivibili a carico del SSN per i pazienti
in trattamento con statine con HDL basse e/o trigliceridi
elevati: il farmaco di prima scelta è il fenofibrato;
- sono prescrivibili a carico del SSN nei pazienti con IRC
moderata e grave con valori di trigliceridi ≥500 mg/dl;
- sono prescrivibili a carico del SSN analogamente ai
fibrati, per le iperchilomicronemie e le gravi
ipertrigliceridemie;
- la loro prescrizione per la prevenzione secondaria in
soggetti post-infartuati non è più a carico del SSN.
Alla luce della evoluzione delle evidenze scientifiche
pubblicate in ambito europeo ed internazionale, l'AIFA ha
ritenuto di dover aggiornare il testo della Nota 13 con
riferimento in particolare alla rimborsabilità dei
farmaci ipolipemizzanti per il trattamento delle
dislipidemie e per la prevenzione degli eventi
cardiovascolari nei pazienti di età superiore ai 65 anni.
In particolare nel capitolo "Particolari categorie di
pazienti" è stato aggiunto un paragrafo relativo ai pz di
età > ai 65 anni con aumentato rischio CV in cui si
afferma che il trattamento con farmaci
ipolipemizzanti è da considerarsi rimborsabile in
prevenzione primaria fino agli 80 anni di età.
Nota n.
Farmaco
36
Testosterone
G.U.
N. 270 del 22/11/2010
Nota n.
Farmaco
39
Ormone della crescita (somatropina)
- Eliminato il principio attivo metiltestosterone
- Specificata la tipologia di ipogonadismi primitivi e
secondari che devono essere caratterizzati da “ridotte
concentrazioni di testosterone totale (< 12 nmoli/L o 350
mg/dl), in presenza di sintomi tipici (riduzione desiderio e
potenza sessuale, osteoporosi, riduzione forza muscolare,
obesità viscerale, alterazioni del tono dell’umore)”
- Eliminata la condizione di pubertà ritardata
Nella prima revisione sono state estese le indicazioni
dell’età evolutiva includendo i bambini nati piccoli per l’età
gestazionale (GSA) con età a 4 anni (autorizzazione al
trattamento per 2 anni e relativo monitoraggio) ed è stata
introdotta l’età di transizione
G.U.
N. 238 del 13/10/2009
N. 286 del 9/12/2009
N. 270 del 18/11/2010
Nella seconda revisione sono state riportate modifiche al
testo in riferimento al trattamento dei soggetti prepuberi
affetti dalla sindrome di Prader Willi (PWS).
Nella terza revisione è stata inserita l’età neonatale, in
individui con evidenza neuroradiologica di
malformazioni/lesioni ipotalamo-ipofisarie e segni clinici
laboratoristici compatibili con la diagnosi di
panipopituitarismo congenito
Nota n.
42
Farmaco
Bifosfonati:
acido etidronico
acido clodronico
G.U.
N. 238 del 13/10/2009
Nota n.
55
Farmaco
Antibiotici iniettabili per uso extraospedaliero:
ceftazidime
cefepime
mezlocillina
piperacillina
ampicillina-sulbactam
piperacillina+tazobactam
amikacina
gentamicina
netilmicina
tobramicina
G.U.
L’aggiornamento consiste nell’aver aggiunto, nella sezione
particolari avvertenze, la seguente frase: “Di recente,
l’Advisory Committee dell’FDA ha pubblicato un warning
circa l’eventuale insorgenza di dolore severo, talora
disabilitante, a livello osseo, articolare o muscolare
associato alla assunzione di bifosfonati. Tale
sintomatologia differisce dalla sindrome acuta similinfluenzale (acute-phase reaction APR) caratterizzata da
febbre, raffreddore, dolore osseo, artralgia e mialgia che
comunemente si osserva in seguito a somministrazione
endovenosa dei bifosfonati iniettabili"
Sono state tolte tutte le cefalosporine di II generazione e
tra quelle di III/IV sono rimaste solo ceftazidime e
cefepime
La prescrizione a carico del SSN è limitata alle seguenti
condizioni:
-trattamento iniettivo di infezioni gravi delle vie
respiratorie, delle vie urinarie, dei tessuti molli, intraaddominali, ostetrico-ginecologiche, ossee e articolari;
-trattamento iniettivo delle infezioni causate da
microrganismi resistenti ai più comuni antibiotici,
particolarmente nei pazienti immunocompromessi
N. 238 del 13/10/2009
Nota n.
56
Farmaco
Antibiotici per continuità
ospedale-territorio
Aztreonam
imipinem+ cilastatina
rifabutina
teicoplanina
La variazione è di tipo formale; nella sezione "evidenze
disponibili" al punto 2) è stato riportato:
monobattami (aztreonam); efficaci verso i soli gramnegativi “difficili”
anzichè
farmaci efficaci verso i soli gram-negativi “difficili", simili,
nei riguardi di questi, alle cefalosporine di III e IV
generazione (aztreonam)
La seconda variazione ha riguardato:
l'esclusione dalla nota dei principi attivi ertapenem e
meropenem
la possibilità per il MMG di iniziare il trattamento con
gli antibiotici, senza che questo sia iniziato in
ospedale. La nota specifica che la decisione da parte
del MMG di intraprendere il trattamento debba
G.U.
Nota n.
Farmaco
N. 268 del 17/11/2009
N. 150 del 30/06/2011
57
Antiemetici (antagonisti dei recettori
serotoninegici)
G.U. n.
N.180 del 05/08/2009
Nota n.
59
Farmaco
Lattilolo, lattulosio
G.U. n.
N.104 del 07/05/2011
Nota n.
65
Farmaco
Farmaci per la sclerosi multipla:
glatiramer acetato
interferoni beta 1a e beta 1b
ricombinanti
Fingolimod cloridrato
G.U.
Nota n.
Farmaco
G.U.
N. 182 del 05/08/2008
N. 75 del 31/03/2009
N. 194 del 22/08/2012
66
Antinfiammatori non steroidei
N. 194 del 21/08/2012
Nota n.
74
Farmaco
Farmaci per l’infertilità femminile e
maschile:
follitropina ricombinante
follitropina ricombinante
lutropina
menotropina
urofollitropina
follitropina + lutropina
coriogonadotropina
G.U.
essere sostenuta da un'adeguata indagine
microbiologica, documentata efficacia del farmaco e
assenza di alternative terapeutiche
N. 81 del 05/04/2008,
N. 156 del 08/07/2009,
N.113 del 17/05/2010
È stata abolita. Gli antagonisti dei recettori
serotoninergici sono pertanto prescrivibili in regime SSN ,
senza limitazioni, in accordo alle indicazioni riportate in
scheda tecnica
È stata abolita. Lattulosio e lattilolo sono pertanto
prescrivibili in regime SSN, senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
Nella prima revisione è stato specificato che la sclerosi
multipla recidivante-remittente è diagnosticata secondo
i criteri di Polman (Polman, 2005) con punteggio
sull’Expanded Disability Status Scale (EDSS) tra 1.0 e 5.5
Nella seconda revisione sono state apportate delle
modifiche alle sezioni evidenze disponibili e bibliografia.
Nella terza revisione è stato introdotto il farmaco
fingolimod per i pazienti con sclerosi multipla recidivante
- remittente (SMRR) grave ad evoluzione rapida, definita
da due o più recidive disabilitanti in un anno, e con 1 o
più lesioni captanti gadolinio alla RM cerebrale o con un
aumento significativo del carico lesionale in T2 rispetto ad
una precedente RM recentemente effettuata
La prescrizione della sola nimesulide è limitata al
trattamento di breve durata del dolore acuto
nell'ambito delle seguenti patologie:
Artropatie su base connettivitica;
Osteoartrosi;
Dolore neoplastico;
Attacco acuto di gotta
Rispetto alla nota originaria, sono soggetti alla nota 74
anche l’associazione follitropina + lutropina
(Pergoveris) entrata in commercio nel 2008 e la
coriogonadotropina (Ovitrelle) che è stata riclassificata
in fascia A a luglio 2009
L’ultima modifica riguarda l'integrazione dell'indicazione
all'utilizzo dei farmaci per il trattamento dell'infertilità
maschile. Nella nota è specificato che il trattamento va
effettuato "in maschi con ipogonadismo-ipogonadotropo
con livelli di gonadotropine bassi o normali o comunque
con FSH non superiore a 8 mUI/ml."
Nota n.
Farmaco
G.U.
75
Farmaci per la disfunzione erettile:
alprostadil
sildenafil
vardenafil
tadalafil
N. 279 del 29/11/2010
Nota n.
76
Farmaco
Ferrico gluconato, ferromaltoso,
ferroso gluconato, ferroglicinalsolfato
G.U.
Nota n.
G.U.
La prescrizione di alprostadil a carico del SSN è limitata ai
pazienti con disfunzione erettile da lesioni permanenti e
complete del midollo spinale o del plesso pelvico
iatrogene, traumatiche o infiammatorie/degenerative.
La prescrizione di inibitori della PDE5 (sildenafil, tadalafil,
vardenafil) a carico del SSN è limitata ai pazienti con
disfunzione erettile da danno transitorio o parziale del
midollo spinale o del plesso pelvico secondo un piano
terapeutico specialistico (andrologo, endocrinologo,
neurologo o urologo)
È stata abolita. Ferrico gluconato, ferromaltoso, ferroso
gluconato, ferroglicinalsolfato sono pertanto prescrivibili in
regime SSN , senza limitazioni, in accordo alle indicazioni
riportate in scheda tecnica
N. 106 del 09/05/2011
78
N.284 del 04/12/2010
Nota n.
79
Farmaco
Bifosfonati:
ac. alendronico
ac. risedronico
ac. ibandronico
ac. Alendronico vitamina D3
ac. zoledronico
raloxifene
bazedoxifene
ranelato di stronzio
teriparatide
ormone paratiroideo
E’ stata abolita dal 5/12/2010
I colliri antiglaucoma di cui alla ex nota 78 sono pertanto
prescrivibili in regime SSN , senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
Nella prima revisione sono state estese le indicazioni della
teriparatide:
Soggetti di età superiore a 50 anni in trattamento da più
di 12 mesi con dosi > 5 mg/die di prednisone o dosi
equivalenti di altri corticosteroidi e che si presentano con
una frattura vertebrale severa o due fratture vertebrali
moderate.
La nota si applica su diagnosi e piano terapeutico, della
durata di 6 mesi prolungabile di ulteriori periodi di 6 mesi
per non più di altre due volte (per un totale complessivo
di 18 mesi), di centri specializzati, Universitari o delle
Aziende Sanitarie, individuate dalle Regioni e dalle
Province autonome di Trento e Bolzano
Nella seconda revisione è stato eliminato l'acido
zolendronico dall'elenco dei principi attivi, erroneamente
G.U.
N. 150 del 01/07/2009
N. 180 del 05/08/2009
N. 137 del 15/06/2011
N.220 19/09/2013
N. 295 17/12/2013
Nota n.
83
Farmaco
Sostituti lacrimali
G.U.
N. 286 del 09/12/2009
Nota n.
85
Farmaco
Inibitori dell'acetilcolinesterasi:
donezepil
galantamina
rivastigmina
inserito nella precedente versione
Nella terza revisione è stato introdotto il principio attivo
bazedoxifene ed è stata prolungata la durata della terapia
con teripararatide ed ormone tiroideo a due anni (il PT
può essere rinnovato 3 volte anziché solo 2)
Introduzione del piano terapeutico AIFA, da rinnovare
ogni 6 mesi, per la prescrizione del Ranelato di Stronzio.
Individuazione dei centri abilitati alla redazione del PT:
- Endocrinologia e Malattie Ricambio
- Geriatria
- Malattie metaboliche e Diabetologia
- Medicina generale
- Medicina interna
- Medicina mal. metaboliche dell'osso
- Recupero e rieducazione funzionale
- Reumatologia
Abolizione del piano terapeutico AIFA per la prescrizione
del Ranelato di Stronzio e classificazione del farmaco, ai
fini della rimborsabilità, in classe A con Nota AIFA 79,
soggetto a prescrizione medica limitativa, da parte
di centri ospedalieri o di specialisti reumatologi, internisti,
geriatri, endocrinologi.
Attualmente il MMG non può prescrivere il farmaco.
È stata aggiunta, nella sezione background, la frase:
"Il carbopol è un polimero che ha dimostrato una certa
efficacia nel trattamento della xeroftalmia di pazienti
affetti da malattia di Sjögren”
Nella prima revisione è stata introdotta la memantina tra
i farmaci rimborsabili per la terapia della malattia di
Alzheimer limitandola al trattamento di grado moderato
con MMSE tra 10 e 20. Donepezil, rivastigmina,
galantamina rimangono prescrivibili nei pazienti con
malattia di Alzheimer di grado lieve, ma sono specificati i
valori di MMSE (tra 21 e 26) e di grado moderato con
MMSE tra 10 e 20
La seconda revisione è di tipo formale in quanto hanno
aggiunto la classe farmacologica di appartenenza della
memantina ovvero gli antagonisti del recettore del
glutammato
Antagonisti del recettore per il
glutammato:
memantina
G.U.
N. 65 del 19/03/2009 e N. 238 del
13.10.2009
Nota n.
90
Farmaco
Metilnaltrexone
La prescrizione di metilnaltrexone a carico del SSN è
limitata alle seguenti condizioni:
G.U.
N. 141 del 20/06/2009
Costipazione indotta da oppiacei in soggetti con malattia
in stato terminale che rispondano contemporaneamente
alle seguenti caratteristiche:
- terapia continuativa con oppiacei della durata di almeno
di 2 settimane;
- resistenza al trattamento con lassativi ad azione
osmotica per più 3 giorni.
Nota n.
91
Farmaco
Febuxostat
La prescrizione di febuxostat a carico del SSN è limitata
alla seguente condizione:
trattamento dell’iperuricemia cronica con anamnesi o
presenza di tofi e/o di artrite gottosa in soggetti che non
siano adeguatamente controllati con allopurinolo o siano
ad esso intolleranti
G.U.
N. 265 del 12/11/2010
Nota n.
92
Farmaco
Benzilpenicillina benzatinica
G.U.
N. 128 del 04/06/2012
Nota n.
93
Farmaco
Midazolam
G.U.
N. 99 del 29/04/2013
Nota n.
94
Farmaco
N3 PUFA con contenuto di EPA+DHA
esteri etilici 85% minimo pari a 850
mg/g
La prescrizione e la dispensazione della benzilpenicillina
benzatinica o benzatilpenicillin, a carico del SSN, è limitata
alle seguenti condizioni:
1. profilassi della malattia reumatica in soggetti con
infezioni delle prime vie respiratorie sostenute da
streptococchi del gruppo A. Profilassi delle recidive della
malattia reumatica;
2. sifilide
Il farmaco deve essere prescritto e dispensato, a carico
del SSN, direttamente dai Centri specialistici delle Aziende
sanitarie regionali o a Direzione universitaria, degli Istituti
di Ricovero e Cura a carattere scientifico e delle strutture
accreditate con il SSR
La prescrizione del farmaco Buccolam a carico del SSN è
limitata alle seguenti condizioni patologiche:
1. trattamento acuto delle crisi nelle epilessie dell'età
pediatrica con elevato rischio di occorrenza di crisi
prolungate (durata maggiore di 5 minuti) o di stato di
male epilettico: Forme idiopatiche; Sindrome di Dravet;
Sindrome di Panayiotopoulos
2. Trattamento acuto delle crisi nelle altre epilessie
dell'età pediatrica, dopo un precedente episodio di crisi
prolungata (durata maggiore di 5 minuti) o di stato di
male epilettico: Forme idiopatiche;Forme sintomatiche a
varia eziologia
La nota è valida limitatamente a Midazolam oromucosale
siringhe pre-riempite da 2,5, 5, 7,5 e 10 mg.
La prescrizione è soggetta a diagnosi e PT da parte di
centri ospedalieri/specialisti in pediatria, neurologia,
neuropsichiatria infantile.
La prescrizione di N3 PUFA è a carico del SSN solo se
rispondente a una delle seguenti condizioni:
- ricovero per sindrome coronarica acuta con o senza
innalzamento del tratto ST (sindrome coronarica acuta
G.U.
N. 285 del 05/12/2013
SCA-STE, sindrome coronarica acuta SCA-NSTE)
- sofferta sindrome coronarica acuta con o senza
innalzamento del tratto ST (sindrome coronarica acuta
SCA-STE, sindrome coronarica acuta SCA-NSTE) nei
precedenti 90 giorni.
Nei pazienti con SCA-STE è necessaria la presenza di:
- sopraslivellamento del tratto ST di almeno 0,1 mV in
almeno due derivazioni contigue o blocco di branca
sinistra di recente (<24 ore) insorgenza
- alterazioni di biomarcatori indicativi di danno miocardico.
Nei pazienti con SCA-NSTE è necessaria la presenza di:
- alterazioni di biomarcatori indicativi di danno miocardico.
La durata del ciclo di trattamento rimborsabile è di:
- 12 mesi nei pazienti con frazione di eiezione alla
dimissione ospedaliera > 40%
- 18 mesi nei pazienti con frazione di eiezione < 40% alla
dimissione ospedaliera.
[ultimo aggiornamento febbraio 2015, le ultime revisioni sono riportate in rosso]












