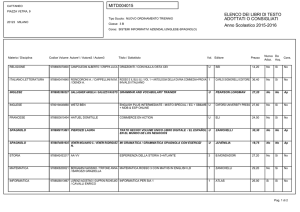
G. Valitutti A.Tifi A.Gentile
Le idee della chimica
Seconda edizione
Copyright © 2009 Zanichelli editore
Capitolo 22
Chimica, tecnologia e ambiente
1. I metalli e la metallurgia
2. I metalli e le loro applicazioni
3. Silicio, semiconduttori e teoria delle bande
4. Leganti, vetri e materiali ceramici
5. Azoto, fosforo e fertilizzanti
6. Lo zolfo e l’acido solforico
7. Idrogeno e ossigeno dall’acqua …e dal Sole
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
I metalli sono gli elementi più numerosi della
tavola periodica, di cui occupano la parte sinistra.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
I metalli che si trovano in natura allo stato libero
sono: argento, platino, rame, osmio, iridio,
mercurio e oro.
Tutti gli altri metalli si trovano come composti e
in particolare: ossidi, solfuri, carbonati, solfati e
cloruri.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
La metallurgia è la serie di operazioni e
trasformazioni necessarie per ottenere il metallo
dal minerale.
La metallurgia comporta tre fasi:
• l’arricchimento;
• la riduzione;
• la raffinazione.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
L’arricchimento serve a separare il minerale dalle
impurità che lo accompagnano.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Nel caso di rame e
zinco si effettua la
flottazione: il
minerale polverizzato
è trattato con acqua e
un detergente. Si
insuffla aria dal basso
in modo da far salire
le particelle del
composto metallico.
Sul fondo rimane il
materiale inerte
(ganga).
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Alcuni minerali dopo l’arricchimento subiscono la
calcinazione: riscaldamento ad alta temperatura
per ottenere gli ossidi dei metalli.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Un altro procedimento è l’arrostimento: si
riscalda il metallo arricchito in presenza di
ossigeno in modo che i solfuri si trasformino in
ossidi.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Il passaggio più importante nell’estrazione di un
metallo è la sua riduzione: consiste nella
trasformazione dello ione metallico in elemento
metallico libero.
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Copyright ©2009 Zanichelli editore
Le idee della chimica
1. I metalli e la metallurgia
Il processo di raffinazione avviene per
distillazione dei metalli a basso punto di
ebollizione o tramite elettrolisi.
La raffinazione dei metalli è difficile e costosa per
cui è più conveniente usare le leghe invece dei
metalli allo stato puro.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il ferro è il quarto elemento più abbondante della
crosta terrestre (4,7%).
La riduzione dell’ematite (Fe2O3) e della magnetite
(Fe3O4) avviene nell’altoforno.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Nell’altoforno si mescolano minerali di ferro,
carbonato di calcio e il coke che fornisce calore
per fondere il metallo.
L’ossido di carbonio che si libera si combina con gli
ossidi di ferro riducendoli a ferro metallico.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
L’altoforno non si spegne
mai e i processi di
eliminazione delle scorie e
di riduzione del minerale si
ripetono ciclicamente.
Periodicamente si
prelevano dal fondo la
ghisa fusa e le scorie.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
La ghisa è un miscuglio di ferro e carbonio.
Per ottenere l’acciaio si allontana dalla ghisa
parte del carbonio disperso.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
La conversione della
ghisa in acciaio si
effettua, fra l’altro,
con ossigeno puro
tramite un
convertitore.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il titanio non esiste libero in natura, ma è molto
abbondante nella crosta terrestre.
Il titanio è resistente come l’acciaio, ma è molto
più leggero; pesa più dell’alluminio, ma ha doppia
resistenza.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il titanio libero si ottiene dal rutilo (TiO2) che
produce vapori di TiCl4 i quali, passando su
magnesio fuso, riducono il titanio a metallo.
Il rutilo, dopo la purificazione si trasforma in un
pigmento bianco: è il minerale di partenza
nell’industria delle vernici, della carta del cemento
e della plastica.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
L’alluminio è il terzo elemento più abbondante
nella crosta terrestre (7,5%).
I suoi principali minerali sono:
• la bauxite Al2O3 n H2O;
• la criolite Na3AlF6;
• il corindone Al2O3.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
L’alluminio puro in polvere è molto
infiammabile; insieme al perclorato d’ammonio
viene utilizzato come combustibile nei razzi delle
navette spaziali.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Per aumentare la resistenza degli oggetti di
alluminio agli agenti atmosferici, si opera
l’anodizzazione: gli oggetti vengono posti come
anodi in una cella di acido solforico diluito, in
modo che si formi uno strato protettivo di
alluminio di una certa consistenza.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
La galena, PbS, è il principale minerale del
piombo: per arrostimento si ottiene l’ossido di
piombo ridotto a piombo metallico con il carbone.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il piombo così preparato contiene impurità di
argento, oro e altri metalli che vengono allontanati
tramite particolari altiforni.
Il piombo trova applicazione nell’industria delle
batterie elettriche e dei proiettili per le armi.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il 40% del fabbisogno annuale di piombo è
costituito da quello riciclato derivante, soprattutto,
dal recupero del piombo dalle batterie.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
L’applicazione dei composti del piombo riguarda
• l’ossido di piombo: fabbricazione degli smalti,
vulcanizzazione della gomma, raffinazione del
petrolio;
• il minio, Pb3O4, per proteggere manufatti
d’acciaio applicato prima della verniciatura;
• in lega con lo stagno per le saldature.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
I composti del piombo sono tossici.
L’ avvelenamento da piombo è detto saturnismo.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
I principali minerali dello zinco sono la blenda,
ZnS, e la smithsonite, ZnCO3.
Lo zinco si ottiene attraverso i processi di
arricchimento per flottazione, arrostimento e
riduzione con carbone.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il piombo viene impiegato nella zincatura di ferro
e di acciaio e nella formazione dell’ottone (lega
con il rame).
Lo Zn2+ è un componente fondamentale di più di
200 enzimi biologici.
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
I principali minerali del rame sono
• calcopirite, CuFeS2
• calcocite, Cu2S
• cuprite, Cu2O
• malachite, CuCO3 Cu(OH)2
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Caratteristiche del rame sono l’elevata conduttività
termica ed elettrica e la resistenza alla corrosione.
Il rame forma il bronzo e l’ottone (leghe).
Copyright ©2009 Zanichelli editore
Le idee della chimica
2. I metalli e le loro applicazioni
Il 50% del rame utilizzato
in Italia è riciclato.
Il rame si trova negli
apparati tecnologici ed è il
maggior costituente della
moneta dell’euro.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Il silicio è, dopo l’ossigeno, il principale
componente della crosta terrestre (25,7%).
È un semimetallo che si trova per lo più combinato
con l’ossigeno.
È grigio scuro e molto lucente.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Si ottiene per riduzione dei suoi minerali con il
carbone a 200 °C; per ottenerlo puro al 99,99% lo
si sottopone a una lunga e costosa purificazione.
Quando raggiunge la massima purezza, viene
impiegato nella produzione di circuiti elettronici
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Il silicio, sottoposto a drogaggio, è un
semiconduttore.
Il numero complessivo di elettroni di un
semiconduttore è sempre uguale a quello dei
protoni; gli atomi aggiunti al silicio sono
elettricamente neutri e hanno tanti elettroni
intorno al nucleo quanti sono i protoni nel nucleo.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
La teoria delle bande prevede che in un metallo
si formi un elevato numero di orbitali molecolari.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Gli orbitali molecolari che danno origine a bande
derivano dalla combinazione di orbitali atomici
esterni; se gli orbitali sono vicini al nucleo le
bande sono ristrettissime e gli elettroni che le
occupano si comportano da elettroni atomici.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Una banda riempita solo parzialmente è detta
banda di conduzione.
La banda piena di elettroni di valenza si chiama
banda di valenza.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
Tutte le sostanze solide che si comportano da
isolanti elettrici hanno una banda di valenza
molto distante da quella di conduzione, cosicché
per eccitare gli elettroni ci vuole molta energia.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
I semiconduttori possono essere
• di tipo p se il numero di elettroni esterni è
inferiore e la banda di valenza non è del tutto
piena;
• di tipo n se gli elettroni sono soprannumerari e
occupano in parte la banda superiore di
conduzione.
Copyright ©2009 Zanichelli editore
Le idee della chimica
3. Silicio, semiconduttori e teoria delle bande
I transistor e i circuiti integrati contengono
congiunzioni p-n, in cui un semiconduttore p è a
contatto con uno di tipo n.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Le materie prime per la ceramica, il cemento e il
vetro sono i calcari e i silicati.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Il calcio è il quinto elemento per abbondanza
nella crosta terrestre (3,5%) e si trova
principalmente come carbonato di calcio, CaCO3.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Dal carbonato di calcio si ottiene l’ossido di calcio
CaO, la calce viva, utilizzato come legante
nell’edilizia.
Per azione dell’acqua il CaO si trasforma
nell’idrossido Ca(OH)2, detto calce spenta.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Miscelando calce, acqua e sabbia si ottiene la
malta che, a contatto con l’aria, solidifica e «fa
presa» in virtù della ritrasformazione della calce in
carbonato di calcio.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Il carbonato di calcio trova impiego anche come
antiacido per i terreni agricoli e per lo stomaco.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Il quarzo è la silice (SiO2) pura.
Tutti i silicati presentano geometria tetraedrica
in cui un atomo di silicio è circondato da quattro
atomi di ossigeno. La modalità con cui le unità si
uniscono fra loro dà origine ai diversi tipi di
silicati.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Il vetro comune è ricavato dalla fusione della
silice con carbonato di calcio e carbonato di sodio.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Diversamente dal quarzo, il vetro non ha una
struttura submicroscopica ordinata cosicché lo si
considera un liquido raffreddato.
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Distinguiamo le tipologie di vetro:
• pyrex resistente al calore;
• fotocromatico sensibile alla luce, si usa nelle
lenti degli occhiali;
• fibre ottiche lunghe fibre sottilissime e
trasparenti che trasportano al luce a distanza
(telecomunicazioni).
Copyright ©2009 Zanichelli editore
Le idee della chimica
4. Leganti, vetri e materiali metallici
Il cemento è il legante nell’industria edilizia.
Si ottiene per cottura a 1500 °C di una miscela di
silice, argilla e calcare in un forno rotante.
È un legante idraulico perché fa presa anche se
immerso nell’acqua.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’azoto è formato da molecole diatomiche stabili.
:N
N:
È il gas più abbondante nell’atmosfera (78%).
Si ottiene per distillazione frazionata dell’aria
liquida.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Con l’ossigeno forma gli ossidi:
• ossido di diazoto, N2O, è il gas esilarante;
• monossido di azoto, NO, regola la pressione
sanguigna;
• diossido di azoto, NO2, si trova nello smog
atmosferico.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’azoto atmosferico viene combinato con altri
elementi (fissato) per poter essere utilizzato dagli
organismi viventi.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’ammoniaca, NH3, è un gas incolore di odore
soffocante.
Presenta geometria piramidale triangolare.
Le molecole sono polari e l’ammoniaca può essere
liquefatta per compressione.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Si produce a partire da idrogeno e azoto mediante
il processo Haber.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’ammoniaca viene utilizzata nell’industria dei
fertilizzanti sottoforma di nitrato d’ammonio,
solfato d’ammonio e fosfato d’ammonio.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’acido nitrico puro, HNO3, è un liquido incolore;
in soluzione acquosa è un acido forte.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Si prepara a partire dall’ammoniaca con il
processo Oswald: l’ammoniaca viene ossidata a
monossido di azoto ossidato a sua volta a diossido
di azoto che, sciolto in acqua dà luogo all’acido
nitrico.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
L’acido nitrico trova impiego nell’industria degli
esplosivi (nitroglicerina e tritolo) e, come
nitrato di sodio, come antibatterico nella
conservazione delle carni.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Il fosforo è una molecola tetratomica, P4, a
struttura piramidale.
Le forme allotropiche sono:
• fosforo rosso si incendia per sfregamento
(fiammiferi);
• fosforo bianco di consistenza cerosa,
velenoso, incendiabile;
• fosforo nero semiconduttore simile alla grafite.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Si trova nella fosforite, Ca3(PO4)2 e nell’apatite,
3 Ca3(PO4)2 CaF2
La purificazione a metallo avviene in una fornace
elettrica a 1500 °C.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
I fertilizzanti sono sostanze che migliorano la
fertilità dei terreni agricoli. Si distinguono in
1. concimi, l’apporto degli elementi nutritivi viene
utilizzato direttamente dalle specie coltivate;
2. ammendanti e correttivi, modificano le
proprietà del terreno rendendolo più fertile.
Copyright ©2009 Zanichelli editore
Le idee della chimica
5. Azoto, fosforo e fertilizzanti
Copyright ©2009 Zanichelli editore
Le idee della chimica
6. Lo zolfo e l’acido solforico
Lo zolfo
elementare si
estrae dalle
miniere mediante
il metodo
Frasch che ne
sfrutta la bassa
temperatura di
fusione (119 °C)
e la bassa densità
(1,96 g/cm3).
Copyright ©2009 Zanichelli editore
Le idee della chimica
6. Lo zolfo e l’acido solforico
Lo zolfo presenta diverse forme allotropiche, di
cui la più stabile a temperatura ambiente è lo
zolfo ortorombico, S8.
Copyright ©2009 Zanichelli editore
Le idee della chimica
6. Lo zolfo e l’acido solforico
L’acido solforico è il prodotto chimico più usato
nell’industria petrolchimica, dei fertilizzanti, dei
coloranti e farmaceutica.
Copyright ©2009 Zanichelli editore
Le idee della chimica
6. Lo zolfo e l’acido solforico
Si ottiene puro e concentrato con il metodo di
contatto a partire dalla combustione dello zolfo.
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
L’ossigeno è l’elemento più abbondante nella
crosta terrestre (49,2%) e lo si trova come:
•
O2 nella bassa atmosfera;
•
O3, ozono, nell’alta atmosfera;
•
H2O nel mare.
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
L’ossigeno atmosferico proviene in gran parte dalla
fotosintesi clorofilliana che ne mantiene alta la
concentrazione.
L’ossigeno industriale si prepara dalla
distillazione frazionata dell’aria liquida e viene
impiegato soprattutto nell’industria siderurgica.
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
L’idrogeno è l’elemento più abbondante
dell’Universo.
Nell’industria viene impiegato per sintetizzare
altri composti o per estrarre alcuni metalli dai loro
minerali.
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
L’idrogeno liquido è impiegato come
combustibile per i razzi, grazie all’elevata entalpia
specifica e alla piccolissima densità.
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
L’idrogeno si prepara industrialmente con una
reazione, catalizzata dal nichel, degli idrocarburi
con il vapore d’acqua a 800-1000 °C (reforming).
Copyright ©2009 Zanichelli editore
Le idee della chimica
7. Idrogeno e ossigeno dall’acqua …e dal Sole
Oggi si sta provando a
ottenere l’idrogeno
per scissione
dell’acqua sfruttando
la luce solare tramite
una cella elettrolitica
in cui l’alimentatore è
la luce solare.
Copyright ©2009 Zanichelli editore
Le idee della chimica