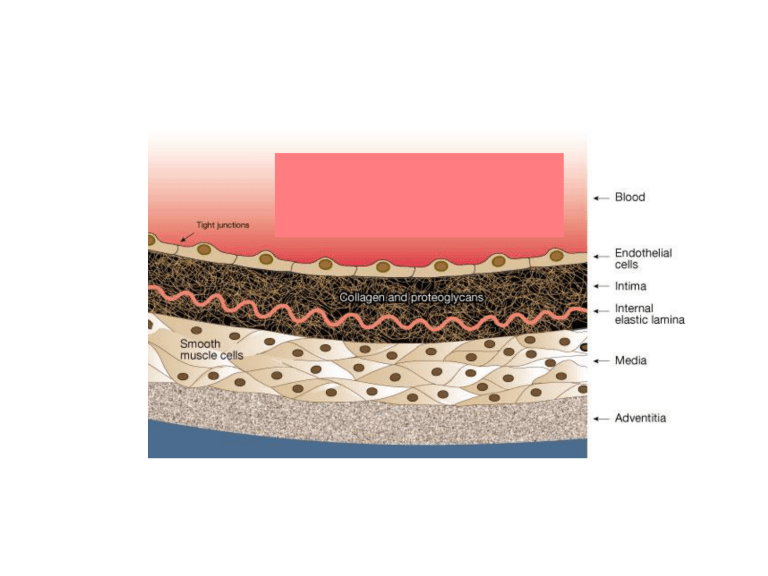
ATEROSCLEROSI
Am J. Pathology 143, 987-1002, 1993
Atherosclerosis: A defence mechanism gone awry
RUSSELL ROSS
La lesione aterosclerotica rappresenta una forma specializzata di risposta
infiammatoria-fibroproliferativa a diversi tipi di insulti della parete
arteriosa. Tale risposta ha caratteri protettivi. In dipendenza dalla
durata e dalla natura di tali insulti, la risposta protettiva può diventare
eccessiva e, nel corso di diversi anni, diventare un processo morboso.
“reaction to injury” hypothesis (teoria della reazione al danno)
Nature 407, 233 - 241 (2000)
Atherosclerosis
ALDONS J. LUSIS
Atherosclerosis is a progressive disease characterized by the
accumulation of lipids and fibrous elements in the large arteries.
Nature 420, 868 - 874 (2002)
Inflammation in atherosclerosis
PETER LIBBY
Atherosclerosis is a progressive disease characterized by the
accumulation of lipids and fibrous elements in the large arteries.
Is atherosclerosis an inflammatory, macrophage-mediated
disease characterized by the accumulation…….??
monocito
STRIA LIPIDICA
foam cell
SMC
SMC
SMC
SMC
SMC
SMC
SMC
SMC
SMC
PLACCA FIBROSA
foam cell
cell. muscolare liscia
fibre collagene
SMC
linfocita T
foam cell apoptotica
SMC
SMC
SMC
lipidi extracellulari
SMC
SMC
SMC
SMC
LESIONE COMPLICATA
monocito
linfocita T
piastrine
fibre collagene
SMC
foam cell
cell. muscolare liscia
in apoptosi
foam cell apoptotica
SMC
lipidi extracellulari
Calcificazioni
emorragie intimali
Neovascolarizzazione
(angiogenesi)
SMC
SMC
SMC
Atrofia della media
SMC
APPROCCI PREVENTIVI E TERAPEUTICI
Inizio lesione: eliminazione
“cause”
Stabilizzazione della placca
Progressione della placca: inibizione
formazione di placca “instabile”
Complicanze trombotiche: riduzione fattori favorenti
formazione di trombi
Table 242-1. Risk Factors For Atherosclerosis
Evidence for
Factor
Causality
Hypercholesterolemia
Strong
Low HDLlevel
Strong
Modifiable
Yes
Yes
Hypertension
Male gender
Diabetes mellitus
Strong
Strong
Strong
Yes
No
Possibly
Family history of premature coronary
artery disease
High lipoprotein (a) level
Cigarette smoking
Post-menopausal state
Strong
No
Strong
Good
Good
Modestly
Yes
Possibly
Hyperfibrinogenemia
Hyperhomocysteinemia
Good
Good
Possibly
Yes
Physical inactivity
Obesity
Angiotensin converting enzyme
polymorphism
Good
Good
Controversial
Yes
Yes
No
Comment
Varies inversely with plasma triglyceride
level
Effectiveness of stringent glycemic control
uncertain
Premature onset before age 55 in firstdegree relative
Skewed distribution (see text)
Estrogen replacement therapy being
evaluated
Fibric acid derivatives may reduce
Some patients respond to folate
supplementation
Homozygous deletion mutant associated
with myocardial infarctions
EVIDENZE DEL RUOLO DI ALTERAZIONI LIPIDICHE (DELLA
COLESTEROLEMIA)
NELLA PATOGENESI DELL’ATEROSCLEROSI
•
•
•
•
•
CARATTERISTICHE DELLA PLACCA
STUDIO DI PAZIENTI CON IPERCOLESTEROLEMIA
FAMIGLIARE ED ALTRE ALTERAZIONI GENETICHE DEL
METABOLISMO DEL COLESTEROLO
EFFETTO DI DIETE RICCHE DI COLESTEROLO IN PRIMATI E
CONIGLI
WATANABE HERITABLE HYPERLIPIDEMIC RABBITS (WHHL
rabbits)
TOPI CON INATTIVAZIONE GENICA DI APOE (Apoproteina) o
RECETTORE PER LDL (LDL-R).
apoproteina
fosfolipide
esterificato
colesterolo
libero
trigliceridi
intestino
chilomicrone
tessuti periferici
microcircolo
lipoproteinlipasi
fegato
VLDL
IDL
LDL
CHILOMICRONI
LDL/IDL
VLDL
HDL
+
b
pre-b
a
-
APO-A
fegato
LCAT
Lecitina Colesterolo Acil Transferasi
CETP
HDL
APO-A
a-HDL
PLTP
CETP*
pre-b-HDL
VLDL/IDL
PLTP
APO-E
LDL
* Colesteryl
Esther Transfer Protein
Tessuti periferici
APO-A
ESPRESSIONE E FUNZIONI APOPROTEINE
APOPROTEINA
ESPRESSIONE
APO-B100
VLDL-IDL-LDL
APO-B48
Chilomicroni
APO-A
APO-C
APO-E
APO(a)
HDL
VLDL-IDL
Chilomicroni
VLDL-IDL-HDL
Chilomocroni
VLDL-IDL-LDL
FUNZIONE
Ligando per Recettore
Strutturale/Ligando per
Recettore(??)
Attivatore di Enzima
(aciltransferasi)
Attivatore di Enzima
(lipoprotein lipasi)
Ligando per Recettore
(??) Inibitore Fibrinolisi
RECETTORI PER LIPOPROTEINE
I. LDL-Receptor
APO-E
APO-B100
ubiquitario
L’espressione è regolata
II. LRP (LDL-Receptor Related Protein)
APO-E
ubiquitario
L’espressione non è regolata
III. Scavenger Receptors (SR)
LDL “modificate”
altri
monociti/macrofagi
SR-A
L’espressione non è regolata
LDL “modificate”
HDL
SR-B1
fegato; tessuti sintetizzanti
ormoni steroidei
LDL “modificate”
altri
SR-B2
mon./macr.; cells endoteliali; adipociti
APO-B100
APO-E
coated pit
H+
Endosoma
Riciclaggio
Lisosomi
Lisosoma secondario
aminoacidi
lipidi
colesterolo
Lisosoma secondario
3
aminoacidi
lipidi
-
colesterolo
NEOSINTESI
1
2
Inibizione HMGCoA REDuttasi
Inbizione neosintesi
Attivazione ACAT
Accumulo esterificato
NUCLEO
basic helix-loop-helix leucin zipper
SREBP cleavage activating protein
sterol regulatory element-binding protein
SREBP 1c e 2: fegato e tessuti mammiferi (regolano trascrizione di geni diversi)
SREBP 1a: regola trascrizione di tutti i geni SREBP regolati (espressione in linee cellulari)
Site 1 protease
Immunofluorescenza co Ab anti-SREBP 2
IPERCOLESTEROLEMIE SU BASE GENETICA
I.
IPERCOLESTEROLEMIA FAMIGLIARE (AD):
* eterozigote (1/500)...300 mg/dl LDL-colesterolo
* omozigote (1/1.000.000)...650 mg/dl LDL-colesterolo
Gene mutato: LDLReceptor
II.
DIFETTO FAMIGLIARE DI APOB-100 (AD):
* eterozigote (1/1000)...270 mg/dl LDL-colesterolo
* omozigote (1/1.000.000)...320 mg/dl LDL-colesterolo
Gene mutato: ApoB-100
III. IPERCOLESTEROLEMIA AUTOSOMICA RECESSIVA (AR):
omozigote (<1/10.000.000)...470 mg/dl LDL-colesterolo
Gene mutato: ARH (regola internalizzazione/localizzazione LDLR)
IV.
SITOSTEROLEMIA (AR):
omozigote (<1/10.000.000)...100-600 mg/dl LDL-colesterolo
(in dipendenza dalla dieta)
Gene mutato: ABCG5 e/o ABCG8 (regolano escrezione colesterolo
nell’intestino e nel canalicolo biliare)
IPERCOLESTEROLEMIA FAMIGLIARE: TIPI DI ALTERAZIONI DEL RECETTORE
I. RIDOTTA ESPRESSIONE
II. SINTESI DI RECETTORI CHE RIMANGONO NEL REL/GOLGI
III. RECETTORI CHE HANNO DIFETTI DI INTERNALIZZAZIONE
IV. RECETTORI CHE HANNO BASSA AFFINITA’ DI LEGAME PER APO-B100
VLDL (diminuita sintesi)
acido nicotinico
FEGATO
Sali biliari
FEGATO E TESSUTI PERIFERICI
statine
VIE BILIARI
acetilCoA
HMGCoAR*
colesterolo
*hydroxymethyl-glutaryl-CoA reductase
colestiramina
Nuovi farmaci inibitori dell’assorbimento di colesterolo
colesterolo
ezetimibe
esteri dello stanolo
LUME INTESTINO
ABCG5/ABCG8 (Sitosterolemia)
LUME CANALICOLO BILIARE
ABCG5/ABCG8 (Sitosterolemia)
LRP: LDL Receptor Related Protein
Lipoproteine contenenti APOE:
Chilomicroni (Remnants), VLDL, IDL
SCAVENGER RECEPTOR A
Rohrer at al. Nature 343, 570, 1990
RECETTORI SCAVENGERS
(SRs)
Classe di recettore e nome
SR-A:
•Macrophage Scavenger Receptor Type I
•Macrophage Scavenger Receptor Type I
SR-B:
SR-BI (Recettore per HDL)
SR-BII (CD36)
Espressione
Ligandi
Monociti/macrofagi
OxLDL, Altri
Fegato, tessuti
sintetizzanti ormoni
steroidei
HDL, OxLDL
Leucociti, Piastrine
Cell endoteliali,
Adipociti
OxLDL, trombospondina, cells
apoptotiche
Platt N and Gordon SJ. Clin. Invest. 108, 649, 2001
Binder CJ et al. Nature Medicine 8:1218, 2002
POSSIBILI MECCANISMI PRO-ATEROGENICI DI LDL OSSIDATE
Componente di oxLDL
Liso fosfatidil colina (PC) e
altri fosfolipidi ossidati.
Effetto
*Aumentata adesività di
monociti.
Meccanismo
*Aumentata espressione di
molecole adesive su
endotelio.
*Aumenta transmigrazione
di monociti e T cells.
*Effetti diretti e
secondari (aumentata
produzione di chemochine
da parte di endotelio).
*Aumentata espressione di
SR-A.
*Attivazione di fattori di
trascrizione (AP-1, ets).
*Induzione di geni proinfiammatori
*Attivazione di NFkB, AP-1
etc.
acido 9-idrossieicosatetraenoico.
*Aumentata espressione di
CD36.
APO-B modificata.
*Aumentata formazione di
foam cells.
*Attivazione di PPAR
*Aumentata
internalizzazione di oxLDL.
APO-B modificata e lipidi
ossidati.
* Induzione di risposta
immunitaria umorale e
cellulare.
*Formazione di nuovi
epitopi.
Liso PC, colesterolo,
ossisteroli.
*Induzione di necrosi ed
apoptosis.
Formazione di cristalli di
colesterolo, danni di
membrana.
Lipidi ossidati.
* Aumentata attività
procoagulante.
Induzione di fattore
tessutale, attivazione
piastrinica
“
“
“
SRB-BI
esteri colesterolo
FEGATO
TESSUTI SINTETIZZANTI ORMONI
STEROIDEI
SR-BI
APO-A
SR-BI
APO-E
APO-A
a-HDL
Libby P Nature 420, 868, 2002
Figure 1 Mononuclear phagocytes in atherogenesis. This figure schematizes steps in the recruitment of mononuclear phagocytes to the nascent atherosclerotic plaque and
some of the functions of these cells in the mature atheroma. The steps are depicted in an approximate time sequence proceeding from left to right. The normal arterial
endothelium resists prolonged contact with leukocytes including the blood monocyte. When endothelial cells undergo inflammatory activation, they increase their expression
of various leukocyte adhesion molecules. In the context of monocyte recruitment to the atheroma, vascular cell adhesion molecule-1 (VCAM-1) seems to have a major role.
Once adherent to the activated endothelial layer, the monocyte diapedeses between intact endothelial cells to penetrate into the tunica intima, or innermost layer of the arterial
wall. This directed migration requires a chemoattractant gradient. Various chemokines seem to participate in this process, particularly interaction of monocyte chemoattractant
protein-1 (MCP-1) with its receptor CCR2. Once resident in the intima the monocyte acquires characteristics of the tissue macrophage. In the atheroma in particular, the
macrophage expresses scavenger receptors that bind internalized lipoprotein particles modified for example by oxidation or glycation. These processes give rise to the arterial
foam cell, a hallmark of the arterial lesion, so named because of the foamy appearance under the microscope, which is the result of accumulation of lipid droplets within the
cytoplasm. Within the arterial intima, the macrophage serves many functions related to atherosclerosis and its complications. Notably, the foam cell secretes pro-inflammatory
cytokines that amplify the local inflammatory response in the lesion, as well as reactive oxygen species. The activated mononuclear phagocyte has a key role in the thrombotic
complications of atherosclerosis by producing matrix metalloproteinases (MMPs) that can degrade extracellular matrix that lends strength to the plaque's fibrous cap. When the
plaque ruptures as a consequence, it permits the blood to contact another macrophage product, the potent pro-coagulant protein tissue factor. Eventually the macrophages
congregate in a central core in the typical atherosclerotic plaque. Macrophages can die in this location, some by apoptosis, hence producing the so-called 'necrotic core' of the
atherosclerotic lesion.
L’inattivazione di geni codificanti per proteine implicate nel reclutamento monocitario riduce lo sviluppo di
Lesioni ateroscelrotiche in topi con inattivazione genica di APOE o LDL-R
CX3C, CXCR2, CCR2
b chain
MCP-1
X X
X
X
X
von Andrian UH and Mackay CR N Engl J Med 343, 1020, 2000
Libby P Nature 420, 868, 2002
Binder CJ et al. Nature Medicine 8:1218, 2002
GENI CHE INFLUENZANO LO SVILUPPO DI LESIONI ATEROSCLEROTICHE IN TOPI RESI IPERCOLESTEROLEMICI
MEDIANTE “KNOCKOUT” (INATTIVAZIONE) DI APO-E O LDL-R.
GENE INATTIVATO
I.
EFFETTI SULLO SVILUPPO
DELLA LESIONE
POSSIBILE MECCANISMO
geni implicati
nell’ossidazione di
lipoproteine
12/15 lipoossigenasi
iNOS
Riduzione marcata
Riduzione
Diminuita
ossidazione
lipoproteine
di
Riduzione marcata
Riduzione
Riduzione marcata
Diminuita differenziazione
Diminuita adesione
Diminuita
adesione
e
migrazione.
II. geni implicati nella
transmigrazione di
monociti
M-CSF
P e E-selectin
MCP-1 o CXCR2
GENE INATTIVATO
III.
POSSIBILE MECCANISMO
geni implicati
nella formazione
di foam cells
SR-A
CD36
EFFETTI SULLO SVILUPPO
DELLA LESIONE
Riduzione
Riduzione marcata
Diminuita
di OxLDL
internalizzazione
IV. geni implicati nella
regolazione di risposte
macrofagiche.
recettore per IFN-
Riduzione
IL-10
Aumento
PPAR
Aumento
V.
Ridotta
attivazione
dei
macrofagi
Eccessiva
attivazione
dei
macrofagi
Eccessiva
attivazione
dei
macrofagi
e
aumentata
formazione di foam cells
geni implicati
nella regolazione
del metabolismo
di lipoproteine e
di colesterolo
APO-A1
Aumento
SR-B1
Aumento
Iperespressione di
CETP
Aumento
Diminuita
formazione
di
HDL e trasporto inverso di
colesterolo
Diminuita
assunzione
di
HDL da parte del fegato
Eccessivo trasferimento di
colesterolo
a
IDL/LDL e
ridotta formazione di HDL
Freeman MW and Moore KJ Nature Medicine 9, 168, 2003
Plutzky J Science 302, 406, 2003
FATTORI DI RISCHIO PER ATEROSCLEROSI: IMPLICAZIONI FISIOPATOLOGICHE
Forte evidenza di causalità
Ipercolesterolemia
Ipertensione
Buona evidenza di causalità
Ridotta espressione LDL-R, Aumento LDL circolanti, Aumentata
probabilità ossidazione e deposito nell’intima
Alterazioni endoteliali e aumentato adsorbimento di LDL nell’intima
Genere maschile
Mancata protezione da parte di ormoni sessuali femminili (vedi poi),
Abitudini di vita, Altri (??)
Diabete mellito
Glicosilazione di proteine della superficie endoteliale e dell’intima
vascolare, Alterazioni metaboliche (Tipo II)
Storia famigliare di
prematura CAD
Elevati livelli di
lipoproteina (a)
Fumo da sigaretta
Stato postmenopausale
Alterazioni recettori per LDL, Alterazioni Apoproteine, Neosintesi ed
eliminazione colesterolo (??)
Aumentate complicanze trombotiche
Alterazioni endoteliali ed aumentata ossidazione LDL
Regressione di alto rapporto HDL/VLDL tipico di donne in età fertile
Iperfibrinogenemia (e
aumento coagu-labilità
del sangue)
Aumentate complicanze trombotiche
Inattività fisica
Riduzione HDL, Ridotto utilizzo colesterolo, Altri
Obesità
Iperomocisteinemia
Ipertensione ealterazioni metaboliche
Alterazioni endoteliali












