COMPOSTI ORGANOMETALLICI DI ALCUNI ELEMENTI DEI
GRUPPI I, II, III, IV(XIV), V (XV)
Litio
I composti organometallici del litio sono fra i rari composti di metalli alcalini
che hanno le proprietà fisiche dei composti covalenti (solubilità negli
idrocarburi e nei solventi apolari, elevata volatilità); sono liquidi e solidi con
basso punto di fusione ed hanno la tendenza all’associazione molecolare. Nei
cristalli di alchil-litio si ha una distribuzione tetraedrica. Il legame alchilico a
ponte è del tipo elettron-deficiente, e la formazione di tali aggregati sembra
dovuta alla interazione Li-C-Li , piuttosto che alle interazioni Li-Li. Gli alchil e
gli aril derivati in soluzione sono associati in maniera differente a seconda del
solvente, delle esigenze steriche del gruppo organico, dalla temperatura. Questi
modi diversi di aggregazione sono responsabili della diversa reattività dei
composti litio-organici. I composti organometallici del litio somigliano nelle
loro reazioni ai reattivi di Grignard, sebbene siano più reattivi di questi.
Possono essere preparati nei seguenti modi:
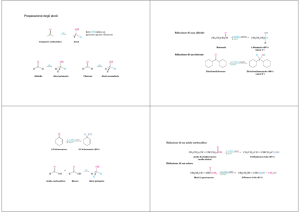
1. C2H5Cl + 2Li → C2H5Li + LiCl
2. n-C4H9Li + Fe(II)-bis (η5-C5H5)2 → Fe(II)-(η5-C5H5)(η5-C5H4 Li) +
n-C4H10
3. n-C4H9Li + C5H5N → n-C4H9Br + C5H4LiN
4. 2Li + R2Hg → 2RLi + Hg
Le 2, 3, 4 costituiscono rispettivamente un esempio di scambio:
2
idrogeno-metallo; 3
alogeno-metallo; 4
metallo-metallo.
I solventi di solito utilizzato per le reazioni suddette sono il benzene o l’esano.
I composti organometallici del litio reagiscono rapidamente con l’ossigeno ed
in genere si incendiano spontaneamente in aria ed a contatto con l’acqua.
Sodio e Potassio
I composti metallorganici di sodio e potassio sono ionici e pertanto insolubili in
solventi apolari. Sensibilissimi all’aria, si idrolizzano facilmente in acqua.
Sono ottimi agenti per le metallazioni. Si preparano a partire da composti
organo mercuriaci:
(CH3)2Hg + 2K (Na) → 2CH3K (Na) + Hg (in THF)
Più importanti sono i composti derivati dalla reazione con idrocarburi aventi
idrogeni acidi:
3C5H6 + 2Na → 2C5H5-Na+ + C5H8 (in THF)
RC≡ CH + Na → RC≡ C-Na+ + ½H2 (in THF)
Molti idrocarburi aromatici possono dare con sodio o potassio dei radicalianioni, è necessario però che la carica negativa possa essere delocalizzata.
Magnesio
Dei derivati organici del magnesio i più conosciuti sono i composti del tipo
RMgX (noti anche come reattivi di Grignard) e MgR2 (alchil magnesiaci). Si
preparano con le seguenti reazioni:
1. RX + Mg → RMgX (in etere dietilico o in THF)
2. HgR2 + Mg → MgR2 + Hg
La natura dei reattivi di Grignard in soluzione è alquanto controversa ed è
dipendente dalla temperatura, dalla concentrazione dei reattivi, dalla natura del
solvente. Una struttura plausibile potrebbe essere RMg <XX>MgR nella quale
si può osservare che i ponti sono preferibilmente ottenuti con l’alogeno
piuttosto che con il carbonio.
Allo stato cristallino invece è prevista una struttura del tipo RMgX·2Et2O con
l’atomo di magnesio coordinato tetraedricamente con l’alchile, l’alogeno e gli
atomi di ossigeno di due molecole di etere dietilico.
Nel caso di eteri con minore ingombro sterico, il numero di coordinazione può
anche essere superiore, 5 ad esempio, dando luogo ad una struttura di
bipiramide trigonale.
I composti MgR2 hanno strutture polimere a catena, con ponti metilenici; i
composti MgAr2 hanno struttura simile al ferrocene (Mg-bis (η5-C5H5)2).
Boro
Si conoscono numerosi composti del boro contenenti legami B-C, B-N, B-O-C,
B-S-C, B-N-C la cui chimica è fondamentalmente di tipo organico.
Un composto molto utile nella chimica degli organo-borani è il diborano B2H6.
Esso ha notevole tendenza ad associarsi per formare molecole più grosse. I due
legami che formano la molecola sono del tipo B-H-B, a tre centri e due
elettroni, dando origine ai cosiddetti orbitali a banana, che sono posizionati
perpendicolarmente al di sopra e al di sotto del piano molecolare dove
giacciono i quattro legami sigma B-H.
Il diborano viene preparato a partire dal sodioboridruro per reazione con
trifluoruro di boro (il più forte acido di Lewis):
3NaBH4 + 4BF3 → 3NaBF4 + 2B2H6
Il diborano con idrocarburi insaturi porta alla formazione di alcoli o di
idrocarburi saturi.
I boroalchili ed i boroarili possono essere preparati dagli alogenuri di boro per
reazione con litio-organo derivati; sono composti reattivi che si incendiano
all’aria. I composti più noti sono quelli contenenti l’anione BR4-, il più
importante dei quali è il tetrafenilborato di sodio BAr4-. Esso è solubile in
acqua e stabile in soluzioni acide. Nel caso in cui l’anione BR4- sia legato al
metallo, come in LiBMe4 il composto è ionico in soluzione e polimero allo
stato cristallino.
Sono pure importanti i cosiddetti acidi boronici RB(OH) 2 dai quali, per
disidratazione, si ottengono le borossine (RBO)3
3RB(OH)2 → (RBO)3 + 3H2O
Le borossine sono trimere con struttura cicilica costituita da un anello planare
di atomi di boro (ibridati sp2) e di ossigeno alternati . I gruppi alchili giacciono
anch’essi sul piano dell’anello.
Alluminio
I composti metallorganici dell’alluminio sono abbastanza ben conosciuti. Si
preparano ad esempio tramite le reazioni seguenti:
1. 3R2Hg + 2Al → 2R3Al + 3Hg
2. RMgCl + AlCl3 → RAlCl2 + MgCl2
3. AlH3 + 3CnH2n → Al(CnH2n+1)3
4. LiAlH4 + 4CnH2n → Li[Al(CnH2n+1)4]
Gli alluminio alchil inferiori sono liquidi reattivi che si incendiano all’aria e
reagiscono esplosivamente con l’acqua. Tutti gli altri derivati sono sensibili
all’aria e all’acqua sebbene non tutti siano infiammabili spontaneamente. Gli
alchil derivati sono acidi di Lewis e reagiscono con i litio alchili:
R3Al + LiR → LiAlR4
La struttura di questi composti è costituita da catene in cui gruppi AlR 4tetraedrici sono alternati a ioni Li+ in modo tale che ciascun atomo di litio
risulta circondato tetraedricamente da quattro atomi di carbonio in α,
sufficientemente vicini da denunciare l’esistenza di deboli legami Li-C.
L’alluminio trietilesesquicloruro (C2H5)3Al2Cl3 è impiegato come catalizzatore
(catalizzatore di Ziegler) nella polimerizzazione di etilene, propilene, etc.
Silicio
Le energie dei legami Si-C sono inferiori a quelle dei legami C-C, ma ancora
sufficientemente elevate da far prevedere una notevole stabilità dei composti
recanti tale legame. La reattività del legame Si-C è maggiore di quella del
legame C-C e ciò è dovuto alla polarizzazione del legame Siδ+-Cδ- che
favorisce un attacco elettrofilo sul carbonio e nucleofilo sul silicio. C’è inoltre
da tener presente la disponibilità degli orbitali d sull’atomo di Si che permette
la formazione di composti di coordinazione.
Una classe di derivati organici molto importante per le reazioni di idrolisi che
questi subiscono è quella degli alogenuri di silicio-alchile o –arile. Si possono
preparare attraverso normali reazioni di Grignard a partire da SiCl 4. Questi
alogenuri sono liquidi e vengono facilmente idrolizzati dall’acqua. Raramente
possono essere isolati gli intermedi, i cosiddetti silanoli R3SiOH, R2Si(OH)2,
RSi(OH)3. I prodotti di condensazione che derivano da questi ultimi per
eliminazione di acqua, i silossani, sono invece stabili. I silossani hanno
strutture polimeriche con unita ripetitive del tipo –O-SiR2-O-con strutture
variabili dalla lineare alla ciclica, oppure possono assumere complicate
strutture reticolari con particolari caratteristiche fisiche: i siliconi. Il
meccanismo delle reazioni dei composti metallorganici del silicio è abbastanza
complicato e non viene qui discusso.
Piombo
I composti metallorganici più noti del Pb sono il Pb(CH3)4 ed il Pb(C2H5)4,
impiegati in un recente passato come additivi antidetonanti nelle benzine.
Questi composti si possono preparare a partire da una lega sodio-piombo:
4Na-Pb + 4R-Cl → R4Pb + 3Pb + 4NaCl
Come si vede dallo schema di reazione si ha una resa del 25% rispetto al Pb
impiegato. Si preferisce allora ricorrere all’elettrolisi del NaAlEt 4 impiegando
l’anodo di piombo ed il catodo di mercurio:
4NaAlEt4 + Pb → PbEt4 + 4Na + 4AlEt3
4Na + 2H2 → 4NaH
4NaH + 4AlEt3 + 4C2H4 → 4NaAlEt4 (con rigenerazione dell’elettrolita)
Fosforo
I derivati organici più importanti sono gli alchil(aril) e gli ossialchil(aril)
derivati. Questi vengono preparati facendo reagire gli alogenuri e gli
ossoalogenuri, rispettivamente, con i reattivi di Grignard:
(O)PX3 + 3RMgX → (O)PR3 + 3MgX2
Il più noto di questi composti è la trimetilfosfina che è spontaneamente
infiammabile all’aria, mentre i trialchil derivati superiori si ossidano più
lentamente. La trifenilfosfina viene usata largamente nella reazione di Wittig
per la sintesi delle olefine.
Le trialchil- e le triarilfosfine sono dei buoni donatori nei confronti dei metalli
di transizione del blocco d.
Mercurio
I composti mercurio organici sono del tipo R2Hg o RHgX e vengono
generalmente preparati a partire da HgCl2 per reazione con RMgX.
I composti RHgX sono solidi cristallini le cui proprietà dipendono dalla natura
di X. Se X è un atomo o il gruppo atomico in grado di dare legami covalenti
con il mercurio il composto formatosi sarà una sostanza covalente, non polare,
solubile nei solventi apolari. Viceversa se l’atomo o il gruppo atomico forma
legami ionici.
I dialchil ed i diaril derivati sono liquidi apolari, poco sensibili all’aria e
all’acqua ma instabili fotochimicamente e termicamente.
Zinco e Cadmio
I composti metallorganici dello Zinco sono storicamente importanti perchè
sono stati i primi ad essere preparati. I composti si preparano o partire da un
derivato magnesiaco R2Mg + Zn → R2Zn + Mg oppure a partire da ioduri
di alchile 2RI + 2Zn → 2RZnI che per riscaldamento → R2Zn +ZnI2.
I composti cadmio organici del tipo RCdX si preparano a partire dai R2Cd per
reazione con CdI2 in THF. I composti tipo R2Cd a loro volta si preparano
trattando CdI2 con RLi o con RMgX.
I composti R2Zn e R2Cd sono liquidi apolari o solidi a basso p.f. solubili nella
maggior parte dei solventi organici.
Sono tutti sensibili alla presenza dell’aria e dell’acqua.