Titolo: Spettroscopia d’emissione
Esperienza n°3
Obiettivo: Osservazione delle colorazioni alla fiamma emesse da sostanze contenenti
metalli ed interpretazione degli spettri attraverso la teoria atomica di Bohr.
Materiali ed apparecchiature utilizzate:
Becco bunsen
Bacchetta di vetro con filo di nichel-cromo
Provetta con acido cloridrico
Sale di bario (Ba)
Sale di potassio (K)
Sale di stronzio (Sr)
Sale di rame (Cu)
Sale di calcio (Ca)
Sale di litio (Li)
Sale di sodio (Na)
Spettroscopio
Vetrino (filtro)
Descrizione esperienza:
Dopo aver intinto il filo di metallo della bacchetta nell’acido cloridrico l’abbiamo fatto
stare sulla fiamma del bunsen per eliminare sostanze persistenti che erano rimaste su
di esso da altre prove.
Una volta pulita la bacchetta col filo l’abbiamo intinta nuovamente nell’acido, poi nel sale
di bario, quindi l’abbiamo messa sulla fiamma.
La fiamma appariva di un verde chiaro, attraverso il vetrino non si vedeva nulla, e non si
vedeva niente neanche attraverso lo spettroscopio.
Con la stessa procedura, abbiamo messo sul bunsen il sale di potassio. A occhio nudo la
fiamma appariva arancione, con il vetrino non si vedeva nulla, con lo spettroscopio si
vedeva la fiamma gialla.
Dopo aver intinto nell’acido il filo e preso con la punta un po’ di sale di stronzio,
l’abbiamo messo sulla fiamma del bunsen (a 2/3 di questa in altezza). La fiamma era
rossa, ma sia dal vetrino che dallo spettroscopio, questa appariva arancione.
Il sale che abbiamo messo poi sulla fiamma è stato quello del rame. Ad occhio nudo la
fiamma era tra il verde e il blu, con il vetrino, invece appariva celeste e, verde, con lo
spettroscopio.
Come successo con altri sali, la luce del calcio è stata visibile solo ad occhio nudo e con il
vetrino. Ad occhio nudo è stata tra l’arancio e il rosso, e con il vetrino è stata arancione.
Con il litio è stata rossa sia ad occhio nudo che con lo spettroscopio, attraverso il
vetrino, invece, è stata arancione.
La fiamma del sodio è stata gialla ad occhio nudo, mentre con il vetrino e con lo
spettroscopio non si è visto nulla.
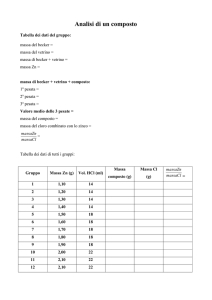
Tabelle e grafici:
Ba
K
Sr
Colore
Verdastro Arancione Rosso
chiaro
Colore
vetrino
Non si
evidenzia
Non si
Colore
spettroscopio evidenzia
Cu
Ca
Li
Na
VerdeBlu
Arancione Rosso- Giallo
-Rosso
Fucsia
Non si
evidenzia
Arancione Celeste Arancione Fucsia
Non si
evidenzia
Giallo
Arancione Verde
Non si
evidenzia
Non si
evidenzia
Rosso
Conclusioni:
Abbiamo osservato in questa esperienza, come le sostanze assorbono energia e cedono
luce.
Questo perché quando un atomo assorbe energia fa salire di livello i suoi elettroni,
emettendo una particella chiamata fotone, quindi luce.
Ogni elemento ha uno spettro diverso e questo è possibile verificarlo sia con un filtro di
vetro, sia con una spettroscopio.
Lo spettroscopio è uno strumento che scompone la luce visibile nelle sue lunghezze
d’onda ed è possibile vedere la lunghezza d’onda che prevale.
Fondamentalmente è formato da un prisma che rifraziona la luce che entra da un foro.
Il vetrino violaceo, invece, è un semplice filtro nel quale le lunghezze d’onda uguali a
quella del vetro non sono visibili.
Abbiamo interpretato questi fenomeni utilizzando la teoria atomica di Rutherford,
perfezionata poi, da Bohr.
Secondo la teoria atomica di Rutherford, gli elettroni perdendo energia, dovevano
cadere a spirale nel nucleo fino a precipitare su di esso.
Nel modello atomico di Bohr non accadeva che gli elettroni precipitassero sul nucleo, ma
che questi cedessero energia passando ad un livello superiore.
Noi, riscaldando i sali con il becco Bunsen a temperature elevate, abbiamo fatto
vaporizzare queste sostanze che accumulando energia hanno fatto salire gli elettroni a
livelli superiori liberando fotoni che abbiamo visto nelle diverse colorazioni della
fiamma.