AREA SCIENTIFICA
COMPETENZE DI BASE FISICO – CHIMICHE
SCHEDA NR. 03 – I PASSAGGI DI STATO
Docente M.Giustinelli
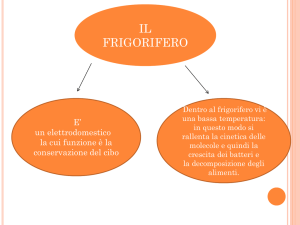
I PASSAGGI DI STATO
Ogni sostanza può esistere in ognuno di questi stati e quindi può passare da uno stato ad un altro; questi passaggi si
chiamano appunto passaggi di stato.
I passaggi di stato hanno i seguenti nomi:
Fusione: passaggio da solido a liquido
Vaporizzazione: passaggio da liquido ad aeriforme
Liquefazione: passaggio da aeriforme a liquido
Solidificazione: passaggio da liquido a solido
Sublimazione: passaggio diretto da solido ad aeriforme e viceversa (il passaggio inverso viene anche chiamato
brinamento).
I passaggi di stato sono fenomeni fisici, perché non danno luogo a cambiamenti nella composizione delle sostanze
interessate.
Ad esempio, il ghiaccio, l’acqua allo stato liquido e il vapore acqueo sono tutti costituiti da molecole di acqua, H 2O; è
diverso solo i modo con cui queste molecole sono unite fra di loro, o nel caso del vapore non sono unite affatto.
I passaggi di stato avvengono a temperature caratteristiche per ogni sostanza pura.
Per ogni sostanza avremo quindi una temperatura di fusione e una temperatura di ebollizione.
La temperatura a cui avviene un passaggio di stato dipende anche dalla pressione.
L’acqua pura bolle a 100 °C se la pressione è di una atmosfera.
Se la pressione è minore, come succede in alta montagna, l’acqua bolle a una temperatura inferiore.
Se invece la pressione è maggiore di una atmosfera, l’acqua bolle a una temperatura superiore ai 100°C.
E’ quello che avviene nella pentola a pressione: la cottura dei cibi è più rapida perché avviene ad una temperatura
maggiore.
Abbassando fortemente la pressione è possibile far bollire l’acqua anche a temperatura ambiente.
Durante un passaggio di stato, la temperatura rimane costante fino a quando il passaggio stesso non si è completato.
La fusione e l’ebollizione avvengono per riscaldamento della sostanza, la liquefazione e la solidificazione per
raffreddamento.
LA FUSIONE
Quando si riscalda un solido la sua temperatura aumenta.
Questo significa che le molecole compiono oscillazioni sempre più ampie e veloci intorno alle loro posizioni di equilibrio
nel reticolo cristallino.
Nel momento in cui si arriva alla temperatura di fusione, l’agitazione termica delle particelle è tale che il reticolo comincia
a rompersi.
Per tutta la durata della fusione, il calore che viene somministrato dall’esterno non viene utilizzato per far aumentare la
temperatura, ma per rompere il reticolo cristallino.
Solo quando tutto il solido si è trasformato in liquido è possibile fare aumentare la temperatura del sistema.
Generalmente la fusione è caratterizzata da un aumento di volume.
LA VAPORIZZAZIONE
Il passaggio da liquido ad aeriforme può avvenire in due modi: evaporazione ed ebollizione.
Di questi due fenomeni, soltanto l’ebollizione presenta tutte le caratteristiche di un passaggio di stato, perché avviene ad
una temperatura fissa per ogni sostanza, e la temperatura del sistema resta costante per tutta la durata del passaggio di
stato.
Man mano che si fornisce calore a un liquido, l’agitazione termica delle sue particelle aumenta.
Quando si raggiunge la temperatura di ebollizione, l’agitazione termica è tanto forte che il suo effetto prevale sulle forze
di attrazione fra le molecole del liquido; le molecole, quindi, si separano l’una dall’ altra, e passano allo stato di vapore.
L’evaporazione è un processo più lento, avviene a qualsiasi temperatura e interessa solo la superficie del liquido: sono
cioè le molecole della superficie che un po’ alla volta si staccano dalle loro vicine e si mescolano all’aria.
Più la temperatura dell’ambiente è elevata, più velocemente avviene l’evaporazione.
Inoltre, siccome il fenomeno interessa solo la superficie del liquido, più ampia è questa superficie più
rapidamente avviene l’evaporazione.
LA LIQUEFAZIONE
La liquefazione è il passaggio da aeriforme a liquido.
Per farla avvenire senza variare la pressione, bisogna raffreddare il gas fino alla temperatura di liquefazione.
A questo punto il gas comincia a condensare formando goccioline di liquido, cioè le molecole del gas cominciano a
formare dei legami fra loro, a unirsi l’una all’altra: si formano così le goccioline di liquido.
Se si continua a raffreddare la temperatura non cambia, ma una quantità sempre maggiore di gas si trasforma in liquido.
Soltanto quando tutto il gas è divenuto liquido è possibile fare abbassare la temperatura del liquido, se si continua a
sottrarre calore.
Durante la liquefazione la temperatura rimane costante, perché il calore che viene sottratto dall’esterno con il
raffreddamento è compensato dal calore che si sviluppa nel processo di formazione del liquido, cioè nella
formazione di legami fra una molecola e l’altra.
LA SOLIDIFICAZIONE
Quando un liquido viene raffreddato, la sua temperatura si abbassa.
Quando raggiunge la temperatura di solidificazione il liquido comincia a trasformarsi in un solido e la temperatura non si
abbassa più.
Il calore sottratto con il raffreddamento viene compensato dal calore che si sviluppa nel processo di formazione del
reticolo cristallino del solido.
Infatti durante la solidificazione le molecole del liquido si dispongono man mano secondo la struttura ordinata propria dei
solidi, e questo è un processo che sviluppa calore.
LA SUBLIMAZIONE
La sublimazione, passaggio diretto da solido a vapore, avviene soprattutto per alcune sostanze.
E’esperienza comune vedere che il ghiaccio “fuma”, cioè ha intorno del vapore; quel vapore è prodotto appunto dalla
sublimazione del ghiaccio.
Ad esempio, se lasciamo all’aria un quadretto di canfora o una pallina di naftalina, vediamo che dopo un po’ di giorni le
loro dimensioni si sono ridotte; il quadretto e la pallina sono diventati più piccoli, e col passare del tempo lo diventano
sempre di più, fino a scomparire; questo perché anche la naftalina e la canfora sublimano, passando lentamente allo
stato gassoso.
La sublimazione è tanto più intensa quanto minore e la pressione.
Ci sono sostanze che non sublimano a pressione ordinaria, ma sublimano se la pressione viene diminuita.E per le
sostanze che già sublimano a pressione ordinaria, l’entità della sublimazione diviene maggiore se si riduce la pressione