LA TERMODINAMICA
La termodinamica è quella branca della fisica che descrive le trasformazioni subite da un sistema in
seguito ad un processo di scambio di energia con altri sistemi o con l'ambiente esterno.
La termodinamica classica si basa sul concetto di sistema macroscopico, ovvero una porzione di
materia fisicamente o concettualmente separata dall'ambiente esterno, che spesso per comodità si
assume non perturbato dallo scambio di energia con il sistema.
Lo stato di un sistema macroscopico che si trova all'equilibrio è specificato da grandezze dette
variabili termodinamiche o di stato come la temperatura, la pressione, il volume, la composizione
chimica.
Gli stati di equilibrio sono stati “semplici” perché possono essere specificati da pochi parametri
quali energia, volume, pressione, temperatura, numero di moli,…Il passaggio da uno stato di
equilibrio all’altro viene detto trasformazione termodinamica o cambiamento di stato.
La termodinamica studia dunque il calore: il modo in cui questo si trasmette, la sua capacità di
trasformarsi in altre forme d’energia il modo in cui altera le altre proprietà dei corpi convertendo
per esempio un solido in un liquido.
Questa disciplina si basa su tre sole leggi, o meglio, tre principi.
PRIMO PRINCIPIO: Il calore è energia e l’energia non si crea né si distrugge
SECONDO PRINCIPIO: Il calore fluisce spontaneamente dai corpi più caldi a quelli più
freddi, mai viceversa
TERZO PRINCIPIO: Raggiungere lo Zero Assoluto è impossibile
Principio ZERO: Se tra due corpi in contatto non scorre calore, allora hanno la stessa
temperatura, e viceversa.
PRIMO PRINCIPIO DELLA TERMODINAMICA
Il calore è una forma di energia, e l'energia non si crea né si distrugge (ma si trasforma in
continuazione). Questo, in sintesi, afferma il primo principio. Ma che cos'è l'energia? Non è facile
rispondere, perché tutto è energia, dal tepore del termosifone all'esplosione di una bomba, dalla luce
alla materia stessa. Una definizione precisa, tuttavia, esiste: l'energia di un oggetto è la sua
capacità di fare lavoro, ossia di esercitare una forza producendo uno spostamento.
Un esempio? Se si spinge un'auto in panne allora si fa del lavoro (e si spende energia). Questo
lavoro è pari alla forza applicata moltiplicata per lo spostamento ottenuto. Quando l'auto non è
guasta, il lavoro lo fa il motore: l'energia è prodotta dallo scoppio della miscela di benzina e aria che
fa muovere il pistone. In parole povere, è energia l'attitudine a produrre movimento.
E il calore? Quando scaldiamo un oggetto, ne aumentiamo l'energia interna accelerando i suoi
atomi. L’ energia interna rappresenta l’energia complessiva (cinetica + potenziale) del sistema
Questo aumento di energia interna è ciò che chiamiamo comunemente calore
mentre la temperatura di un corpo è la nostra percezione dei movimenti delle sue particelle.
Il calore e il lavoro sono energie che vengono trasferite e, in questo caso, non è più possibile
distinguerle una dall’altra. Il calore può essere visto come quella quantità di energia trasferita dal
sistema non attraverso il lavoro, ma come energia in transito entro i confini del sistema, transito
causato da un salto di temperatura tra il sistema e l'ambiente circostante: si può quindi parlare di
assorbimento o cessione di calore ma non di calore contenuto in un sistema. Un sistema infatti
possiede un'energia interna, non del calore.
La descrizione matematica del primo principio è la seguente
UUfinale-UinizialeQL
dove U rappresenta l’energia interna del sistema, Q il calore e L il lavoro. Il simbolo U indica una
variazione dell’energia interna intesa come differenza tra il valore finale e quello iniziale e sta
anche ad indicare che l’energia interna è una funzione di stato, cioè una funzione la cui variazione
dipende solo dalle condizioni iniziali e finali della trasformazione che sta avvenendo ma non dal
percorso effettuato dalla trasformazione. Il calore e il lavoro, invece, non sono funzioni di stato per
cui la loro variazione dipende dal tipo di trasformazione effettuata. Per questo motivo si utilizza il
simbolo .
La formulazione matematica del primo principio ha la seguente interpretazione: quando un sistema
passa dallo stato iniziale i allo stato finale f, la variazione dell'energia interna non dipende dalla
particolare trasformazione eseguita ma soltanto dallo stato iniziale e da quello finale, ed è pari
all'energia acquisita dall'ambiente circostante come flusso di calore (Q) meno il lavoro (L)
eseguito sull'ambiente circostante. Il primo principio della termodinamica può essere applicato in
ogni processo che avviene in natura in cui intervengano scambi di energia anche sotto forma di
calore. Esso vale sia per processi reversibili che per processi irreversibili.
Il primo principio della termodinamica stabilisce dunque l'equivalenza tra calore e lavoro
meccanico: è possibile quindi, in base al primo principio della termodinamica, assorbire calore da
un termostato e trasformarlo in lavoro meccanico. Il primo principio della termodinamica è quindi
particolarmente importante, perché per la prima volta permette di ottenere movimento (lavoro
meccanico) partendo dal calore che movimento non è, almeno dal punto di vista macroscopico.
Prima di questa equazione bisognava partire da qualcosa in moto per produrre movimento da
qualche altra parte: cascate, vento, movimento prodotto dalla forza muscolare di animali o schiavi,
ecc. E' chiaro che il primo principio della termodinamica apre nuove prospettive.
SECONDO PRINCIPIO DELLA TERMODINAMICA
Quando si fornisce calore a un oggetto, dunque, si aumenta la sua energia interna. Ma non sempre
questo ha l'effetto di aumentarne la temperatura. Durante l'ebollizione, e cioè a 100 gradi, purché ci
si trovi a livello del mare e quindi alla pressione di 1 atmosfera, l'acqua viene trasformata da liquido
a gas. In questo caso, fornire più calore serve solo a far evaporare l'acqua più velocemente. Ecco
perché quando l'acqua bolle conviene abbassare la fiamma: la temperatura resta di 100 gradi e si
risparmia gas. Questo fenomeno si chiama transizione di fase.
Se la termodinamica si fosse fermata al primo principio, molte domande sarebbero rimaste senza
risposta. Per esempio, perché non capita che il vapore ridiventi acqua in una pentola vuota,
cedendo calore all'ambiente? Oppure, domanda equivalente: perché non si riesce a trasformare
completamente il calore in lavoro? Qualunque motore, infatti, dai primitivi sistemi a vapore alle
più moderne turbine, sfrutta solo una parte dell'energia fornita (spesso non più del 25%).
All'inizio dell'800 si pensava che fosse soltanto una questione tecnica.
Invece non era così: anche se il primo principio permetterebbe di trasformare interamente il calore
in lavoro, c'è un guastafeste che lo rende impossibile: il secondo principio.
Questo principio ha varie formulazioni, ciascuna delle quali aiuta a capirlo un po' di più. Eccone tre:
1. Il calore va, spontaneamente, sempre da un corpo più caldo a uno più freddo
2 . E' impossibile trasformare calore in lavoro, senza altre conseguenze, prelevandolo da
un'unica sorgente; (in caso contrario potremmo assorbire calore dall'oceano, diminuendone la
temperatura ma procurandoci un'energia praticamente illimitata)
3. In natura esistono processi, come un fiammifero che brucia o un bambino che cresce, che
possono svolgersi solo in un senso
Il secondo principio della termodinamica non vieta la trasformazione integrale del calore assorbito
in lavoro, solo che la trasformazione deve essere accompagnata da qualche modifica delle
condizioni del sistema o dell'ambiente circostante.
Se il secondo principio non fosse vero si potrebbe pensare di estrarre energia dall'oceano e
trasformarlo in lavoro meccanico per esempio per far muovere una nave su di esso. Oppure si
potrebbe pensare di estrarre energia interna dall'aria e far funzionare in questo modo una centrale
elettrica. Sia l'oceano che l’atmosfera hanno una energia interna elevatissima. Nessuna delle due
trasformazioni menzionate è contraria al primo principio della termodinamica; la loro realizzazione
è vietata dal II principio della termodinamica, che pertanto non è contenuto nel primo, ma si
presenta come una legge di natura indipendente che contempla un aspetto dei fenomeni naturali non
considerato dal primo principio.
Il secondo principio della termodinamica riconosce il fatto che molti fenomeni naturali avvengono
in un verso ben preciso e che pertanto sono intrinsecamente irreversibili: non è possibile realizzare
una combinazione di fenomeni naturali che ripristini esattamente lo stato iniziale.
Consideriamo per esempio il passaggio di calore da un corpo a un altro a temperatura più bassa: il
secondo principio della termodinamica vieta il processo inverso cioè il passaggio di calore dal corpo
a temperatura più bassa a quello a temperatura più alta senza produrre alcuna modifica nel sistema
stesso o nell'ambiente circostante (affinché il calore venga trasferito dal corpo freddo a quello caldo
occorre eseguire del lavoro esterno).
L’ENTROPIA
L’entropia è una funzione di stato che si introduce insieme al secondo principio della
termodinamica e che viene interpretata come una misura del disordine di un sistema fisico o più in
generale dell'universo. In base a questa definizione possiamo dire che quando un sistema passa da
uno stato ordinato ad uno disordinato la sua entropia aumenta.
In una goccia d'acqua per esempio, si trovano miliardi di miliardi di miliardi di atomi, a loro volta
composti da migliaia di particelle elementari. Eppure possiamo definire la goccia in base a poche
caratteristiche, come forma, peso e temperatura, che non dipendono certo dalla sua particolare
configurazione microscopica: se rallentiamo una molecola per accelerarne un'altra, la goccia non
cambia.
Ebbene, più sono i modi in cui la goccia può cambiare dal punto di vista microscopico, restando
però identica dal punto di vista macroscopico, e più è elevata la sua entropia. Questa grandezza è la
misura del disordine microscopico di un sistema. Quel che succede in un processo irreversibile è
che parte dell'energia degli oggetti coinvolti va ad aumentare il loro disordine interno (cioè va a
perdersi nel movimento microscopico delle particelle che lo compongono) e non può più essere
utilizzata per creare lavoro macroscopico.
Più precisamente, l'entropia di un sistema isolato che cioè non scambia né calore né lavoro con
l'esterno, non può mai diminuire.
L'energia, dunque, tende a degradarsi o, meglio, a distribuirsi tra i corpi in contatto termico fino a
che tutti non raggiungono la stessa temperatura. E a questa legge non sfugge l'universo stesso. Le
stelle, per esempio, prima o poi si spegneranno e il cosmo intero diventerà una "zuppa" a
temperatura uniforme e bassissima in cui non sarà possibile alcuna forma di vita né alcuna forma di
movimento macroscopico. Perché, come abbiamo visto, nessuna macchina (o organismo) può
funzionare estraendo calore da un'unica sorgente.
Il concetto di processo termodinamico reversibile di un dato sistema è collegato all’idea che si
possa passare dallo stato i allo stato f attraverso una successione infinita di stati di equilibrio, per
ognuno dei quali sono definite le variabili di stato del sistema (P,V,T).
In un processo reale, che è irreversibile, non è possibile definire le variabili P,V,T negli stati
intermedi. Queste possono essere definite solo negli stati di equilibrio i ed f. Si dice che in un
processo irreversibile il sistema non è termodinamicamente definito negli stati intermedi. Tuttavia,
qualunque sia l’evoluzione reale del sistema, si può definire la grandezza S, detta entropia, che è
una funzione di stato per cui la sua variazione, durante la trasformazione considerata, non dipende
dal cammino percorso dal sistema durante la trasformazione ma solo dallo stato iniziale i e da
quello finale f.
In natura hanno luogo i processi più probabili, quelli in cui si sviluppa calore, quelli in cui il
disordine aumenta, quelli in cui l'entropia aumenta cioè S>0. In questo modo di vedere, i sistemi
ordinati sono quelli a bassa entropia, mentre quelli disordinati sono quelli ad alta entropia: in natura
si preferiscono le trasformazioni da bassa ad alta entropia, tutte quelle in cui l'entropia dello stato
finale è maggiore di quella dello stato iniziale, tutte quelle in cui l'entropia aumenta. E proprio
quest'ultimo è un altro modo di enunciare il 2° principio della termodinamica: in un sistema isolato
possono aver luogo solo quei processi in cui l'entropia aumenta e poiché quelli sono i soli processi
possibili, facendo un bilancio tra tutti i possibili processi che avvengono nell'universo, si può anche
dire che l'entropia dell'universo aumenta.
Dire che l'entropia dell'universo aumenta significa dire che il disordine dell'universo aumenta e,
quindi, che tutti i processi che avvengono tendono a produrre calore il quale va, poco a poco, ad
accumularsi in quell'immenso serbatoio che è l'universo. Quindi l'energia utilizzata e prodotta in
qualunque parte di questo universo scarica in esso una parte di calore.
Energia interna ed entropia soddisfano le seguenti due affermazioni:
Tra tutti gli stati vincolati ad assumere energia interna U costante, lo stato di equilibrio è
quello con entropia S massima, cioè è uno stato con il massimo disordine molecolare
Tra tutti gli stati vincolati ad assumere entropia =costante (stati isoentropici), lo stato di
equilibrio è quello con energia interna U minima.
MECCANICA STATISTICA
La goccia d'acqua che osserviamo ad occhio nudo, ci appare come un qualcosa di continuo e
regolare, ma ad un'osservazione accurata con sistemi di misura sofisticati, scopriamo una struttura
fine molecolare, atomica, subatomica.... Se invece ci allontaniamo vediamo la nostra goccia d'acqua
come parte minuscola di un mare, che, allontanandoci ancora, ci appare ora come parte minuscola
di un oceano, e, proseguendo, della terra, del sistema solare...
La natura ha dunque una struttura gerarchica fatta a livelli, ogni livello ha le sue caratteristiche e
una teoria fisica che le spiega o cerca di spiegarle. In prima approssimazione, ogni livello è
indipendente dagli altri, ma, a volte, alcuni fenomeni non possono essere spiegati senza studiare
quelli sottostanti.
La Meccanica Statistica è la disciplina che studia questo problema relativamente alla connessione
tra le grandezze macroscopiche, termodinamiche e idrodinamiche che caratterizzano un fluido sulla
scala dei centimetri o dei chilometri in termini delle interazioni microscopiche intermolecolari delle
sue componenti che in generale avvengono sulla scala dell'angstrom. Il passaggio tra questi due
livelli (che chiameremo semplicemente macroscopico e microscopico) coinvolge una drastica
riduzione di informazione se pensiamo che un elemento di fluido (per esempio un centimetro cubo
d'acqua) può contenere 1023 molecole e, macroscopicamente, il suo stato è descritto da pochi
parametri, densità, temperatura,... Intervengono perciò nel passaggio dal microscopico al
macroscopico, complessi fenomeni di natura statistica per cui le singole componenti contribuiscono
a comportamenti collettivi in cui perdono la propria individualità. Per citare un ben noto e
sorprendente fenomeno in un campo totalmente diverso, si sa che ``con grande accuratezza'' è
possibile predire il comportamento elettorale di una nazione di 50 milioni di persone dalla
conoscenza del voto di qualche migliaio di elettori, pur essendo i singoli cittadini liberi di
esprimere il voto a loro completo gradimento. L'insorgere di un concetto statistico nello studio della
meccanica (legato appunto al cambio di scala dal microscopico al macroscopico) è tra i più
affascinanti e dibattuti sia da un punto di vista strettamente scientifico, che concettuale e filosofico.
La meccanica statistica non è altro che l'applicazione della statistica (che include strumenti
matematici) per gestire insiemi formati da numerosi elementi al campo della meccanica, che si
occupa del moto di particelle o di oggetti quando soggetti ad una forza, ed in particolare si occupa
dello studio di sistemi composti da molte particelle (es. sistemi termodinamici).
Per lo studio di questi sistemi è necessario un approccio statistico per due motivi:
1. Da un punto di vista classico, lo studio di un sistema con N particelle non interagenti
richiede la soluzione di N equazioni differenziali (ovvero, le equazioni del moto di Newton
di ogni particella). La difficoltà nel determinare la dinamica di un sistema a molte particelle
non solo consiste nell'elevato numero di equazioni da risolvere ma anche nell'impossibilità
di risolvere analiticamente sistemi con particelle interagenti (come ad esempio il problema
dei tre corpi o l'urto anelastico).
2. Per risolvere le innumerevoli equazioni di un sistema a molte particelle è necessario stabilire
le condizioni iniziali di ogni particella, cioè posizione e quantità di moto (ad esempio)
all'istante di tempo scelto come iniziale. Questo è un problema intrinsecamente irrisolubile,
perché le leggi della meccanica quantistica ci dicono che non è possibile conoscere con
esattezza e contemporaneamente due grandezze (ad esempio appunto posizione e quantità di
moto) di una particella. Se il problema al punto 1 era solo un problema "pratico", questo è
un problema di tipo teorico, legato alle leggi fondamentali della natura.
La meccanica statistica fornisce un modello per collegare le proprietà di atomi singoli e molecole
alle proprietà macroscopiche dei materiali che vediamo nella vita quotidiana, spiegando dunque la
termodinamica come un risultato naturale di statistica e meccanica (classica e quantistica) a livello
microscopico. In particolare può essere usata per calcolare le proprietà termodinamiche dei
materiali a partire dai dati spettroscopici delle singole molecole.
Questa abilità di fare previsioni microscopiche basate su proprietà microscopiche è il vantaggio
maggiore della meccanica statistica sulla termodinamica. Entrambe le teorie si fondano sul secondo
principio della termodinamica attraverso il mezzo dell'entropia. Ma, l'entropia in termodinamica
può essere conosciuta solo empiricamente, mentre in meccanica statistica essa è una funzione della
distribuzione del sistema nei suoi microstati. Il microstato descrive una specifica e dettagliata
configurazione di un sistema, che il sistema attraversa durante le sue fluttuazioni termiche. Invece il
macrostato di un sistema si riferisce alle proprietà macroscopiche di tale sistema come la
temperatura e la pressione. In meccanica statistica, un macrostato è caratterizzato da una
distribuzione di probabilità su un certo insieme di microstati. Questa distribuzione descrive la
probabilità di trovare il sistema in un certo microstato quando è soggetto a fluttuazioni termiche.
Il postulato fondamentale della meccanica statistica (conosciuto anche come postulato
dell'equiprobabilità a priori) è il seguente:
Dato un sistema isolato in equilibrio, ogni microstato ha eguale probabilità di manifestarsi.
Questo postulato è una premessa fondamentale in meccanica statistica in quanto stabilisce che un
sistema in equilibrio non ha nessuna preferenza per nessuno dei suoi microstati possibili. Dati Ω
microstati a una particolare energia, la probabilità di trovare il sistema in un particolare microstato è
p = 1/Ω.
Questo postulato è necessario perché permette di concludere che per un sistema in equilibrio, lo
stato termodinamico (macrostato) che può risultare dal maggior numero di microstati è anche il
macrostato più probabile del sistema.
Nella studio dei sistemi si introduce lo spazio delle fasi del sistema come lo spazio i cui punti
rappresentano univocamente tutti e soli i possibili stati del sistema. Nella meccanica classica lo
spazio delle fasi di solito rappresenta tutte le possibili posizioni e velocità di ogni punto materiale.
Quindi lo spazio delle fasi è l’insieme degli stati che il sistema può assumere. A seconda delle
caratteristiche dei microstati esistono diversi tipi di insiemi statistici caratterizzati da energia interna
costante, volume costante o numero di particelle costante.
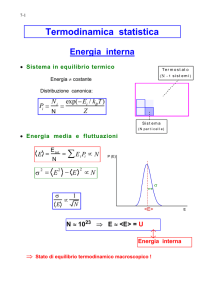
INSIEME MICROCANONICO
L' insieme microcanonico rappresenta l’insieme dei microstati di un descrive un sistema isolato in
cui non avviene scambio di energia (E), particelle (N) e il volume (V) è costante.
L'entropia di un tale sistema può solo aumentare, e lo stato di massima entropia del sistema entropia
corrisponde allo stato di equilibrio termodinamico per il sistema. Poiché un sistema isolato
mantiene costante l'energia, l'energia totale del sistema non fluttua. Pertanto il sistema può accedere
solamente a quei microstati che corrispondono al valore dato E dell'energia. L'energia interna è
quindi strettamente uguale alla sua energia. Chiamiamo
il numero di microstati
corrispondenti a questo valore dell'energia del sistema. Lo stato macroscopico (detto anche
macrostato) di massima entropia per il sistema è quello al quale corrispondono il maggior numero
di microstati. Di seguito è presentata l'equazione di Boltzmann grazie alla quale è possibile
calcolare il valore dell'entropia in un sistema isolato:
dove
è l'entropia del sistema,
è la costante di Boltzmann
INSIEME CANONICO
L’insieme canonico rappresenta l’insieme di microstati di un sistema in cui può avvenire scambio di
energia E. La probabilità
che un sistema macroscopico in equilibrio termico col proprio
ambiente alla temperatura T sia in un dato microstato con energia
è uguale a
dove
Si può introdurre la quantità Z, detta funzione di partizione canonica, la
quale può essere usata per trovare il valore previsto (medio) di una
proprietà microscopica del sistema potendola poi collegare a variabili
macroscopiche. Per esempio, il valore previsto dell'energia
è
interpretato come la definizione microscopica della variabile termodinamica energia interna
,e
può essere ottenuta prendendo la derivata della funzione di partizione con riguardo alla temperatura.
Avere una descrizione microscopica per i potenziali di base termodinamici
(energia interna),
(entropia) è sufficiente per dedurre espressioni per altre quantità termodinamiche. La strategia di
base è la seguente. Può esserci una quantità intensiva o estensiva che entra esplicitamente
nell'espressione per l'energia microscopica
, per esempio il campo magnetico (intensiva) o il
volume (estensiva). Allora, le variabili termodinamiche coniugate sono derivate dell'energia interna.
L’energia interna del sistema corrisponde al valor medio dell’energia calcolato sull’insieme
canonico, cioè
INSIEME GRANCANONICO
Se il sistema sotto studio è un sistema aperto, (sono possibili scambi di materia), e il numero di
particelle è conservato, bisognerebbe introdurre i potenziali chimici, μj, j=1,...,n e rimpiazzare la
funzione di partizione canonica con la funzione di partizione per l' Insieme gran canonico.
Dato chein questo insieme il volume fisso V è fisso ma sia E che N possono fluttuare, le variabili
che controllano tali fluttuazioni sono β (per l’energia) e - βµ (per il numero di particelle)
Se ν denota uno stato con Nν particelle ed energia Eν, allora
e
è la funzione di partizione gran-canonica. Essa è funzione di β, βµ e del volume (le energie Eν
dipendono implicitamente dal volume del sistema).
STATISTICA DI CATENE MOLECOLARI
Consideriamo l’analisi della statistica delle configurazioni di una catena molecolare libera, dove la
valutazione statistica delle proprietà della catena viene fatta mediando su tutte le conformazioni. Le
proprietà che valuteremo sono strettamente legate ai gradi di libertà della catena (angoli e lunghezze
di legame). Le proprietà medie di catena libera (coil) devono essere nettamente distinte da quelle
dello stato nativo in cui molte molecole biologiche (le proteine per esempio) vengono normalmente
trovate.
Le informazioni ottenute sono utili sia nel protein folding che nello studio di altre proprietà delle
macromolecole. In particolare, relativamente al folding, tali modelli risulteranno adatti a descrivere
le proprieta` statistiche di una proteina nello stato unfolded. D’altra parte, c’è una stretta
connessione tra la distanza end-to-end e le proprietà idrodinamiche e altre proprietà fisiche di un
coil, come la viscosità intrinseca ed i coefficienti di sedimentazione. In effetti, è proprio da queste
proprietà che in genere si può cominciare a capire se la catena può essere trattata come un semplice
coil, o invece si debbono introdurre altri tipi di modelli.
In una ipotetica catena polimerica; ogni pallina indica
un atomo o un gruppo di atomi del suo backbone. I
bonds sono indicati con gli indici da 1 a n, (il bond i
unisce gli elementi i-1 e i della catena). Gli angoli
diedrici sono quindi numerati da φ2 a φn-1.
Per catene reali, si suppone spesso che le lunghezze che
gli angoli e dei bonds siano fisse. L’approssimazione, a
causa delle compensazioni statistiche, non genera grandi inesattezze. Quindi, le conformazioni
della catena sono determinate sulla base dei valori degli angoli di rotazione φi.
La distanza end-to-end r corrisponde alla somma dei vettori associati ai bonds, cioè
Il modulo quadro di r sarà dato da
Portando fuori dalla sommatoria gli n termini diagonali (i = j), e tenendo conto dell’uguaglianza
delle lunghezze dei bonds (pari a l), otteniamo
Il valor medio di tale quantità è
dove le parentesi angolari denotano i valori medi. Il problema del calcolo del valor medio del
quadrato della distanza end-to-end, si riduce al calcolo della proiezione media che ogni bond ha
sugli altri. Quindi, i prodotti dipendono dai valori permessi agli angoli di rotazione tra i bonds i e j;
cioè l’orientazione di φi rispetto a quella di φi+1
a)Freely Jointed Chain(random walk)
La catena freely jointed o random walk è un modello astratto in cui la direzione di ogni bond è
completamente scorrelata da ogni altro bond della catena. Quindi, le conformazioni della catena
sono descritte da un random walk (cammino casuale) in cui ogni passo, di lunghezza l, è fatto in una
direzione casuale indipendente dal precedente.
Dato che in questo caso i passi sono completamente scorrelati (cioè casuali), si ha
per cui
Ved
endo la catena come il cammino seguito da una particella, il tempo t intercorso tra il primo e
l’ultimo step sarà essenzialmente proporzionale al numero di step fatti, n. Quindi
Questa relazione costituisce una delle proprietà caratteristiche di una
particella che segue un moto browniano (per esempio, particella di
soluto in un solvente).
b)Catene molecolari con bonds ad angoli fissi
Questo modello, anche se non include effetti di volume escluso, è un passo in avanti rispetto al
modello precedente. Infatti, supporremo che i bond della catena formino angoli fissi (pari a θ)
mantenendo però libertà di rotazioni intorno all’asse dei bond stessi figura qui sotto).
La maggior realisticità del modello risiede nel fatto
che, per esempio nelle proteine i bonds che
compongono i peptidi che costituiscono il backbone
della proteina stessa formano angoli essenzialmente
fissi tra loro. In tali condizioni il calcolo di
comporta
l’effettivo
calcolo
di
e quindi
Tale espressione mostra che, contrariamente al caso della catena freely jointed (random walk) r2 non
dipende solo da n. Tuttavia, nel limite n → ∞ (per λ≠ 1) abbiamo
che comunque ci riporta verso un andamento del tipo di quello del
random walk puro.
Defininendo la quantità
sottostante
in funzione di n di osserva l’andamento nella figura
Ad esempio, per λ= 1/3 ( θ≈ 70.5°) Cn ha l’andamento
mostrato nel grafico e C∞ = 2. Si noti che in generale è
È interessante notare che nel caso di λ= 1, Cn cresce indefinitamente. Ciò è dovuto al fatto che i
bond della catena sono allineati. In effetti, tanto più grande è il valore limite di Cn, cioè C∞, tanto
più i bond della catena tendono ad essere allineati. C∞ può quindi essere visto come una misura di
questa tendenza.