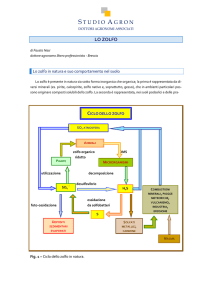
Comportamenti
ZOLFO
Elemento non metallico della famiglia dell'ossigeno. Chimica. Lo zolfo è l'elemento chimico di numero
atomico 16 e di peso atomico 32,064, di simbolo S.
Fonde a 119 °C formando un liquido giallo chiaro, che con l'aumentare della temperatura diventa più scuro e
più viscoso; a 200 °C è nero e pastoso; a temperatura maggiore ritorna fluido pur restando nero; bolle a
444,6 °C.
È insolubile in acqua, poco solubile in benzene, molto solubile in solfuro di carbonio.
Raffreddando vapori di zolfo formati da molecole S2 con azoto liquido, cioè a 195 °C, si ottiene il cosiddetto
zolfo purpureo, instabile, che riscaldato a temperatura ambiente si trasforma in -zolfo. Addizionando
idrogeno solforato a una soluzione acquosa di biossido di zolfo, si ottiene il -zolfo o zolfo colloidale,
dispersione colloidale di zolfo in acqua, mentre il latte di zolfo, sospensione di zolfo in acqua, si prepara
aggiungendo un acido minerale diluito a una soluzione di polisolfuro alcalino.
Chimicamente lo zolfo presenta molte analogie con l'ossigeno, che può sostituire nei composti. Si unisce a
caldo con l'idrogeno e con il carbonio per dar luogo rispettivamente al solfuro di idrogeno o idrogeno
solforato H2S e al solfuro di carbonio CS2, di gran lunga meno stabili dell'acqua e del biossido di carbonio. I
metalli bruciano nei vapori di zolfo, come nell'ossigeno, formando solfuri
Meno elettronegativo degli alogeni e dell'ossigeno, lo zolfo si combina direttamente con il fluoro, il cloro, il
bromo, e brucia in aria con fiamma azzurra generando biossido di zolfo SO2. È di conseguenza un riducente.
Gli alcali fusi lo trasformano in tiosolfato e polisolfuro, l'acido nitrico in acido solforico. con i clorati o con i
nitrati forma miscele esplosive. Lo zolfo è un elemento diffuso in natura; si trova allo stato nativo in vicinanza
degli antichi vulcani, in mezzo a strati di gesso o di calcare, soprattutto in Sicilia, nella Louisiana, nel Texas e
in Giappone, dove esistono i maggiori giacimenti. Più spesso lo zolfo si ritrova combinato con vari metalli,
come pirite FeS2, blenda ZnS e galena PbS. Come solfato si ritrova nello spato pesante BaSO 4, infine come
idrogeno solforato è presente nelle emanazioni vulcaniche, in alcuni gas naturali e in alcune acque, cui
conferisce il caratteristico odore di uova marce, oltre che nel gas naturale e nel petrolio.
Estrazione e usi. I solfuri servono per ricavare i corrispondenti metalli e lo zolfo in essi
contenuto viene trasformato in biossido e poi in acido solforico. Lo zolfo nativo si ottiene con metodi che
consistono nel separarlo dalla ganga per fusione. In Sicilia e in Romagna si usarono per lungo tempo i
calcaroni, forni scavati nel terreno, di solito in collina a mezza costa, a cielo aperto, in cui parte dello zolfo
brucia formando biossido di zolfo e fornendo calore che fonde il rimanente, che cola in stampi