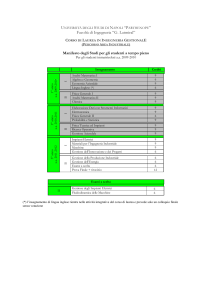
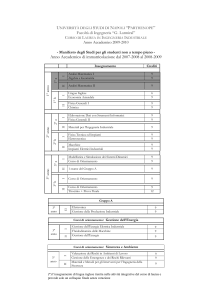
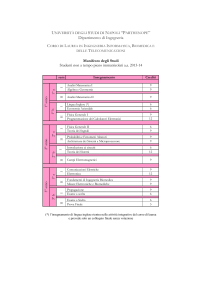
Ingegneria Chimica e Settore Farmaceutico: interazioni sinergiche per
obiettivi comuni
M. Grassi
EURAND, Dipartimento Ricerca, Via del Follatoio 12, 34148-Trieste
URL: http://www.dicamp.univ.trieste.it/
e-mail: [email protected]; [email protected]
Le sinergie tra ingegneria chimica e settore farmaceutico si possono esplicare sia a livello
fondamentale che a livello di processo. Infatti, la maggior parte delle tecnologie
farmaceutiche si basa su aspetti fondamentali quali i fenomeni di trasporto (massa, calore,
quantità di moto), la termodinamica degli equilibri, la reologia e le proprietà chimico-fisiche
dei farmaci. Non c’è dubbio, tuttavia, che la modellazione dei sistemi a rilascio controllato sia
uno dei più importanti anelli saldanti tra i due settori in quanto permette di raggiungere
immediatamente obiettivi comuni quali la previsione delle cinetiche di rilascio in vitro ed in
vivo. Quindi, scopo primario di questo contributo è quello di illustrare alcuni significativi
esempi di interazione sinergica tra i due settori.
Parole chiave: Ingegneria Chimica, Farmacia, Interazioni, Affinità
1 INTRODUZIONE
1.1
Origini dell’Ingegneria Chimica
La fine del diciannovesimo secolo vede un continuo
crescendo
della
competizione
nell’ambito
dell’industria chimica negli allora paesi leader quali
Gran Bretagna, Germania e USA [1]. In questo
contesto non è assolutamente sorprendente che
Lewis M. Norton (Chemistry Department, MIT,
Boston) istituisca un corso in ingegneria chimica.
Gli argomenti trattati si rifanno principalmente alle
attività svolte nelle industrie tedesche, le più
avanzate nel settore chimico a livello mondiale a
quel tempo. Alla morte di Norton (1893), Frank T.
Horpe, laureatosi al MIT di Boston e dottoratosi ad
Heidelberg, assume la docenza del corso in
ingegneria chimica e nel 1898 pubblica il primo
libro a riguardo intitolandolo Outlines of Industrial
Chemistry. Sebbene Norton e Thorpe possono essere
considerati i progenitori dell’ingegneria chimica
mondiale, furono Arthur A. Noyes e, più tardi,
William H. Walker (1869-1934) a delineare le
caratteristiche
fondamentali
del
curriculum
dell’ingegnere chimico [2]. Infatti, mentre Noyes
(laurea in Chimica al MIT di Boston e dottorato
all’Università di Leipzig) fonda un laboratorio di
Chimica Fisica nel 1903, Walker (dottorato
all’Università di Göttigen) fonda nel 1908 un
laboratorio
di
Chimica
Applicata.
Contemporaneamente, in Gran Bretagna, Davis,
pubblicando un libro dal titolo Handbook of
Chemical Engineering (1904), si erge a padre del
concetto di “operazione unitaria” che prevede la
suddivisione dei processi chimici in parti distinte
come, ad esempio, la distillazione, l’estrazione, la
filtrazione, la cristallizzazione, ciascuna governata
da principi distinti. La fondazione dell’American
Institute of Chemical Engineering AIChE, avvenuta
nel 1908, sancisce definitivamente la nascita
dell’ingegneria chimica. Ovviamente, in queste fasi
iniziali di crescita della nuova disciplina che si va
progressivamente staccando dall’originale natura
prettamente chimica, il dibattito su quali debbano
essere esattamente le conoscenze dell’ingegnere
chimico è molto acceso. Milton C. Whitaker, uno dei
primi membri dell’AIChE di cui diventa presidente
1
nel 1914, professore di ingegneria chimica alla
Columbia University, sostiene che chimica, fisica e
matematica debbano costituire le conoscenze di base
alle quali debbono sommarsi nozioni di meccanica,
elettricità ed economia. Inoltre, sottolinea che la
fondamentale differenza tra chimici ed ingegneri
chimici risiede nella capacità degli ingegneri di
trasferire le scoperte di laboratorio a livello
industriale. Intorno al 1920, e sino all’inizio della
seconda guerra mondiale, gli ulteriori sviluppi
nell’ambito del settore delle operazioni unitarie e la
conseguente introduzione della termodinamica e
della cinetica chimica contribuiscono sensibilmente
alla causa ed all’affermazione dell’ingegneria
chimica. Intorno al 1950, lo sviluppo della nuova
disciplina subisce una brusca accelerazione ed un
definitivo distacco dalle sue origini chimiche per
merito di cinque ricercatori americani: Neal R.
Amundson e Rutherford Aris dell’Università del
Minnesota, R. Byron Bird, Edwin N. Lightfoot e
Warren E. Stewart dell’Università del Wisconsin.
Essi promuovono l’innovativa idea secondo la quale
esiste un unico filo conduttore che unifica le
apparentemente diverse operazioni unitarie: le
equazioni di conservazione della massa, dell’energia
e della quantità di moto. La pratica di analizzare
separatamente le varie operazioni unitarie continua
ad esistere, ma il volume differenziale e le equazioni
di bilancio diventano il cuore del nuovo modo di
affrontare le problematiche dell’ingegnere chimico.
Dopo circa 5 anni dalla pubblicazione del
celeberrimo libro intitolato Transport Phenomena
(1960) ad opera di Bird, Stewart e Lightfoot, il
concetto di operazioni unitarie è diventato obsoleto e
la nuova visione si è definitivamente affermata sia a
livello di ricerca che a livello di didattica.
In Italia, come del resto in altri paesi, lo sviluppo
dell’ingegneria chimica è successivo a quello degli
USA. Di fatto, è solo nel dopoguerra, con la ripresa
economica nazionale, che si possono collocare le
origini dell’ingegneria chimica in Italia. Tuttavia,
segni nettamente evidenti di questa disciplina, si
hanno a partire dagli anni ’50. Infatti, in questi anni,
un grosso contributo alla crescita della chimica
italiana, e quindi dell’ingegneria chimica, viene,
indirettamente, dalla nazionalizzazione della
produzione dell’energia elettrica e la conseguente
costituzione dell’ENEL (ente nazionale energia
elettrica). A seguito di ciò, infatti, EDISON, l’allora
principale produttore privato di energia elettrica,
riceve un forte indennizzo dalla stato italiano per la
cessione dei suoi impianti. Tale indennizzo viene
investito nel settore chimico con l’intento, però, di
distaccarsi dalla tradizione chimica antecedente
rappresentato dalla Montecatini. La necessità,
quindi, di acquisire rapidamente un opportuno
background tecnico-scientifico per lo sfruttamento
delle nuove tecnologie chimiche, senza dover
passare attraverso un lento processo di ricerca,
impone di rivolgersi alle grandi realtà chimiche
tedesche come la BASF e la BAYER. Il bisogno di
avere un organismo in grado di ottimizzare e
razionalizzare la comunicazione tra l’investitore e la
controparte tecnica tedesca, spinge, nel 1958, alla
fondazione dell’AIDIC (Associazione Italiana di
Ingegneria Chimica). E’ di questo periodo, il
potenziamento o la formazione dei celeberrimi siti
chimici italiani di Marghera, Mantova e Priolo [3].
Ovviamente, lo sviluppo dell’ingegneria chimica a
livello accademico segue quello industriale ed
infatti, è solo del 1974 la fondazione del GRICU
(Gruppo Ricercatori Italiani di Ingegneria Chimica
dell’Università). E’, comunque, doveroso precisare
che per quella data l’ingegneria chimica è già ben
consolidata all’interno dell’Università italiana e la
formazione del GRICU può essere vista come una
definitiva presa d’atto di questa nuova realtà. Da
allora, lo sviluppo è stato rapido e variegato [4]
nonché ricco di discussioni, anche vivaci [5], sulla
migliore organizzazione da adottare a livello
nazionale.
1.2
Differenziazioni nell’Ingegneria Chimica
Sebbene una netta evidenza dell’estensione degli
orizzonti culturali dell’ingegneria chimica a settori
ad essa tradizionalmente distanti quali la medicina,
la biologia e la farmacia abbia luogo solo a metà
degli anni ’70, la nascita dell’ingegneria biomedica
(BME) si colloca attorno ai primi anni ’60 [1]. Tale
evoluzione si deve a talentuosi ricercatori americani
(Elmer L. Gaden, Arthur B. Metzner, R. Byron Bird,
Edward W. Merrill) che comprendono come
l’ingegnere chimico possa contribuire proficuamente
a settori diversi da quelli tradizionali ed a lui più
familiari, gettando così le basi del concetto di
interdisciplinarietà, che si rivelerà una strategia
vincente nella ricerca moderna. Ovviamente, la
realizzazione di un così profondo cambiamento è
possibile anche perché importanti finanziatori
americani quali il National Science Foundation ed il
National Institutes of Health, decidono di investire
in questi nuovi approcci metodologici alla medicina,
biologia e farmacia. Un esempio dei risultati di tale
2
strategia si può vedere nella tabella 1, dove sono
riportati alcuni tra i più significativi contributi su
questi temi tra gli inizi degli anni ’60 e la fine degli
anni ’70.
Tabella 1. Esempi di importanti contributi di ingegneri chimici
nel settore biomedico.
Soggetto
Autore
Reologia del sangue
Merrill (1959)
Rene artificiale
Leonard (1959)
Emodialisi
Colton (1966)
Biomembrane
Michaels (1966)
Biomateriali non
Merrill (1967)
trombogenetici
Lenti a contatto
Peppas (1976)
Rilascio da matrici
Langer (1976)
polimeriche
Idrogel intelligenti
Peppas (1979)
Come spesso capita, uno dei primi coinvolgimenti di
un ingegnere chimico nel settore biomedico è
totalmente casuale in quanto un medico di Boston si
rivolge a Merrill per risolvere un problema
concernente la misura della viscosità del sangue.
Come conseguenza, si acquisiscono importanti
conoscenze sulle caratteristiche non-newtoniane del
sangue a basse e moderate velocità di deformazione,
in relazione sia all’ematocrito che alla presenza di
varie proteine e dei globuli bianchi. Mentre Ed
Leonard [6] studia a fondo il trasporto di massa negli
apparecchi per emodialisi, ricevendo dall’AIChE nel
1969 un prestigioso riconoscimento per il
fondamentale contributo sulla progettazione ed
ingegnerizzazione di organi artificiali, Powers [7],
Lightfoot [8] e Dan Hershey [9] conducono
importanti studi sul trasporto di massa negli
ossigenatori del sangue. Colton [10-12] a metà degli
anni ’60 studia in dettaglio la permeazione di soluti
attraverso diverse membrane al fine di selezionarne
la migliore da usare negli emodializzatori (vedi
figura 1).
Figura 1. Cella di diffusione usata da Cotton per selezionare le
membrane più adatte da usare negli emodializzatori.
Parallelamente, Lightfoot, analizzando con successo
il flusso di fluidi newtoniani in condotti elastici [13],
getta le basi per il lavoro di Ajit Yoganathan [14]
incentrato sul comportamento fluidodinamico del
sangue in cuori artificiali. Grazie allo sviluppo dei
modelli matematici e della potenza di calcolo dei
computer, dagli inizi degli anni ’80 l’ingegnere
chimico può sconfinare in settori della medicina sino
ad allora inarrivabili. A tal proposito vale la pena
ricordare lo studio della formazione delle placche
arteriosclerotiche, condotto sulla base di modelli
matematici che considerano il trasporto di massa nel
sangue dovuto alla diffusione, convezione ed
all’effetto di agenti trasportatori [15]. Tutta questa
attività scientifica, inevitabilmente, si traduce in
numerosi articoli e nella pubblicazione di molti libri,
alcuni dei quali sono riportati nella tabella 2.
Tabella 2. Esempi di libri e monografie pubblicati agli inizi
dello sviluppo dell’ingegneria biomedica.
Autore
Titolo
Chemical Engineering in Medicine and
D. Hershey, ed.
Biology, Plenum Press, New York (1967)
Biomedical Applications of Heat and Mass
Transfer, Iowa State University Press,
R. C. Segrave
Ames (1971)
Transport Phenomena in the
S. Middleman Cardiovascular System, Wiley, New York
(1972)
Fluid Mechanics and Mass Transfer in
Artificial Organs, ASAIO, Washington,
K. H. Keller
DC (1973)
E. N. Lightfoot Transport Phenomena and Living Systems,
Jr.
Wiley, New York (1973)
Biomedical Engineering Principles,
D. O. Cooney
Dekker, New York (1976)
Un contributo decisamente importante dato dagli
ingegneri chimici al settore biomedico riguarda,
senza dubbio, anche i biomateriali.
Tabella 3. Esempi di importanti contributi di ingegneri chimici
nel settore biomedico.
Biomateriale
Ricercatore
Acetato di cellulosa
Colton (1966)
Idrogel
Hoffman (1966)
Merrill (1966)
Polivinilalcol
Merrill (1969)
Peppas (1975)
Sefton (1976)
Poliuretani
Cooper (1972)
Poliidrossietilmetacrilato
Batner (1973)
Polietilenossido
Merrill (1974)
Polianidridi
Langer (1982)
Questo, secondo Peppas e Langer [1], si può
3
spiegare con il fatto che gli ingegneri chimici sono
stati pionieri nello studio dei materiali polimerici. A
titolo di esempio, la tabella 3 riassume alcuni tipi di
biomateriali studiati agli inizi dello sviluppo
dell’ingegneria biomedica. In questo ambito è
sicuramente da ricordare il lavoro di Hoffman
sull’uso della polimerizzazione per radiazione per
ottenere idrogel biocompatibili. Questa attività si
innesta in un filone, gli idrogel, che, sebbene già
disponibili sin dal 1935, diventano soggetto di
intenso interesse biomedico solo dopo il
pionieristico lavoro di Wichterle e Lim [16] che per
primi preparano i celeberrimi gel a base di
poliidrossietilmetacrilato, materiale costitutivo delle
lenti a contatto morbide prodotte a partire dagli anni
’70. Inoltre, la termodinamica applicata e le teorie
molecolari danno un considerevole contributo alla
progettazione ed alla comprensione delle proprietà
di vari biomateriali, primi fra tutti gli idrogel.
Questo porta agli interessanti studi sui gel a base di
polivinilalcol progettati per il rilascio dell’eparina
(anticoagulante del sangue) [17], la produzione di
polimeri ultrapuri per la formazione di idrogel
assolutamente inerti da impiegarsi come cartilagini e
rivestimenti di cuori artificiali [18]. Strettamente
connesso al settore biomedico è, senza dubbio,
anche quello dello studio e dell’ingegnerizzazione di
tessuti viventi. Il principio base di questa settore è
che per provare a formare tessuti o parti di organi
umani, è necessario che le cellule siano poste in un
appropriato rapporto spaziale. Recentemente, è stato
possibile ottenere, su supporto polimerico, tessuti
umani nervosi, cartilaginei ed epatici. Questo è stato
dimostrato in vitro con cellule endoteliali e cellule
epiteliali mammarie. Se poste sufficientemente
vicine le une alle altre, le prime danno luogo alla
formazioni di capillari [19], mentre le altre danno
luogo agli acini, strutture preposte alla produzione
del latte nei mammiferi [20]. Langer e Vacanti [21]
ipotizzano che, usando un corretto terreno di coltura
ed appropriate strutture polimeriche, sia possibile
creare un ambiente caratterizzato da un’elevata area
superficiale per unità di volume in cui possano
essere contenute in stretto contatto e fatte crescere le
cellule. Il polimero da impiegare deve essere
biodegradabile in modo da scomparire una volta che
il tessuto si sia formato così da evitare pericolose
reazioni biologiche a lungo termine in grado di
deteriorare seriamente il tessuto formatosi. La
strategia di utilizzo di tale tecnologia prevede la
crescita del tessuto al di fuori del corpo umano ed il
successivo impianto nella sede voluta. Tra i primi
materiali usati a questo scopo possiamo ricordare
l’acido lattico e l’acido glicolico, scelti per le loro
buone proprietà fisiche e per la biocompatibilità e
biodegradabilità. Parallelamente a queste tecniche,
gli ingegneri chimici si sono anche occupati
dell’incapsulamento di cellule all’interno di strutture
polimeriche per ottenere membrane dette
immunoisolanti. L’idea base è quella di realizzare
una membrana permeabile a piccole molecole come
il glucosio od altri nutrienti, ma impermeabile a
molecole grandi come le immunoglobuline e
impermeabili anche alle cellule del sistema
immunitario. Chick e Solomon [22] dimostrano,
conducendo esperimenti sui cani, che con questa
tecnologia si può curare il diabete. Infatti, usando un
copolimero fatto da acrilonitrile e vinilcloruro,
realizzano una membrana cava da ultrafiltrazione
permeabile al glucosio (peso molecolare 180) ed
all’insulina
(peso
molecolare
6000)
ma
impermeabile agli anticorpi (peso molecolare >
150000). Sebbene con un ritardo fisiologico rispetto
agli USA, anche in Italia si è fatto sentire
l’allargamento delle tematiche dell’ingegneria
chimica a settori tradizionalmente distanti come la
medicina, la farmacia e la biologia. Infatti, dai primi
anni ’90 compaiono, più o meno stabilmente, nei
principali congressi italiani di ingegneria chimica
(GRICU – AIDIC) sezioni dedicate al settore
biomedico con particolare attenzione a quello
farmaceutico [23]. Senza avere minimamente la
pretesa di essere esaustivo ed a puro titolo di
esempio, in questo contesto si devono segnalare le
interazioni presenti e pregresse tra il Dipartimento di
Farmacia dell’Università di Parma ed il professor
Peppas (Department of Chemical and Biomedical
Engineering, University of Texas), quelle tra il
Dipartimento di Ingegneria Chimica dell’Università
di Roma “La Sapienza” ed il Dipartimento di
Farmacia della stessa università nonché quelle tra il
Dipartimento di Ingegneria Chimica dell’Università
di Trieste ed i Dipartimenti di Farmacia
dell’Università di Trieste, Roma “La Sapienza”,
Milano [24] e, recentemente, anche di Padova.
Curiosamente, almeno a mia conoscenza, la prima
importante e duratura relazione tra farmacia ed
ingegneria chimica nel panorama italiano, ovvero
quella tra Dipartimento di Farmacia dell’Università
di Parma ed il professor Peppas, vede come
controparte ingegneristica un ingegnere chimico
straniero. Infine, vorrei ricordare le interazioni, in
corso ormai dal 2000, tra EURAND, ditta
farmaceutica impegnata nel settore del rilascio
4
controllato per uso orale, e realtà ingegneristiche
accademiche come i Dipartimenti di Ingegneria
Chimica del Politecnico di Milano e dell’Università
di Trieste su tematiche riguardanti non solo i
processi farmaceutici, ma anche il modeling dei
sistemi a rilascio controllato. Questo esempio vuol
essere indice del fatto che l'industria farmaceutica, in
un contesto di sempre maggior competizione
internazionale, sta scoprendo l'utilità delle
competenze proprie dell’Ingegneria Chimica.
2 INTERAZIONI SINERGICHE
Come sopra esposto, interazioni tra ingegneria
chimica e farmacia (oltrechè medicina e biologia)
sono decisamente in corso d’opera. E’ ora intenzione
sottolineare più nel dettaglio le modalità, l’utilità ed
i piani sui quali queste interazioni possono aver
luogo. Al contrario dell’ingegneria chimica,
discipline come la medicina e la farmacia, possono
vantare origini molto antiche. Basti infatti pensare
alle scuole di medicina fondate da Ippocrate e
Galeno risalenti, rispettivamente al V-IV secolo
A.C. ed al II secolo D.C. Inoltre, la necessità di
fornire validi rimedi contro le malattie ha sempre
spinto alla formulazione ed ottimizzazione di sistemi
farmaceutici per una sempre più efficace
somministrazione di principi attivi. L’idea di
controllare il rilascio di un farmaco, infatti, risale a
più di 2000 anni fa, come testimoniano testi del
primo Islam [25]. A partire, poi, dal X secolo D.C., è
ampiamente documentato l’uso di pillole rivestite
anche in Europa [25]. Le conoscenze dell’ingegneria
chimica, sviluppatesi per affrontare obiettivi
completamente diversi, si possono, quindi,
considerare come nuovi strumenti a disposizione del
settore farmaceutico che si trova a dover risolvere,
sempre più complessi e pressanti problemi
nell’ambito di un mercato sempre più competitivo e
tecnologico. Tutto ciò può essere visto come la
riscoperta del fatto che i bilanci di materia, energia e
quantità di moto hanno validità generale e possono
essere applicati, per esempio, per studiare il flusso in
tubazioni, arterie o la diffusione in sistemi
polimerici. A tal proposito, è interessante citare il
D.M. sulle lauree specialistiche in farmacia e
farmacia industriale [24]: “i corsi di laurea della
classe possono fornire anche la preparazione
specifica adeguata ad operare nell'ambito
industriale, determinando una figura professionale
che ha come applicazione elettiva il settore
industriale farmaceutico, grazie all'insieme di
conoscenze teoriche e pratiche in campo biologico e
farmaceutico che permettono di affrontare l'intera
sequenza del complesso processo multidisciplinare
che, partendo dalla progettazione strutturale, porta
alla produzione o al controllo del farmaco…”.
Risulta, quindi, evidente come l’ingegnere chimico
possa intervenire in diversi e molteplici momenti
della progettazione e produzione di sistemi
farmaceutici. I campi di intervento aumentano
ancora se nell’ambito della messa a punto del
sistema
farmaceutico
inseriamo
anche
le
caratteristiche di rilascio del farmaco ed il suo
assorbimento da parte del corpo umano (ciò si
identifica con la biodisponibilità definita come la
velocità ed il grado con il quale un principio attivo é
assorbito e reso disponibile presso il sito d'azione
[26]). In particolare, per quanto concerne la
progettazione e la gestione, le apparecchiature e gli
impianti
farmaceutici
sono,
nell’ottica
dell’ingegnere chimico, niente altro che impianti
chimici in cui abbondano operazioni “non
tradizionali” e che devono operare con specifiche
più stringenti, maggiori garanzie di controllo di
qualità, e cosi’ via [24]. In aggiunta, è doveroso
sottolineare che esiste un settore delle scienze
farmaceutiche, denominato, fisica farmaceutica, che
ha notevoli affinità con le competenze proprie
dell’ingegnere chimico. A tal proposito, vale la pena
riportare l’indice di un celeberrimo testo largamente
in uso nel settore farmaceutico [27]:
1.
Atomic and Molecular Structure
2.
States of Matter and Phase Equilibria
(equazione dei gas perfetti, eq. di ClausiusClapeyron, legge delle fasi, diagrammi binari e
ternari, miscibilità parziale)
3.
Thermodynamics
(tre
leggi
della
termodinamica, termochimica, concetto di attività)
4.
Solutions of Nonelectrolytes (potenziale
chimico, legge di Raoult, soluzioni reali ed ideali,
legge di Henry, Distillazione di miscele binarie,
proprietà colligative, pressione osmotica)
5.
Solutions of Electrolytes (attività e
coefficienti di attività)
6.
Ionic Equilibria (teoria di Brönsted-Lowry,
teoria di Lewis, equilibri acido-base, pH)
7.
Solubilità and distribution phenomena
(solubilità di gas in liquidi, di liquidi in liquidi, di
solidi in liquidi, approccio di Hildebrand, parametri
di solubilità, partizione di un soluto tra due solventi
immiscibili (coefficiente di partizione)
8.
Kinetics (velocità ed ordini di reazione,
termodinamica delle reazioni chimiche)
5
9.
Diffusion and Dissolution (legge di Fick,
legge di Noyes and Whitney, legge di HixsonCrowell, drug release, permeazione, assorbimento
gastro intestinale)
10.
Interfacial Phenomena (bagnabilità ed
energie coinvolte, tensione interfacciale, angoli di
contatto, tensioattivi, teoria di Gibbs per le
interfacce)
11.
Colloids (equilibrio di Donnan)
12.
Rheology (fluidi newtoniani e non,
tissotropia,
antitissotropia,
viscosimetria
e
reometria, viscoelasticità, modelli di Maxwell e
Voigt)
13.
Coarse
dispersions
(teoria
della
sedimentazione, moti browniani, emulsioni e loro
proprietà reologiche, microemulsioni, sineresi e
swelling dei gel)
14.
Polymer science
(teoria
di
Flory,
microincapsulazione,
proprietà
meccaniche,
estrusione, injection molding).
Un’altra area critica in cui l’ingegnere chimico può
dare ed ha dato importanti contributi è quello della
farmacocinetica (variazione temporale della
concentrazione di principio attivo nel sangue a
seguito di un qualunque tipo di somministrazione
(orale, transdermale, rettale, vaginale, endovenoso,
eccetera) del principio attivo.
k
ke
V
a
l
Tratto
Sangue
gastrointestinal
e
e
Figura 2a. Modello monocompartimentale.
Tessuti,
organi
k
a
Tratto
gastrointestinal
e
k1
k2
2
1
V
ke
l
Sangue
e
Figura 2b. Modello bicompartimentale.
Bischoff e Dedrick [28] sono i primi ad affrontare la
farmacocinetica mediante un semplice ed efficace
modello compartimentale che permette di studiare la
distribuzione del farmaco nel corpo umano. In
sintesi, tale approccio prevede di suddividere il
corpo umano in diversi reattori perfettamente
agitati, detti compartimenti, in ciascuno dei quali la
concentrazione del principio attivo è assunta
omogenea.
Nel
modello
più
semplice
(monocompartimentale), si assume che il corpo
umano sia rappresentato da un solo reattore
perfettamente agitato (sangue) oltre al tratto
gastrointestinale (GI) identificabile con il reattore
zero. Il sangue riceve dal reattore GI il principio
attivo mediante una cinetica del primo ordine (viste
le esigue quantità di principio attivo in gioco, il
volume del reattore rimane costante) e perde
principio attivo a causa di una reazione del primo
ordine che simula l’effetto del metabolismo (figura
2a). La variazione di concentrazione C nel sangue
secondo il modello monocompartimentale è [29]:
C
F * dose * k a
e kelt e ka t
V * k a k el
(1)
dove ka e kel sono, rispettivamente, la costante di
assorbimento e di eliminazione del principio attivo e
regolano il flusso e la sparizione del principio attivo,
V il volume di distribuzione (volume del reattoresangue), dose è la massa di principio attivo
somministrato ed F è la frazione della dose
assorbita, ovvero la biodisponibilità del principio
attivo secondo il modello monocompartimentale.
Ovviamente, si possono avere modelli più complessi
come quello bicompartimentale in cui il principio
attivo si ripartisce tra due compartimenti (reattori)
identificabili con il sangue ed i tessuti o gli organi
(Figura 2b). Credendo fermamente che quanto sinora
esposto evidenzi molto bene le possibili interazioni
sinergiche tra ingegneria chimica e settore
farmaceutico, ritengo utile esaminare più nel
dettaglio uno degli argomenti riportati e,
precisamente, quello relativo al rilascio di un
principio attivo da un dato sistema di rilascio
(Diffusion and Dissolution). La scelta cade su questo
argomento non solo perchè è tema portante della mia
attività di ricerca ma, soprattutto, perchè autorevoli
ricercatori quali Peppas e Langer lo indicano come
una delle più importanti aree farmaceutiche in cui il
contributo dell’ingegneria chimica può esprimersi
[1, 30]. Tra l’altro, fattore non trascurabile, questo
settore ha attualmente vendite per un ammontare di
25 miliardi di dollari all’anno [1].
2.1
Drug Delivery
6
Alan Michaels è uno dei primi a condurre importanti
esperimenti su come le membrane possano
controllare il rilascio di un principio attivo [31].
Inoltre, si occupa anche della somministrazione
transdermale di principi attivi mettendo a punto un
modello in grado di predire la permeazione
attraverso la pelle. Sulla base di questi studi, la
ALZA Corporation brevetta la somministrazione
transdermale di principi attivi molto importanti quali
l’estradiolo, la scopolamina e la nitroglicerina. Se
fino agli anni ’70 non si ritiene possibile rilasciare
da polimeri reticolati molecole caratterizzate da un
peso molecolare superiore a 300-400, Langer ed il
suo gruppo sfatano questa credenza studiando il
rilascio di proteine e peptidi. In particolare, scoprono
che quando polimeri altamente idrofobici come
l’etilenvinilacetato o copolimeri costituiti da acido
lattico e glicolico, sono mescolati, in opportune
condizioni, con macromolecole come i peptidi o le
proteine, si possono ottenere strutture altamente
porose in grado di rilasciare le macromolecole per
mesi [32]. Sulla base di questi studi, diverse
compagnie hanno brevettato sistemi farmaceutici
dediti al rilascio di peptidi e proteine. Possiamo
ricordare, ad esempio, i sistemi per il rilascio
dell’ormone luteinizzante come lo Zoladex, il
Lupron, il Depot ed il Decapeptyl. Se nelle prime
versioni il rilascio durava un mese, oggigiorno si è
arrivati sino a quattro mesi. Questi sistemi sono
impiegati per il trattamento del tumore della
prostata, dell’endometriosi e della pubertà precoce.
Più recentemente, sono stati prodotti sistemi a
rilascio controllato costituiti da microsfere iniettabili
per il rilascio dell’ormone della crescita umano in
grado di garantire il rilascio per 2-4 settimane
dall’iniezione. In aggiunta, si è cominciato a
produrre gli stent medicati, strutture metalliche
grossolanamente simili alle molle delle penne per
scrivere, ricoperte di matrici polimeriche in grado di
rilasciare principi attivi. Gli stent medicati sono oggi
impiegati per prevenire la reocclusione delle arterie
trattate con con
angioplastica percutanea
transluminale (APT), approccio terapeutico usato
per rimuovere le placche ateromasiche che
impediscono il corretto flusso sanguigno. In
particolare, la copertura polimerica degli stent
medicati rilascia sostanze ad attività antiproliferativa
che inibisce la crescita delle cellule della parte
arteriosa, causa principale delle restenosi
susseguente ad APT [33]) ricoperti da polimeri che
rilasciano opportune sostanze in grado di impedire
l’abnorme crescita cellulare della parete interna
(intima) dell’arteria in risposta alla lacerazione
dell’intima prodotta dalla dilatazione meccanica
dell’arteria stessa necessaria per rimuovere
un’ostruzione dovuta al deposito di sostanze grasse
come il colesterolo. Questa tecnica ha contribuito
notevolmente a curare la restenosi, patologia che si
presenta nel 30-40% dei pazienti trattati con
angioplastica [33]. Senza dubbio, gli ingegneri
chimici possono contribuire, ed hanno contribuito,
notevolmente alla creazione e messa a punto di
modelli matematici in grado di descrivere o, nei casi
migliori, predire il rilascio di un principio attivo da
sistemi a rilascio controllato (SRC). Gli SRC mirano
a mantenere costante la concentrazione del principio
attivo nei tessuti o nel sangue il più a lungo
possibile. Per raggiungere questo obiettivo, essi
devono rilasciare rapidamente una certa quantità
della dose contenuta in modo da far salire
velocemente la concentrazione del principio attivo
ad un valore terapeuticamente efficace. Questa
prima fase dell'emissione deve essere seguita da una
seconda fase caratterizzata da una ben determinata
velocità di rilascio: il sistema deve fornire la "dose
di mantenimento" [34]. Nei sistemi farmaceutici
tradizionali, invece, il rilascio del principio attivo è
rapido e totale ed avviene in maniera incontrollata.
L'assorbimento dello stesso dipende unicamente
dalla capacità di assimilazione dell'ambiente nel
quale è avvenuto il rilascio cosicché il tipico
andamento concentrazione-tempo che si ottiene è
caratterizzato da un elevato picco iniziale seguito poi
da un decremento monotono. Di conseguenza, può
capitare che la concentrazione si avvicini
pericolosamente al limite di tossicità e rapidamente
scenda sotto il limite terapeutico, condizione
corrispondente ad una azione terapeutica inefficace.
Vista la grande versatilità (applicazioni nel campo
della contraccezione, oftalmico, prevenzione della
trombosi, odontoiatrico, lotta contro il cancro, lotta
all'alcolismo, trattamenti disintossicanti, veterinario
e nel trattamento del diabete), gli SRC sono ormai
alla base della moderna concezione di trattamento
terapeutico il cui obiettivo è quello di aumentare
l’efficacia del farmaco e ridurre i disagi per il
paziente legati, ad esempio, a somministrazioni
troppo frequenti o dosaggi elevati. Proprio per
queste ragioni, la realizzazione di tali sistemi non
può più prescindere dalla fase di progettazione ed a
tal fine i metodi e le conoscenze tipiche
dell’Ingegneria
Chimica
si
sono
rivelati
fondamentali. Ecco dunque che due settori
tradizionalmente distanti (Chimica Farmaceutica ed
7
Ingegneria Chimica) si trovano, di fatto, ad operare
congiuntamente sullo stesso campo ed il concetto di
modello matematico, tipico dell’ingegneria, è ormai
comune anche per la Chimica Farmaceutica [35].
Infatti, non c’è dubbio che l’uso di modelli
matematici sia molto utile in fase di progettazione in
quanto può permettere di simulare il comportamento
del sistema di rilascio prima che venga realizzato
come anche la determinazione di parametri fisici di
grande rilevanza, quali il coefficiente di diffusione
di un farmaco, in sistemi già realizzati. Il modello
matematico assume quindi un’importante valenza
nell’ottimizzazione degli SRC in quanto obbliga a
comprendere la natura e l’importanza relativa di tutti
quei fenomeni fisici che concorrono a determinare la
cinetica di rilascio, elemento di fondamentale
importanza per l’efficacia terapeutica. Infatti, il
modello matematico può essere semplicemente
pensato come una “metafora matematica di alcuni
aspetti della realtà” (ora identificata con l’insieme
dei fenomeni che determinano la cinetica di rilascio)
[36] ed è per questa generalità di base che trova
ampio uso in discipline diverse tra loro come la
genetica, la medicina, la psicologia, la biologia,
l’economia ed, ovviamente, l’ingegneria. In virtù
dell'ampio campo di applicazione, è facile
immaginare quante diverse tipologie di SRC
possano esistere. Nel tentativo di darne una
classificazione, seppur incompleta ed approssimata,
visti i continui e rapidi sviluppi caratterizzanti
questo settore, possiamo individuare quattro
categorie principali: le matrici polimeriche, i sistemi
a serbatoio con membrana, i sistemi bioerodibili e i
sistemi a catena pendente. Uno dei maggiori
vantaggi derivanti dall’uso delle matrici polimeriche
riguarda la facilità di fabbricazione in quanto
possono essere preparate mescolando il principio
attivo, sotto forma di polvere fine, con il
prepolimero e introducendo la miscela nel reattore di
polimerizzazione. Una procedura alternativa consiste
nel preparare la matrice polimerica e nel metterla,
successivamente, a contatto con una soluzione satura
del principio attivo. Infine, si può avere la
simultanea compattazione del principio attivo, del
polimero e degli eccipienti per dar luogo alla
compressa come avviene nel caso delle matrici di
idrossipropilmetilcellulosa (HPMC) che trovano
largo uso nel settore farmaceutico. Sebbene le
matrici possano differire notevolmente tra di loro per
la natura chimico-fisica del polimero (poliettrolita,
neutro, idrofilo, liofilo, anfifilico) e per il tipo di
interazioni (fisiche o chimiche) che intercorrono tra
le catene polimeriche, sono accomunate da uno
stesso principio di strutturazione. Infatti, possono
essere pensate come sistemi coerenti, aventi
caratteristiche meccaniche intermedie tra quelle dei
solidi e dei liquidi, e costituiti da un mezzo continuo
liquido in cui molecole di alto peso molecolare sono
disperse e sistemate, in senso spaziale, a formare un
reticolo continuo tridimensionale che si estende
attraverso l'intero sistema. La presenza di legami tra
le catene polimeriche impedisce alla fase liquida di
portarle in soluzione cosicché l’intera struttura può
soltanto essere rigonfiata dalla fase liquida.
Semplicisticamente parlando, tale sistema è
paragonabile ad una spugna imbevuta da un liquido.
Tuttavia, questa è una spugna particolare in quanto
se si ha prevalenza di legami forti (tipicamente
legami chimici) tra catena e catena, la struttura del
reticolo polimerico è costante nel tempo. Se, invece,
prevalgono i legami deboli (tipicamente legami
fisici), le catene non sono più così saldamente legate
tra di loro e la "spugna" non si adatta bene a
rappresentare la situazione. La densità spaziale di
connessioni tra catena e catena è costante nel tempo
(in condizioni statiche), ma per la mobilità delle
catene e dei segmenti di catena, la distribuzione
spaziale delle connessioni tra diversi elementi di
volume può cambiare nel tempo. Parallelamente, la
densità e le dimensioni medie delle maglie del
reticolo sono costanti, ma ciascuna maglia può
modificarsi nel tempo. Il reticolo tridimensionale
non è più permanente ma statistico e, in particolari
condizioni, il sistema può andare incontro ad
erosione. Ovviamente, il quadro è reso più
complesso dal fatto che, spesso, non si ha a che fare
con un unico reticolo polimerico, nel senso che il
sistema è realizzato da un insieme di piccoli domini
a carattere di matrice, immersi in un mezzo continuo
generalmente rappresentato da una soluzione dello
stesso polimero. Alternativamente, poi, si possono
avere sistemi ancora più complessi costituititi
dall’intreccio di due reticoli, ciascuno originato da
un particolare polimero. Infine, può capitare che il
sistema di rilascio sia costituito da molte minimatrici indipendenti le une dalle altre, ciascuna delle
quali concorre a determinare la cinetica di rilascio.
Se, generalmente, la fase liquida è rappresentata da
acqua o soluzioni fisiologiche, la scelta del polimero
viene fatta in ragione della destinazione d’uso della
matrice (uso orale, oftalmico, sottocutaneo, rettale,
vaginale etc.) valutando diversi fattori tra i quali il
grado di rigonfiamento in un dato solvente, la
bioadesività , la biocompatibilità, le interazioni con
8
gli eccipienti ed i farmaci e le proprietà meccaniche
e chimiche. Sino ad ora, per chiarezza di
esposizione, si è focalizzata l’attenzione sulla
struttura della matrice polimerica senza far
menzione al principio attivo ed alle sue possibili
interazioni con le catene polimeriche. In realtà, la
situazione che deve essere analizzata per
comprendere la cinetica di rilascio è complicata dal
fatto che, per motivi di stabilità, la matrice
polimerica viene, nella stragrande maggioranza dei
casi (fanno eccezione alcune matrici ad uso
oftalmico), conservata allo stato secco, ovvero in
assenza della fase liquida. In questo stato, il farmaco
può trovarsi disperso nel reticolo polimerico secco in
forma di microcristalli, nanocristalli o a livello
molecolare (questa condizione corrisponde allo stato
amorfo) in ragione delle proprietà chimico-fisiche
della coppia farmaco-polimero e della tecnica di
caricamento adottata. Infatti, lo stato fisico del
farmaco nel reticolo polimerico secco non è altro
che il risultato tra l’energia fornita per il
caricamento, le interazioni chimico-fisiche farmacopolimero e l’ingombro sterico dei cristalli di farmaco
che devono collocarsi nelle maglie polimeriche
ristrette a causa dell’assenza della fase liquida.
Tipicamente, i sistemi di caricamento fanno uso di
solventi (caricamento diretto o indiretto), di energia
meccanica (comacinazione della coppia polimerofarmaco), di fluidi supercritici quando non si realizzi
il caricamento del farmaco direttamente durante la
fase di reticolazione del polimero.
Solvente esterno
Polimero
farmaco
Dissoluzione e
ricristatlliuazione
diffusione
rilascio
Figura 3. Meccanismo di rilascio di un principio attivo da una
matrice polimerica reticolata.
Indipendentemente dalla tecnica di caricamento, in
condizioni di matrice secca, il principio attivo, per
motivi sterici, non può diffondere e quindi il sistema
si trova in uno stato quiescente. Non appena viene
posto a contatto con un solvente esterno (acqua o
liquidi fisiologici), si assiste all’instaurarsi di una
serie di fenomeni che danno origine al rilascio del
principio attivo (Figura 3). Il solvente, penetrando ed
allargando le maglie del polimero, permette la
dissoluzione del principio attivo e quindi il rilascio
nell’ambiente esterno. Il rilascio, conseguentemente,
dipenderà dalle modalità di diffusione del solvente
nel reticolo polimerico, dalla cinetica di dissoluzione
del farmaco nel solvente entrante e dalla diffusione
del farmaco stesso nella matrice polimerica in via di
rigonfiamento. Se la diffusione del farmaco nella
matrice è, di norma, un processo semplice,
descrivibile accuratamente dalla legge di Fick, non
altrettanto può dirsi per la penetrazione del solvente
nel reticolo polimerico e la dissoluzione del
farmaco. Infatti, a causa della natura viscoelastica
dei sistemi polimero-solvente, può capitare che la
legge di Fick non valga più, ovvero si debba, ad
esempio, postulare l’esistenza di un coefficiente di
diffusione dipendente dal tempo e non solo dalla
concentrazione. Fisicamente parlando, ciò equivale a
dire che ove il solvente rigonfi la matrice, si instaura
un processo di riassestamento (rilassamento) delle
catene polimeriche che tendono ad una nuova
condizione di equilibrio, diversa da quella iniziale
corrispondente allo stato secco e che ora annovera la
presenza del solvente. Le catene polimeriche, infatti,
possono essere grossolanamente pensate come
elementi elastici, connessi da giunzioni parzialmente
labili, che si oppongono al rigonfiamento indotto
dall’ingresso del solvente. Se il riassestamento
avviene molto velocemente o molto lentamente
rispetto al processo diffusivo, la legge di Fick sarà
ancora valida. Al contrario, quando il processo di
rilassamento avviene ad una velocità comparabile
con il processo diffusivo (questo è il caso dei
materiali viscoelastici), la legge di Fick perde di
validità. Anche il processo di dissoluzione del
farmaco può presentare delle peculiarità legate al
fatto che la presenza del solvente può determinare,
contemporaneamente
alla
dissoluzione,
una
transizione di fase del farmaco da una forma anidra
ad una idrata, da uno status cristallino ad un’altro o
dallo stato amorfo a quello cristallino, generalmente
più stabile del corrispondente stato amorfo. Di
norma, tale transizione comporta una variazione
della solubilità del farmaco in quanto le forme idrate
sono meno solubili di quelle anidre e le forme
9
cristalline sono meno solubili di quelle amorfe,
come ampiamente dimostrato in letteratura. Ciò
obbliga a tener conto della ricristallizzazione del
farmaco dovuto alla riduzione della sua solubilità a
seguito della transizione di fase imposta dal
solvente. Senza voler entrare nel dettaglio, vale la
pena ricordare che questo aspetto è sfruttato per
aumentare la biodisponibilità di farmaci, dotati di
buona permeabilità, scarsamente solubili in ambienti
acquosi (< 100 g/cm3) in forma cristallina ma
molto più solubili in forma amorfa. In conclusione,
dunque, un modello matematico generale che voglia
descrivere il quadro fisico sopraesposto, deve tener
conto della diffusione del farmaco nel matrice che si
rigonfia, della sua dissoluzione/ricristallizazione,
della penetrazione del solvente nelle maglie
polimeriche e, nei sistemi costituiti da una
popolazione di matrici, deve considerare anche la
distribuzione delle dimensioni delle varie matrici.
Infine, non va dimenticato l’ importante ruolo della
distribuzione iniziale del farmaco all’interno della
matrice, come ampiamente dimostrato in letteratura.
Su questi temi si sono cimentati moltissimi
ricercatori adottando diverse strategie. Peppas e
collaboratori sono stati indubbiamente i primi ad
intraprendere questa strada e, anche per questo,
hanno fatto scuola a livello mondiale. Per esempio,
tali autori hanno dimostrato che, in assenza di
particolari condizioni al contorno e di particolari
geometrie, il rilascio da matrici polimeriche può
venir descritto da una semplice relazione
esponenziale dove il valore dell’esponente può
fornire indicazioni sulla natura fickiana o meno del
rilascio a livello macroscopico [37]. L’analisi della
diffusione mediante la legge di Fick ha permesso di
definire le migliori geometrie per un rilascio
costante del principio attivo. Infatti, riferendosi per
semplicità ad una matrice polimerica in forma di
parallelepipedo, supponendo che il rilascio avvenga
solo secondo una direzione normale ad una delle tre
coppie di facce parallele, e che il principio attivo sia
presente nel reticolo polimerico in concentrazione
costante, la velocità di rilascio decresce nel tempo.
Per ovviare a ciò, Rhine [38] suggerisce una matrice
emisferica completamente ricoperta da una
membrana impermeabile eccezion fatta per una zona
circolare della parte centrale della sua superficie
piatta (vedi figura 4). Il modello matematico,
sviluppato sulla base della legge di Fick, predice un
rilascio costante del principio attivo perché tanto più
il fronte di diffusione (è il fronte ideale che separa la
zona della matrice in cui la concentrazione del
principio attivo è uguale a quella iniziale da quella in
cui la concentrazione è più bassa a causa del
processo di rilascio) si allontana dall’interfaccia
matrice/fluido di rilascio, tanto più grande è la sua
superficie a causa della natura emisferica della
matrice.
Rilascio
Fronte di diffusione
Figura 4. Visione prospettica e sezione del sistema di rilascio
studiato da Rhine.
Sempre basandosi sulla legge di Fick, Lee [39]
affronta il problema dell’ottenimento di una velocità
di rilascio costante adottando una concentrazione
non uniforme del principio attivo nella matrice. Egli
dimostra teoricamente e sperimentalmente che un
profilo di concentrazione sigmoidale decrescente dal
centro della matrice verso l’esterno, assicura una
velocità di rilascio pressoché costante. Quando il
sistema di rilascio è un polimero reticolato che va
incontro a rigonfiamento ad opera di un solvente
esterno, la descrizione del rilascio diventa più
complessa. Dunque, si devono usare equazioni di
trasporto che incorporino il comportamento
viscolelastico del sistema polimero/solvente. Senza
la pretesa di essere esaustivi, a tal proposito si
possono ricordare i lavori di Lustig [40], quelli di
Cohen [41, 42] e l’uso dell’equazione di CameraRoda e Sarti [43] fatta da Grassi [44]. Ovviamente,
si potrebbero citare moltissimi altri lavori in materia,
ma questo esula dagli obiettivi di questa
presentazione e per questo si rimanda il lettore a
recenti review [35, 45].
3 SVILUPPI FUTURI
Il futuro prossimo richiederà un potenziamento
dell’interazione tra ingegneria chimica e settore
farmaceutico. Infatti, a parte le attività già
menzionate, si stanno prepotentemente sviluppando i
cosiddetti sistemi intelligenti che possono rispondere
autonomamente a stimoli esterni. Per esempio, con
10
tecniche di imprinting molecolare si possono
ottenere materiali biomimetici in grado di simulare i
meccanismi naturali per il riconoscimento di
particolari molecole bersaglio [46]. L’uso di questi
materiali permetterà di affrontare sempre più
efficacemente malattie come il diabete una volta che
la molecola bersaglio sia il glucosio. Il sistema sarà
in grado di rilevare concentrazioni elevate di
glucosio e rilascerà, quindi, l’insulina. Le
nanotecnologie renderanno tra breve possibile l’uso
comune di sistemi farmaceutici contenti uno o più
microchip che funzioneranno come una farmacia
miniaturizzata per il rilascio del farmaco desiderato
nella quantità voluta. Inoltre, sarà possibile
realizzare nanomacchine in grado di viaggiare nel
corpo umano ed intervenire ove necessario.
Potranno, per esempio, attaccare meccanicamente
batteri patogeni (come attualmente fa il sistema
immunitario) o portare ossigeno ai polmoni in caso
di insufficienza respiratoria o distruggere cellule
tumorali. Le nanomacchine, probabilmente in
funzione tra 50 anni, sono concepiti come enormi
molecole composte da atomi di diversi elementi
scelti accuratamente per dimensioni e proprietà
chimiche [47]. Infine, il continuo sviluppo del
molecular modeling fornirà sempre più precise
informazioni sulle proprietà macroscopiche dei
materiali a partire da quelle a livello atomico.
specialisti nella progettazione di prodotti
farmaceutici (modificazioni del principio attivo,
scelta del tipo di formulazione, sistemi di rilascio o
targeting) e di processi per l'ottenimento dei suddetti
prodotti. Alcuni contenuti potrebbero essere:
relazione struttura-proprietà di sostanze
biologicamente attive
•
farmacocinetica
•
progettazione
dei prodotti farmaceutici
(scelta del principio attivo, progettazione della
formulazione tradizionale, di sistemi di rilascio
ritardato o controllato, di sistemi di drug delivery..)
•
processi di produzione (oltre alle operazioni
unitarie
tradizionali,
liofilizzazione,
cristallizzazione,
separazioni
cromatografiche,
biotecnologie tradizionali (fermentazioni) e avanzate
(ingegneria genetica) e progettazione dei relativi
impianti
•
progettazione e produzione di strumenti
diagnostici (biosensori, kit analitici..)
Ovviamente, sarebbe interessante e logico offrire il
corso a studenti provenienti dalle due aree culturali
(ingegneria chimica, farmacia e chimica e tecnologia
farmaceutica), anche se la differente formazione di
base imporrebbe un accurato lavoro nella
formulazione del curriculum e nell'impostazione dei
corsi. Questa unificazione non sarebbe altro che una
chiara e netta testimonianza di quanto si sta
sviluppando a livello mondiale.
4 CONCLUSIONI
Alla luce di quanto esposto, risulta evidente la
potenzialità dell’interazione tra ingegneria chimica e
settore farmaceutico. Su questa base, si potranno
avere nuovi e significativi progressi scientificotecnologici con interessanti ricadute, anche in
termini di finanziamenti per la ricerca, nel settore
ingegneristico-farmaceutico. Tutto ciò favorirà la
formazione di nuove figure professionali e, quindi,
nuovi posto di lavoro con conseguente richiamo di
studenti laddove questa sinergia sia in atto. I
maggiori ricercatori del settore [1, 48] sostengono la
necessità di aprire nuovi corsi universitari atti
all’insegnamento dei fondamenti di ingegneria
chimica, biologia e farmacia, in modo da fornire ai
futuri ricercatori e manager gli strumenti adatti a per
poter capire tutti gli aspetti di questo nuovo settore
in rapida evoluzione. Sostanzialmente in questa
ottica sono le considerazioni fatte recentemente da
Annesini [24] che propone un corso (master di I, II
livello o laurea specialistica) in Ingegneria (chimica)
dei prodotti e dei processi farmaceutici per formare
BIBLIOGRAFIA
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
N. Peppas, R. Langer, Origins and development of
biomedical engineering within chemical engineering.
AIChE J. 50(3) (2004) 536.
N. Peppas, One Hundred Years of Chemical Engineering,
Kluwer, Amsterdam (1989).
Fonte AIDIC.
G. Astarita, The history of chemical engineering in Italy.
Adv. Chem. 190(12) (1980) 205.
G. Astarita, Ingegneria chimica accademica in Italia:
giganti o pigmei? La Chimica & L’industria. 74 (1992)
271.
E. F. Leonard, L. W. Bluemle Jr., The Permeability
Concept as Applied to Dialysis. Trans. Am. Soc. Artif.
Internal Organs 33 (1960) 6.
E. Landino, J. G. McGreary,. W. A. Thompson, J. E.
Powers, Mass Transfer in a Horizontal Rotating Cylinder
with Applications to the Oxygenation of Blood. AIChE J.,
12 (1966) 117.
E. N. Lightfoot, Low-Order Approximations for
Membrane Blood Oxygenators. AIChE J 14 (1968) 669.
D. Hershey, T. Karhan, Diffusion Coefficients for Oxygen
Transport in Whole Blood. AIChE J. 14 (1968) 969.
C. K. Colton, K. A. Smith, E.W. Merrill, P. C. Farrell,
11
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
Permeability Studies with Cellulosic Membranes, J.
Biomed. Mater. Res. 5 (1971) 459.
C. K., Colton, K. A. Smith, E.W. Merrill, S. Friedman,
Diffusion of Urea in Flowing Blood. AIChE J. 17 (1971)
800.
C. K. Colton, Uremia Therapy: Technical Foundations of
Renal Prostheses, Springer, Berlin, (1987) pp 187–217.
E. LN. Lightfoot Jr., Transport phenomena in living
systems, Wiley, New York, (1973).
A. P. Yoganathan, W. H. Corcoran, E. C. Harrison, Wall
Shear Stress Measurements in the Near Vicinity of
Prosthetic Aortic Heart Valves, J. Bioeng. 2 (1978) 369.
L. A. Feig, N. A. Peppas, C. K. Colton, K. A. Smith, R. S.
Lees, The Effect of Angiotensin II on In Vivo Albumin
Transport in Normal Rabbit Aortic Tissue, Atherosclerosis
44 (1982) 307.
O. Wichterle, D. Lim, Hydrophilic Gels for Biological
Use, Nature 185 (1960) 117.
N. A. Peppas, E. W. Merrill, Development of
Semicrystalline PVA Networks for Biomedical
Applications, J. Biomed. Mater. Res. 11 (1977) 423.
C. M. Hassan, N. A. Peppas, Structure and Applications of
Poly(vinylalcohol) Hydrogels Produced by Conventional
Crosslinking or by Freezing/Thawing Methods, Adv.
Polym. Sci. 153 (2000) 37.
J Folkman, C. Haudenchild, Angiogenesis In vitro, Nature
288 (1980) 551.
M. J. Bissell, M. H. Barcellos-Hoff, The Influence of
Extracellular Matrix on Gene Expression: Is Structure the
Message? J. Cell. Sci., 8 (1987) 327.
J. Vacanti, M. Morse, M. Saltzman, A. Domb, A. PerezAtayde, R. Langer, Selective Cell Transplantation Using
Bioabsorbable Artificial Polymers as Matrices, J. Ped.
Surg. 23 (1988) 3.
S. Sullivan, T. Maki, K. M. Borland, M. D. Mahoney, B.
A. Solomon, T. E. Muller, A. P. Monaco, W. L. Chick,
The Biohybrid Perfused Artificial Pancreas: Long-term,
Implantation Studies in Diabetic, Pancreatectomized
Dogs, Science 252 (1991) 718.
ICheaP-2, The Second Italian conference on Chemical
and Process Engineering, Firenze, 15-17 Maggio 1995.
M. Annesini, R. Lapasin, M. Grassi, Relazioni tra
Ingegneria Chimica e Facoltà di Farmacia, appunti,
(2002), sito web GRICU http://gricu.dicpm.unipa.it/.
M. Grassi, Studio della diffusione in idrogeli di
biopolomeri per la progettazione di sistemi farmaceutici a
rilascio controllato, Tesi di Laurea, Dipartimento di
Ingegneria Chimica, Università di Trieste, (1990).
Pharmacos 4. Medicinal Products for Human Use:
Guidelines; directive 65/65/EEC, 75/318/EEC, (1991).
Eudralex Collection; Vol. 3C, p 234 (Internet site:
http://pharmacos.eudra.org/F2/eudralex/vol-3/home.htm).
A. Martin, J. Swarbrick, A. Cammarata, Physical
Pharmacy, Physical Chemical Principles in the
Pharmaceutical Sciences, LEA & FEBIGER,
Philadelphia (1983).
K. B. Bischoff, R. G. Brown, Drug Distribution in
Mammals, Chem. Eng. Prog. Symp. Series 62 (1966) 62.
D. W. A. Bourne, Mathematical Modeling of
Pharmacokinetic Data, Technomic Publishing Co. Inc.,
Lancaster Basel, (1995).
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
R. S. langer, An Interview with a Distinguished
Pharmaceutical Scientist, Pharm. Res. 16(4) (1999) 475.
A. S. Michaels, Synthetic Polymeric Membranes:
Practical Applications- Past, Present and Future, Pure
Appl. Chem. 46 (1976) 193.
R. Langer, J. Folkman, Polymers for the Sustained
Release of Proteins and Other Macromolecules, Nature
263 (1976) 797.
G. Grassi, P. Dawson, G. Guarnieri, R. Kandolf, M.
Grassi, Therapeutic Potential of Hammerhead Ribozymes
in the Treatment of Hyper-Proliferative Diseases, Curr.
Pharm. Biotec. (2004) in corso di stampa.
M. Grassi, Meccanismi di rilascio di farmaci da matrici
polimeriche, Memorie del 3° Corso della Scuola Dottorale
per la Formazione Avanzata in Discipline TecnologicoFarmaceutiche (CHIM 09) (2003), Università della
Calabria, Arcavacata di Rende.
J. Siepman, N. A. Peppas, Modeling of drug release from
delivery systems based on hydroxypropyl methylcellulose
(HPMC), Adv, Drug Del. Rev. 48 (2001) 139.
G. Israel, in Modelli Matematici nelle Scienze Biologiche,
a cura di P. Freguglia, Edizioni Quattro Venti, Urbino,
(1998) 134.
N. A. Peppas, P. L. Ritger, A Simple Equation for
Description of Solute Release I. Fickian and Non-Fickian
Release from Non-swellable Devices in the Form of
Slabs, Spheres, Cylinders of Discs, J. Controlled Release
5 (1987) 23.
W. Rhine, V. Sukhatme, D. Hsieh, R. Langer, A New
Approach to Achieve Zero-Order Release Kinetics from
Diffusion-controlled Polymer Matrix Systems, Controlled
Release of Bioactive Materials, Academic Press, New
York, (1980) 177-188.
P.I. Lee, Initial concentration distribution as a mechanism
for regulating drug release from diffusion controlled and
surface erosion controlled matrix systems, J. Control.
Release 4 (1986) 1.
S.R. Lustig, J.M. Caruthers, N.A. Peppas, Continuum
thermodynamics and transport theory for polymer–fluid
mixtures, Chem. Eng. Sci. 47 (2) (1992) 3037.
D.S. Cohen, Theoretical models for diffusion in glassy
polymers, J. Polym. Sci.: part B: Polym. Phys. 22 (1984)
1001.
D.S. Cohen, Sharp fronts due to diffusion and stress at the
glass transition in polymers, J. Polym. Sci.: part B: Polym.
Phys. 27 (1989) 1731.
G. Camera-Roda, G.C. Sarti, Mass transport with
relaxation in polymers, AIChE J. 36 (6) (1990) 851.
M. Grassi, I. Colombo, R. Lapasin, Drug release from an
ensemble of swellable crosslinked polymer particles, J.
Controlled Release, 68(1) (2000) 97.
M. Grassi, G. Grassi, Mathematical modelling and
controlled drug delivery: matrix systems, Current Drug
Delivery, in corso di stampa, 2004.
R. langer, N. A. Peppas, Advances in biomaterials, drug
delivery and bionanotechnology, AIChE J. 49(12) (2003)
2990.
L’invasione delle nanomacchine, Quark 38 (2004) 77.
M. Saltzman, Drug Delivery, Oxford University Press,
Oxford (2001).
12