15/01/2004
CHIRURGIA GENERALE
Prof. Gaspari
Premessa: ricordo, per chi non era presente, che la lezione si è svolta come una
sorta di duetto tra Gaspari (G) e la specializzanda biondina (S), durante il quale lei
cantava B. Spears e lui i grandi successi di G. Cinguetti. Non trovate stupore quindi in
qualche contraddizione qui e lì!!
CASO CLINICO
S:
Parliamo di una paziente di 47 anni, ricoverata presso il nostro reparto.
Raccogliendo l’anamnesi era emersa una familiarità per patologie cardiovascolari
(aveva avuto un familiare di primo grado con IMA) e per il diabete.
Nella sua anamnesi fisiologica l’unico dato di rilievo era l’abitudine al fumo.
Nella anamnesi patologica remota si metteva in evidenza un ricovero a 16 anni per
una endocardite, una appendicectomia a 21 anni, una lieve ipertensione (non richiesto
trattamento farmacologico) ed una iperbilirubinemia familiare.
Il ricovero veniva giustificato dalla presenza da circa due mesi di tenesmo, dolori
addominali diffusi e recente rettorragia.
Per rettorragia intendiamo l’emissione di sangue rosso vivo dall’ano.
G:
Il sintomo che deve attirare la nostra attenzione è il tenesmo: può essere causato da
una serie di patologie, anche infiammatorie. L’altro aspetto importante è quello della
rettorragia, causata nella maggioranza dei casi dalle emorroidi: questo dato può
essere frequentemente causa di errore, perché il paziente viene tranquillizzato con
superficialità dal medico di famiglia, mentre andrebbe prestata maggiore attenzione.
Ancor di più nel paziente realmente portatore di emorroidi, nel quale è importante non
fare diagnosi sbrigative, lasciandosi ingannare dalla patologia più evidente.
Ricordiamo che la rettorragia da emorroidi e quella causata da altre patologie ha delle
caratteristiche diverse…
S:
Ad esempio nei pazienti con sanguinamento imputabile esclusivamente alle emorroidi
esso si verifica in seguito alla defecazione: il passaggio delle feci determina un trauma
sulle emorroidi stesse facendole sanguinare. Una rettorragia causata invece da una
neoformazione, è spontanea…
G:
In tutti i libri di testo è riportato che il sanguinamento da emorroidi si verifica, anche
abbondantemente, alla fine della defecazione, perché durante il passaggio delle feci
c’è una compressione dei gavoccioli che non permette il sanguinamento, mentre esso
avviene per aumento della pressione venosa, causata dalla contrazione del torchio
addominale, alla fine della defecazione. I sanguinamenti ripetuti possono portare ad
una anemizzazione importante.
I sanguinamenti causati da un polipo o da una neoplasia sono decisamente più
modesti, ma tendono a manifestarsi verniciando le feci.
Ogni sanguinamento rettale dopo i 30 anni deve mettere in allarme.
S:
L’esame obiettivo addominale metteva in evidenza una dolorabilità lieve, alla
palpazione profonda, in fossa iliaca sinistra; all’esplorazione rettale era possibile
apprezzare con la punta del dito una neoformazione nel retto basso, senza sangue sul
dito esplorante.
G:
Facendo l’esplorazione rettale valutiamo, per prima cosa, la tonicità dello sfintere,
quindi lo stato della mucosa. In questo caso il dito esplorante apprezza della mucosa
inizialmente normale, quindi del tessuto molto duro, che può avere diverse
caratteristiche morfologiche.
A livello del retto basso, dove si arriva con un dito, il tumore tende a crescere come
una scodella: in altre parole è una placca che si ulcera nella parte centrale con dei
bordi rilevati ed una parte centrale più depressa.
A livello dell’ampolla, in corrispondenza della quale assai spesso la neoplasia è
stenosante, si osserva spesso un sanguinamento.
Il chirurgo deve valutare la mobilità di questa placca: se essa scorre sui piani
sottostanti è una neoplasia allo stadio iniziale, che interessa la mucosa e la
sottomucosa ma non la parete muscolare. Se c’è una fissità, la zona patologica fa
blocco con la parete del retto e magari c’è un’invasione oltre il confine muscolare del
retto.
S:
La paziente, prima del ricovero, aveva eseguito una TC dell’addome con delle
ricostruzioni specifiche per il colon, ovvero una colonscopia virtuale…
G:
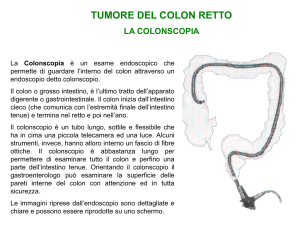
Però quale sarà l’esame che si farà dopo l’esplorazione rettale?
S:
… una rettoscopia, una colonscopia, una pancolonscopia (Nds: deciditi!) perché
consente una visione diretta della lesione e permette l’esecuzione di prelievi bioptici
per esame istologico, a differenza della colonscopia virtuale che ci indica, ma non
sempre, la presenza di una neoformazione ma non dà indizi sulla sua natura. Non si
può fare a meno dell’esame endoscopico tradizionale…
G:
Se con il dito si apprezza la lesione, la diagnosi è clinica; se la lesione è più alta
faremo una colonscopia per studiare tutto il colon fino al cieco.
L’esame istologico è importante per il grading e per stabilire l’aggressività della
neoplasia: distinguiamo una forma molto differenziata, una mediamente differenziata
ed una di tipo anaplastico. Questa informazione è importante perché nelle forme
iniziali di neoplasia è possibile eseguire un trattamento locale, cioè una escissione
chirurgica transanale, intervento che può essere eseguito in anestesia epidurale,
purché sia garantita la non recidiva della malattia con una exeresi completa. Questo
trattamento si può eseguire in forme molto iniziali (T1), con interessamento
solamente della mucosa, quando la dimensione è inferiore ad un terzo della
circonferenza o quando non esistono linfonodi metastatici. Si può fare, in caso di
controindicazione all’intervento maggiore, anche nelle forme T2, purché il grading sia
basso.
Quindi non deve essere eseguita una rettoscopia ma una pancolonscopia, per la quota
non indifferente di neoplasie sincrone, nel retto e nel colon. Gli adenocarcinomi della
mucosa colica si sviluppano assai di frequente da polipi e raramente questi sono
solitari. Può esserci una neoplasia e più polipi che possono essere cancerizzati:
durante l’esame vengono tolti e viene seguito l’esame istologico perché il chirurgo
potrebbe dover fare un intervento di colectomia totale. Operare un tumore e lasciarne
un altro è un errore molto grave ma che viene commesso: sebbene in camera
operatoria si palpi tutto il colon per individuare altre lesioni, quelle molto piccole
possono sfuggire.
La colonscopia virtuale è una metodica radiologica che utilizza la tecnologia della
risonanza magnetica (Nds: non mi risulta) e permette di fare uno studio
elettronicamente ricostruito della cavità del colon. E’ più gradita al paziente, perché
l’introduzione dell’endoscopio è fastidiosa, è più accettato di un esame radiologico.
Durante le colonscopie si può andare incontro a perforazioni: con l’esame virtuale si
evitano fastidi e rischi. Dobbiamo però dire che non si possono fare biopsie, inoltre
l’esame endoscopico è sia diagnostico che terapeutico. Il carcinoma del colon è una
neoplasia con una precisa sequenza, cioè adenoma, adenoma cancerizzato, cancro:
l’asportazione degli adenomi è una formidabile arma di prevenzione delle neoplasie.
L’esame endoscopico può quindi essere trasformato da diagnostico a solamente
terapeutico tramite la TC virtuale, come è già successo per il versante biliare tramite
la colangio-RM al posto della CPRE.
La colonscopia virtuale dà delle bellissime immagini, che sono però di difficile
interpretazione.
Ricordo il caso di un paziente anziano con masse epatiche metastatiche: con uno
studio citologico si dimostrò che erano metastasi da adenocarcinoma.
Quali adenocarcinomi possono dare metastasi al fegato? Dobbiamo pensare agli
organi con drenaggio portale: stomaco, colon e pancreas.
Il paziente era stato precedentemente operato per emorroidi ed aveva avuto una rara
complicanza che è la stenosi del canale anale molto serrata, tanto da consentire il
passaggio di sole feci liquide. In quelle condizioni non era possibile far passare
neanche un endoscopio pediatrico e venne per questo sottoposto a colonscopia
virtuale: la risposta era negativa.
Vennero trattate le metastasi e si intervenne sulla stenosi con una plastica: fatta
successivamente una colonscopia è stato trovato un carcinoma dell’angolo epatico.
S:
Vediamo l’esame TC convenzionale della paziente, con una neoformazione del retto
che interessa quasi tutta la circonferenza, ad un livello di retto molto basso perché
vediamo i muscoli del pavimento pelvico…
G:
La colonscopia virtuale può essere utilizzata per ragioni di studio: voi non
prescrivetela ad un paziente con sospetto carcinoma! (Nds: Gaspari è un tipo senza
pregiudizi…)
S:
La TC va prescritta nei pazienti con tumore del colon per verificare lo stadio locale
della malattia; può darci indicazioni sulla eventuale infiltrazione verso il grasso
perirettale o sulla presenza di un buon piano di clivaggio. Altre informazioni
comprendono la presenza di metastasi e di linfonodi aumentati di volume.
G:
Quindi, fondamentalmente, serve a stadiare preoperatoriamente tutti i pazienti
dandoci informazioni sulla M (presenza di metastasi a livello del fegato o del polmone)
e sulla T (invasione del tumore dalla mucosa verso l’esterno). Ciò è importante ai fini
della tecnica chirurgica, perché il tumore potrebbe aver invaso altri organi come
l’utero, la vagina, la vescica.
Dobbiamo cercare di definire il T nei tumori bassi del retto… perché?
S:
… Perché i pazienti con tumori bassi del retto dal T avanzato (ha oltrepassato la
sierosa e invade le strutture circostanti) si avvalgono di un trattamento neoadiuvante
(T3 e T4), cioè di trattamenti chemio e radioterapici che hanno il fine di ridurre il T,
cioè di sottostadiare la malattia e consentire una escissione radicale.
G:
L’esame TC ci fornisce informazioni anche sui linfonodi, con precisione non assoluta,
perché risultano positivi solamente se sono aumentati di volume.
Come muore un paziente che ha un cancro del retto? Se non viene curato può avere
una perforazione, una peritonite, un’occlusione intestinale. Dipende poi da come la
malattia recidiva o persiste: può recidivare, ad esempio, a livello del fegato con
metastasi sincrone o metacrone. La condizione più favorevole si ha quando la
metastasi si manifesta a distanza di tempo dalla diagnosi di tumore primitivo, perché
questo è meno aggressivo; se il follow-up è attento possiamo cogliere la diffusione
ematogena tempestivamente ed una quota di pazienti può essere ancora trattata.
Circa un terzo dei pazienti possono essere trattati con resezioni, associate o meno ad
altre tecniche: di questi circa un terzo guarisce.
L’altra modalità di progressione è la recidiva locale a livello pelvico con congelamento
della pelvi, invasione delle strutture pelviche, dei vasi, degli ureteri, della vescica, del
pavimento pelvico muscolare e delle strutture ossee. Questa patologia ha un’incidenza
del circa 30%. La recidiva pelvica può essere trattata ancora con intervento chirurgico
se diagnosticata per tempo in un terzo dei casi: solamente il 20% guarisce. Quindi per
molti pazienti la recidiva significa la progressione fino alla morte: per questo motivo
va ridotta la sua incidenza in due modi che possono essere associati. In primo luogo
l’avanzamento della tecnica chirurgica ed il trattamento adiuvante con chemio e
radioterapia per distruggere le cellule neoplastiche che si trovano nelle strutture
linfatiche della pelvi.
Facendo un trattamento preoperatorio si ottengono risultati migliori rispetto allo
stesso trattamento condotto in regime postoperatorio, perché diminuiscono le
complicanze di tipo attinico: quando trattiamo un paziente con tumore del retto
retroperitoneale prima dell’intervento, esiste lo sfondato del Douglas che mantiene in
alto le anse del tenue, molto sensibili alle radiazioni. Se interveniamo dopo la
resezione, la peritonizzazione non completa determina la discesa delle anse nella
pelvi, che vengono così colpite dalle radiazioni: si hanno lesioni attiniche e stenosi.
La chemioterapia è tanto più efficace tanto più è irrorata la parte: i tumori producono
sostanze che stimolano la formazione di vasi e la circolazione del sangue. Facendo la
chemioterapia in presenza del tumore abbiamo una buona circolazione al livello
pelvico e maggiore efficacia; se operiamo prima il paziente induciamo una sclerosi
cicatriziale del campo operatorio e le zone meno irrorate saranno meno sensibili alla
chemioterapia. E’ indicata negli stadi T3 e T4 mentre non c’è indicazione in T1 e T2.
Dobbiamo quindi conoscere subito che stadio abbiamo di fronte.
I chirurghi erano timorosi nel far irradiare il paziente prima dell’intervento, pensando
di trovare maggiori difficoltà per la diminuita irrorazione locale e temendo l’insorgenza
di deiscenze anastomotiche. Non è vero. Più grande è la neoplasia più difficile è
l’intervento perché la pelvi è stretta in basso (soprattutto negli uomini) limitando lo
spazio per le manovre chirurgiche: una riduzione del tumore facilita la tecnica
operatoria. Se si opera dopo 8 settimane dalla terapia neoadiuvante si ha una zona di
lieve edema che rende più facile i piani di dissezione.
Solamente nel T1 la radioterapia può sostituire la chirurgia.
S:
In questo caso avevamo un T4 perché la lesione oltrepassava posteriormente la
parete del retto. La paziente esegue durante il ricovero tutti gli esami di routine più i
markers tumorali (CEA, CA 19.9) che erano nella norma. I markers tumorali non
hanno ancora un valore nella diagnosi della malattia…
G:
Tranne in alcune malattie come il cancro della prostata nel quale il marker permette
una diagnosi precoce e può essere usato nella sorveglianza… nel carcinoma del retto e
del colon il CEA ed il CA 19.9 sono abbastanza aspecifici e non hanno significato di
diagnosi precoce. Infatti la nostra paziente aveva un tumore avanzato e dei markers
normali. Non si usano negli screening, ma nel caso di pazienti con diagnosi già fatta di
tumore, perché, se risultano alti alla diagnosi e crollano dopo l’intervento chirurgico si
ha un segnale indiretto della completa (o quasi) asportazione della neoplasia. Il valore
maggiore lo assume nel follow-up postoperatorio: se dopo un anno i markers
aumentano nuovamente, significa che c’è una recidiva. Una metastasi epatica può
produrre CEA più frequentemente di una recidiva pelvica.
S:
Esegue poi una ecografia transanale con una sonda simile a quella usata per lo studio
della prostata, esame che ci dà un’idea dell’invasione della neoplasia in termini di
spessore. Inoltre è più accurata della TC per la definizione del T.
G:
Dopo avere fatto il trattamento preoperatiorio si ripetono gli esami per verificare se si
è ottenuta la retrostadiazione della lesione.
S:
Infine è stata eseguita una colonscopia tradizionale. Abbiamo trovato una
neoformazione che occupava quasi interamente il lume del viscere in modo
circonferenziale, sanguinante, posta a circa 8 cm dal margine anale e che si
estendeva per una lunghezza di circa 5 cm in senso caudocraniale.
E’ importante sapere la distanza tra il margine inferiore della neoplasia e l’ano perché
su questo si basa la scelta dell’intervento chirurgico. Quello che serve per ricostituire
una continuità intestinale è del tessuto con cui confezionare l’anastomosi: più la
neoplasia è bassa meno tessuto ci sarà libero da malattia con margine di sicurezza (2
cm). Più si va in basso meno tessuto c’è: si rischia di dover eseguire un intervento di
Myles (?) ovvero di amputazione addomino-perineale.
G:
Quando ero un giovane assistente in clinica chirurgica (Nds… parliamo di età del
bronzo) tutti i tumori del retto che era possibile palpare all’esplorazione rettale
venivano sottoposti ad amputazione addomino-perineale; in quell’epoca non si faceva
chemio o radioterapia pre o postoperatoria, non c’era la TC non c’era l’ecografia…
(Nds… mi viene quasi da piangere…). Avevamo la rettoscopia e successivamente la
colonscopia. Si riteneva che questo intervento demolitivo fosse l’unico in grado di
garantire una radicalità chirurgica. Non c’era il rischio di deiscenza dell’anastomosi,
ma rimaneva il problema della guarigione di questo cavo che veniva lasciato aperto e
guariva per seconda intenzione: i pazienti rimanevano in ospedale per mesi ed
avevano un ano definitivo non facile da accettare. Esistevano poi dei problemi tecnici:
quando il tumore si presentava molto basso era difficile confezionare l’anastomosi
perché non esistevano le suturatici meccaniche, quindi l’anastomosi era manuale. Si
riteneva inoltre che fosse necessario uno spazio di almeno 5 cm dal margine inferiore
del tumore per impedire le recidive a livello dell’anastomosi, cosa che
successivamente è stata ridimensionata a 2-2.5 cm.
S:
L’esame istologico confermava trattarsi di un adenocarcinoma: vediamo gli assetti
ghiandolari tipici del tumore e gli infiltrati linfocitari.
Dovevamo scegliere un programma terapeutico: la paziente poteva giovarsi di un
trattamento neoadiuvante essendo un T4 molto basso. Si è cercato di retrostadiare la
neoplasia.
La paziente è stata sottoposta a posizionamento di un port-a-cath che è un impianto
sottocutaneo che dà accesso venoso ad un vaso centrale di grosso calibro, che si
utilizza per l’infusione degli agenti chemioterapici.
G:
La terapia con fluorouracile è piuttosto semplice e poco tossica, al contrario dei
farmaci a base di platino che sono efficaci ma molto tossici. L’utilità dei sistemi
impiantabili è quella di fare l’infusione senza creare trauma né flebiti alle vene
periferiche, perché il catere va direttamente in vena cava. Un sistema moderno molto
efficace è quello della cronoterapia: ogni paziente ha un apparecchio che contiene il
farmaco da infondere, con uno spingisiringa elettronico ed è programmato per i tempi
e le velocità di infusione. Consente di fare l’infusione in determinati momenti della
giornata, quando magari si ha il picco degli ormoni dello stress: si ottengono così
risultati migliori e migliore tollerabilità.
S:
Un port-a-cath è formato da un serbatoio posto sottocute tramite il confezionamento
di una tasca, alla base c’è una placca di titanio che non consente all’ago di
oltrepassare il serbatoio e di fare danni, è collegato ad un tubicino che tramite una
collaterale, mette in collegamento con un vaso centrale. Il port si sente al tatto e
viene usato tramite aghi particolari.
G:
E’ un’apparecchiatura sicura ma che può portare alcuni problemi: è un corpo estraneo
e può infettarsi con ulcerazione della cute, oppure assai raramente, si può avere una
trombosi della vene entro cui il catetere passa, oppure può spezzarsi il collegamento
tra il serbatoio ed il tubicino, e questo viene trascinato dal sangue fino ad un ramo
dell’arteria polmonare, dando un’embolia da corpo estraneo.
S:
La paziente si sottopone a trattamento con 5-FU e torna dopo 5 settimane per
l’intervento chirurgico.
Dopo l’intervento chirurgico è stato eseguito l’esame istologico definitivo con
stadiazione della malattia come T3N1MX: la malattia si era retrostadiata e l’invasione
N era limitata ai linfonodi regionali. Non c’erano segni di metastatizzazione della
malattia ma non era possibile essere sicuri.
La paziente è stata sottoposta a resezione anteriore del retto.
Dalla settima giornata postoperatoria la paziente ha cominciato ad avere dei picchi
febbrili fin oltre 39°C e si doveva capirne la causa.
L’infezione poteva essere della ferita, del sito dell’intervento con formazione di un
ascesso, oppure a livello del port-a-cath, oppure poteva avere una polmonite
nosocomiale. E’stato rimosso il port ma la temperatura si è mantenuta alta.
Cosa abbiamo fatto:
- ferita ben epitelizzata senza segni di infezione
- canalizzata con alvo aperto a feci e gas con diarrea (6 ev./die)
G:
La paziente poteva avere diarrea per una colite causata dalla terapia antibiotica, la cui
forma più pericolosa è la colite pseudomembranosa da C. difficile; l’altra possibilità è
una localizzata irritazione peritoneale per una infezione causata da una deiscenza.
Prima dell’ileo paralitico può esserci un iperdinamismo con una diarrea.
S:
La paziente comincia a bere e compare febbre con brivido, quindi febbre di tipo
settico. In nona giornata comincia a lamentare disuria, tenesmo vescicale e disturbi
alla defecazione.
G:
Dobbiamo dire che tutti i pazienti che portano il catetere per qualche giorno hanno poi
difficoltà alla minzione e possono sviluppare una cistite. In alcuni casi i germi possono
risalire e dare una febbre urosettica, che si manifesta con brivido. L’infezione del port
può dare facilmente una setticemia perché i germi finiscono nel torrente circolatorio.
Comunque il primo pensiero che dobbiamo avere è che non ci sia una deiscenza della
anastomosi, perché nella chirurgia del colon sottoperitoneale c’è una possibilità del
10% circa di formazione di fistole. Sarà una peritonite settica localizzata?
S:
Per verificare ciò abbiamo fatto una TC addome-pelvi che non mostrava raccolte
fluide; non c’era ascesso. Si presenta una piastrinosi fino a 605 mila e dolore
addominale. E’ stata fatta una consulenza infettivologica con emocolture ed
urinocolture risultate tutte negative. La paziente è stata sottoposta a rimozione del
port ed il giorno seguente è stato eseguito un ecocardiogramma per il sospetto di
un’endocardite risultato negativo.
G:
Palpando l’addome della paziente non c’erano segni di difesa addominale né di
peritonite, infatti i disturbi principali erano dolore importante in sede perineale
durante la defecazione e disuria.
S:
Abbiamo fatto una consulenza oncologica necessaria per determinare una terapia
adiuvante.
In 15a giornata si è rimosso il port-a-cath e si è inviata la punta all’esame colturale.
Compariva anche tenesmo rettale. All’esplorazione rettale si apprezzava l’anastomosi
confezionata: era ampia con calibro buono e la paziente aveva dolore all’eplorazione.
L’ecografia della pelvi era negativa per raccolte endoaddominali, così come era
negativa la ricerca del C. difficile
G:
Del resto non c’erano pseudomembrane nella diarrea…
Armando’s question:
Quando sono stati fatti gli esami colturali la paziente era già in terapia antibiotica?
G:
Li avevamo sospesi…
Armando’s question 2:
Magari poteva esserci una fistola con la vescica…
G:
No! L’anastomosi era così bassa da trovarsi sotto il piano della vescica, in sede
extraperitoneale; inoltre si dovevano trovare germi fecali nell’urina e doveva esserci
pneumaturia.
S:
In 17a giornata è stata ripetuta la TC della pelvi senza e con mdc, con insufflazione di
aria dall’ano: negativa.
G:
Perché si è fatto questo? Pensavo sempre che la causa fosse una fistola che magari
non si metteva in evidenza, allora insufflando aria doveva andare fuori dal retto e
doveva essere visualizzabile.
S:
In 20a giornata abbiamo fatto un eco-color-doppler della vena succlavia sinistra dove
la paziente aveva impiantato il port, per vedere che non ci fosse una flebite.
La paziente continuava ad avere molte evacuazioni dolorose.
La punta del catetere è risultata positiva per gram negativi ed è stata aggiunta in
terapia la Gentamicina (Gentalyn). Arriva poi il risultato definitivo della coltura che
rilevava la crescita del Bacillus firmus che non è patogeno. La paziente modifica la
terapia da Ampicillina-Sulbactam a Cefotaxime e continua la Gentamicina.
Si decide di far eseguire alla paziente una scintigrafia con leucociti marcati: viene
prelevato un campione di sangue per marcare i leucociti con un tracciante radioattivo
e vengono reiniettati alla paziente; i leucociti si localizzano nel luogo dell’infezione e
possono essere seguiti. Si evidenzia così una localizzazione flogistica a livello dello
scavo pelvico che coincide con la sintomatologia.
G:
Ho discusso questo caso con il prof. Di Matteo che mi ha detto che la fistola c’era!!
S:
In 27a giornata è stata ripetuta l’ecografia transrettale: negativa.
E’ stata eseguita una rettoscopia con l’endoscopio flessibile, che prima non poteva
essere eseguita per la presenza dell’anastomosi fresca: si è vista la presenza di un
recesso, di alcuni centimetri, a partenza dall’anastomosi, che aveva dato origine alla
fistola.
Durante l’intervento si esegue un’anastomosi meccanica con suturatrice circolare,
introducendone, attraverso l’ano, il manico…
G:
Il retto è inizialmente intraperitoneale, poi, a livello dello sfondato del Douglas,
diventa extraperitoneale ed è circondato da un grosso manicotto di tessuto grasso
attraverso cui passano i vasi sanguigni e linfatici: questa struttura si chiama
mesoretto. L’intervento chirurgico si eseguiva andando vicino al retto e lasciando il
mesoretto. Le recidive erano causate dalle cellule neoplastiche presenti nel mesoretto:
bisogna asportare completamente il mesoretto e la dissezione non va portata vicino al
retto ma vicino alle pareti pelviche. Con questa tecnica le recidive sono passate dal
30% al 12%; se si aggiunge la chemio-radioterapia si scende al 10-8%.
Le suture meccaniche si usano in anastomosi molto distali perché più semplici e
sicure. La suturatrice è fatta di due parti, una si chiama “incudine” che si trova vicino
al manico, ed una seconda che si chiama “testina”.
Le due parti di intestino da suturare sono intorno a queste due zone… nella parte più
esterna ci sono i punti metallici, nella parte più interna c’è una lama circolare: bisogna
che le pareti del colon e del retto si pongano in questa posizione, avvicinando la
testina, si sparano i punti che suturano tutto intorno l’intestino e al centro scatta la
lama che taglia la parte interna degli anelli. Come si fa a mandare l’intestino
all’interno perché sia vicino allo stelo e sia suturato? Si fa con un filo una borsa di
tabacco intorno al retto ed una intorno al colon. La cosa difficile è la borsa di tabacco
in profondità: si preferisce usare la tecnica di Naiten-Griffin (?). Mettiamo una
suturatrice lineare che sutura i retto e non dobbiamo più fare la borsa di tabacco; a
questo punto togliamo la testina e tramite un perno che buca il retto facciamo passare
lo stelo, poi rimontiamo la testina e facciamo l’anastomosi.
Il problema è che si incrociano due linee di sutura e restano ai lati due orecchiette che
sono le zone più a rischio, dove c’è meno irrorazione: nella nostra paziente, infatti, il
recesso si è formato in una di quelle zone, che ha ceduto. Le cose sono andate bene
perché si è formata un’infezione ma non una peritonite, perché la paziente era
giovane e i suoi organi hanno resistito.
Nelle anastomosi basse le fistole con manifestazione clinica sono del 6-8%; nella
tecnica che vi ho descritto sono del 15-20%.
Poiché nella mia casistica avevo percentuali molto più basse, non proteggevo le
anastomosi con un ano artificiale temporaneo per 20-25 giorni: era un errore, perché
una buona tecnica non annulla questi rischi.
Per la nostra paziente cosa si poteva fare? Un’ileostomia di protezione oppure una
nutrizione parenterale: la prima è certamente più efficace ma in questo caso non era
psicologicamente proponibile.
S:
Si è scelta la strada della nutrizione parenterale per 4 settimane, con crollo della
febbre e risoluzione spontanea della fistola (ciò che la manteneva aperta era il
passaggio delle feci).
G:
Abbiamo imparato che quando si fa un’anastomosi ultrabassa, in particolare se si usa
la tecnica di Naiten-Griffin, si deve fare un’ileostomia durante l’intervento; in 20a
giornata si fa un controllo radiologico ed endoscopico e se non ci sono fistole si chiude
l’ileostomia senza problemi.
Quando si fa una colectomia totale e si fa un’anastomosi tra ileo e retto basso si perde
la capacità del colon di assorbimento, così che i pazienti vanno incontro a numerose
deiezioni liquide: si può creare una pouch fatta di ileo per ricostruire l’ampolla rettale
e migliorare la continenza.
Nel nostro caso si perde la discriminazione tra contenuto gassoso e solido con perdita
di feci involontaria e perdita durante la notte: per ovviare a ciò si è creata una pouch
colica per fare una camera più ampia che dia una continenza accettabile. Questo
intervento va protetto con la stomia perché rende più facile la formazione delle fistole.