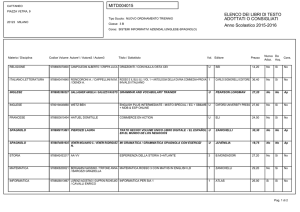
Copyright © 2008 Zanichelli editore
CAPITOLO
7
7.1 L'energia è l'attitudine a compiere lavoro e a fornire
calore
7.2 L'energia interna è l'energia totale contenuta nelle
molecole di un corpo
7.3 Il calore può essere determinato misurando i
cambiamenti di temperatura
7.4 Rottura e formazione dei legami chimici implicano
assorbimento o liberazione di energia
7.5 Il calore di reazione viene misurato in condizioni di
volume o pressione costante
7.6 Le equazioni termochimiche indicano anche il calore
scambiato
7.7 Le equazioni termochimiche possono essere combinate
7.8 La previsione e il calcolo del calore di reazione
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.1 L'energia è l'attitudine a compiere lavoro
e a fornire calore
L’energia è la capacità di compiere un lavoro e di fornire
calore.
Il lavoro è un’azione esercitata contro una forza che si
oppone.
Copyright © 2008 Zanichelli editore
L’energia cinetica è l’energia posseduta da un corpo in
movimento.
Per un oggetto con massa m e velocità v
Energia cinetica
1
2
2
mv
7 • L'ENERGIA È L'ATTITUDINE A COMPIERE LAVORO E A FORNIRE CALORE
La legge della conservazione dell’energia afferma che l’energia
non può essere né creata né distrutta.
Copyright © 2008 Zanichelli editore
Prendiamo in esame la collisione tra due atomi: l’atomo A
che si muove più velocemente trasferisce energia all’atomo B
per collisione. L’energia totale si conserva.
7 • L'ENERGIA È L'ATTITUDINE A COMPIERE LAVORO E A FORNIRE CALORE
L’energia potenziale è l’energia posseduta da un corpo in
base alla sua posizione o alla disposizione delle sue parti.
L’energia cinetica può essere convertita in energia
potenziale e viceversa.
Copyright © 2008 Zanichelli editore
Quando la ragazza è in (a) o in (c)
possiede solo energia potenziale;
in (b) solo energia cinetica.
L’energia totale si conserva
7 • L'ENERGIA È L'ATTITUDINE A COMPIERE LAVORO E A FORNIRE CALORE
Copyright © 2008 Zanichelli editore
L'energia potenziale di una molla dipende dalla sua
lunghezza. Sia la compressione sia lo stiramento determinano
un aumento della sua energia potenziale. L'energia potenziale
è minima quando la molla ha la sua lunghezza naturale.
7 • L'ENERGIA È L'ATTITUDINE A COMPIERE LAVORO E A FORNIRE CALORE
L’unità SI dell’energia è il joule (J).
Un oggetto con una massa pari a 2 kg che si muove alla
velocità di 1 metro al secondo possiede un J di energia
cinetica.
Un’altra importante unità di misura dell’energia è la caloria
(cal).
Copyright © 2008 Zanichelli editore
1J
1
2
(2 kg)
1m 2
1s
2
1 kg m s
1 cal 4,184 J (esatti)
-2
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.2 L'energia interna è l'energia totale
contenuta nelle molecole di un corpo
Quando un oggetto freddo e un oggetto caldo vengono a
contatto raggiungono un equilibrio termico (la stessa
temperatura).
Copyright © 2008 Zanichelli editore
L’energia trasferita sotto forma di calore proviene da una
riserva di energia interna del corpo.
L’energia associata con il movimento delle molecole viene
definita energia cinetica molecolare.
L’energia che deriva dalle forze di attrazione e repulsione che
si stabiliscono tra le molecole viene definita energia
potenziale molecolare.
7 • L'ENERGIA INTERNA È L'ENERGIA TOTALE CONTENUTA NELLE MOLECOLE DI UN
CORPO
L’energia interna è l’energia totale di tutte le particelle.
L’energia interna viene indicata con il simbolo E o U.
Noi siamo interessati ai cambiamenti di E:
Copyright © 2008 Zanichelli editore
E Efinale - Einiziale o E Eprodotti - Ereagenti
La variazione di energia interna è positiva se il sistema
assorbe energia dall’ambiente e negativa se rilascia energia
all’ambiente.
7 • L'ENERGIA INTERNA È L'ENERGIA TOTALE CONTENUTA NELLE MOLECOLE DI UN
CORPO
La temperatura di un corpo è in relazione con l’energia
cinetica media delle sue molecole.
Frazione del numero totale di
particelle che hanno una data
energia cinetica
Copyright © 2008 Zanichelli editore
La temperatura per la curva (1) è più bassa della temperatura della
curva (2) perché l’energia cinetica media è minore.
Energia cinetica (unità arbitrarie)
7 • L'ENERGIA INTERNA È L'ENERGIA TOTALE CONTENUTA NELLE MOLECOLE DI UN
CORPO
Copyright © 2008 Zanichelli editore
Trasferimento di energia da un corpo più caldo a un
corpo più freddo:
A) Un corpo caldo (sinistra) e uno freddo (destra) isolati.
B) Viene permesso un contatto termico tra i due corpi.
C) Viene raggiunto un equilibrio termico: l’energia cinetica molecolare
di entrambi i corpi è la stessa.
7 • L'ENERGIA INTERNA È L'ENERGIA TOTALE CONTENUTA NELLE MOLECOLE DI UN
CORPO
L’energia di un corpo dipende solo dalle condizioni in cui si
trova il corpo.
Lo stato di un corpo è definito dall’insieme dei valori delle
proprietà fisiche: composizione, stato fisico, concentrazione,
temperatura, pressione e volume .
L’energia interna è una funzione di stato.
Copyright © 2008 Zanichelli editore
Un’importante proprietà delle funzioni di stato è che sono
indipendenti dalla modalità o dal meccanismo con cui avviene
una variazione.
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.3 Il calore può essere determinato
misurando i cambiamenti di temperatura
Il corpo che intendiamo studiare è chiamato sistema.
Tutto ciò che è esterno al sistema prende il nome di
ambiente.
I confini separano il sistema dall’ambiente.
Copyright © 2008 Zanichelli editore
L’insieme del sistema e dell’ambiente costituisce l’universo.
7 • IL CALORE PUÒ ESSERE DETERMINATO MISURANDO I CAMBIAMENTI DI
TEMPERATURA
Esistono tre tipi di sistemi:
• Sistema aperto: scambia materia ed energia con
l’ambiente.
• Sistema chiuso: scambia soltanto energia
• Sistema isolato: non scambia né materia né energia.
Copyright © 2008 Zanichelli editore
Quando consideriamo uno scambio di calore dobbiamo
indicare se il calore viene assorbito o ceduto:
• Se il corpo assorbe calore adoperiamo un numero
positivo.
• Se il corpo cede calore adoperiamo un numero
negativo.
7 • IL CALORE PUÒ ESSERE DETERMINATO MISURANDO I CAMBIAMENTI DI
TEMPERATURA
Il calore acquisito o rilasciato da un corpo è direttamente
proporzionale alla variazione di temperatura a cui va
incontro.
q
C (t finale - tiniziale) C t
La capacità termica è la quantità di calore che un corpo
deve assorbire per aumentare la temperatura di 1 °C.
Copyright © 2008 Zanichelli editore
Le sue unità di misura sono J/°C.
C è una proprietà estensiva.
7 • IL CALORE PUÒ ESSERE DETERMINATO MISURANDO I CAMBIAMENTI DI
TEMPERATURA
Il calore specifico (s) è una proprietà intensiva,
caratteristica di ogni sostanza:
C m s o s C/m
unità di misura di s J g-1 C-1
Copyright © 2008 Zanichelli editore
Una sostanza con calore
specifico maggiore rilascia una
maggiore quantità di energia
durante il suo raffreddamento.
Il calore assorbito o rilasciato
da un corpo si ricava
dall’espressione:
q m s t
7 • IL CALORE PUÒ ESSERE DETERMINATO MISURANDO I CAMBIAMENTI DI
TEMPERATURA
Esempio: La temperatura di 251 g di acqua varia da 25,0 a
30,0 °C. Quanto calore viene scambiato con l’acqua?
Analisi: Colleghiamo il calore al cambiamento di temperatura.
Soluzione:
q m s t
Copyright © 2008 Zanichelli editore
(251 g) (4,18 J g-1 C-1 ) (30,0 - 25,0) C
5250 J 5,25 kJ
Nota: Il calore viene assorbito perché q è positivo
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.4 Rottura e formazione dei legami chimici
implicano assorbimento o liberazione di
energia
Le forze di attrazione che si stabiliscono tra due atomi
prendono il nome di legami chimici.
Copyright © 2008 Zanichelli editore
La rottura di un legame chimico richiede energia.
L’attrazione tra gli elettroni e i
nuclei è abbastanza forte da
superare le repulsioni nucleonucleo ed elettrone-elettrone.
Creare un legame chimico comporta un rilascio di energia.
L’energia potenziale contenuta nei legami chimici è chiamata
energia chimica.
7 • ROTTURA E FORMAZIONE DEI LEGAMI CHIMICI IMPLICANO ASSORBIMENTO O
LIBERAZIONE DI ENERGIA
Le reazioni chimiche generalmente implicano la formazione e
la rottura di legami.
La perdita o il guadagno di energia avviene spesso sotto
forma di calore.
Una reazione che libera calore è chiamata esotermica.
Una reazione che consuma energia è chiamata endotermica.
Copyright © 2008 Zanichelli editore
Le reazioni possono rilasciare calore perché legami “deboli”
vengono sostituiti da legami “forti”.
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.5 Il calore di reazione viene misurato in
condizioni di volume o pressione costante
La quantità di calore assorbita o rilasciata in una reazione
chimica è chiamata calore di reazione.
Per misurare il calore di reazione si adopera un calorimetro.
Copyright © 2008 Zanichelli editore
I calorimetri vengono adoperati per effettuare misure di calore
di reazione a volume o a pressione costante.
qv e qp sono i simboli per indicare il calore misurato
rispettivamente a volume e a pressione costante.
Nelle variazioni dove c’è una grande variazione di volume per
consumo o produzione di gas i valori di qv and qp possono
essere molto diversi.
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
Il lavoro di espansione è w = -P∆V dove P è la pressione
che si oppone al pistone e ∆V la variazione di volume.
Copyright © 2008 Zanichelli editore
Il lavoro di espansione è negativo.
Lavoro di espansione:
A) Un gas racchiuso sotto
pressione.
B) Il gas compie un
lavoro di espansione
sull’ambiente.
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
Lavoro e calore sono modi alternativi di trasferire energia.
La loro somma indica il cambiamento in energia interna a
cui va incontro il sistema:
E q w
Copyright © 2008 Zanichelli editore
Tale affermazione è la prima legge della termodinamica,
che dice che l’energia non può essere né creata né distrutta.
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
Copyright © 2008 Zanichelli editore
Il calore e il lavoro non sono funzioni di stato perché
dipendono da ciò che accade fra lo stato iniziale e quello finale
Entrambi i percorsi
forniscono la stessa
quantità di energia. Nel
percorso 1 l’energia si
libera completamente
sotto forma di calore (q),
nel percorso 2 gran parte
dell’energia appare come
lavoro (w).
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
Il calore prodotto in una reazione di combustione è chiamato
calore di combustione.
I calori di combustione sono misurati in recipienti chiusi
(bomba calorimetrica) perché le reazioni consumano e
producono gas.
La reazione procede a volume costante e quindi:
Copyright © 2008 Zanichelli editore
E qv
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
Copyright © 2008 Zanichelli editore
Bomba calorimetrica
La camera di reazione ha un volume costante. Non viene
compiuto lavoro di espansione. Il calore rilasciato è assorbito
dal recipiente di reazione e dall’acqua.
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
La maggior parte delle reazioni si svolgono in recipienti aperti
a pressione costante.
A pressione costante le reazioni possono scambiare calore e
lavoro di espansione.
La variazione di calore misurata a pressione costante è
l’entalpia, H
Copyright © 2008 Zanichelli editore
Hproduc ts-Hreac tants H E PV qp
L’entalpia è una funzione di stato:
• è negativa per un processo esotermico
• è positiva per un processo endotermico
7 • IL CALORE DI REAZIONE VIENE MISURATO IN CONDIZIONI DI VOLUME O
PRESSIONE COSTANTE
La differenza tra la variazione di energia interna e la
variazione di entalpia può essere molto alta per le reazioni in
cui si hanno grandi variazioni di volume.
Copyright © 2008 Zanichelli editore
Per misurare il calore di
reazione a pressione costante
si adopera un calorimetro a
tazza.
Il calore rilasciato o assorbito
viene determinato dalla
variazione della temperatura
della soluzione.
La quantità di calore che una
reazione produce dipende dal
numero di moli dei
reagenti.
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.6 Le equazioni termochimiche indicano
anche il calore scambiato
Per confrontare i calori di reazione è stato definito un insieme
di stati standard.
Stati standard termodinamici: 1 bar per le sostanza gassose e
concentrazione 1 M per le soluzioni acquose.
Copyright © 2008 Zanichelli editore
Spesso viene indicata anche la temperatura: 25 °C (298 K).
Il calore standard di reazione è il valore di ∆H di una
reazione che si svolge in condizioni standard e in cui è
specificato dai coefficienti di reazione il numero delle moli
delle sostanze coinvolte.
7 • LE EQUAZIONI TERMOCHIMICHE INDICANO ANCHE IL CALORE SCAMBIATO
Un cambiamento di entalpia in condizioni standard viene
indicato con ∆H°.
Esempio: l’equazione termochimica per la produzione di
ammoniaca dai suoi elementi in condizioni standard è
N2 (g) 3H2 (g) 2NH 3(g)
H 92.38 kJ
Copyright © 2008 Zanichelli editore
L’equazione termochimica riporta sempre lo stato fisico dei
reagenti e dei prodotti.
Come conseguenza delle legge della conservazione
dell’energia
2NH3(g) N2 (g) 3H2 (g)
H 92.38 kJ
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.7 Le equazioni termochimiche possono
essere combinate
Copyright © 2008 Zanichelli editore
Un diagramma dell’entalpia rappresenta graficamente i
percorsi alternativi di una stessa reazione
Due percorsi diversi per
la formazione del CO2(g).
La variazione di entalpia
complessiva è identica
nei due percorsi.
7 • LE EQUAZIONI TERMOCHIMICHE POSSONO ESSERE COMBINATE
Le variazioni dell’entalpia di reazione possono essere calcolate
per somma algebrica.
Legge di Hess: il ∆H° complessivo di una qualsiasi reazione
che può svolgersi attraverso più stadi è pari alla somma dei
∆H° dei singoli stadi.
Copyright © 2008 Zanichelli editore
L’applicazione della legge di Hess richiede di riadattare le
equazioni termochimiche secondo semplici regole.
7 • LE EQUAZIONI TERMOCHIMICHE POSSONO ESSERE COMBINATE
Regole per riadattare le equazioni termochimiche:
1. Quando un’equazione viene invertita deve essere cambiato
il segno del ∆H°.
2. Formule uguali da entrambi i lati dell’equazione possono
essere cancellate solo se le sostanze si trovano nello stesso
stato fisico.
Copyright © 2008 Zanichelli editore
3. Se si moltiplicano o si dividono tutti i coefficienti
dell’equazione per un certo fattore anche il ∆H° deve essere
moltiplicato o diviso per lo stesso fattore.
Sono disponibili banche dati di equazioni termochimiche che
permettono di calcolare il ∆H° di qualsiasi reazione.
7 • ENERGIA E TRASFORMAZIONI CHIMICHE
7.8 La previsione e il calcolo del calore di
reazione
Il calore standard di combustione è la quantità di calore
liberata quando una mole di combustibile viene
completamente bruciata in atmosfera di ossigeno puro, alla
temperatura di 25 °C e alla pressione di 1 bar:
Copyright © 2008 Zanichelli editore
CH4 (g) 2O2 (g) CO2 (g) 2H2O(l ) HC -890 kJ
I calori di combustione sono sempre negativi e producono
acqua allo stato liquido
7 • LA PREVISIONE E IL CALCOLO DEL CALORE DI REAZIONE
L’entalpia standard di formazione di una sostanza è la
quantità di calore assorbita o liberata quando una mole della
sostanza viene formata, a 25 °C e 1 bar, dai suoi elementi nei
loro stati standard:
H2(g)
1
2
O2(g) H2O(l )
Hf 285.9 kJ/mol
Copyright © 2008 Zanichelli editore
I valori dell’entalpia di formazione per gli elementi nei loro
stati standard sono uguali a zero.
7 • LA PREVISIONE E IL CALCOLO DEL CALORE DI REAZIONE
La legge di Hess può essere espressa sotto forma di
un’equazione nota come equazione della legge di Hess:
Ο
ΔHreazione
somma dei ΔHΟf somma dei ΔHΟf
di
tutti
i
prodotti
di
tutti
i
reagenti
Esempio: Calcola il ∆H° per l’equazione 2NO(g)+O2(g)
2NO2(g)
Copyright © 2008 Zanichelli editore
Analisi: Adoperiamo la legge di Hess e i valori di entalpia di
formazione tabulati (tabella 7.2)
Soluzione:
ΔH 2ΔHfNO2 2ΔHfNO ΔHf O2
2(33,8 kJ) - (2(90,37 kJ) 0 kJ) -113,1 kJ