Nelle forme di vita superiore le sostanze alimentari,
rappresentate principalmente da carboidrati e lipidi,
sono metabolizzate a biossido di carbonio e ad acqua
L’energia fornita da questa catena di reazioni
ossidative è conservata sotto forma di un composto
fosforilato ad alta energia, l’adenosina trifosfato (ATP)
La fosforilazione ossidativa è il processo in cui viene
formato ATP, mentre gli elettroni sono trasferiti dal
NADH oppure dal FADH2 all’ossigeno, attraverso una
serie di trasportatori di elettroni
L’ATP è composto da una base purinica, l’adenina,
uno zucchero a cinque atomi di carbonio, il ribosio, e
dai gruppi fosforici a, b, e g
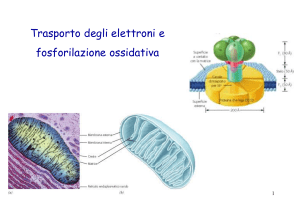
La fosforilazione ossidativa ha luogo su strutture
respiratorie localizzate nella membrana interna dei
mitocondri
I mitocondri sono organelli di forma ovoidale costituiti da
due sistemi di membrane: una membrana esterna ed una
membrana interna molto estesa e ripiegata
La membrana esterna del mitocondrio è
permeabile alla maggior parte delle molecole
piccole ed agli ioni, in quanto contiene molte
copie della proteina porina, una proteina
transmembrana che forma un poro
La membrana interna è impermeabile a quasi
tutti gli ioni ed alle molecole polari. La
membrana interna è attraversata da specifiche
proteine trasportatrici, come quella per l’ADP e
per gli acidi grassi a lunga catena
Nei mitocondri esistono due compartimenti: lo spazio
intermembrana, tra la membrana interna e quella
esterna, e la matrice, lo spazio delimitato dalla
membrana interna
La fosforilazione ossidativa ha luogo nella membrana
mitocondriale interna, mentre la maggior parte delle
reazioni del ciclo dell’acido citrico e della via di
ossidazione degli acidi grassi avvengono nella
matrice
La catena di trasporto degli elettroni o catena
respiratoria, è localizzata nella membrana
mitocondriale interna, e consiste di diversi grandi
complessi proteici e di due piccole componenti
indipendenti: l’ubichinone e il citocromo c
Gli elettroni attraversano questo sistema in una
sequenza che li porta dai coenzimi ridotti
all’ossigeno, e lungo la quale i cambiamenti di
energia libera alimentano il trasporto di protoni
dalla matrice allo spazio intermembrana
Vi sono quattro siti d’ingresso per gli elettroni nella
catena respiratoria: uno per il NADH (Complesso I) e
tre per il FADH2 (Complesso II). Queste vie
confluiscono a livello della piccola molecola lipofila
dell’ubichinone (coenzima Q10), all’inizio della
porzione comune della catena di trasporto, che
consiste nel Complesso III, del citocromo c e del
Complesso IV
L’accettore finale degli elettroni, al termine della
catena, è l’ossigeno molecolare che viene ridotto ad
acqua
Il Complesso I, è una flavoproteina contenente FMN.
Il Complesso I è responsabile dell’ossidazione del
NADH mitocondriale e del trasferimento degli
elettroni, attraverso il FMN e i complessi ferro-zolfo,
all’ubichinone, fornendo cosi energia sufficiente,
sotto forma di gradiente di protoni, per la sintesi di
una mole di ATP
L’ubichinone che si trova in tutti i sistemi viventi, è una
piccola molecola liposolubile localizzata nella
membrana interna dei mitocondri di cellule vegetali ed
animali
L’ubichinone delle cellule dei mammiferi contiene una
coda idrocarburica di 10 unità isopreniche, e viene perciò
definito CoQ10. E’ in grado di diffondere lungo la
membrana mitocondriale interna dove accetta elettroni
dalle flavoproteine e li trasferisce al Complesso III (QH2citocromo c reduttasi)
L’ubichinone incanala il flusso di elettroni
provenienti dalle flavoproteine dei Complessi I e II
verso il Complesso III, un oligomero di circa otto
peptidi contenente il citocromo b, un centro ferrozolfo e il citocromo c1
Questo complesso enzimatico (ubichinonecitocromo c reduttasi) ossida l’ubichinone e
riduce il citocromo c
Esistono diversi tipi di centri ferro-zolfo: Fe2S2 e
Fe4S4.
In ciascun tipo il centro ferro-zolfo è legato a residui
di cisteina della catena polipeptidica
Il citocromo c è una piccola proteina contenente eme,
che si trova associata debolmente alla superficie
esterna della membrana mitocondriale interna e
trasporta elettroni dal complesso III al complesso IV
La riduzione, ad opera del citocromo c1, del ferricitocromo
c (Fe3+) a ferrocitocromo c (Fe2+), induce un
cambiamento nella conformazione tridimensionale di
quest’ultimo, che favorisce il trasferimento di elettroni al
citocromo a del complesso IV
Il complesso IV, noto come citocromo c
ossidasi, ossida il citocromo c e trasferisce gli
elettroni, attraverso i citocromi a e a3,
all’ossigeno che viene ridotto.
Il rame è un componente comune a questo
enzima ed ad altre ossidasi, alcuni veleni come
l’azide ed il cianuro reagiscono con il rame ed
inibiscono questo enzima.
Come per i complessi I e IIII, il complesso
citocromo ossidasi pompa protoni all’esterno del
mitocondrio fornendo energia libera per la sintesi di
ATP
Durante il trasporto di elettroni, i protoni sono pompati
dalla matrice nello spazio intermembrana, creando un
potenziale elettrochimico attraverso la membrana
interna. L’estero del mitocondrio diventa così più
acido e più carico positivamente rispetto alla matrice
La sintesi di ATP, una reazione non spontanea, è
sostenuta dal ritorno dei protoni, in favore del
gradiente elettrochimico, nella matrice attraverso
l’ATP-sintasi
Il mitocondrio assomiglia quindi ad unna “batteria” ad
ATP in cui l’energia per la sintesi di ATP è
immagazzinata sotto forma di gradiente di protoni.
Per funzionare, richiede l’integrità del sistema di
membrane interne, che devono essere impermeabili ai
protoni tranne che in corrispondenza del complesso
ATP- sintasi.
In condizioni normali, i processi di ossidazione e
fosforilazione sono strettamente accoppiati: i substrati
sono ossidati, gli elettroni trasportati, e l’ossigeno
consumato solo quando c’è richiesta di sintesi di ATP
Perciò nei mitocondri a riposo, la velocità di
consumo di ossigeno è bassa. Questa può essere
fortemente aumentata dall’aggiunta di ADP
I mitocondri sono definiti “disaccoppiati” quando la
membrana mitocondriale interna perde la sua
integrità strutturale: in questa circostanza i protoni
possono diffondere attraverso la membrana lungo
vie improduttive
I disaccoppianti della fosforilazione ossidativa
dissipano il gradiente di protoni favorendone il reflusso
nella matrice mitocondriale scavalcando il sistema
dell’ATP-sintasi
Un disaccoppiante tipico è il 2,4-dinitrofenolo (DNP),
altri comuni disaccopianti sono sostanze conservanti
ed antimicrobiche come il pentaclorofenolo e il pcresolo
Gli inibitori del trasporto degli elettroni interrompono
il flusso di elettroni lungo la catena respiratoria
agendo selettivamente sui complessi I, III o IV
Il risultato è sempre il blocco delle pompe
protoniche, della sintesi di ATP e del
consumo di ossigeno
Molti di questi inibitori sono veleni, quali ad
esempio il rotenone che è un insetticida che
inibisce il complesso I del sistema di trasporto
degli elettroni
Poiché il malato e il lattato sono ossidati dal NAD, il
rotenone inibirà la loro ossidazione
L’antimicina A, inibendo il complesso III,
impedisce il trasferimento di elettroni dai
complessi I o II al citocromo c
Sia il cianuro che il monossido di carbonio si
legano, inibendolo, al complesso IV
Le cellule rispondono all’avvelenamento da cianuro o
da monossido di carbonio passando ad un
metabolismo anaerobico, che causa acidosi e da
ultimo morte, se non si prendono immediate
contromisure.
L’avvelenamento da monossido di carbonio può
essere trattato con la somministrazione di ossigeno