ORGANIZZAZIONE DI VOLONTARIATO
PROTEZIONE CIVILE SETTIMO SAN PIETRO
CAGLIARI
ELEMENTI DI FISICA
NUCLEARE
Corso Interno Rivelatori
Chimico Biologici
Settimo San Pietro
27 marzo – 1° luglio 2012
Presentazione in power point
Relatore Lgt. G.FARCI
OdV Protezione Civile SSP
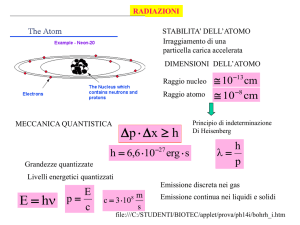
Un po' di fisica nucleare:
La radioattività
Struttura dell’atomo
Atomi al microscopio
Atomi al microscopio
Numero Atomico
Il numero atomico (indicato solitamente con Z , dal
tedesco Zahl, e detto anche numero protonico)
corrisponde al numero di protoni contenuti in un nucleo
atomico. In un atomo neutro il numero atomico è pari
anche al numero di elettroni; in caso contrario l'atomo è
detto ione. Si usa scrivere questo numero come pedice
sinistro del simbolo dell'elemento chimico in questione: per
esempio 6C, poiché il carbonio ha sei protoni.
Ad ogni numero atomico corrisponde un diverso
elemento chimico.
Atomi aventi stesso numero atomico ma diverso numero
di neutroni sono detti isotopi.
In fisica il numero atomico è indicato con la sigla N.A. ed
indica il numero di protoni presenti in un atomo cioè se il
numero atomico di un atomo è 5 vuol dire che essendo
l'atomo neutro avrà 5 protoni e 5 elettroni
Numero di Massa
Il numero di massa (solitamente indicato con A) è
pari alla somma delle masse di tutti i protoni e i
neutroni presenti in un atomo, siccome le masse
di neutroni e protoni sono circa pari a 1 si può dire
che il numero di massa sia pari al numero di
nucleoni (ovvero protoni e neutroni) contenuti in
un nucleo atomico.
Quando di un elemento si vuole specificare il numero
di massa, lo si scrive in alto, a sinistra del simbolo
chimico. Per esempio, per l'isotopo del carbonio con
numero di massa 12 si rappresenta con: 12C.
Tavola Periodica
La tavola periodica degli elementi è lo schema col quale vengono
ordinati gli atomi sulla base del loro numero atomico Z. Ideata dal
chimico russo Dimitrij Mendeleev nel 1869, contemporaneamente
ed indipendentemente dal chimico tedesco Julius Lothar Meyer
(1830 - 1895), inizialmente contava numerosi spazi vuoti, previsti
per gli elementi che sarebbero stati scoperti in futuro, taluni nella
seconda metà del 1900.
La tavola periodica si articola in gruppi e periodi:
· Ogni gruppo (colonne verticali della tavola) comprende gli
elementi che hanno la stessa configurazione elettronica esterna
(modo in cui gli elettroni si dispongono attorno al nucleo).
All'interno di ogni gruppo si trovano elementi con caratteristiche
simili.
Ogni periodo (linee orizzontali delle tabella) inizia con un elemento
il cui atomo ha come configurazione elettronica esterna un
elettrone di tipo s, o ns dove n è il numero quantico principale, e
procedendo verso gli atomi successivi del periodo, il numero
atomico Z aumenta di una unità ad ogni passaggio.
Tavola Periodica
Legame Ionico
Quando due o più atomi si uniscono per formare una molecola,
può esserci competizione per gli elettroni disponibili tale da avere il
quasi completo trasferimento d'uno o più elettroni da un atomo
all'altro. In tal modo gli atomi risultano carichi e sono legati
fortemente dalle forze elettrostatiche esistenti tra gli anioni
negativi e i cationi positivi. La formazione di un legame ionico
comporta l'asportazione di un elettrone da un atomo, un processo
chiamato ionizzazione, e l'energia necessaria è il potenziale di
ionizzazione di quell'atomo (v. ioni; ionizzazione). L'altro atomo
acquista un elettrone e la misura della sua capacità di farlo è detta
affinità elettronica dell'atomo. Quando un atomo di sodio e uno di
cloro interagiscono, per esempio, si forma il sale da cucina.
Legame Covalente
Quando la competizione per gli elettroni di legame non è tanta
quanta nel legame ionico, gli elettroni esterni vengono condivisi e si
forma una legame covalente. Gli elettroni esterni che partecipano
al legame si chiamano elettroni di valenza. Per esempio, due atomi
di idrogeno, ognuno con valenza uno, possono combinarsi per
formare la molecola biatomica di idrogeno, mettendo in
compartecipazione due elettroni. Mentre i due atomi si avvicinano
la nuvola elettronica di un atomo risente della forza attrattiva del
nucleo dell'altro. Questa attrazione viene bilanciata, ad una
piccola distanza interatomica, dalla repulsione dei due nuclei
positivi e delle due nuvole elettroniche. La distanza favorita è
quella alla quale vi è la massima stabilizzazione e questa è la
distanza internucleare di equilibrio, o distanza di legame.
Protone
Particella nucleare dotata di carica positiva uguale e opposta a
quella dell’elettrone. Insieme al neutrone, è un costituente
fondamentale dei nuclei atomici e per questo motivo ci si riferisce
alle due particelle con il termine comune nucleone. Il protone ha
massa approssimativamente 1836 volte la massa dell’elettrone; la
massa di un atomo è quasi interamente concentrata nel nucleo.
Attualmente sono in corso numerosi esperimenti volti a dimostrare
l’instabilità del protone, ma finora non è stata ottenuta nessuna
prova definitiva.
L’antiprotone, cioè l’antiparticella del protone, è stabile nel vuoto e
non decade spontaneamente. Quando un antiprotone collide con
un protone o un neutrone, le due particelle coinvolte nel processo
si trasformano in mesoni, hanno vita media estremamente breve.
La particella venne identificata per la prima volta nel 1955 presso
Radiation Laboratory dell’universita della California.
Neutrone
In fisica, il neutrone è una particella subatomica senza carica elettrica e
con massa a riposo di 939,57 MeV (leggermente superiore a quella del
protone, pari a 938,27 MeV). Al di fuori del nucleo, i neutroni sono
instabili ed hanno una emivita di circa 15 minuti. Decadono in un
protone, emettendo un elettrone e un antineutrino.
La caratteristica dei neutroni, che li differenzia dalle altre particelle
subatomiche, è l'assenza di carica elettrica. Questa proprietà dei neutroni
ritardò la loro scoperta, li rende molto penetranti, e impossibili da
osservare direttamente.
Anche se gli atomi, nel loro stato normale, sono privi di carica, sono
migliaia di volte più grandi di un neutrone e consistono di un complesso
sistema di elettroni con carica negativa, spaziati attorno a un nucleo con
carica positiva.
Elettrone
Delle tre particelle che costituiscono gli atomi, l'elettrone è
di gran lunga il più leggero ed il più piccolo. Per avere un
idea del suo peso dobbiamo pensare che ci vorrebbero
dieci miliardi di miliardi di miliardi di elettroni per fare un
solo grammo di materia!
Sappiamo inoltre che l’elettrone è privo di struttura
interna, cioè è una particella fondamentale in quanto
non composta da altre più piccole. Nell'uso comune,
l'elettrone viene abbreviato con il simbolo "e-" e la sua
carica elettrica per convenzione è negativa. La carica
dell'elettrone Qe viene identificata come carica
elementare. In questo modo, la carica di tutte le altre
particelle viene riferita a quella dell'elettrone: la carica
elettrica di una particella è sempre un multiplo intero o
una frazione, segno a parte, della carica elementare Qe.
La scoperta degli elettroni, nel 1897, da parte di J.J.
Thompson, ha messo in evidenza per la prima volta
l'esistenza delle particelle elementari, o meglio la natura
non continua della materia.
John Dalton
Nel corso dei suoi studi Dalton si avvalse delle
conoscenze chimiche che possedeva (la legge della
conservazione della massa e la legge delle proporzioni
definite) e formulò la sua teoria atomica, che si fondava
su cinque punti:
•la materia è formata da particelle elementari chiamate
atomi che sono indivisibili e indistruttibili;
•gli atomi di uno stesso elemento sono tutti uguali tra loro;
•gli atomi di elementi diversi si combinano tra loro in
rapporti di numeri interi e generalmente piccoli dando così
origine a composti;
•gli atomi non possono essere né creati né distrutti.
•gli atomi di un elemento non possono essere convertiti in
atomi di altri elementi.
Questa viene considerata la prima teoria atomica della
materia perché per primo Dalton ricavò le sue ipotesi per
via empirica.
Cosa
pensate
vedendo..
=
Cosa
pensate
vedendo..
=
Il sincrotrone del Centro Nazionale di Adroterapia
La radioattività
La radioattività è il fenomeno per cui alcuni nuclei si
trasformano in altri emettendo particelle. La
radioattività non è stata inventata dall'uomo, ma è un
fenomeno naturale, presente ovunque: nelle Stelle,
nella Terra e nei nostri stessi corpi.
Il nucleo dell’atomo è composto da protoni (carica
elettrica positiva,+) e da neutroni (carica nulla).
L'atomo è elettricamente neutro: il nucleo è circondato
da elettroni (carica -), uguali in numero ai protoni
presenti nel nucleo.
La radioattività: isotopi
La struttura dell’atomo è la stessa per tutti gli elementi
chimici che conosciamo. Quello che cambia da un
elemento all’altro è il numero dei protoni e dei neutroni
che l’atomo contiene.
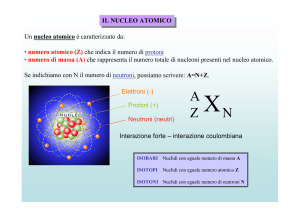
Il numero totale di protoni nel nucleo viene chiamato
“numero atomico” e si indica con la lettera Z. L'elemento
chimico con 8 protoni è l'ossigeno (O), quello con 26 p è il
ferro, quello con 79 p è l'oro, quello con 92 p è l'uranio...
Poiché in un nucleo di una data specie possono essere
presenti anche N neutroni, la somma A=N+Z viene
chiamata numero di massa.
I nuclei con lo stesso valore di Z ma diverso valore di A
(ossia, con un numero diverso di neutroni) vengono
chiamati isotopi.
La radioattività: i decadimenti
Gli isotopi presenti in natura sono quasi tutti stabili.
Tuttavia, alcuni isotopi naturali, e quasi tutti gli isotopi
artificiali, sono instabili, a causa di un eccesso di protoni
e/o di neutroni. Tale instabilità provoca la
trasformazione spontanea in altri isotopi
accompagnata dall'emissione di particelle. Questi
isotopi sono detti isotopi radioattivi.
La trasformazione di un nucleo radioattivo porta alla
produzione di un altro nucleo, che può essere
anch'esso radioattivo oppure stabile. Essa è chiamata
decadimento radioattivo.
La radioattività: la vita media
Il tempo medio che occorre aspettare (che può
essere estremamente breve o estremamente lungo)
viene detto “vita media” del radioisotopo e può
variare da frazioni di secondo a miliardi di anni.
Radiazioni alfa, beta e gamma
Esistono tre diversi tipi di decadimenti radioattivi, che
si differenziano dal tipo di particella emessa a seguito
del decadimento. Le particelle emesse vengono
indicate col nome generico di radiazioni.
alfa
beta
gamma
La radioattività – Decadimento a
In seguito ad un decadimento alfa, il nucleo (Z,A)
emette una particella a (= un nucleo di elio = 2
protoni+ 2 neutroni) e si trasforma in un nucleo
diverso, con numero atomico (Z - 2) e numero di
massa (A – 4).
Le radiazioni a sono
poco penetranti e
possono essere
completamente
bloccate da un
semplice foglio di
carta
La radioattività – Decadimento b
Decadimento b: Il nucleo emette un e- e un
antineutrino e si trasforma in un nucleo con carica
(Z+1), ma stesso numero di massa A.
Le radiazioni beta sono più penetranti di quelle a,
ma sono bloccate da piccoli spessori di materiali
metallici
La radioattività – Decadimento g
Decadimento g: Il nucleo non si trasforma ma passa
in uno stato di energia inferiore ed emette un
fotone; la radiazione gamma accompagna spesso
quella a o b.
Al contrario delle radiazioni a e b, le radiazioni g
sono molto penetranti, e per bloccarle occorrono
materiali ad elevata densità come il piombo.
• Utilizzo:
terapie
oncologiche
L’AMERICIO 241
241
94
Pu
decad. b
T1/2=13 anni
decad. a
237
T1/2=433 anni
93
Np
Viene considerato stabile
Perche ha un tempo di dimezzamento
di 2,2 106 anni.
Come vediamo le particelle???
Esistono diversi tipi di rivelatori di particelle
che sfruttano diversi meccanismi: alcuni sono
elettronici (sfruttano un segnale elettrico indotto
dalla particella), altri “memorizzano” la sua traccia,
ecc.
Oggi qui useremo un particolare tipo di rivelatore:
il CR39, un rivelatore nucleare “a tracce”.
Come funziona?
S16+200 GeV/nucleone
Tantissime applicazioni
Raggi cosmici
Monopoli magnetici, nucleariti…
Studio delle reazioni nucleari
Dosimetria delle radiazioni
Misure ambientali (radon)
…
Composizione dei raggi cosmici: in pallone o satelliti
Un esempio: l’esperimento CAKE
Esperimento CAKE : ~ 2 m2sr per nuclei di Fe
Esperimento in alta quota per:
• Monopoli magnetici
•Matteria strana di quark
•Q-balls…
Laboratorio di Chacaltaya, Bolivia
5230 m a.s.l
L’esperimento
Nuclear track
detectors
Absorber
Area totale ~ 440 m2
Un modulo (2424 cm2)
MACRO:
Esperimento sotto terra (LNGS)
-50%
-20%
CR39
Efficienza della misura = 30%
Il RISCHIO NUCLEARE è dovuto ad eventi
incidentali o volutamente provocati che
determinano un danno sostanzialmente
dovuto alla RADIOATTIVITA’ ed alle
RADIAZIONI IONIZZANTI
La Radioattività
Argomenti Principali
•Struttura dell’atomo e significato di “numero
atomico”e “numero di massa”
•Definizione di Isotopo e relativa simbologia
•Definizione di radioattività
•Reazione nucleari di decadimento radioattivo
IL
NUMERO ATOMICO:
è il numero di PROTONI contenuti nel NUCLEO
dell’Atomo
Determina le PROPRIETÀ CHIMICHE
dell’Atomo e quindi il tipo di ELEMENTO a cui
l’Atomo appartiene
IL
NUMERO DI MASSA:
è la somma del numero dei PROTONI e
NEUTRONI contenuti nel NUCLEO dell’Atomo
Determina PROPRIETÀ FISICHE dell’Atomo,
tra cui:
IL PESO
LA STABILITA’ DEL NUCLEO
Due o più Atomi si dicono ISOTOPI di un certo
elemento chimico quando:
Hanno
UGUALE NUMERO ATOMICO
(Quello dell’Elemento)
e quindi
STESSE PROPRIETA’ CHIMICHE
Hanno
DIVERSO NUMERO DI MASSA
e quindi
DIFFERENTI PROPRIETA’ FISICHE
ESEMPIO DI ISOTOPI DI UN ELEMENTO
IDROGENO
isotopi:
H
1
H
2
H
3
1
1
1
IDROGENO 1 (Anche detto PROTIO)
non è radioattivo
IDROGENO 2 (Anche detto DEUTERIO)
non è radioattivo
IDROGENO 3 (Anche detto TRIZIO)
è radioattivo !!!!!!!!!!
LA TABELLA DEGLI ISOTOPI
LA “TABELLA DEGLI ISOTOPI” RIPORTA PER CIASCUN
ELEMENTO CHIMICO GLI ISOTOPI CONOSCIUTI NONCHE’ LA
LORO ABBONDANZA IN NATURA.
INOLTRE PER CIASCUN ISOTOPO VIENE INDICATO L’EVENTUALE TIPO DI
RADIAZIONE EMESSA ED ALTRI PARAMETRI IMPORTANTI QUALI IL
“TEMPO DI DIMEZZAMENTO” E L’ENERGIA DELLA RADIAZIONE.
ESEMPIO DI TABELLA DEGLI ISOTOPI
Z
ELEMENTO
NUMERO
ATOMICO
A
NUMERO
DI MASSA
ABBOND.
RADIAZIONE
T½
TEMPO DI DIMEZZAMENTO
%
ENERGIA
(MeV)
ab
1
2
IDROGENO
ELIO
1
2
3
3
4
6
99,98
0,0156
1,3*10-6
100
-
BETABETA-
12,5 ANNI
0,8 SEC.
g
0,018
3,5
13
ALLUMINIO
26
27
28
29
100
-
BETA+
BETA-,GAMMA
BETA-
6,3 SEC.
2,3 MIN.
6,5 MIN.
4
4,6
3,7
1,25
-
92
URANIO
228
229
230
231
232
233
234
235
236
237
238
0,0051
0,71
99,28
ALFA
ALFA
ALFA
KAPPA
ALFA
ALFA-GAMMA
ALFA
ALFA-GAMMA
BETA-GAMMA
ALFA
ALFA
9,3 MIN.
58 MIN.
20,8 GIORN.
4,2 GIORN.
70 ANNI
1,62*105 ANNI
2,67*105 ANNI
7*108 ANNI
6,7 GIORN.
2,3*107 ANNI
4,49*109 ANNI
6,72
6,42
5,85
5,29
4,82
4,76
4,39
0,23
4,6
4,18
0,04
0,162
0,032
-
LA RADIOATTIVITA’
La RADIOATTIVITA’ è l’effetto
della trasformazione spontanea
(decadimento radioattivo) del
nucleo di alcuni isotopi che
come tali si chiamano
RADIOISOTOPI
LE FORME DI DECADIMENTO RADIOATTIVO
(TRASFORMAZIONI SPONTANEE ) PIU’ FREQUENTI SONO
IL:
DECADIMENTO ALFA
DECADIMENTO BETA
DECADIMENTO ALFA - GAMMA
DECADIMENTO BETA - GAMMA
DEFINIZIONE DI RADIAZIONE
Emissione di energia associata al moto di
particelle o alla propagazione di onde
elettromagnetiche (fotoni)
RADIAZIONI NUCLEARI
LE RADIAZIONI DENOMINATE “NUCLEARI” SONO QUELLE
ALFA, BETA E GAMMA EMESSE SPONTANEAMENTE DA ISOTOPI
RADIOATTIVI MEDIANTE IL DECADIMENTO.
OCCORRE TUTTAVIA PRECISARE CHE ALLE SUDDETTE
OCCORRE AGGIUNGERE LE RADIAZIONI NUCLEARI
DI TIPO GAMMA E NEUTRONICHE CHE POSSONO ESSERE
EMESSE DA REAZIONI NUCLEARI ARTIFICIALI QUALI LA
FISSIONE E LA FUSIONE CHE VEDREMO IN SEGUITO.
LA FISSIONE
PRODOTTI RADIOATTIVI
RESIDUI
RADIAZIONI INIZIALI GAMMA E NEUTRONICHE
RIEPILOGO
RADIAZIONI NUCLEARI
DECADIMENTO RADIOATTTIVO
NEUTRONICA
RADIAZIONE INIZIALE FISSIONE-FUSIONE
Poteri delle radiazioni nucleari
Argomenti Principali
•Origine delle radiazioni nucleari
•Irradiazione e contaminazione radioattiva
•Poteri delle radiazioni
Origine delle radiazioni nucleari
Le radiazioni nucleari possono essere originate:
•da reazioni nucleari spontanee (decadimento
radioattivo) di radioisotopi naturali o artificiali
•da reazioni nucleari artificiali (fissione e fusione)
Le reazioni nucleari spontanee (decadimento
radioattivo) dei radioisotopi naturali o artificiali
possono provocare l’emissione
di radiazioni
Alfa (corpuscolare)
Beta (corpuscolare)
Gamma (elettromagnetica)
Le reazioni nucleari artificiali (fissione e fusione)
possono provocare l’emissione di radiazioni:
Gamma (elettromagnetica)
Neutronica (corpuscolare)
Inoltre la reazione nucleare di fissione provoca
formazione di radioisotopi (prodotti di fissione) che quindi possono emettere
radiazioni:
Alfa - Beta e Gamma
La presenza di radiazioni nucleari non configura necessariamente una
situazione di pericolo o di emergenza
ALLO SCOPO DI CONFIGURARE IL RISCHIO CAUSATO
DALL’ESPOSIZIONE DELL’UOMO ALLA RADIOATTIVITA’
ARTIFICIALE OCCORRE ESAMINARE:
LE MODALITA’ DI ESPOSIZIONE
I POTERI DELLE RADIAZIONI (DANNO)
Irradiazione e Contaminazione
Un corpo e’ irradiato quando e’ investito da radiazioni nucleari.
Un corpo si dice contaminato radiologicamente quando e’ a diretto
contatto con sostanze radioattive costituite da radioisotopi.
IRRADIAZIONE
Sorgente
Radiazione
CONTAMINAZIONE
ESTERNA
INTERNA
CON RIFERIMENTO ALL’UOMO
si definisce:
Contaminazione esterna: caso in cui la sostanza radioattiva e’ a
contatto con le mucose esterne;
Contaminazione interna: caso in cui la sostanza e’ incorporata
all’interno dell’organismo.
Poteri delle radiazioni:
potere ionizzante
potere penetrante
potere di attivazione
POTERE IONIZZANTE
E’ il potere che hanno le radiazioni (Alfa,
Beta, Gamma e neutroniche) di
produrre ionizzazioni (alterazioni chimiche)
nella materia con cui interagiscono.
Per tale motivo le suddette radiazioni vengono
denominate “radiazioni ionizzanti”
POTERE IONIZZANTE DIRETTO
(RADIAZIONE ALFA E BETA CON CARICA ELETTRICA
POTERE IONIZZANTE DIRETTO
POTERE IONIZZANTE DIRETTO
POTERE IONIZZANTE INDIRETTO
(RADIAZIONE GAMMA E NEUTRONICA SENZA CARICA ELETTRICA)
IL POTERE IONIZZANTE SI QUANTIFICA
VALUTANDO IL NUMERO DI IONIZZAZIONI
PER UNITA’ DI PERCORSO CHE LA PARTICELLA O LA RADIAZIONE
PROVOCA INTERAGENDO CON LA MATERIA (Densita’ lineare di
ionizzazioni)
++++++++
Alto potere ionizzante
+ + + + + + + + Basso potere ionizzante
IL POTERE IONIZZANTE DELLE RADIAZIONI E’:
ALTISSIMO PER LE ALFA
ALTO PER LE BETA, GAMMA ED X
ALTO O ALTISSIMO (a seconda dell’Energia)
PER I NEUTRONI
POTERE PENETRANTE:
E’ il potere che hanno le radiazioni (Alfa,
Beta, Gamma e neutroniche) di
attraversare la materia che irradiano.
Maggiore e’ il potere ionizzante, minore e’ il potere
penetrante, ovvero
le radiazioni che fanno piu’ male sono anche quelle meno
penetranti.
POTERE PENETRANTE DELLE RADIAZIONI NUCLEARI IN ARIA:
NEUTRONICA
1 Kilometro
3 Kilometri
POTERE PENETRANTE DELLE RADIAZIONI NUCLEARI
NELL’UOMO
EFFETTO DELLA CONTAMINAZIONE
Tem o solo
le radiazioni g
ESTERNA
Le radiazioni a
mi fanno male
più della g e della b
INTERNA
IL POTERE DI ATTIVAZIONE E’ :
LA CAPACITA’ CHE HA LA SOLA RADIAZIONE
NEUTRONICA DI INDURRE RADIOATTIVITA’
NELLA MATERIA CHE IRRADIA.