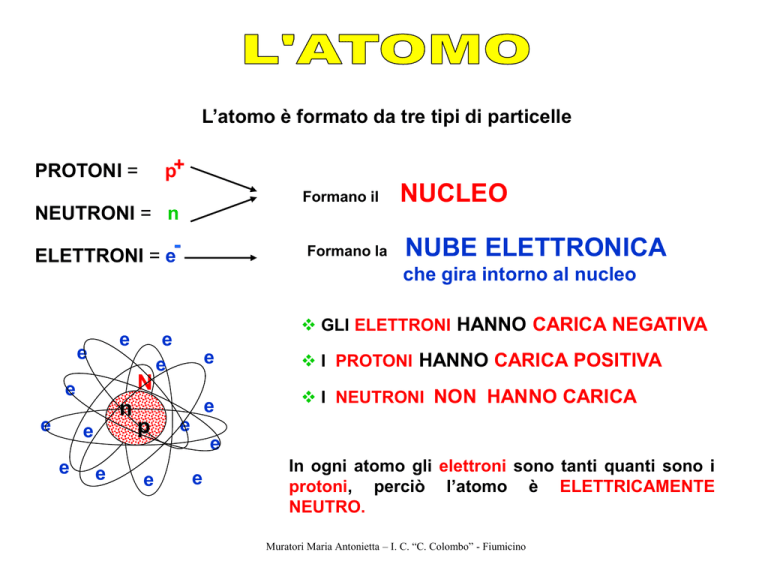
L’atomo è formato da tre tipi di particelle
p+
PROTONI =
Formano il
NEUTRONI = n
-
Formano la
ELETTRONI = e
NUCLEO
NUBE ELETTRONICA
che gira intorno al nucleo
e
e
N
e
n
e
e
e
e
GLI ELETTRONI HANNO CARICA NEGATIVA
e
e
e
e
p
e
I PROTONI HANNO CARICA POSITIVA
I NEUTRONI NON HANNO CARICA
e
e
e
In ogni atomo gli elettroni sono tanti quanti sono i
protoni, perciò l’atomo è ELETTRICAMENTE
NEUTRO.
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Sono forze che attirano cariche di segno opposto
FORZE ELETTRICHE
e-
Tengono insieme gli elettroni (negativi), al nucleo
(positivo).
p+
Sono le forze più potenti che esistono in natura
FORZE NUCLEARI
perché tengono insieme il nucleo, formato da
cariche dello stesso segno (protoni positivi), che
normalmente dovrebbero respingersi.
p+
p+
I neutroni, nel nucleo, collaborano attenuando la repulsione tra i protoni.
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
PROTONI e NEUTRONI hanno uguale massa
gli ELETTRONI hanno massa circa 1860 volte più piccola dei protoni
p+n
e
La massa dell’atomo coincide perciò con la massa del solo nucleo
La massa, espressa in Daltons, di un atomo di un elemento si chiama PESO
ATOMICO dell’elemento e si indica con P.A.
ES: Un atomo di carbonio (C) ha 6 protoni e 6 neutroni nel nucleo + 6 elettroni.
Un atomo di carbonio peserà 12 Daltons e diremo che il peso atomico del
carbonio è 12 (C = P.A. 12 )
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Il NUMERO ATOMICO è il numero dei PROTONI presenti nel nucleo di un
atomo e si indica con N.A.
ES: se nel nucleo di un atomo vi sono 20 protoni, diremo che
quell’atomo ha numero atomico uguale a 20.
Poiché un atomo è elettricamente neutro, il numero dei protoni ci dice
anche quanti elettroni avrà l’atomo.
238
URANIO
92
U
P.A. (l’uranio ha 92 protoni e 146 neutroni)
N.A. (l’uranio ha 92 protoni)
Un atomo che non è elettricamente neutro si chiama IONE.
IONE POSITIVO
se l’atomo ha perso un elettrone
IONE NEGATIVO
se l’atomo ha acquistato un elettrone
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Alcuni atomi, pur avendo stesso N.A. , hanno un diverso P.A.
IDROGENO
DEUTERIO
TRIZIO
H
D
T
N.A. = 1
(1 protone)
P.A.= 1
(1 protone)
N.A. = 1
(1 protone)
P.A.= 2
(1 protone + 1 neutrone)
N.A. = 1
(1 protone)
P.A.= 3
(1 protone + 2 neutroni)
DEUTERIO e TRIZIO si dicono ISOTOPI dell’ IDROGENO
ISOTOPI =
atomi di uno stesso elemento che
differiscono per la massa atomica
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
1
1H
238
92
1
2D
U
12
6
C
235
92
1
3T
234
U
14
6
ISOTOPI DELL’IDROGENO
92
H
e=1
p= 1
n= 0
D
e=1
p= 1
n= 1
T
e=1
p= 1
n= 2
ISOTOPI DELL’URANIO
U
U 238
e = 92
p= 92
n= 146
U 235
e = 92
p= 92
n= 143
U 234
e = 92
p= 92
n= 142
ISOTOPI DEL CARBONIO
C
C 12
e=6
p= 6
n= 6
C 14
e=6
p= 6
n= 8
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Quando il nucleo di un atomo è molto grande le forze nucleari non sono più
in grado di tenerlo unito e quindi il nucleo si spezza in nuclei più piccoli,
spontaneamente o se urtato, per raggiungere la stabilità. Questo fenomeno
si chiama DECADIMENTO.
+ RADIAZIONI
Spezzandosi il nucleo emette RADIAZIONI che possono essere di 3 tipi:
α
=
2 n e 2p
cioè nuclei di ELIO poco penetranti
β
=
elettroni
mediamente penetranti
γ
=
simili ai raggi X
molto penetranti
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
La capacità di emettere RADIAZIONI, tipica di molti ISOTOPI, si chiama
RADIOATTIVITA’
Il tempo che un elemento impiega perché la metà dei suoi atomi perda
la RADIOATTIVITA’ si chiama
235
238
TEMPO DI DIMEZZAMENTO
U
8 x 108 anni
U
4500 milioni di anni
Ra
Radio
Pb
Piombo 27 minuti
(800 milioni di anni)
4 giorni
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Consiste nella SCISSIONE di 1 atomo in 2 atomi, con perdita di MASSA
La MASSA perduta si è trasformata in ENERGIA in base
all’EQUAZIONE DI EINSTEIN
E = m x c2
m = massa
c = velocità della luce (300.000 km/sec)
Per la fissione nucleare si utilizza l’ISOTOPO DELL’URANIO
che, bombardato con neutroni, si spezza in due atomi, il
Kripto e il Bario. La somma delle masse di questi due
atomi è inferiore alla massa dell’uranio di partenza.
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
235
U
93
36
235
U
92
Kr
+ 1n
+ 3n
140
+
E
Ba
56
MASSA KRIPTO + BARIO = 93 + 140 = 233
MASSA URANIO = 235
233 < 235
La massa perduta, sebbene piccola, moltiplicata per un numero molto grande
(300.0002), diventerà una grande quantità di energia.
La reazione libera neutroni che andranno a bombardare altri atomi di uranio
innescando una reazione a catena che, se non rallentata con barre di
materiali che assorbono neutroni, diventerà esplosiva (bomba atomica).
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino
Consiste nell’ UNIONE di 2 atomi per formarne uno di MASSA inferiore
La MASSA perduta si è trasformata in ENERGIA
Per la FUSIONE si utilizzano gli ISOTOPI dell’ IDROGENO
1
2D
+
1
3T
4
2H
+ n
+
E
DEUTERIO + TRIZIO diventano ELIO + neutroni + ENERGIA
La FUSIONE avviene spontaneamente nelle STELLE, cui fornisce l’ENERGIA
La fusione richiede milioni di gradi perché gli isotopi dell’idrogeno si
uniscano, per cui è stata realizzata solo una fusione incontrollata, perciò
esplosiva, nella BOMBA H (in cui le alte temperature sono fornite da piccole
esplosioni di bombe atomiche)
In laboratorio, poiché non si conoscono ancora materiali in grado di non
fondere alle temperature necessarie per la fusione, è stata realizzata per
brevissimo tempo, in reattori sperimentali, solo la FUSIONE A FREDDO.
Muratori Maria Antonietta – I. C. “C. Colombo” - Fiumicino












