Sorgenti Naturali di
Radiazioni
Dott. Filippo Russo
Concetto di Radiazione
In generale si parla di radiazioni tutte le volte
che esiste una cessione di energia tra un
corpo ed un altro senza che vi sia un
contatto diretto o mediato.
Concetto di Radiazione
Con l’espressione RADIAZIONI si descrivono
fenomeni fisici quali, p.e.
La luce (radiazione luminosa)
Il
calore (radiazione termica)
percettibili dai sensi umani,
La
radiazione elettromagnetica (la radiazione
cosmica, le radiazioni ionizzanti, le radiazioni non
ionizzanti)
quasi sempre invisibile e non immediatamente
percettibile
L'assorbimento di energia si manifesta in
genere in un aumento locale di temperatura
ovvero con la produzione di fenomeni fisici,
chimici o biologici.
La Radioattività
Si definisce Radioattività la proprietà che
hanno gli atomi di alcuni elementi di emettere
spontaneamente radiazioni
La Radioattività
La radioattività non é stata inventata ma
scoperta dall'uomo!
Gli esseri viventi, dalla loro apparizione
sulla Terra, sono immersi in un vero e
proprio bagno di radioattività.
Henry Becquerel
Parigi 15.12.1852 Croisic 25.8.1908
Nel 1896 Henri Becquerel, indagando
sui fenomeni di luminescenza di
alcuni materiali, correlò
l’annerimento di una lastra fotografica
lasciata vicino a minerali d’uranio agli
esperimenti ed alle radiografie
effettuate da
Wilhelm Conrad Roentgen
1845-1923
Becquerel notò altresì che tali raggi
scaricavano rapidamente i corpi elettricamente
carichi p.e. le foglie d'oro di un elettroscopio.
Due anni più tardi Marie Curie, proseguendo
gli studi iniziati da Becquerel, scoprì che
anche altre sostanze godevano della stessa
proprietà dell'uranio p.e. il Th e suggerì di
chiamare tali sostanze radio (radium = raggio)
attive.
Separò il polonio e il radio la cui radioattività
risultava rispettivamente 400 e 1.000.000 di
volte superiore a quella dei sali di uranio puri
e riuscì a stabilire la natura dei raggi emessi
scoprendo che trattava di 3 tipi di radiazioni:
la prima elettricamente carica negativamente,
la seconda carica positivamente e la terza
neutra. Associò a tali raggi le prime tre lettere
dell'alfabeto greco a (alfa), b (beta), g
(gamma).
Radiazioni Ionizzanti
Le radiazioni si dicono ionizzanti quando
hanno energia sufficiente per produrre il
fenomeno fisico della ionizzazione che
consiste nel far diventare un atomo
elettricamente carico (ione).
Un gas ionizzato è un conduttore
Nei
tessuti biologici gli ioni generati dalle
radiazioni ionizzanti possono avere influenza
sui normali processi biologici.
Gli effetti biologici indotti dalle radiazioni
possono avere caratteristiche molto diverse
anche a parità di dose fisica; per valutare il
danno biologico é quindi necessario
conoscere anche il tipo e l’energia delle
radiazioni che deposita la dose.
Dose
dE
D=
dm
1J
1 Gy = 1 kg = 100 rad
L’attività
dN
A=
dt
A = - N
Bequerel (Bq) = 1 dis/sec
In generale la legge del decadimento è
dN
dt
=
- N
Dove N è il numero dei nuclei radioattivi al tempo t e è la“costante
di decadimento“ .
La relazione ha come soluzione
N = N (0) e - t
Henri Becquerel fu il primo
uomo a contrarre una
malattia da radiazioni
Marie Curie fu il primo
essere umano morto per
una malattia (diagnosticata
successivamente) da radiazioni
DECADIMENTO
RADIOATTIVO
Il decadimento radioattivo è un processo per
cui un nucleo radioattivo di un elemento o
radionuclide si trasforma nel nucleo di un
elemento diverso o raggiunge uno stato
energetico minore, emettendo radiazioni
ionizzanti.
DECADIMENTO RADIOATTIVO
Si distinguono: d.r. alfa (a); d.r. beta (b)
positivo o negativo; d.r. per cattura
elettronica; d.r. gamma (g); d.r. per
conversione interna. I d.r. a, b e g. danno
origine a flussi di particelle noti,
rispettivamente, come radiazioni (o raggi)
a, b e g.
“Tempo di dimezzamento”
T1/2 = Ln 2
.
1
=
Tempo di vita medio
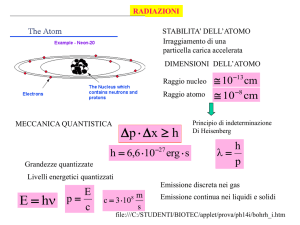
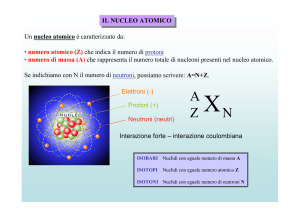
Numero di massa – Numero Atomico
Sappiamo che ogni atomo è
caratterizzato dal numero atomico Z,
che rappresenta il numero di protoni nel
nucleo (uguale al numero degli elettroni
dell'atomo neutro) e dal numero di
massa A che rappresenta il numero di
nucleoni (protoni e neutroni) del nucleo.
E' sempre A Z
ISOTOPI
Molti elementi hanno massa atomica (da non
confondere col numero di massa!) non sempre vicina
all'unità (per esempio Cl 35.45; H 1.008; Ni
58.71...). Ciò è dovuto alla possibilità di esistenza di
nuclei con eguale Z (perciò chimicamente eguali) e
diverso A (perciò con diverso numero di neutroni
nel nucleo).
Questi nuclidi di uno stesso elemento si
chiamano isotopi.
isotopi (dal greco iso-opos = eguale posto,
nella tavola periodica, dato che si tratta di
atomi con lo stesso nome), con eguale Z ed A
diverso (per esempio 11H, 21H; oppure 126C,
13 C) , che per noi chimici sono i più importanti
6
isobari: (dal greco iso-baros = con lo stesso
peso), con Z diverso, (perciò chimicamente
diversi) ed A uguale (4018Ar, 4019K, 4020Ca)
isotoni: (con lo stesso numero di neutroni), cioè
con A-Z uguale (per esempio 21H, 32He)
Nella figura sono riportati,
in funzione di Z e di A,
tutti i nuclidi stabili,
cioè tutti quelli riscontrati
in natura; mancano perciò
quelli artificiali e quelli
radioattivi; in particolare si
può notare la mancanza di
Z=43 (tecnezio Tc) e di
Z=61 (promezio Pm),
artificiali, benché a Z
relativamente basso (ma
dispari per ambedue). Il
grafico si ferma a Z=83
(bismuto Bi), poiché tutti i
nuclidi con Z>83 sono
instabili e radioattivi, e
molti di essi artificiali.
Gli atomi di uno stesso elemento, pur avendo lo
stesso numero di protoni, possono avere diverso
numero di neutroni, dando origine ai diversi
"isotopi". Essi sono identificati dal numero totale
di particelle presenti nel nucleo. Ad esempio,
l'uranio (simbolo U) ha vari isotopi: U-238, U235, U-233. L'uranio-238 ha 92 protoni e (238-92)
= 146 neutroni; l'uranio-235 ha sempre 92 protoni,
ma (235-92) = 143 neutroni; l'uranio-233 ha 92
protoni e 141 neutroni.
L'elemento più semplice esistente in natura
l'idrogeno (H-1) ha due isotopi: il deuterio (H-2) e
il tritio (H-3). Quest'ultimo è radioattivo ed emette
particelle beta negative. In generale un isotopo il
cui simbolo sia Y è caratterizzato dal numero
atomico Z, pari al numero dei protoni e degli
elettroni, dal numero di massa A, pari al numero
totale di particelle presenti nel nucleo e dal
numero N = A-Z pari al numero di neutroni. Se
l'isotopo è radioattivo, si parla di radioisotopo o
anche di radionuclide.
DECADIMENTO a
Il decadimento a viene sinteticamente
espresso tramite la formula:
XAZ Y A-4Z-2 + a
( Z , A ) ( Z – 2 , A – 4 ) + 4 2He
Decadimento alfa
Un nucleo di un elemento di numero atomico Z e di massa
atomica (o peso atomico) A emette una particella alfa (a),
corrispondente al nucleo dell'elio (due protoni p e due neutroni
n), trasformandosi nel nucleo dell'elemento con numero
atomico Z-2 e peso atomico A-4.
decadimento a: un nucleo di
radio si trasforma in rado
emettendo un fotone e una
particella alfa.
Il decadimento a è possibile
per nuclei con A >150 in
questo caso la costante di
decadimento dipende
dall’energia cinetica e ciò
viene correlato nelle legge di
Geiger-Nuttal
Log = B Log Ra - c
Decadimento beta
Nel d.r. beta negativo (b-), un neutrone emette un elettrone e-,
trasformandosi in un protone e facendo diventare il nucleo
originario di numero atomico Z un nucleo dell'elemento di
numero atomico Z+1; nel d.r. beta positivo (b+) si ha invece
l'emissione di un positrone e+ (elettrone positivo) da parte di un
protone, che diviene neutrone e trasforma il nucleo in uno
dell'elemento di numero atomico Z-1; in entrambi i d.r. beta la
massa atomica non cambia poichè la massa dell'elettrone è
molto minore di quella del protone e del neutrone; elettroni e
positroni provenienti da un nucleo per d.r. b± sono detti
particelle beta (b).
DECADIMENTO β
Decadimento beta
decadimento b
negativo: un neutrone
si traforma in protone
emettendo un fotone,
un elettrone e un
neutrino (che
contribuisce a
conservare la quantità
di moto).
Decadimento gamma
E' associato ai d.r. a e b e avviene quando il
nucleo si porta su un livello di energia inferiore
grazie all'emissione di un fotone g (di energia tra
10 keV e 10 MeV, maggiore dei raggi X); il
numero atomico e la massa atomica non variano
DECADIMENTO g
I raggi γ sono radiazioni
elettromagnetiche che vengono emesse
in vari processi.
Decadimento per cattura
elettronica
Avviene quando un nucleo cattura un
elettrone di un livello energetico interno,
facendo diminuire di 1 il numero atomico del
nucleo stesso con l'emissione di un raggio X,
a causa del riassestamento degli elettroni
rimasti
Decadimento per
conversione interna
Avviene quando un elettrone assorbe
l'energia emessa dal nucleo e sfugge
all'atomo; il numero atomico e la massa non
cambiano.
Principali fonti di esposizione alle radiazioni
ionizzanti
Radon 56%
Medicina nucleare - 4%
Raggi
cosmici -8%
Interne - 10%
Terreno -8%
Altro - 1%
Prodotti di
consumo 3%
Radiografie - 10%
Famiglie radioattive
Il nucleo figlio generato dalla produzione di un decadimento
radioattivo di tipo a o b da un genitore pesante può però non essere
comunque stabile e decadere ulteriormente finché non raggiunge
un isotopo stabile . in natura esistono degli isotopi che danno luogo a
processi seriali accompagnati da emissioni a e b e spesso anche da
emissioni g. Gli elementi in questione hanno un numero atomico che
va da 82 a 95, ed assieme ai loro figli sono catalogati nelle cosiddette
serie o famiglie radioattive
Gli isotopi radioattivi naturali possono essere raggruppati in 3
famiglie, con un capostipite da cui prendono il nome; poiché le
emissioni che portano a variazione di A (oltre che di Z) sono le a,
ogni isotopo avrà A con differenza di 4 rispetto al predecessore:
avremo così le seguenti famiglie, identificabili, oltre che col nome
del capostipite, con una espressione algebrica che esprime il numero
di massa di ogni membro della famiglia con n variabile (per
semplicità saranno indicati solo i numeri di massa; Z è
comunque identificato dal simbolo dell'elemento):
(4n+2) del Torio 234: 234Th, 234Pa, 234U, 230Th, 226Ra,
222Rn, 218Po, 218At, 214Pb, 214Bi, 214Po, 210Ti, 210Pb,
210Bi, 210Po, 206Ti, 206Pb.
(4n) del Torio 232: parte da 232Th e termina con 208Pb.
(4n+3) dell'Uranio 235: parte da 235U e termina con 207Pb.
E' interessante notare che tutte queste tre famiglie
terminano con un isotopo del Pb, elemento che è
evidentemente molto stabile; ricordando le tabelle
dell'abbondanza di nuclidi (figg. 11.3, 11.5, 11.6), Pb ha
Z=82, pari.
Manca però, in natura, una serie, quella (4n+1).
Evidentemente non esiste più un capostipite di questa
famiglia, perciò essa deve essersi esaurita. La serie però
può essere considerata a partenza da un elemento
artificiale
Famiglie Radioattive Naturali
ed Artificiali
SERIE DELL’URANIO
SERIE DEL TORIO
SERIE DELL’ATTINIO
SERIE DEL NETTUNIO
Ognuna delle serie considerate presentano un elemento
gassoso mentre tutti gli altri sono solidi e termina con un
elemento stabile che è un isotopo del piombo, ad eccezione
della serie del nettunio (artificiale) che non ha nuclidi gassosi
e che termina con un isotopo del bismuto
SERIE DELL’URANIO Il capostipite di questa serie è l’ 238U che
emette a trasformandosi in 234Th. L’elemento gassoso è il
222Rn ( Radon ). L’elemento stabile della serie è 206Pb.La serie è
detta “4n+2” poiché il numero di massa dei suoi membri può essere
ricavato da questa relazione.
Famiglia del Th 234
(4n+2) del Torio 234: 234Th, 234Pa,
234U, 230Th, 226Ra, 222Rn, 218Po, 218At,
214Pb, 214Bi, 214Po, 210Ti, 210Pb, 210Bi, 210Po,
206Ti, 206Pb.
SERIE DEL TORIO Il capostipite è il 232Th che emette a
trasformandosi in 228Rn. L’elemento gassoso è il 220Rn220(Thoron).L’elemento stabile della serie è il 208Pb (Thorium D).
La serie è detta “4n”
SERIE DELL’ATTINIO Il capostipite è l’235U che decade a
trasformandosi in 231Th . L’elemento stabile della serie 207Pb
(Actinium D) . La serie è detta “ 4n+3”
SERIE DEL NETTUNIO Il capostipite è il 241Pu ( che viene creato
artificialmente ) che emette β dando 241Am. L’elemento stabile è
209Bi. La serie è detta “4n+1”.