LA RADIOATTIVITA’
LA STORIA DELLA RADIOATTIVITA’
•
•
•
•
•
•
•
•
•
•
•
•
•
•
1895 Roentgen scopre i raggi X
1896 Bequerel scopre la radioattività naturale nella pecblenda
1898 Pierre e Marie Curie estraggono il Radio dalla pecblenda
1899 Rutherford scopre le particelle alfa
1900 Villard scopre i raggi gamma
1912 Hess scopre i raggi cosmici
1915 La British Roentgen Society propone standard di
protezione dalle radiazioni per lavoratori e popolazione
1925 Inizio della radioterapia per la cura del cancro
1927 Uso di traccianti radioattivi in diagnostica medica
1928 primo congresso dell’International Committee on X-ray
and Radium Protection
1932 Chadwick scopre il neutrone
1934 Primo isotopo radioattivo artificiale P-30
1938 Scoperta della fissione nucleare
1942 Pila di uranio e grafite: Fermi crea il prototipo del reattore
nucleare
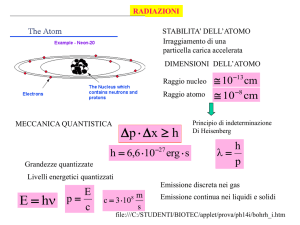
COME E’ FATTO UN ATOMO?
• Un atomo si può rappresentare come un
nucleo centrale composto da protoni e
neutroni. I protoni hanno carica elettrica
positiva e i neutroni non hanno carica il
nucleo ha carica positiva.
• Intorno al nucleo ci sono gli elettroni. Ogni
elettrone sta su un’“orbita elettronica”
(livello energetico) ben precisa. Gli
elettroni hanno carica negativa.
COME SI CARATTERIZZA UN
ATOMO?
• Numero atomico: è il numero di protoni e
quindi corrisponde alla carica (positiva) del
nucleo.
• Massa atomica (o numero di massa): è la
somma della massa del nucleo (protoni +
neutroni); gli elettroni hanno massa
trascurabile.
Isotopi = stesso numero atomico ma diverso numero di
massa (diverso numero di neutroni).
numero atomico diverso
elemento diverso
In condizioni “normali”
le particelle sub
atomiche:
• sono legate tra loro
da forze di varia
natura;
• possiedono precise
quantità di energia
l’atomo è stabile e
elettricamente
neutro (carica
nucleo = carica
elettroni).
Ci sono condizioni in cui un atomo non è
più neutro o stabile:
• perdita/acquisto di elettroni l’atomo
diventa uno ione positivo/negativo;
• nucleo energeticamente instabile
nucleo radioattivo (anche se si parla
genericamente di atomo radioattivo) =
radionuclide
COSA E’ LA RADIOATTIVITA’?
Radioattività = emissione di energia da parte
di un nucleo (fenomeno nucleare).
Avviene quando il nucleo è energeticamente
instabile e decade rilasciando energia per
raggiungere un livello energetico stabile
decadimento disintegrazione: processo
di trasformazione di un nucleo radioattivo
con rilascio di energia.
• Il decadimento è quindi un fenomeno nucleare,
anche se si parla poi in generale di atomi
radioattivi radionuclidi.
• A seguito di un decadimento l’atomo radioattivo
si trasforma in un atomo di un altro elemento
perché viene modificato il numero di protoni nel
nucleo (quindi cambia il numero atomico).
• Anche l’atomo a seguito del decadimento può
non essere stabile si formano serie o catene
radioattive (per es. le serie naturali U-238, Th232, U-235).
IN CHE FORMA E’ L’ENERGIA
RILASCIATA?
Particelle (decadimento ):
nucleo di elio (He): 2 protoni e 2 neutroni.
• Il nucleo rimane con 2
protoni e 2 neutroni in
meno
il numero atomico
diminuisce di 2, il
numero di massa
diminuisce di 4.
Particelle (decadimenti ):
positive o negative (positroni o elettroni provenienti dal nucleo).
• Nel decadimento - il nucleo rimane con un protone in
più e un neutrone in meno il numero atomico aumenta
di 1.
• Nel decadimento + il nucleo rimane con un protone in
meno e un neutrone in più il numero atomico
diminuisce di 1.
Le particelle :
• Positive con carica 2+
• corpuscolari
• “grosse” e poco
penetranti nella materia;
• le particelle emesse da
un nucleo di un
determinato elemento
hanno una ben precisa
energia (e sempre
quella) possibilità di
spettrometria alfa.
Le particelle :
• Positive o negative con
carica 1+ o 1• corpuscolari
• più penetranti nella
materia che le particelle
;
• le particelle emesse da
un nucleo di un
determinato elemento
possono avere infiniti
valori di energia fino a
un valore massimo,
tipico del radionuclide
(Emedia = 1/3 Emax).
NOTA:
Esiste un terzo tipo di decadimento: la
cattura elettronica, che sostanzialmente ha
l’effetto sul nucleo di un decadimento +
(diminuzione di un protone).
I RAGGI GAMMA
• Dopo un decadimento o il nucleo
può “riaggiustarsi” energeticamente
emissione di raggi . Sono fotoni (non
corpuscolari) simili quindi ai raggi di
luce ma molto più energetici.
• Attraverso i raggi il nucleo rilascia
ulteriore energia.
• I raggi sono molto penetranti
(attraversano muri o spessori metallici).
Esempio di decadimento beta con emissione di
raggi gamma
• Non sempre vengono emessi raggi ,
esistono anche elementi o emettitori puri.
• I raggi emessi da uno stesso elemento
hanno sempre la stessa energia (e sempre
quella) possibilità di spettrometria gamma.
• I raggi emessi da uno stesso elemento
vengono emessi con una certa probabilità,
fissa e tipica di ogni raggio (e non di ogni
elemento) resa gamma
La resa indica la probabilità con cui un
raggio viene emesso in seguito a un
decadimento nucleare.
Esempio: il Cs-137 ha una resa gamma dell’85 %
per il raggio a 662 keV; vuol dire che su 100
atomi di Cs-137 che decadono, verranno
emessi solo 85 raggi . Questo è importante
per risalire all’attività di un elemento dal
numero dei raggi registrati dagli strumenti.
Ricordare: un elemento che emette più
raggi ha una resa per ogni raggio.
I RAGGI X
• Sempre in seguito a un decadimento
può succedere che le particelle o o i
raggi interferiscano con gli elettroni
dell’atomo emissione di raggi X
(fotoni) o di elettroni (l’atomo diventa
ione positivo).
• I raggi X generati da un elemento hanno
sempre la stessa energia (e sempre
quella).
SPETTRO DELLE RADIAZIONI
ELETTROMAGNETICHE
RICORDARE
• I decadimenti sono o , i raggi sono una
conseguenza, anche se sono originati anch’essi nel
nucleo.
• Con il termine “radiazioni” vengono identificate tutte
le emissioni di energia (, , , X).
• Dopo un decadimento l’atomo diventa un atomo di un
altro elemento (stabile o instabile).
• I raggi e i raggi X hanno origini diverse (nucleo e
orbite elettroniche) ma fisicamente sono la stessa
cosa (fotoni) si misurano allo stesso modo.
NON CONFONDERE
• Perdita/acquisto di
elettroni IONI
FENOMENO ATOMICO
• Decadimento nucleare
perdita/acquisto di protoni
e neutroni (anche nei
decadimenti beta)
atomi di elementi diversi
(non necessariamente
ionizzati)
FENOMENO NUCLEARE
COME SI MISURA LA
RADIOATTIVITA’?
ATTIVITA’= numero di decadimenti o
disintegrazioni nell’unità di tempo.
L’unità di misura è il Bequerel:
1 Bq = 1 dis./sec
esiste ancora la vecchia unità di misura (Curie):
1 Ci = 3,7 1010 Bq
L’attività diminuisce nel tempo: se all’istante
iniziale c’è un certo numero di decadimenti al
secondo, dopo un po’ di tempo ce n’è un
numero minore.
QUESTA DIMINUZIONE HA LEGGE
ESPONENZIALE
2.5
attività
2
1.5
1
0.5
0
T1/2
tempo
A(t) = A(0) e-t
= costante di
decadimento
= tempo di
decadimento = 1/
T(1/2) = tempo di
dimezzamento =
0,693
• Il valore di indica la probabilità che un
nucleo radioattivo ha di decadere;
graficamente rappresenta la pendenza
della curva, la ripidità di discesa.
• T(1/2) indica il tempo necessario perché
l’attività si riduca alla metà dell’attività
iniziale.
N.B. A volte la diminuzione dell’attività nel
tempo viene chiamata decadimento
esponenziale dell’attività.
NON CONFONDERE
DECADIMENTO
NUCLEARE è il
decadimento di un
nucleo radioattivo in
un altro elemento
con l’emissione di
energia (particelle ,
ecc…).
DECADIMENTO
(ESPONENZIALE)
DELL’ATTIVITA’
indica solamente la
diminuzione, secondo
legge esponenziale,
dell’attività di una
sostanza radioattiva
nel tempo.
RICORDARE
• Il decadimento è un fenomeno
probabilistico. Un atomo radioattivo ha
una certa probabilità di decadere
nell’unità di tempo (espressa dalla )
ma non è detto che lo faccia.
• Più ci sono atomi radioattivi, più c’è
probabilità che un alto numero di essi
decada nell’unità di tempo.
Dove si usa la radioattività?
• Produzione di energia (reattori nucleari);
• medicina (diagnostica e terapia);
• agricoltura (tecniche antiparassitarie e fertilizzanti;
irraggiamento di alimenti);
• industria (radio e gamma grafie; misuratori di
spessore e di livello; trasformazione di materiali);
• ambiente (dispersione di inquinanti; mappatura falde
acquifere; accumulo di sedimenti);
• archeologia
(datazione
con
C-14
o
con
termoluminescenza);
• geologia (datazioni e stratigrafia);
• sicurezza (aeroporti; rivelatori di fumo);
• ricerca scientifica e tecnologica (struttura della
materia; processi chimico-fisici e biologici).
Sorgenti naturali di radiazioni ionizzanti
• Raggi cosmici (provengono dallo spazio; protoni e
positroni che producono mesoni, elettroni, fotoni,
protoni e neutroni; dose massima a 20 km dal suolo).
• Radioisotopi cosmogenici (interazione dei raggi
cosmici con atomi e molecole dell’atmosfera; H-3,
Be-7, C-14, Na-22).
• Radioisotopi primordiali (presenti nella crosta
terrestre; formatisi con la formazione della terra; U238, U-235, Th-232, K-40).
Sorgenti artificiali di radiazioni ionizzanti
• Pratiche medico-diagnostiche.
• Fall-out da esplosioni nucleari in atmosfera negli anni
‘50-’60 (520 esplosioni in totale); Cs-137 e Sr-90
danno ancora contributo alla dose.
• Produzione di energia (nucleare, carbone, petrolio,
gas naturale, torba, geotermia).
• Dispositivi industriali.
• Incidenti.
COME SI PRODUCE LA
RADIOATTIVITA’ ARTIFICIALE?
• Tubo a raggi X o macchina radiogena o
tubo radiogeno (elettroni accelerati che
impattano su un anodo metallico).
• Reattore nucleare.
• Attivazione (bombardamento di atomi
con particelle cariche o neutroni).
TUBO A RAGGI X (tubo catodico)
COME FUNZIONA UN TUBO
RADIOGENO?
• In un tubo a raggi X c’è un filamento
(catodo) che riscaldato emette elettroni.
• Gli elettroni vengono attirati verso un
bersaglio metallico (anodo) da una
differenza di potenziale.
• Impattando contro l’anodo perdono
l’energia in loro possesso (tutta o in
parte).
(1)
L’energia persa si
trasforma in raggi X,
che possono avere
infiniti valori di
energia fino
all’energia massima
pari all’energia degli
elettroni.
(2)
L’energia persa eccita
gli atomi dell’anodo
che emettono a loro
volta raggi X di una
ben precisa energia
che dipende dal tipo
di materiale di cui è
fatto l’anodo.
Entrambi i fenomeni concorrono alla
produzione di raggi X.
IMPIEGHI DELLA
RADIOATTIVITA’ IN MEDICINA
DIAGNOSTICA
• radiografie (tubi a raggi
X);
• TAC (tubi a raggi X);
• medicina nucleare:
scintigrafie (radioisotopi
TERAPIA
• irraggiamento esterno:
sorgenti (Co-60, Cs-137)
e acceleratori
(irraggiamento con
elettroni);
•
irraggiamento
interno:
emettitori: Tc-99m, I-131,
terapia metabolica (I…) e PET (radioisotopi
131, Sr-89, P-32) e
emettitori di positroni: Fbrachiterapia (Ir-192,
18, O-15 …).
…).
IMPIEGHI DELLA
RADIOATTIVITA’
NELL’INDUSTRIA
•
•
•
•
Radiografie (tubi a raggi X).
Gammagrafie (Co-60, Ir-192, Cs-137, Se-75).
Analizzatori di leghe (Fe-55, Cd-109).
Misuratori di grammatura/spessore di
tessuti/carta (Sr-90, Am-241, Kr-85).
• Rivelatori di fumo (Am-241).
• Ricerca (I-125, C-14, … sorgenti non
sigillate).
COME CI SI ESPONE?
• irraggiamento esterno;
• introduzione ingestione
inalazione;
• assorbimento transcutaneo;
• ferita.
COME CI SI DIFENDE
DALL’IRRAGGIAMENTO
ESTERNO?
•
•
•
•
tempo di esposizione minimo;
distanza massima dalle sorgenti;
utilizzo di schermature;
utilizzo di dosimetri personali (filmbadge, penne, TLD).
COME CI SI DIFENDE
DALL’INTRODUZIONE?
• non mangiare, bere, fumare, ecc. nei
laboratori;
• utilizzo di guanti, soprascarpe,
mascherine, ecc.;
• monitoraggio dell’aria;
• controlli periodici o occasionali sui
lavoratori (TBC, misura escreti e liquidi
organici, tamponi nasali o faringei).
QUALI SONO GLI EFFETTI
DELL’ESPOSIZIONE?
DETERMINISTICI
• si manifestano
sull’individuo esposto
superata una certa
dose (effetti a soglia);
• la gravità aumenta con
la dose (eritemi, …);
• immediati;
• somatici.
STOCASTICI
• la probabilità aumenta
con la dose;
• sono sempre gravi;
• tardivi;
• somatici (leucemie,
tumori) e genetici
(malformazioni sui
discendenti).
CONCETTI DI DOSIMETRIA
Per “radiazioni” si intendono tutti i tipi di
emissioni (, , raggi e raggi X).
• La dose (dose assorbita) è l’energia
depositata dalla radiazione nella
materia.
• La dose quindi si misura in
energia/massa Joule/kg Gray (Gy).
• Il concetto di dose vale per ogni tipo di
radiazione e per ogni tipo di materia.
• L’esposizione è l’”antenata” della dose: si
riferisce solo ai fotoni e solo in aria. Si misura in
Roentgen (R). 1 R = 0.0087 Gy
• Quando invece ci si riferisce al corpo umano si
parla invece di dose equivalente: è la dose già
ponderata sull’effetto che i diversi tipi di
radiazione possono avere sui diversi tipi di
tessuto del corpo umano. La dose equivalente si
misura in Sievert (Sv), che è sempre
energia/massa.
• In prima approssimazione per fotoni e per
elettroni si ha l’equivalenza 1 Sv = 1 Gy. Non è
così per particelle alfa, protoni e neutroni.
• La dose efficace è la dose equivalente riferita
a tutto il corpo intero.
• La dose efficace si misura sempre in Sievert
(Sv).
• Nel caso di esposizioni prolungate la dose
impegnata è la dose integrata sul tutto il
periodo di esposizione.
• La dose impegnata si misura in Sievert (Sv).
• Nel caso di esposizione di più individui si parla di
dose collettiva. E’ il prodotto tra la dose presa in
totale dalla popolazione e il numero di individui
della popolazione stessa.
• La dose collettiva si misura in Sv * persona.
• Una dose collettiva alta può significare che pochi
individui di una popolazione ricevono tanta dose
oppure tanti ne ricevono poca.
NON CONFONDERE
L’ATTIVITA’ (Bq)
misura la quantità di
energia emessa.
La DOSE (Gy, Sv)
misura l’energia
depositata nella
materia.
DIMENSIONI
UNITA' MISURA
ATTIVITA'
disint./sec.
Bq
DOSE ASS.TA
energia/massa
Gy
DOSE EQUIV.TE energia/massa ponderata
Sv
DOSE EFF.CE
energia/massa corpo intero
Sv
DOSE COLL.VA dose per n° potenziali esposti Sv * persona
DOSI SOGLIA
(per effetti deterministici)
Dose equivalente (ICRP 60, 1990):
• cristallino: 0,5-2 Sv per opacità visibili
fino a 5 Sv per cataratta;
• testicoli: da 0,15 Sv per sterilità temp.
3,5-6 Sv per sterilità perm.;
• ovaie: da 2,5 a 6 Sv per sterilità.
Irradiazione dell’intero organismo:
• 0,25 Gy: no sintomi;
• 0,5 Gy: nausea e malessere lievi;
• 1 Gy: nausea e a volte vomito, astenia,
affaticamento;
• 2 Gy: sindrome acuta da radiazioni;
• 4 Gy: DL 50 %.
DOSI MEDIE ANNUALI
•
•
•
•
•
•
•
•
•
raggi cosmici 4000 m : 2 mSv;
raggi cosmici 1000 m : 0,44 mSv;
raggi cosmici 0 m : 0,27 mSv;
ingestione C-14 : 0,012 mSv;
introduzione di K-40 : 0,165 mSv;
introduzione primordiali : 0,06 mSv;
Radon : 0,3-2,5 mSv;
diagnostica medica : 1 mSv;
diagnostica dentale : 0,01 mSv.
Tra le dosi soglia e le dosi medie annuali c’è
un fattore circa 1000 di differenza
PRINCIPI DI
RADIOPROTEZIONE
(ICRP 60,1990)
ICRP (1928):gruppo internazionale per tenere sotto
controllo i problemi della radioprotezione
1 i benefici di ogni irradiazione accettabile
devono superare i danni;
2 l’irradiazione deve essere mantenuta ai “livelli
più bassi ragionevolmente ottenibili” (ALARA);
3 non devono essere superati i limiti di dose
raccomandati dall’ICRP.
Questi principi sono stati ripresi dalla normativa
italiana (D.Lvo 230/95 e D.Lvo 241/2000).
LIMITI DI DOSE (ICRP 60)
(ripresi dalla normativa italiana)
•
•
•
•
•
LAVORATORI
dose efficace 20
mSv/anno;
cristallino 150
mSv/anno;
pelle 500 mSv/anno
mani e piedi 500
mSv/anno;
donne in gravidanza 2
mSv all’addome.
POPOLAZIONE
• dose efficace 1
mSv/anno;
• cristallino 15 mSv/anno;
• pelle 50 mSv/anno.
UN PO’ DI STORIA…. (per chi
volesse approfondire…)
•
•
•
•
•
•
•
1977: PUBBLICAZIONE ICRP 26
1990: PUBBLICAZIONE ICRP 60
1995: D.Lvo 17 marzo n° 230
1996: DIRETTIVA 96/29/EURATOM
1997: DIRETTIVA 97/43/EURATOM
2000: D.Lvo 27 maggio n° 241
2001: D.Lvo 9 maggio n° 257