Termodinamica: introduzione
Abbiamo visto che, in presenza di forze conservative, si
ha la conservazione dell’energia meccanica
(Ecin+U=costante)
Nella realtà però si hanno quasi sempre anche forze non
conservative (p. es. attriti). Quindi, se voglio mantenere un
corpo in movimento dobbiamo compiere del lavoro.
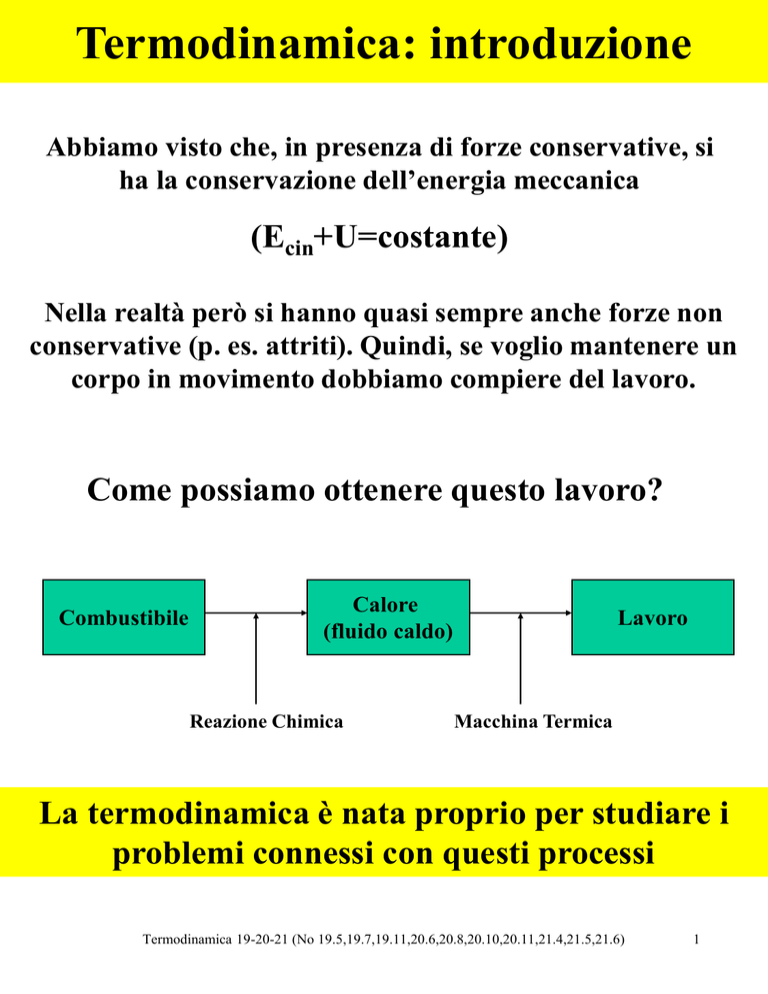
Come possiamo ottenere questo lavoro?
Combustibile
Calore
(fluido caldo)
Reazione Chimica
Lavoro
Macchina Termica
La termodinamica è nata proprio per studiare i
problemi connessi con questi processi
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
1
Descrizione dello stato di un sistema
La termodinamica si occupa fra l’altro di fluidi (liquidi e gas). In
generale, un corpo macroscopico è composto da un grandissimo numero di
particelle (atomi o molecole), ed è assolutamente impossibile descrivere il
moto di ogni particella singolarmente. È quindi necessario dare una
descrizione statistica. Vediamo quali variabili possono essere utilizzate.
Massa e Volume
Densità (Massa Volumica)
r
m
V
La densità r di una sostanza è la
massa della sostanza divisa per il suo
volume. Essa si misura in kg/m3
Volumi uguali di sostanze differenti hanno masse diverse e, quindi, diverse
densità. Le densità dei gas sono inferiori rispetto a quelli dei solidi e dei
liquidi in quanto le molecole di un gas sono relativamente distanti tra loro.
Un volume di gas contiene una frazione relativamente grande di spazio
vuoto.
Attenzione però !! Il comportamento di un gas non dipende dalla
massa, ma dal numero di costituenti di base (atomi o molecole) !!
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
2
In termodinamica, per definire la quantità di
materia, si usa il numero di moli
Una mole di una sostanza è semplicemente costituita da un numero fisso
di costituenti di base (atomi o molecole).
Questo numero è detto numero di Avogadro (NA = 6.022 1023)
Il numero di Avogadro è scelto in modo tale che una mole di H pesi
(circa) 1 g, di He 2g, e così via. La definizione “ufficiale” viene fatta per
mezzo del 12C e prevede che una mole di carbonio-12 pesi 12 g.
Il peso di una mole di materiale si definisce Peso Atomico o Peso
Molecolare. Esso si ricava facilmente dalla tabella periodica degli
elementi (vedi appendice F e G - HRW)
Per calcolare il numero di moli di una data
sostanza ho quindi bisogno del suo peso, e del
peso di una mole della sostanza stessa.
Una mole è un numero di g pari al peso
molecolare.
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
3
Se si immette aria in un pneumatico, si
aumenta il numero di molecole di gas
all’interno del pneumatico stesso, e la
forza complessiva che queste esercitano
contro le sue pareti aumenta.
La molecole di aria all’interno del
pneumatico sono libere di migrare in tutto
il suo volume. Tuttavia non possono
uscirne. Gli urti che si producono
continuamente tra le molecole del gas e le
pareti del pneumatico permettono al gas di
esercitare una forza contro ogni parte
della superficie delle pareti (principio di
Pascal).
Pressione
La pressione è il modulo della forza agente perpendicolarmente ad una
superficie, diviso per l’area A della superficie stessa
P
F
A
pascal 105 bar
P N 2 Kg
m s2 m
Camminando sulla superficie della Terra siamo sul fondo dell’atmosfera terrestre,
che, essendo un gas, spinge sul nostro corpo (isotropicamente) esattamente come il
gas in un pneumatico.
La pressione esercitata dall’atmosfera è pari a circa 1.013 105 Pascal cioè 1.013
bar (è la pressione atmosferica delle previsioni del tempo).
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
4
Temperatura
Il variare della proprietà che definiamo temperatura induce effetti di natura differente
che vengono poi usati come criteri per la misura della temperatura stessa:
Il nostro senso del tatto è in grado di distinguere due corpi a temperatura differente e può fare da
termometro primitivo.
Le sostanze solide e liquide in generale si dilatano all’aumentare della temperatura
E’ il principio su cui si basa il termometro a mercurio. All’aumentare della temperatura
il volume del mercurio aumenta e quindi sale il suo livello sulla scala graduata
In un gas la pressione aumenta all’aumentare della temperatura
E’ il principio su cui si basa il funzionamento della caffettiera, all’aumentare della
temperatura il vapore all’interno della caffettiera si espande spingendo verso l’alto
l’acqua
La differenza di potenziale ai capi di una termocoppia cambia con la temperatura
E’ un criterio usato per misurare la temperatura ampiamente usato nei laboratori di
ricerca. La termocoppia è costituita da due fili sottili composti da due materiali diversi
saldati agli estremi. Una differenza di temperatura tra le due saldature induce una
differenza di potenziale.
La resistenza di un filo sale con il salire della temperatura
In tutti conduttori la resistenza elettrica dipende dalla temperatura. I termometri a
resistenza elettrica (PT100) sono costituiti da un un filo di platino di cui si misura la
resistenza.
Un fattore importante da ricordare è che la temperatura non è una misura della quantità di calore
presente in un corpo. E’ certamente legata a questa quantità (infatti scaldando un corpo si aumenta
la temperatura) ma non la può quantificare.
Se do la stessa quantità di calore a un mattone di marmo ed uno di rame, di uguale peso,
alla stessa temperatura iniziale ottengo due temperature finali estremamente differenti.
Per il momento è opportuno mantenere come definizione di temperatura quella
intuitiva risultato di ciò che osserviamo nella vita quotidiana
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
5
La temperatura si misura in gradi
Celsius o centigradi C° (negli
U.S.A. si usa la scala Fahrenheit
F°). Un grado centigrado è la
centesima parte della dilatazione
del mercurio tra il punto di fusione
del ghiaccio (posto a 0 C°) ed il
punto di ebollizione dell’acqua
(posto a 100 C°)
Se si considerano alcuni gas particolari (perfetti) si osservano relazioni molto semplici tra
Temperatura e Pressione (con Volume costante) e tra Temperatura e Volume (con Pressione
costante). Mettendo per esempio in un grafico la pressione in funzione della Temperatura si osserva
che, estrapolando a basse temperature, è possibile trovare una Temperatura per cui la pressione
diventa zero. Questa temperatura è detta zero assoluto e corrisponde a - 273.15 C°.
La temperatura di zero assoluto rappresenta la più bassa temperatura mai raggiungibile.
La scala Kelvin (K) è una scala di temperatura identica a quella Celsius ma con lo zero
posto allo zero assoluto. Ovviamente non esistono temperature Kelvin negative.
TK TC 273.15
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
6
Due concetti molto importanti: calore e lavoro
Più che misurare il calore presente in un corpo è possibile misurare il calore che due
corpi si scambiano. Definiamo calore l’energia che si trasmette da un corpo a
temperatura più alta ad un corpo a temperatura più bassa. Il calore si misura in Joule
(una caloria è pari a 4.186 Joule). Si può dimostrare sperimentalmente che calore e
lavoro sono equivalenti.
• La temperatura è l’osservabile che determina la direzione del flusso di calore
• Il calore è una forma di energia che si scambiano due corpi a diversa temperatura
• L’uguale temperatura fra due corpi blocca il trasferimento di calore
• La temperatura non misura la quantità di calore
Scambio di calore: il calore dQ che si deve fornire o sottrarre per variare di una
quantità dT la temperatura di una sostanza di massa m è pari a
dQ c m dT
c Calore
specifico
Il Calore specifico è una costante tipica del materiale e, nel caso dei gas, anche del
metodo usato per fornire il calore
2
2
J
kgm
m
c
K kg s 2 K kg s 2 K
Lavoro: vedi meccanica
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
7
Termodinamica: la termodinamica è la branca della fisica che studia le modalità
con cui i corpi si scambiano calore e come questo possa essere trasformato in lavoro.
Sistema: si definisce sistema (termodinamico) l’insieme dei corpi che si sta
studiando.
Esterno: si definisce esterno tutto ciò che è presente nell’ambiente e non appartiene
al sistema.
Stato del sistema: Si definisce stato del sistema l’insieme delle condizioni fisiche
del sistema stesso specificate dalle osservabili fisiche come pressione, volume,
numero di moli e temperatura.
Funzione di stato: si definisce funzione di stato del sistema una osservabile il cui
valore dipende solo dallo stato in cui si trova il sistema e non dalle modalità con cui è
stato raggiunto.
Equilibrio Termico: due sistemi sono detti in equilibrio termico se, quando sono
portati a contatto termico, è nulla la quantità totale di energia termica che si trasmette.
La temperatura è un indice dell’equilibrio termico, nel senso che è nulla la quantità
totale di calore che si trasmette fra due sistemi, a contatto termico, che hanno la stessa
temperatura.
Esterno
Energia (L,Q)
Sistema termodinamico
Principio zero della Termodinamica
Due corpi posti in contatto raggiungono dopo un certo tempo l’equilibrio termico.
Due corpi (sistemi) in equilibrio termico con un terzo sono in equilibrio termico
anche fra loro. La temperatura cioè è un indice dell’equilibrio termico.
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
8
Il principio zero definisce l’assenza di scambio di calore (come la prima legge di
Newton definisce il moto in assenza di Forze) tra corpi che hanno la stessa temperatura.
Primo Principio della Termodinamica
Quando un sistema assorbe una quantità di calore Q e compie una quantità
di lavoro W, l’energia interna del sistema varia di una quantità dU.
dU Q W
Convenzioni: il lavoro ha segno positivo se è fatto dal sistema, è negativo se fatto
sul sistema; il calore è positivo se è assorbito dal sistema, negativo se è ceduto dal
sistema
Note:
• E’ un principio di conservazione dell’energia. È l’equivalente del principio di
conservazione dell’energia meccanica
• L’ energia interna è una funzione di stato. La sua variazione è espressa con un
differenziale esatto dU. Il lavoro fatto/subito e il calore assorbito/ceduto (che non sono
funzioni di stato) sono espressi con differenziali non esatti W e Q.
Una considerazione importante: il lavoro fatto dal sistema è sempre un lavoro
di espansione/compressione, quindi la forza applicata è in pratica sempre
parallela allo spostamento per cui:
L F ds
l
l
F
Ads PdV
A
l
V
dV
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
P
9
Diagramma PV
In meccanica abbiamo definito il Diagramma Orario per mettere
in forma grafica le caratteristiche principali del moto di un corpo.
In termodinamica allo stesso scopo è usato il Diagramma PV,
uno spazio in cui sull’asse delle ascisse è posto il volume del
sistema e sulle ordinate la pressione
Noto il numero di moli, P e V consentono di trovare
T e tutte le altre funzioni di stato
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
10
Come? In linea di principio con l’eq. di stato
Lo stato gassoso
L’elemento costitutivo base di un qualsiasi
materiale è costituito da un atomo o da un
insieme di questi legati tra loro (molecola).
Le proprietà fisico chimiche di un
atomo/molecola di un materiale sono le stesse
del materiale stesso. Se la divido ulteriormente
ottengo degli oggetti con proprietà fisicochimiche sensibilmente differenti da quelle di
partenza.
La fase gassosa, liquida o solida è dovuta al tipo
di legame esistente tra gli atomi/molecole di un
materiale. Nella fase gassosa non esistono
legami (o sono molto deboli) nella fase solida
invece i legami sono molto forti .
Gas
Solido
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
11
Per la descrizione di un fluido o gas sono state definite le osservabili
pressione, temperatura, mole (oltre ovviamente al volume).
Sperimentalmente si osserva che sono osservabili legate tra loro.
Misurando la pressione del gas in funzione della
temperatura (in Kelvin) (V=cost) si osserva che tra
le due quantità esiste una relazione lineare
L’esperienza indica che se aumento il numero di
molecole presente in un recipiente (V=cost)
aumenta la pressione nel recipiente stesso
P T
P n numero moli
1
P
V
Se a parità di massa (numero molecole) e
temperatura riduco il volume di un gas, la pressione
aumenta
Dall’evidenza sperimentale si può quindi ricavare l’equazione di stato dei
gas perfetti
Pn
T
V
PV nRT
R è la costante di proporzionalità che viene definita costante universale dei
gas e vale 8.31 J/(mole K)
R
PV nRT n
N AT NkT
NA
N = nNA è il numero di molecole presenti
k è la costante di Boltzmann = 1.38 10-23 J/K°
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
12
Equazione dei Gas Perfetti
PV nRT
L’equazione di stato dei gas perfetti si può mettere in un grafico ponendo
sulle ascisse la pressione e sulle ordinate il volume.
Volume (m3)
0.04
T=300 K°
T=350 K°
T=150 K°
0.03
0.02
0.01
0
0
2
4
6
8
Pressione*10000 (Pascal)
Ciascuna delle curve mette in relazione il volume e la pressione a
temperatura costante ed è detta isoterma
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
13
L’equazione di stato dei gas mette in relazione diretta le osservabili
pressione, volume e temperatura. In particolare, note due la terza
risulta univocamente determinata.
Attenzione:
• E’ una legge sperimentale approssimata.
• Non tiene conto che il gas ha un volume finito, cioè ipotizza che le molecole siano
oggetti puntiformi di volume nullo
• Non tiene conto delle forze che agiscono tra le molecole dei gas.
• Vale quindi solo esclusivamente per gas rarefatti, a temperatura molto lontana dallo
zero assoluto e per volumi macroscopici.
A partire dalla equazione di stato dei gas si possono ricavare alcune delle leggi più
comuni dei gas
Legge di Boyle
A temperatura costante il prodotto del volume di una massa m di gas per la
pressione risulta costante P1V1=P2V2
Legge di Gay-Lussac
A pressione costante il rapporto del volume di una massa m di gas per la
temperatura (in Kelvin) risulta costante V1/T1=V2/T2
Legge di Dalton
In una miscela di gas la pressione totale è uguale alla somma delle pressioni
parziali dei suoi gas componenti
PTot n1
RT
RT
RT
RT
n2
n3
..... n1 n2 n3 ...
V
V
V
V
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
14
Torniamo al diagramma P,V
Lavoro
L F ds
l
l
F
Ads PdV
A
l
Il lavoro richiesto o fornito da una trasformazione termodinamica
non è altro che l’area della superficie sottesa dalla trasformazione
termodinamica
P1DV + P2DV + P3DV +…
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
15
Dati uno stato iniziale ed uno finale esistono molte diverse
trasformazioni che li collegano.
Ad ognuna corrisponde un diverso lavoro (esempi).
Se la trasformazione viene compiuta in senso inverso (da “f” ad
“i”), il modulo del lavoro non cambia, ma cambia il segno.
È anche molto interessante considerare il lavoro effettuato nelle
trasformazioni cicliche. In questo caso U non cambia (funzione
di stato), perciò si ha solo trasformazione di calore in lavoro.
Anche le trasformazioni cicliche possono essere invertite.
Per ogni trasformazione (o ciclo) è ovviamente essenziale avere
sempre in mente come essa possa essere realizzata nella pratica.
Come si procede?
I principio
Equazione di stato
Altre relazioni (Q DT)
L, Q, DU
Per un ciclo DU=0 e da L, Q
Rendimento (L/Qass)
Vedremo più avanti in dettaglio un ciclo che
esemplifica tutto ciò: il ciclo di Carnot
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
16
Trasformazioni Termodinamiche fondamentali
Trasformazioni reversibili
Una trasformazione reversibile è una trasformazione quasi-statica che cioè procede
lentamente quanto basta affinché il sistema risulti sempre in equilibrio (tutte le leggi e
relazioni fino ad ora viste valgono solo ed esclusivamente in situazioni di equilibrio).
Trasformazione Isocora
Una trasformazione isocora è una trasformazione a Volume costante
dV 0 W 0 dU dQ
Per un gas monoatomico
3
cv R e quindi , essendo dQ n cv dT ,
2
3
dU nR dT
2
Ecco un’altra espressione di una funzione di stato
Trasformazione Isobara
Una trasformazione isobara è una trasformazione a Pressione costante
dP 0 d ( PV ) PdV VdP PdV
dU Q PdV dU Q d ( PV ) Q nRdT
Per un gas monoatomico
3
5
nR dT Q nRdT Q nR dT
2
2
5
cp R
2
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
17
La costante universale dei gas perfetti acquista cosi il significato fisico di differenza tra
il calore specifico a pressione costante e quello a volume costante.
R c p cv
Trasformazione Isoterma
Una trasformazione isoterma è una trasformazione a temperatura costante
dT 0 dU 0 dW dQ
dV
Q W PdV nRT
V
V
Q W nRT log 2
V1
Trasformazione Adiabatica
Una trasformazione Adiabatica è una trasformazione in cui non vi è scambio di calore
Q 0 dU dW
per un gas monoatomico
3
dU nRdT
2
dW PdV nRT dV / V
dT
2 dV
dV
1
( cp / cv )
T
3 V
V
log T 1 log V cost
1
TV
1
costante
T1 V1
T2 V2
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
18
Equivalente meccanico della Temperatura
Teoria Cinetica dei Gas
Un gas è un insieme di molecole, in un gas perfetto (un gas di idealizzato) le molecole
sono puntiformi, non hanno cioè un loro volume e non interagiscono tra loro.
Dato un un contenitore di lato L con
all’interno una sola molecola di massa m con
velocità v parallela all’asse delle ascisse.
Se la molecola si trova al tempo t = 0
adiacente alla parete sinistra dopo un tempo t
= L/v urta la parete di destra. Supponiamo
che l’urto sia di tipo elastico.
La quantità di moto ceduta dalla molecola è
pari a
D p mv (mv) 2mv
che corrisponde per il teorema dell’impulso e
quantità di moto ad una forza pari a
F
D p 2mv
Dt
Dt
Poiché ogni T=2L/v ho un urto allora la forza media che la parete del
contenitore esercita sulla molecola è pari a
2mv 2mv mv2
F
Dt
2L / v
L
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
19
Per il principio di azione e reazione la forza media che la molecola esercita sulla
superficie del contenitore è pari a
mv 2
F
L
Se invece di una sola molecola ne consideriamo N identiche, che per ipotesi non
interagiscono tra loro ma solo con la parete del contenitore, la forza che queste N
molecole esercitano sulla parete sarà:
mv2
Fi
i 1
i 1 L
N
Ftot
N
In primissima approssimazione (ma è possibile dimostrarlo più rigorosamente) 1/3
delle molecole ha una velocità v parallela all’asse delle ascisse e urta la parete di destra
2
mv2 1 m v
N
L
3 L
i 1
N
Ftot
dove <v2> è il valore medio del quadrato della velocità e vqm = (<v2>)1/2 è detta
velocità quadratica media. Passando dalla forza alla pressione.
2
1 m v 1 2 1 2 1
P 2 N
N mvqm
L
3 L L2 3 2
V
2
PV N Ecin
3
Per l ' equazione di stato dei gas perfetti
Ftot
PV NkT nRT
per cui
PV
Ecin
2
N Ecin NkT
3
3
kT
2
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
20
La Temperatura non è altro che l’energia cinetica media delle
molecole di un gas.
Aumentando la temperatura non facciamo altro che aumentare
la velocità delle molecole del gas.
Acquista un significato intuitivo lo zero assoluto ! A temperatura zero tutte
le molecole sono assolutamente ferme, hanno cioè energia cinetica nulla.
Non ha quindi senso fisico una temperatura inferiore (l’energia cinetica non
può mai essere negativa).
Due gas alla stessa temperatura, pur avendo la stessa energia cinetica, NON
hanno la stessa velocità quadratica media.
Esempio:
L’aria è una miscela di azoto (N2’ (M(N2) = 28.0 u)) ossigeno (O2, (M(O2) =
32.0 u)) ed argon (Ar, (M(Ar) = 39.9 u)). Alla temperatura di 20 °C (293 K)
la velocità quadratica media di ciascun gas sarà:
1 2
3
mvqm kT
2
2
3kT
m
Ecin
vqm
3kT
3 *1.38 10 23 * 293
vqm ( N 2 )
511 m / s
27
m
28 *1.66 10
3kT
3 *1.38 10 23 * 293
vqm (O2 )
478 m / s
m
32 *1.66 10 27
3kT
3 *1.38 10 23 * 293
vqm ( Ar )
428 m / s
m
39.9 *1.66 10 27
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
21
Le osservabili macroscopiche come pressione e temperatura sono quindi collegate con le
variabili dinamiche definite precedentemente in meccanica:
Pressione
Somma della forza che ciascuna molecola esercita su una parete
divisa per la superficie della parete stessa
Temperatura
Energia cinetica media
Per completare il parallelo tra le proprietà dinamiche e quelle termodinamiche è utile
presentare l’equivalente dell’energia (quantità fondamentale in quanto è una quantità che
si conserva sempre).
Energia Interna (per un Gas)
L’energia interna U è definita come l’energia cinetica totale di un gas, cioè la somma
delle energie cinetiche di tutti le molecole presenti.
1 2
3 3
U N mvqm
N kT nRT
2
2 2
Questa relazione vale per un gas monoatomico (quanto più vicino esiste in natura
all’ipotesi di particella puntiforme). Nel caso di molecole più complesse parte
dell’energia cinetica può essere immagazzinata non solo nei moti traslazionali ma anche
vibrazionali o rotazionali.
U
U
Gas monoatomico
3
kT
2
5
kT
2
Gas biatomico
Ma è sempre possibile utilizzare questa Energia?
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
22
A questa domanda risponde il II principio della Termodinamica
Il II principio può essere enunciato in molti modi diversi (equivalenti).
Cerchiamo di capire cosa esso rappresenti in sostanza
Innanzitutto osserviamo che in termodinamica il Tempo ha direzione
A
B
Quale è la corretta sequenza temporale e perché?
Teoria cinetica/moti caotici/interpretazione in
termini di calcolo delle probabilità
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
23
La Direzione del Tempo
A
B
Quale è la corretta sequenza temporale e perchè?
Una configurazione è energeticamente più conveniente dell’altra ?
Esiste una variabile di stato che assume valore diverso in “i” e “f”?
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
24
La Direzione del Tempo è controllata da una nuova
osservabile definita ENTROPIA
Entropia
Si definisce variazione di entropia il rapporto tra la quantità di calore Q
scambiato in una trasformazione reversibile e la temperatura a cui essa
avviene.
f
Q
Q
dS
DS
T
T reversibile
i
Si può dimostrare che l’entropia è una funzione di stato, in altre parole solo lo stato del
sistema determina il valore dell’entropia che il sistema possiede.
La variazione di entropia, quindi, non è altro che la differenza tra il valore dell’entropia
finale e l’entropia finale
Secondo Principio della Termodinamica
(Entropia)
L’Entropia totale in un sistema chiuso rimane
invariata quando si svolge una trasformazione
reversibile ed aumenta quando si svolge una
trasformazione irreversibile.
In una trasformazione spontanea l’entropia non può mai diminuire
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
25
TiL = 60°
TiR = 20°
M = 1.5 Kg
c = 386 j/(Kg K)
TfL = TfR = 40°
DS = ?
1
3
2
f
1) DS L
i
Tf
T
dQ Tf mcdT
dT
40 273
mc
mc ln f 1.5 386 ln
35.86 J / K
T Ti T
Ti
60 273
Ti T
Un corpo ' caldo ' scende di Temperatura
Tf
T
dQ Tf mcdT
dT
40 273
2) DS R
mc
mc ln f 1.5 386 ln
38.23 J / K
T
Ti
20 273
i T
Ti
Ti T
f
Un corpo ' freddo' sale di Temperatura
DSTot DS L DS R 2.4J / K
DSTot 0
La reazione avviene Spontaneamente
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
26
II Principio della Termodinamica (termico)
L’energia termica si trasmette spontaneamente da una sostanza a
temperatura più alta ad una sostanza a temperatura più bassa e
non si trasmette spontaneamente nel verso opposto (Clausius).
______________________________________________________
È impossibile realizzare una macchina ciclica che funzioni con
una sola sorgente di calore e sia capace di produrre lavoro
(Kelvin)
Il II principio della termodinamica dà un verso al tempo (intuitivo).
E’ importante tenere conto che il calore può essere forzato a trasmettersi in
direzione opposta, ma compiendo del lavoro.
Queste formulazioni (e quella che seguirà) del II principio della
termodinamica sono assolutamente equivalenti. Se ne assumo
una posso dimostrare le altre e viceversa.
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
27
Il II principio della termodinamica è lo strumento principale
per lo studio del funzionamento delle macchine termiche.
Cioè delle macchine che usano energia termica per produrre
un certo tipo di lavoro o viceversa.
Una macchina termica è costituita da una
caldaia (o sorgente ad alta temperatura (T1)),
uno strumento che lavora ed un pozzo di
calore (a temperatura T2)
Per il funzionamento di una macchina termica
sono necessarie due sorgenti a differente
temperatura.
Parte del calore preso dalla sorgente ad alta
temperatura viene usato per produrre lavoro
L, parte viene ceduto alla sorgente a
temperatura più bassa Q2.
Macchina termica Ideale:
È una macchina termica in cui tutte le trasformazioni
sono reversibili e non avvengono dispersioni di energia
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
28
Rendimento
Il rendimento di una macchina termica è definito come il rapporto tra il lavoro
compiuto ed il calore assorbito dalla sorgente calda.
Lavoro compiuto
W
Lavoro compiuto
W
assorbito Q
calore
assorbito Q
calore assorbito
assorbito
0 W 0
1 W Qassorbito
1 infatti W Qassorbito
II Principio della Termodinamica (Carnot)
Nessuna macchina termica può avere un rendimento maggiore di quello di una
macchina termica ideale. Tutte le macchine termiche reversibili, fissata la differenza
di temperatura, hanno lo stesso rendimento.
1
T2
T1
1 T2 0
(in K !!)
Non esiste un ciclo di trasformazioni che dia come unico risultato l’acquisizione di
calore da una sorgente termica e la sua totale trasformazione in lavoro (già visto
(Kelvin))
• In questa formulazione del II principio della termodinamica non si fa
menzione di alcun dettaglio tecnico o del tipo di macchina; è
assolutamente generale, indipendente dal tipo di macchina termica usata
• Poiché ogni tipo di macchina reale non è in grado di procedere per mezzo di
trasformazioni di quasi equilibrio, è cioè una macchina irreversibile (il solo
attrito la rende irreversibile) il II principio della termodinamica da un
limite superiore al rendimento di una qualsiasi macchina termica.
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
29
Calcolo del rendimento di una macchina
termica ideale - Ciclo di carnot
Visto che una macchina termica, fissata la temperatura delle due sorgenti, ha un
rendimento fisso per calcolarlo è sufficiente costruire un ciclo termico qualsiasi.
Supponiamo che T1 > T2
1) Da un punto P1V1T1 ad un punto P2V2T1 (espando isotermicamente)
2) Dal punto P2V2T1 ad un punto P3V3T2 (espando adiabaticamente)
3) Dal punto P3V3T2 ad un punto P4V4T2 (comprimo isotermicamente)
4) Dal punto P4V4T2 al punto P1V1T1 (comprimo adiabaticamente)
In questo caso ho una macchina termica di cui posso calcolare il rendimento.
1)
2)
3)
4)
V
Q W nRT1 log 2 0
V1
Q0
1
P
T2
3
V
Q W nRT2 log 4 0
V3
Q0
2
4
T1
V
Nella espansione isoterma il sistema compie lavoro ed assorbe calore
Nella espansione adiabatica non scambio calore
Nella compressione isoterma devo compiere lavoro sul sistema
Nella compressione adiabatica non scambio calore
In questa trasformazione, poiché è ciclica, non ho una variazione di energia interna
dU Q W
Q W
dU 0
W Qassorbito Qceduto Qassorbito Qceduto
W
Qassorbito
Qassorbito Qceduto
Qassorbito
1
Qceduto
Qassorbito
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
30
W
Qassorbito
Qassorbito Qceduto
Qassorbito
1
Qceduto
Qassorbito
V
V
nRT2 log 4
nRT2 log 4
V3
V3 1 T2
1
1
T1
V
V
nRT1 log 2
nRT1 log 1
V1
V2
Infatti in una trasformazione adiabatica
1
1
V4
T V
2 1
T1 V2
V3
V4 V1
V3 V2
Questo ciclo è reversibile, quindi può essere percorso in senso inverso. Le quantità di
lavoro scambiate con le sorgenti cambiano di segno come pure i lavori . In questo caso
ho una macchina frigorifera di cui posso calcolare il coefficiente di effetto frigogeno.
coeff . eff . frig .
Qtolto al frigo
W
Qtolto al frigo
Qdatoall'ambiente Qtolto al frigo
T2
T1 T2
Attenzione:
In questa trattazione si ipotizza sempre che, indipendentemente dalla quantità di calore
assorbito o ceduto le due sorgenti termiche rimangano sempre alla stessa temperatura
Termodinamica 19-20-21 (No 19.5,19.7,19.11,20.6,20.8,20.10,20.11,21.4,21.5,21.6)
31












