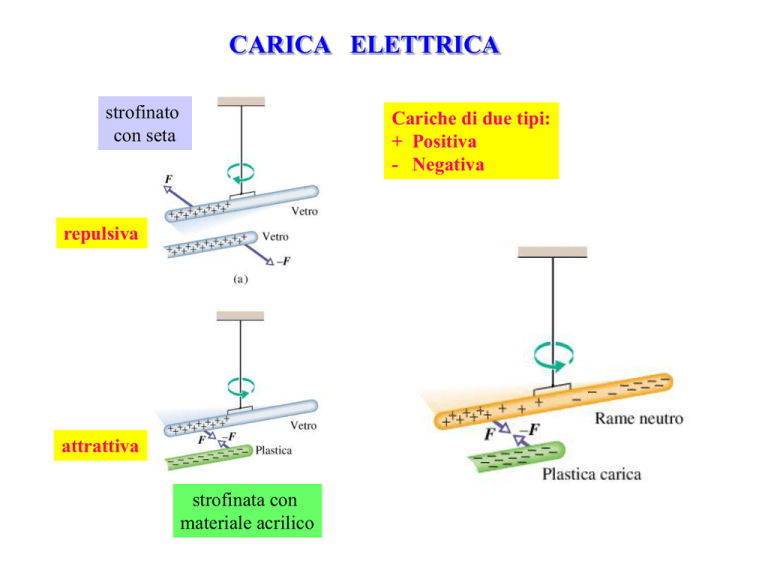
CARICA ELETTRICA
strofinato
con seta
Cariche di due tipi:
+ Positiva
- Negativa
repulsiva
attrattiva
strofinata con
materiale acrilico
LEGGE DI COULOMB
1
q1q2
F
2
40 r
0 costante dielettric a del vuoto
materiale
materiale
relativa
0
Unità di misura della carica
coulomb
C
materiale
C2
Nm2
relativa
adimensionale
q1
F12 r
+
q2
F21
Ordini di grandezza
1
N
9 10 2 2
40
mC
9
q1
F12 r
q2
F21
r 1m
q1 q2 1C
2
N
m
1C 1C
9
9
F 9 10
9
10
N
2
2
C
1m
q p qe e 1.6 1019 C
rH 5.3 1011 m
me 9.110 31 Kg
mp 1.7 10
18/5/06
27
Kg
Fel 8.2 10 8 N Fgrav. 3.6 1047 N
rp 11015 m
19 2
(
1
.
6
10
)
9
Fpp 9 10
140 N
15
(110 )
repulsiva
Forza nucleare
per legare il nucleo
CAMPO ELETTRICO
FN
E
qC
LINEE DI FORZA DEL CAMPO ELETTRICO
FN
E
qC
Il campo elettrico è tangente
punto per punto alla linea di forza
LINEE DI FORZA DEL CAMPO ELETTRICO
LINEE DI FORZA DEL CAMPO ELETTRICO
FORZA ELETTRICA
F
E
q
E
Q
F qE
F F
qqEE
Q
Q
q 1C
q q
F qE ma
q
a E
m
moto uniformemente accelerato
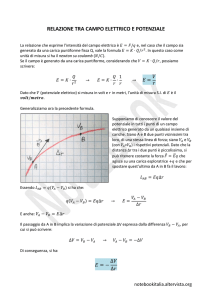
POTENZIALE ELETTRICO
La forza elettrica è conservativa
perché è una forza centrale
Energia potenziale
elettrica
F ds
B
U U B U A L A B
A
U
E ds
U q E ds
q
A
B
B
A
F U
E V
Lavoro su una carica q
U
V
q
Differenza di
potenziale elettrico
Lavoro su una
carica di + 1C
POTENZIALE ELETTRICO
La forza elettrica è conservativa
perché è una forza centrale
Energia potenziale
elettrica
F ds
B
U U B U A L A B
A
U
E ds
U q E ds
q
A
B
B
A
F U
E V
Lavoro su una carica q
U
V
q
Differenza di
potenziale elettrico
Lavoro su una
carica di + 1C
SUPERFICI EQUIPOTENZIALI
V E ds
B
A
dV E ds
dV 0 E ds
Le superfici equipotenziali sono perpendicolari alle linee di forza
SUPERFICI EQUIPOTENZIALI
B
B
V E d s E ds E ds Ed
B
A
VA
E
d
E gradV
A
A
B
VB VA Ed
VB
VB VA
V
E
d
x
EX
V( x, y, z)
x
EY
V( x, y, z)
y
Ez
V( x , y, z)
z
A
19/05/06
Q
1F
CAPACITA’ ELETTRICA
1C
1V
Q1 Q2 Q3
C
..... C C
farad F
V 0 V1 V2 V3
V
Condensatore cilindrico
Condensatore piano
C 0
A
d
C 0 r
A
d
R
l
2Rl
C 0 r
CAPACITA’ ELETTRICA
Condensatori in parallelo
C1
q1
V
C2
q2
V
C3
q3
V
q1 q 2 q 3
q
C1 C 2 C3
C eq
V V
V
V
C eq C1 C 2 C3
CAPACITA’ ELETTRICA
Condensatori in serie
C1
q
V1
C2
q
V2
C3
q
V3
V
1
1
1
V
V
1 2 3
C1 C 2 C3
q
q
q
V1 V2 V3 V
1
q
q
C eq
1
1
1
1
Ceq C1 C2 C3
CORRENTE ELETTRICA
q
q
S
V
Densità di corrente
q
q ampère coulomb
s
J
i
St
t
C
C
s m 2
A
s
i
J i JS
S
RESISTENZA E RESISTIVITA’
V
resistenza
V
R
i
volt
ohm
ampère
V
A
RESISTENZA E RESISTIVITA’
Su piccoli intervalli di temperatura
L
S
resistività
L
S
R
R
S
L
m
(T ) (T0 )1 (T T0 )
LEGGE DI OHM
Per una classe di conduttori
Legge di Ohm
V
J E
conducibilità
1
V
E
L
VA VB
S
i JS ES S
V
L
L
1 S 1
L R
1
i V
R
1S
i
V
L
V Ri
Conduttore
ohmico
LEGGE DI OHM
V Ri
Conduttore
non ohmico
RESISTENZE IN SERIE
v1
v
v2
v
v3
R eq i V V1 V2 V3
R 1i R 2i R 3i
( R 1 R 2 R 3 )i
R eq R 1 R 2 R 3
RESISTENZE IN PARALLELO
i i1 i 2 i 3
V
V
V
R1 R 2 R 3
1
1
1
V(
)
R1 R 2 R 3
i
1
1
1
(
)
V
R1 R 2 R 3
i
1
V
Req
1
i
1
1
1
(
)
R eq
V
R1 R 2 R 3
POTENZA ELETTRICA
L U q V q
POTENZA W
V I V
t t
t
t
V RI
V2
W I V RI
R
2
J C J
W V A W
C s s
V
J
1KW h 10 3600s 3.6 106 J
s
3
Effetto Joule
Il passaggio della corrente
riscalda il conduttore
25/05/06
1cal 4.186J
1 cal (dieta) = 1Kcal
2
Qcalore
1
1
V
2
RI
La potenza dissipata
t
4.186
4.186 R
DIPOLO ELETTRICO
Sostanze polari
Sostanze polarizzate
+
+
q l q
p ql
Momento di dipolo elettrico
1
DISSOCIAZIONE ELETTROLITICA
esempio : NaCl
in acqua
legame ionico
(forza di Coulomb)
Na+
I : indebolimento del legame
qQ
1
Fc = 4 2
o r r
r (aria) 1
r (acqua) 80
}
Fc(acqua) 1 Fc(aria)
80
Dovuto soprattutto alle molecole di acqua
Polarizzate che si dispongono intorno agli
Ioni e schermando il loro campo elettrico
+
II : rottura del legame
da urti per agitazione termica
Cl–
Na
+
–
+
O– – H2+
–
Cl
dissociazione elettrolitica
DISSOCIAZIONE ELETTROLITICA
DISSOCIAZIONE ELETTROLITICA
–
III° : mancata ricombinazione
da polarità molecola H2O
2
+
Na
+
+ –
O– – H2+
–
Cl
–
+
conduttori elettrolitici :acidi, basi, sali in H2O
forte
sostanze organiche
debole dissociazione
forte legame covalente
}
esempio
NaCl
100 molecole NaCl
CORRENTE ELETTRICA
9
in H2O
dissociazione 84 %
84 Na+
84 Cl–
16 NaCl (non dissociate)
184 particelle
D.S. gen. 95
LEGGE DI OHM
–
B
+
G
F qE ZeE
A
l
K–
I-
S
I+
+A
E
i JS
R
l
S
a b
a
J E
Concentrazione
ionica in grammoioni/cm3
b 1 grammoione contiene
1 NA di ioni
Mobilità ioniche
q
i Z 2 e 2 N A S a a bb E
t
1
1
Z2 e 2 N a a b b
ELETTROLISI
voltametro o
cella elettrolitica
moto di ioni in soluzione
ioni +
elettrodo negativo
(catodo K)
elettrodo positivo
(anodo A)
ioni –
esempio
–
B
mq
Ac
A
l
–
I
K
nitrato d'argento in acqua
AgNO3
Ag+ + NO3deposito al catodo di una massa m
legge di Faraday
+
G
S
I+
+A
E
equiv. elettrochimico
Ac
Ac
m Ae q
q
q
F
N Ae
A peso atom.
equiv. chimico
f
valenza
Na e F
Costante
di Faraday
Na e 96460C
f valenza
m
N a fe q
A
moli
particelle
particelle
carica
A
A 1
m
q
q
fN a e
f Nae
Equivalente
chimico
Equivalente
elettrochimico
ELETTROFORESI
Migrazione di particelle cariche
in sospensione
sotto l’azione di un campo elettrico
Fe qE Fa 6rv
elettrica
Macromolecole
gruppi acidi e basici
pH
grossi ioni + o A regime
r
Fe Fa 0
attrito
v
1
6r
1
6r
qE qE ' E
Mobilità elettroforetica
1
'
q
6r