Famiglia TOGAVIRIDAE
Generalità
Alphavirus
Comprende i generi
Rubivirus
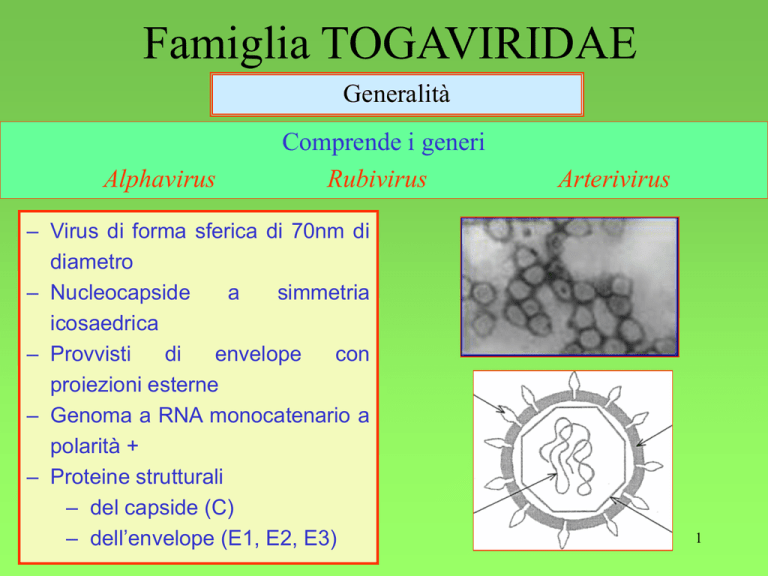
– Virus di forma sferica di 70nm di
diametro
– Nucleocapside
a
simmetria
icosaedrica
– Provvisti
di
envelope
con
proiezioni esterne
– Genoma a RNA monocatenario a
polarità +
– Proteine strutturali
– del capside (C)
– dell’envelope (E1, E2, E3)
Arterivirus
1
Genere Alphavirus
Encefalite equina dell’est (EEE)
Encefalite equina dell’Ovest (WEE)
Encefalite equina venezuelana (VEE)
Ospiti:
equidi, uomo, uccelli, rettili
e invertebrati
Malattie di gravità variabile a seconda del sierotipo in causa
La trasmissione attraverso i vettori condiziona la prevalenza stagionale o nelle zone
caldo-umide
L’insorgenza di segni neurologici è dovuta alla presenza di alte quote virali nel sangue
Genere Rubivirus
Rosolia dell’uomo
2
ARTERITE VIRALE EQUINA
Malattia infettiva contagiosa del cavallo
Caratterizzata da vasculite generalizzata
con particolare interessamento delle
arterie di medio calibro
L'aborto è l’evento più grave di questa patologia
Malattia in forte aumento in conseguenza:
• dell'aumentato spostamento dei cavalli
•del diffondersi della IA
• del miglioramento della tecnica diagnostica
3
Eziologia
Oggi classificato nell’Ordine Nidovirales Famiglia Arterivirus
Genere Arterivirus
Alla stessa famiglia appartiene il virus della
sindrome respiratoria e riproduttiva del suino
(PRRV)
Virus labile ai solventi dei lipidi e all'azione dei
detergenti
inattivato a 56 °C
Esiste un solo sierotipo probabile l’esistenza di
varianti con differenti proprietà biologiche
(virulenza)
Spettro d' ospite:
Equidi
I purosangue sono meno
sensibili
In vitro cresce su colture primarie e
continue di derma di cavallo e altre
specie
CPE caratterizzato da aumento 4di
Ciclo di replicazione
Gli arterivirus hanno struttura simile ai Togavirus?? e organizzazione
genomica e modalità replicative simili ai Coronavirus
5
Epidemiologia
La malattia è oggi diffusa a livello mondiale
Giappone e Islanda sono esenti dal virus
La % di sieropositività aumenta con l'aumentare dell'età degli animali
considerati
Molti focolai sono stati osservati nelle stazioni di
monta
• La trasmissione della malattia avviene essenzialmente per contatto
diretto
• via aerogena per quanto riguarda animali che presentino la malattia
in forma acuta
• via venerea, nelle stazioni di monta
• Possibile la trasmissione transplacentare
• Se l'infezione avviene in fase avanzata di gestazione la gravidanza
viene comunque portata a termine ed il feto arriva a nascere
6
• Il virus si ritrova
• Nelle secrezioni nasali nella fase acuta della malattia
• Nelle urine per la persistenza a livello renale
• Nelle feci, secrezioni vaginali ed uterine, feti abortiti
• nel seme dove è presente ad alto titolo
• Probabilità di contagio stimata tra l' 85 e il 100 %
Possibile una forma asintomatica o paucisintomatica
Il 30% degli stalloni sieropositivi risulta essere portatore e
per molti anni trasmette l' infezione con il coito
La persistenza del virus è possibile a tre livelli
1. negli animali convalescenti per 2-5 settimane
2. in casi intermedi per 3-8 mesi
3. nei soggetti con forma cronica anche per tutta
la vita
7
Lo stallone portatore sano
Lo stato di portatore sano
è stato dimostrato nello
stallone e nel puledro
maschio post-puberale
Lo stabilirsi e
permanere del virus è
androgeno-dipendente
Lo stallone portatore sano
è la riserva naturale del
virus
Il virus è presente in alcune
ghiandole sessuali accessorie
dalle quali è rilasciato al
momento dell’eiaculazione
Gli stalloni portatori trasmettono l’infezione
solo attraverso la monta. La
disseminazione del virus può quindi
avvenire solo per via venerea o attraverso
materiali contaminati dal virus
Il virus nel tratto riproduttivo
dello stallone non causa
effetti negativi sullo stato
generale di salute e sulla
fertilità
Una percentuale variabile di
stalloni portatori sani
eliminano il virus
spontaneamente dai loro
organi e cessano di essere
portatori
8
Trasmissione
9
Eliminazione virus
Stalloni portatori a breve termine
Per alcune settimane
Stalloni portatori a medio termine
Per 3 – 9 mesi
Stalloni portatori a lungo termine
Per anni
Maschi castrati
Max 57 giorni
Femmine
Max 57 giorni
La cavalla infetta NON diventa portatrice
10
Patogenesi
Replicazione primaria
MACROFAGI ALVEOLARI
Porta d’ingresso
Via inalatoria
REPLICAZIONE A LIVELLO
LINFONODALE
VIREMIA
(virus libero o associato ai
macrofagi)
Diffusione in tutto l'organismo escluso il
SNC
Cellule bersaglio: MACROFAGI e CELLULE ENDOTELIALI
Siti di replicazione secondari: surrene, rene, fegato, tubuli seminiferi,
tiroide, mesotelio e tunica media delle arterie
11
• I danni a livello vascolare sono rappresentati da:
•
Vasculite generalizzata
•
Aumento della permeabilità vasale
• La localizzazione del virus a livello della tunica media delle arterie medie
comporta un aumento dello spessore della parete dei vasi e
conseguentemente scompensi circolatori
•
Le lesioni alle arterie tendono a cronicizzare
• La localizzazione renale determina glomerulonefrite
•
Presenza di immunocomplessi, accompagnata da persistenza del
virus per molto tempo
• I casi di aborto sono dovuti al distacco della placenta per edema del
miometrio e conseguente ridotta irrorazione placentare
12
Sintomi e lesioni
Periodo di incubazione: 3-7 gg
• I sintomi (compaiono in una modesta % di soggetti infetti) sono caratterizzati
da:
• Febbre e leucopenia
• Anoressia, depressione, edema degli arti e dell' addome, penieno e
fotofobia scrotale
• Congiuntivite, ed edema palpebrale
• Congestione della mucosa nasale, con secrezione sierosa.
• Meno frequentemente si osserva opacità corneale, tosse, diarrea,
debolezza
• L'aborto, si riscontra nel 50% delle giumente infette senza segni premonitori,
13
Edemi diffusi
14
Emorragie viscerali e polmonari
15
• Le lesioni sono costituite da congestione, edema ed emorragie del
sottocute, dei linfonodi, degli organi interni
• Più pronunciate nei tessuti intorno alle piccole arterie
• L'intestino tenue mostra edema segmentato con costrizione del lume ed
arrossamento della mucosa
• Comune la necrosi della ghiandola surrenale
• Istologicamente si evidenzia arterite necrotica diffusa con edema,
emorragie e trombi in molti tessuti, e piccoli infarti nel polmone ed
intestino
16
Diagnosi
Clinico-epidemiologica
Spostamento di animali, stato febbrile precoce, leucopenia, edemi
sottocutanei, aborto
L'isolamento del virus è possibile a partire dal muco nasale e
congiuntivale, dal seme o da tessuti di animali morti e feti abortiti
Nella diagnosi sierologica (SN ed ELISA) si valuta la
sieroconversione operando sul doppio campione
La PCR è utilizzabile per l' identificazione degli animali portatori
17
Profilassi
•
Obiettivo: prevenire l’aborto, la malattia e la morte dei giovani puledri ed evitare lo
stabilirsi dello stato di portatore nello stallone e nel puledro maschio post-puberale
•
Ridurre al minimo o eliminare il contatto diretto o indiretto di individui suscettibili con
animali infetti
• Situazioni di rischio: ippodromi, aste e altre manifestazioni ippiche o dove i cavalli sono concentrati
in piccoli spazi
• Eliminazione degli stalloni sieropositivi e degli eliminatori
– Gli stalloni escretori possono tuttavia essere utilizzati con giumente vaccinate a
patto che esse rimangono poi isolate dal resto del branco
– Viceversa giumente sieropositive possono essere utilizzate con stalloni vaccinati
o sieropositivi
•
Ad oggi è in atto un piano di controllo che si basa su di un esame sierologico degli
stalloni da effettuarsi prima della stagione riproduttiva
•
Stabilire lo stato virologico del seme usato per l’inseminazione artificiale,
specialmente se importato dall’estero
18
Programma di eradicazione (O.M.
13/1/94)
• Identificazione degli animali sieropositivi
– Sieroneutralizzazione in RK-13 con stipite referenza
Bucyrus, titolo minimo 1:4
• Isolamento/identificazione virus in colture cellulari
– Da sperma raccolto con vagina artificiale per 3 volte a
distanza di 15 giorni
• Prova dell’accoppiamento (Breeding test)
– Monta 2 cavalle per 2 volte per 2-4 giorni consecutivi
19
•
L'Immunizzazione è possibile attraverso l' utilizzo di vaccini attenuati
previa autorizzazione sanitaria
•
Un vaccino inattivato, adiuvato è approvato ad uso commerciale in un
numero limitato di paesi della CEE
•
E’ altamente raccomandato che tutti gli stalloni usati a fini riproduttivi
siano rivaccinati annualmente sia per ottenere protezione clinica che
per prevenire lo stabilirsi dello stato di portatore
•
Puledri maschi sessualmente immaturi fra i 6 e i 12 mesi di età
dovrebbero essere immunizzati per le stesse ragioni
•
NON UTILIZZABILI IN ITALIA
20
Porcine Reproductive & Respiratory Sindrome
(PRRS)
Attualmente l’infezione è ubiquitaria
• Sopravvivenza nell’ambiente non elevata: alcune settimane a 4 °C,
pH 7.5; in allevamento meno di 1 giorno a 25 °C;
• nell’acqua può resistere sino a 10 gg;
• facilmente inattivato da calore, secco, comuni disinfettanti;
• resistente al congelamento
21
Alta variabilità fra ceppi circolanti
22
Epidemiologia
Ospite primario
SUINO
Altre specie suscettibili
Germano reale (Anas platyrhinchos)
Suscettibile all’infezione
Elimina il virus per lunghi periodi (40 gg nelle feci)
Trasmette l’infezione ad altri germani
È in grado di infettare il suino
Il ruolo epidemiologico è però marginale
23
Modalità di trasmissione
•
Il virus è eliminato con le secrezioni nasali, saliva, latte, feci, urine
•
L’escrezione virale è di durata variabile
• La viremia (specie in suini giovani) può durare più di 2 mesi
• Alcuni animali possono rimanere portatori a livello di orofaringe e tonsille anche più di 200gg dopo la fase viremica
•
È eliminato anche col seme, in modo intermittente (100 gg)
•
Possibile la trasmissione intrauterina nell’ultimo terzo di gravidanza
•
Trasmissione indiretta tramite aghi, strumenti, indumenti, veicoli
•
Possibile anche la trasmissione aerogena (fino a 3 km)
24
– I ceppi americani sono più patogeni dei ceppi europei
– I due ceppi sono differenziabili geneticamente e antigenicamente
– All’interno di entrambi i ceppi la variabilità sia dal punto di vista antigenico
(cross-protezione), che da quello della patogenicità è elevatissima
– La via più comune di infezione per un allevamento è l’introduzione di suini
infetti
– Nello stesso allevamento possono circolare stipiti diversi
25
Patogenesi
Il virus ha uno spiccato tropismo per i macrofagi
alveolari
26
Sintomi e lesioni
La sintomatologia varia in rapporto a
•
Stipite virale
•
Tipo, gestione e stato sanitario dell’allevamento
•
Età, sesso, stato immunitario
•
Presenza di infezioni concomitanti e fattori di stress
Nel verro si osserva
Nei suinetti si osserva
• Febbre (40 – 41 °C)
• Debolezza alla nascita
• Depressione
• Ipoglicemia per ridotta assunzione di latte
• Inappetenza (4 – 7 gg)
• Sintomatologia respiratoria, diarrea
• Calo della libido e della fertilità
• Tremori, emorragie
27
Nei suini all’ingrasso si osserva
• Sintomatologia respiratoria
• Febbre
• Inappetenza
Nella scrofa si osserva
• Febbre (40 –41 °C), depressione, inappetenza (4 – 7gg)
• colpisce in successione gruppi diversi di animali
• Aborti tardivi (oltre il 70° g), feti mummificati, parti prematuri, natimortalità
• Suinetti deboli poco vitali, mortalità pre-svezzamento
• Ritorni in calore (21 –35 gg dopo fecondazione) e ritardi nella comparsa dei
calori post-svezzamento;
• Agalassia, mastite, “orecchi blu”, sintomi respiratori
28
Le lesioni sono aspecifiche o assenti
• presenti in animali in fase di accrescimento
• Si osserva polmonite interstiziale
• La gravità varia in relazione alla presenza di infezioni
secondarie
• Linfoadenomegalia
• Nel feto si osserva polmonite interstiziale e arterite ombelicale
necrotizzante
29
Diagnosi
• Diretta
• da sangue, polmone, tonsille, raschiato orofaringeo, fluido toracico di
feti abortiti, seme
•
PCR, IF, IHC
• Virus molto labile nei tessuti di animali morti
• Indiretta
• ELISA (Ab dimostrabili 7 –10 gg p. i.)
• SN (Ab dimostrabili 2 –3 mesi p. i.)
• IF
• Prelevare materiale da campioni significativi di diversi gruppi
di suini
30
Profilassi
Igienico sanitaria
• Introduzione di scrofette da allevamenti PRRS free
• Seme o verri PRRS free
• Strette misure di biosicurezza
• Tutto pieno-tutto vuoto
• Separazione fra reparti e restrizioni nell’accesso all’allevamento
• Pulizie e disinfezioni degli ambienti, delle attrezzature e dei veicoli
• Controllo degli infestanti
• Distruzione delle carcasse di animali morti, feti e placente
31
Vaccinale
• Disponibili vaccini spenti e vivi attenuati
• Evitano la malattia ma non l’infezione
• non proteggono al 100 %
• Hanno scarsa cross-protezione con ceppi virali diversi
• Necessitano di lungo tempo per indurre immunità (6 sett)
• I vaccini vivi americani hanno causato danni in Europa
32












