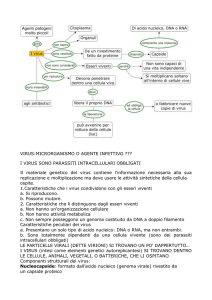
I virus
1898: Beijerinck e Iwanowsky dimostrano che il mosaico
del tabacco è una malattia infettiva sostenuta da un
agente filtrabile; Loeffler e Frosch isolano da animali il
virus dell'afta epizootica
1915: Twort dimostra l'esistenza dei virus dei batteri,
definiti da d'Herelle "batteriofagi"
1935: Stanley ottiene virus del mosaico del tabacco in
forma cristallina; dimostra la presenza di proteine
1936-40: dimostrazione della presenza dell'acido
nucleico
Anni quaranta: colture cellulari, coltivazione in vitro
Anni cinquanta: scoperta della replicazione virale
Anni sessanta:
utilizzazione
del
microscopio
elettronico e caratterizzazione dei virus
Caratteristiche generali dei virus
Entità biologiche subcellulari (virione: particella
virale completa ed infettante)
Parassiti endocellulari obbligati (di animali, piante,
funghi, batteri) (non possono produrre energia o
sintetizzare acidi nucleici e proteine al di fuori di una
cellula ospite)
Hanno dimensioni piccolissime (sono filtrabili)
Possiedono un solo tipo di acido nucleico (DNA o
RNA)
Possiedono un involucro proteico (capside) e, a volte,
un involucro lipoproteico (pericapside o peplos)
Presentano in superficie strutture proteiche
(antirecettori) che si legano a specifici recettori della
cellula bersaglio
Definizione e proprietà dei virus
Non sono esseri viventi
Per esistere in natura devono essere infettanti
Devono utilizzare i meccanismi della cellula ospite
per produrre i propri componenti (mRNA virali,
proteine e copie identiche del genoma)
Devono codificare proprie proteine specifiche per
ogni processo da loro richiesto e non effettuabile
dalla cellula
La produzione di nuovi virioni avviene per
assemblaggio delle componenti virali
Principali differenze fra procarioti e virus
Eubatteri Micoplasmi Ricketsie Clamidie Virus
Presenza contemporanea
di DNA ed RNA
+
+
+
+
-
Presenza di ribosomi
+
+
+
+
-
Capacità biosintetiche
autonome
+
+
+
+
-
Sensibilità agli antibiotici
+
+
+
+
-
Presenza di sistemi
enzimatici per la
produzione di energia
+
+
+
-
-
Crescita in terreni
artificiali acellulari
+
+
-
-
-
Sensibilità all'interferone
-
-
-
+
+
Confronto tra le dimensioni di virus e batteri
Dimensioni
200-280 Å
450 Å
600 Å
800-1200 Å
1200-1500 Å
(fino a 3000)
1 × 6 µm
Struttura del virione
Composizione chimica dei virus
Core Ö Acido nucleico: DNA
Deossiribovirus
DNA bicatenario lineare (Herpesvirus, Poxvirus,
Adenovirus)
DNA bicatenario circolare (Papovavirus)
DNA monocatenario lineare (Parvovirus)
DNA parzialmente bicatenario circolare
(Hepadnavirus)
1,5 - 2,2 / 130 - 240 milioni di daltons
Composizione chimica dei virus
Core Ö Acido nucleico: RNA
Ribovirus
RNA bicatenario frammentato (Reovirus)
RNA monocatenario lineare a polarità positiva (Coronavirus,
Flavivirus, Togavirus, Astrovirus, Calicivirus, Picornavirus)
RNA monocatenario diploide a polarità positiva (Retrovirus)
RNA monocatenario frammentato a polarità negativa
(Orthomyxovirus)
RNA monocatenario lineare a polarità negativa (Filovirus,
Paramixovirus, Rhabdovirus)
RNA monocatenario frammentato circolare a polarità
negativa o ambisenso (in 2 o 3 distinti nucleocapsidi,
Arenavirus, Bunyavirus)
2,5 / 16 milioni di daltons
Virus a DNA
presenza o assenza di pericapside
Virus a RNA
presenza o assenza di pericapside
Virus a DNA
Virus a RNA
Virus a RNA
Composizione chimica dei virus
Capside Ö rivestimento proteico
(fino al 90% del virione)
il capside:
• fornisce protezione all'acido nucleico
• è importante per l’ infettività (strutture anti-recettoriali)
dal momento che il genoma virale ha un numero
limitato di geni, il capside è costituito dalla associazione
di subunità proteiche in protomeri ripetuti (capsomeri)
collegati da legami tra gruppi chimici presenti sulla
superficie e autoassemblanti
Composizione chimica dei virus
Proteine non strutturali
Enzimi
mancano enzimi deputati alla produzione di energia o
coinvolti nelle vie biosintetiche dei precursori
- lisozima (in alcuni batteriofagi) - neuraminidasi (Ortho e Paramyxovirus)
- proteasi virus-specifiche
- RNA polimerasi RNA-dipendente (virus a RNA)
- Trascrittasi inversa (DNA polimerasi RNAdipendente, Retrovirus)
- RNA polimerasi DNA-dipendente (Poxvirus)
Composizione chimica dei virus
Componente lipidica e glucidica
Pericapside (peplos o envelope)
Rivestimento lipoproteico
acquisito per gemmazione da membrane cellulari
modificate
sensibile a solventi dei lipidi e sali biliari
Nei virus provvisti di peplos sono anche presenti
glicoproteine
Morfologia e struttura
Il modo in cui i diversi componenti sono organizzati
nella struttura del virione è stato chiarito mediante
microscopia elettronica e studi di diffrazione dei
raggi X.
Le catene polipeptidiche che costituiscono il capside
sono disposte in modo simmetrico e la morfologia
risultante del virione è variabile:
rotondeggiante, allungata (a bastoncino), complessa,
pleiomorfa.
Morfologia di vari gruppi di virus
Simmetria elicoidale
capside cilindrico spiraliforme, capsomeri = protomeri;
spire successive sfalsate → maggiore stabilità;
asse di simmetria rotatoria centrale
Tutti i protomeri sono identici e si susseguono l’uno all’altro disponendosi
in modo elicoidale intorno all’asse centrale, formando legami ognuno con
altri 2 protomeri; questo conferisce alla struttura estrema stabilità. I
protomeri vengono prima montati a formare dischi (a destra) che vengono
progressivamente aggiunti durante la formazione del capside. L’acido
nucleico si trova all’interno del cilindro cavo, avvolto in modo elicoidale a
stretto contatto con la superficie interna del capside.
Simmetria del capside: elicoidale
Virus del mosaico del tabacco (elicoidale nudo). Sin.:
rappresentazione schematica di un segmento del virus in cui si
vedono i protomeri e nella parte alta (dove i protomeri sono
stati omessi) l’acido nucleico (RNA); Dx: fotografia al M.E.
Simmetria icosaedrica
Icosaedro: poliedro regolare (12 vertici, 20 facce
costituite da triangoli equilateri, 30 spigoli)
Nei virus a simmetria icosaedrica, i protomeri sono
organizzati in pentoni (ai vertici, sempre 12) e, nei
virus più grandi anche in
esoni (su facce e spigoli) legati da legami non covalenti,
il cui numero varia a seconda dei virus
(20, 60, 150 o 240)
L’icosaedro presenta tre assi di simmetria:
asse di simmetria 2 che passa attraverso il centro degli spigoli,
asse di simmetria 3 che passa attraverso il centro delle facce,
asse di simmetria 3 che passa attraverso i vertici
(simmetria di tipo 3:5:2 o simmetria cubica)
Virus a simmetria icosaedrica
Assemblaggio del capside icosaedrico di un
picornavirus (12 pentoni)
Adenovirus (12 pentoni che si prolungano in
strutture fibrose e 240 esoni) Ö
Simmetria icosaedrica
A,B,C: icosaedro visto lungo i
3 assi di simmetria
D,E,F:
diversi
tipi
di
disposizione delle subunità che
costituiscono il capside
D) nei virus più piccoli
(poliovirus)
i
protomeri
possono formare dei trimeri;
E) nei virus di medie
dimensioni (es. Parvovirus) i
protomeri costituiscono 12
pentoni (sui vertici) e 20 esoni
(sulle facce);
F) nei virus più grandi i
protomeri costituiscono 12
pentoni (sui vertici) ed un
numero
variabile di esoni
(sulle facce e sugli spigoli), fino
a 252.
Simmetria complessa
Poxvirus
Fotografia al M.E.
(200.000 ×) di un poxvirus
Schema della struttura del virione dei Poxvirus
A: visto dall’esterno; B, C, D: in sezione lungo i 3 piani dello
spazio. La porzione centrale (core) biconcava, circondata da una
membrana interna (MI), contiene il DNA in una struttura
filamentosa centrale (FC); i 2 voluminosi corpi laterali (CL),
situati tra MI e la membrana esterna (ME) hanno funzione
ignota. L’intera superficie è avvolta da una struttura tubolare
superficiale (TS).
Simmetria del capside: combinata
Batteriofagi
Caratteristiche morfologiche dei
vari tipi di batteriofagi
A) coda contrattile, DNA
bicatenario (T2, T4);
B) coda lunga non contrattile,
DNA bicatenario (T1, λ);
C) coda corta non contrattile,
DNA bicatenario(T3);
D) coda assente, ampi
capsomeri, DNA a singola
catena (Φx 174);
E) coda assente, piccoli
capsomeri, RNA a singola
catena (MS2);
F) testa assente, filamentosi,
DNA a singola catena (M13)
Simmetria del capside: combinata
Batteriofagi della serie T
Fotografia al M.E. di
un batteriofago T4
Struttura del batteriofago T4
Testa icosaedrica, coda elicoidale
Fasi della moltiplicazione virale
Nella fase di parassitismo intracellulare il virus perde le
caratteristiche morfologiche della fase extracellulare
Acido nucleico e proteine strutturali della progenie virale
sono sintetizzati separatamente in un gran numero di copie,
poi assemblati in virioni maturi al termine del ciclo di
moltiplicazione
Il ciclo moltiplicativo si divide in 5 fasi
1. adsorbimento
2. penetrazione
3. esposizione dell'acido nucleico
4. sintesi dei componenti virali
5. assemblaggio e fuoriuscita dei virioni
dalla cellula infetta
Adsorbimento
Riconoscimento ed attacco del virus alla cellula ospite
Interazione stereochimica tra specifici gruppi chimici
esposti sulla superficie esterna della cellula suscettibile
(recettori) e del virione (antirecettori)
Il processo di adsorbimento richiede solo una
partecipazione passiva della cellula e si verifica anche a
basse temperature (4°C) mentre per il successivo processo
di penetrazione è necessario un certo grado di intervento
attivo della cellula ed è possibile solo a temperature ottimali.
Recettori
104 - 105 per singola cellula
pochi con funzione nota, complementari a molecole presenti sulla
superficie virale;
solitamente virus diversi usano recettori diversi, a volte virus
diversi usano gli stessi recettori (ad es. Adenovirus e
Coxsackievirus);
lo stesso virus usa recettori diversi su cellule diverse,
La presenza dei recettori determina il “tropismo” per
specifici tipi cellulari (es. specificità d'organo) e la
specificità d'ospite (uomo, animali, ecc.)
*Virus Epstein-Barr → linfociti B (recettore: CD21)
*HIV → linfociti T helper (recettore: CD4)
*Influenza A → acido sialico delle cellule epiteliali
*Virus della rabbia → recettori per l’acetilcolina
Antirecettori
componenti della superficie virale che si legano ai
recettori
proteine del capside o glicoproteine del peplos ripetute
numerose volte (ad es. virus influenzali → 800 molecole
per virione)
- a volte, proiezioni che sporgono dal virione
es. → HA dei virus influenzali e del morbillo
→ fibre degli Adenovirus
→ gp120 di HIV
- a volte, strutture superficiali non ben evidenti
es. → VP7 dei Rotavirus
→ VP1-VP2-VP3 dei Rinovirus
Penetrazione di virus privi di rivestimento
Micropinocitosi (adsorbimento endocitico, viropessi)
meccanismo più frequente: lo stesso che le cellule usano per
internalizzare sostanze corpuscolate al di sotto di 1 µm (introflessioni
della membrana rivestite di clatrina con successiva fusione con
lisosomi) (1);
in qualche caso entra solo l’acido nucleico (2)
Penetrazione di virus con rivestimento
1. Fusione
- lipidi e proteine del
peplos si fondono con
quelli della membrana
della cellula, il
nucleocapside viene a
trovarsi direttamente
nel citoplasma
(in alcuni virus una
specifica glicoproteina
F del peplos favorisce
la fusione)
2. Endocitosi
tutto il virus viene
inglobato in una
vescicola endosomica
Esposizione dell'acido nucleico
scapsidamento (uncoating) → eclissi
• destabilizzazione e disorganizzazione del virione con
l'adsorbimento
• perdita del peplos (durante la fusione)
• degradazione di proteine virioniche da parte di proteasi
citoplasmatiche
• intervento di enzimi scapsidanti virali (es. Poxvirus)
Sintesi dei componenti virali
Replicazione dell’acido nucleico
Sede intracellulare di replicazione:
- nucleo → deossiribovirus (utilizzano RNA polimerasi
DNA-dipendenti cellulari presenti nel nucleo), tranne
Poxvirus (che possiede una RNA-polimerasi DNAdipendente virus-specifica)
- citoplasma → ribovirus (con polarità positiva che
fungono da mRNA o a polarità negativa che utilizzano
RNA polimerasi RNA-dipendenti virali), tranne
Orthomixovirus e Retrovirus
Tutti i virus devono produrre mRNA per la sintesi di
proteine
Sintesi dei componenti virali
Strategie per la produzione di mRNA
Espressione del genoma virale
• sintesi delle proteine precoci, non strutturali:
- enzimi replicativi
- inibitori sintesi cellulari (Polio, Adeno, Herpes)
- stimolatori sintesi cellulari (virus oncògeni)
• replicazione dell'acido nucleico
(in modi diversi nelle diverse classi replicative)
• sintesi proteine tardive strutturali
(dopo la replicazione dell'acido nucleico)
Assemblaggio e fuoriuscita dei virioni
diverse strategie
Virus nudi: automontaggio del capside in sede citoplasmatica
o nucleare, dovuto alla natura dei capsomeri; legami non
covalenti tra i capsomeri
Schema dell’automontaggio di un Picornavirus
Viene prodotta una poliprotreina (protomero), clivata in 3
proteine (VP0, VP1, VP3) che si aggregano a formare il
procapside. Nel procapside entra una molecola di +RNA
(provirione); alcune proteine vengono ulteriormente
tagliate (maturazione → virione definitivo infettivo).
Assemblaggio e fuoriuscita dei virioni
Virus nudi
- Non è necessaria la preventiva presenza dell'acido nucleico
(virioni vuoti)
- L'incapsidamento dell'acido nucleico solitamente stabilizza
la struttura
- Maturazione: automontaggio e incapsidamento
Aggregati
paracristallini
(inclusioni)
inclusioni nucleari
(Adenovirus)
inclusioni citoplasmatiche
(Reovirus)
La liberazione del virus avviene in seguito a disgregazione cellulare:
lisi totale (es. Poliovirus) o parziale (es. Adenovirus) della cellula
Assemblaggio e fuoriuscita dei virioni
Virus con pericapside
- nucleocapside assemblato in modo analogo
- pericapside acquisito da membrane della cellula per gemmazione,
preceduta da una modificazione delle membrane cellulari
Schema della
modificazione
della membrana
cellulare con
inserimento di
glicoproteine e
proteine virali del
pericapside
Le proteine virali tendono ad aggregarsi,
escludendo proteine cellulari (4)
Assemblaggio e fuoriuscita dei virioni
Virus con pericapside - Gemmazione
A) Dopo l’automontaggio,
il nucleocapside si avvicina
alla membrana modificata;
B) Inizia il processo di
gemmazione;
C) Il virus fuoriesce
avvolgendosi in parte della
membrana modificata
(pericapside)
Herpesvirus: gemmazione attraverso la lamella interna della
membrana nucleare, uscita attraverso il reticolo endoplasmatico
Altri virus: gemmazione dalla membrana cellulare
- Alcuni virus sono citocidi (Paramyxo, Toga, Herpes)
- Altri sono liberati per lunghi periodi (Rabdo, Rosolia) o per
periodi indefiniti (Retrovirus)
Durata e cinetica del ciclo di
replicazione virale
Curva di un singolo ciclo di
replicazione di un virus
rilasciato con lisi cellulare
La durata del ciclo è variabile nei
diversi gruppi di virus, da poche
ore nei Picornavirus a diversi
giorni nei virus di maggiori
dimensioni
Numero di virioni prodotti/cellula:
104 - 105 nei virus litici
106 e più negli altri
Tipi di infezione virale a livello cellulare
Replicazione abortiva
In determinate condizioni i virus possono penetrare nelle cellule, esprimere
parte del proprio genoma e produrre parte delle proprie macromolecole, ma
non riescono a dare origine a nuovi virioni infettanti
Virus normale - cellula restrittiva
(Cellule permissive, semipermissive, restrittive)
Virus defettivo - cellula normale (Virus helper → satellitismo virale)
es.
- virus sarcoma di Rous del pollo (deriva pericapside da altri retrovirus)
- parvovirus adeno-associati
- viroide epatite D, dipendente da virus epatite B (capside)
Interferenza virale
Fenomeno attraverso il quale un virus può impedire o ridurre la replicazione
di un altro virus nelle stesse cellule o nello stesso organismo
3 meccanismi possibili:
- Competizione per i recettori cellulari
Recettori cellulari bloccati da anti-recettori prodotti in eccesso
- Competizione per eventi biochimici intracellulari
Apparati biosintetici cellulari impegnati da un virus, non disponibili
(particelle defettive interferenti)
- Produzione di interferone
Meccanismo più importante di interferenza
Glicoproteine a basso P.M. (20.000 - 40.000 daltons) prodotte dalle
cellule in seguito a diversi stimoli (tra cui l'infezione virale), ad attività
antivirale e antineoplastica
Interferoni α e β:
- prodotti da leucociti e fibroblasti
- attivi su cellule infettate da virus o tumorali
- inducono stato antivirale e attivazione cellule NK
→ specie - specifici, ma non virus - specifici
- prodotto da linfociti TH1 e cellule NK
Interferone γ:
- attivo su macrofagi e linfociti T
- attivazione macrofagi - risposta immunitaria cellulo-mediata
Meccanismo d’azione antivirale
dell’interferone
Il virus infettante si replica (1) ed
induce la cellula infetta ad attivare il
gene per l’interferone (2, 3, 4)
Induzione
induttori → RNA bicatenari
(intermedi replicativi virali)
Meccanismo d’azione
l’interferone viene secreto e si
lega a recettori specifici sulle
cellule vicine (5), inducendo la
sintesi (6, 7, 8) di due enzimi
antivirali:
protein chinasi → fosforilazione
di EF-2 (fattore di innesco della
S.P.) con perdita della attività
oligoadenilato sintetasi (2'-5'
(A)n sintetasi) → sintesi di acido
2'-5'- oligoadenilico, nucleotide che
attiva una ribonucleasi che
degrada gli mRNA virali (RNAsi L)
I due enzimi bloccano la sintesi
proteica e degradano gli mRNA
virali (9)
Gli stadi
dell’infezione
virale
nell’organismo
Alcuni esempi
di malattie
sostenute da
virus
Patogenicità dei virus:
danno cellulare
Infezioni localizzate o
sistemiche
acute, croniche
(virus lenti o oncògeni)
o latenti (recidive)
Virus teratogeni
(infezioni del feto e
malformazioni)
principalmente,
Citomegalovirus e
virus della rosolia
Modalità di trasmissione dell’infezione virale
Classificazione dei virus
Struttura
dimensioni, morfologia e tipo di acido nucleico
es. picornavirus [piccolo RNA], togavirus [mantello]
Tipo di replicazione
(es. replicazione nucleare o citoplasmatica)
Cellula ospite (spettro d’ospite)
animali (uomo compreso), piante, funghi, batteri
Tropismo di tessuto od organo
es. enterovirus, adenovirus
Malattia sostenuta
es. encefaliti, epatiti, ecc.
Tipo di trasmissione
es. arbovirus diffusi dagli insetti
Sensibilità dei virus ad agenti chimici e fisici
Preparazione di vaccini, prevenzione della diffusione dei virus
Agenti chimici
- Solventi dei lipidi (etere, cloroformio, detergenti anionici): virus con peplos
- Fenolo: inattiva le proteine del capside e peplos (disinfettanti)
- Formaldeide: inattiva acidi nucleici e proteine, senza alterarne le proprietà
antigeniche (preparazione di vaccini)
- Alcool isopropilico, etilico, iodofori, ipoclorito di sodio, glutaraldeide 2%
- Fotoinattivazione: alcuni coloranti (rosso neutro, proflavina, blu di
toluidina) possono penetrare nel capside, legarsi all'acido nucleico; in presenza
di luce → fotoossidazione
Virus + resistenti: Enterovirus (clorazione delle acque) e virus dell'epatite B
Agenti fisici
- Temperatura:
- Radiazioni:
conservati a basse temperature
inattivati a 50-70°C
metodi di sterilizzazione (autoclave e stufa) efficaci
raggi X e gamma (ionizzanti) → rottura dell'acido nucleico
UV (non ionizzanti) → dimeri di timina o di uracile
Metodi di coltivazione dei virus animali
Coltivazione indispensabile per la diagnosi di laboratorio, la
preparazione di vaccini e a scopo sperimentale
Cellule viventi: colture cellulari, uova embrionate o
animali (utilizzati per la produzione di antisieri, studi
sull'azione patogena, studi su vaccini e sostanze antivirali)
Colture cellulari
- Colture primarie, derivate da tessuti o organi animali
(massimo 50 subcolture, diploidi)
- Colture secondarie, derivate da primarie
- Fibroblasti (cellule embrionali, diploidi; oltre 100 subcolture)
- Cellule in linea continua, trasformate o tumorali
(spesso aneuploidi o poliploidi)
Colture cellulari
Effetti citopatici
- Comparsa di inclusioni citoplasmatiche e/o nucleari
- Comparsa di modificazioni morfologiche evidenti
- necrosi e lisi (Picornavirus e Togavirus)
- sincizi, megacariociti (Paramyxovirus,
Herpesvirus)
- foci di cellule arrotondate (Citomegalovirus)
- Comparsa di nuovi antigeni virus-indotti:
- Emoadsorbimento
- Immunofluorescenza
Effetti citopatici da virus
sincizio (virus del morbillo)
cellule giganti multinucleate (freccia)
cellule Vero (linea continua) non infettate
effetto litico su cellule Vero (Poliovirus)
effetto litico su cellule Vero (Enterovirus)
Effetti citopatici da virus
fibroblasti umani non infetti
effetto litico su fibroblasti umani
immunofluorescenza citoplasmatica (Rotavirus)
Effetti citopatici da virus
immunofluorescenza nucleare
cellule infettate e trattate con anticorpi
marcati con perossidasi:
immunofluorescenza nucleare e citoplasmatica localizzazione
nucleare degli antigeni virali
Uovo embrionato
Annessi embrionali
Inoculazione in:
A) membrana
corionallantoidea
(MCA)
(Pox, alcuni Herpes)
B) cavità allantoidea
(virus influenzali:
preparazione vaccino)
C) cavità amniotica
(virus influenzali:
preparazione vaccino)
D) sacco vitellino











![Lezione 15 Virus [modalità compatibilità]](http://s1.studylibit.com/store/data/000771737_1-84b1cca561c5813066d1b76125338a98-300x300.png)