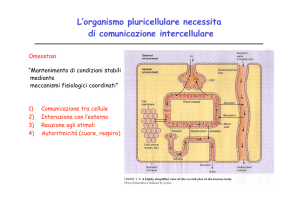
I sistemi sensoriali
Come funzionano i nostri sistemi sensoriali?
Come vengono ricosciuti gli stimoli iniziali?
In che modo questi processi sono trasformati in
percezioni e esperienze?
Principali sistemi sensoriali presenti negli esseri umani e
negli altri mammiferi
1) Olfatto:
il senso dell’odorato, capacità di
individuare piccole molecole nell’aria
2) Gusto:
riconoscimento di composti organici e ioni da
parte della lingua
3) Vista:
percezione della luce
4) Udito:
percezione dei suoni o delle onde di
pressione dell’aria
5) Tatto:
percezione delle variazioni di pressione,
temperatura e altri fattori da parte della pelle
La percezione sensoriale usa meccanismi tipici della
trasduzione del segnale
Es.:
Recettoti 7TM: olfatto, gusto e vista
Canali ionici sensibili alle sollecitazioni meccaniche:
udito e tatto
Connessioni sensoriali al cervello
Ogni
sistema
sensoriale
comprende neuroni sensoriali
specializzati che trasmettono
gli impulsi nervosi al sistema
nervoso centrale
L’olfatto percepisce una grande varietà di composti
organici
Sostanze odorose: piccole molecole organiche con una volatilità sufficiente per
essere trasportate sotto forma di vapori
Quale caratteristica di una molecola determina
il suo odore?
La forma
L’odore di una molecola dipende dall’interazione
con un recettore specifico di natura proteica
Alcune persone sono incapaci di percepire
l’odore di alcuni particolari composti (anosmia
specifica).
In questi soggetti sono state riscontrate
mutazioni specifiche in alcuni geni che
codificano per singoli recettori del gusto
Gli odori vengono percepiti in una specifica regione del
naso detta epitelio olfattivo principale
I neuroni sensoriali dell’epitelio olfattivo principale (circa 1 x 106) possiedono
ciglia contenenti i recettori proteici che legano i composti odorosi
Gli impulsi nervosi generati dal legame delle molecole odoranti ai recettori
sono trasmessi dai neuroni sensoriali al bulbo olfattivo.
.. un po’ di storia sugli studi che hanno portato
all’identificazione dei recettori per l’olfatto.
Fine ‘80: l’esposizione agli odori causa un aumento di
AMPc osservabile solo in presenza di GTP
Ipotesi: E’ coinvolta una proteina G e quindi un
recettore 7TM
Randall Reed purifica e clona la subunità α di una
proteina G trimerica, detta G(olf), espressa
unicamente nelle ciglia olfattive.
Strategia per identificare i cDNA dei recettori:
1) I cDNA dovevano essere espressi nei neuroni sensoriali
che rivestono l’epitelio nasale
2) Dovevano codificare per 7TM
3) Dovevano essere presenti sotto forma di una famiglia
numerosa e diversificata
Utilizzando questi
hanno identificato
criteri nel 1991 Richard Axel e Linda Buck
i cDNA dei recettori olfattivi del ratto
I recettori dell’olfatto (OR) costituiscono una vasta
famiglia di recettori a 7 eliche transmembrana
Nel topo e nel ratto sono presenti più di 1000 geni OR
Il genoma umano codifica un numero di OR stimato tra 500 e
750 molti dei quali sono pseudogeni
Evoluzione dei recettori olfattivi
( ) percentuale di OR
ancora funzionanti
Apparentemente nel corso dell’evoluzione i mammiferi superiori (in
particolare i primati) hanno perduto sensibilità agli odori (gli OR
hanno perso funzionalità tramite trasformazione in pseudogeni)
perché sono diventati meno dipendenti da questo senso per la
sopravvivenza
Regioni costanti (blu) e variabili (rosso) nei recettori
olfattivi
Le eliche transmembrana 4 e 5 potrebbero rappresentare il sito di
legame dei composti odorosi
Ogni neurone olfattivo esprime solo un singolo gene OR
tra le centinaia disponibili.
Uno solo dei due alleli del gene attivo è espresso
(allelic exclusion)
La determinazione di quale gene (e poi di quale
allele) debba essere espresso è in gran parte
casuale e il meccanismo che blocca l’espressione di
tutti gli altri geni OR deve essere ancora chiarito.
Il legame di un composto odoroso a un OR sulla
superficie del neurone innesca una cascata di
trasduzione del segnale che determina un potenziale
d’azione
Gli odori sono decodificati da un meccanismo
combinatorio
E’ possibile associare a ciascun OR la o le
molecole odorose alle quali si lega? (a)
Primi studi:
Sovraespimendo un gene per uno specifico OR in un ratto è
stato possibile determinare che tale recettore legava aldeidi
a catena lineare (n-ottanale > n -eptanale > n -esanale)
E’ possibile associare a ciascun OR la o le
molecole odorose alle quali si lega? (b)
Sezione di epitelio nasale di topo trattato con Fura-2
(fluoroforo sensibile al Ca2+) e quindi esposto a quantità note
di diversi composti odorosi.
Se il composto odoroso si lega a un OR, induce
depolarizzazione del neurone e il neurone può essere
individuato al microscopio in quanto la cellula diventa
fluorescente per l’ingresso di Ca2+
E’ possibile associare a ciascun OR la o le
molecole odorose alle quali si lega? (c)
Per identificare quale OR determina la risposta,
a) si producono i cDNA a partire dall’mRNA isolato dai
singoli neuroni attivati;
b) I cDNA sono amplificati mediante PCR con primers che
amplificano tutti i geni OR;
c) I prodotti di PCR derivati da ogni neurone vengono
sequenziati
Con questo metodo sono state analizzate le risposte dei neuroni a
una serie di composti con catene carboniose di diversa
lunghezza e con diversi gruppi funzionali alle estremità
I risultati sono sorprendenti…..
Non esiste una semplice corrispondenza tra
odore e recettore!
Quasi ogni odore attiva un certo
numero di recettori (di solito in
diversa misura);
quasi ogni recettore è attivato
da più di un odore.
Ogni composto odoroso però
attiva una combinazione unica e
caratteristica di neuroni!
Questo meccanismo combinatorio
permette anche a una ristretta
gamma di recettori di distinguere
un numero elevato di odori
Come viene trasmessa al cervello l’informazione
su quali recettori sono attivati?
Sono stati ottenuti topi transgenici che esprimono un gene per un
marcatore colorato (LacZ) in associazione con uno specifico
gene OR.
I recettori che esprimono la combinazione OR-marcatore possono
essere identificati e il loro percorso può essere ricostruito.
In
tutti
i
topi
prolungamenti
dei
esprimono lo stesso
riunivano nella stessa
bulbo olfattivo
esaminati
i
neuroni
che
gene OR si
posizione nel
I neuroni che esprimono determinati
OR sono collegati a siti specifici nel
cervello e pertanto è possibile
generare
una
mappa
spaziale
dell’attività neurale di risposta agli
odori all’interno del bulbo olfattivo.
Epitelio olfattivo e neuroni olfattivi
Sezione
trasversale
dei
bulbi
olfattivi
destro
e
sinistro
colorati per LacZ. Gli
assoni di tutti i
neuroni che esprimono
lo stesso recettore
convergono
sugli
stessi glomeruli
Un naso elettronico funziona sugli stessi principi
I recettori, in questo caso, sono
polimeri che si legano a una certa
gamma di piccole molecole.
Ogni polimero lega ogni composto ma
in quantità diverse; le proprietà
elettriche del polimero cambiano con il
legame del composto odoroso.
Una serie di 32 di questi sensori
polimerici, collegati tra loro in modo
da individuare gli schemi di risposta,
permette di individuare sia odoranti
singoli che miscele complesse
La risonanza magnetica funzionale per immagini
(fMRI) rivela quali regioni del cervello
elaborano le informazioni sensoriali
La risonanza magnetica funzionale per immagini
(fMRI)
La tecnica si basa su due osservazioni fondamentali:
a) Una specifica area del cervello è maggiormente irrorata dal
sangue quando è attiva (+ emoglobina in quella regione)
b) A causa delle riorganizzazioni elettroniche intorno all’atomo di
Fe2+ in seguito al legame dell’O2 il Fe2+ della deossiemoglobina ha
caratteristiche magnetiche diverse dal Fe2+ della ossiemoglobina.
In particolare l’atomo di ferro nella deossiemoglobina agisce da
potente magnete, mentre nell’ossiemoglobina no.
Queste differenze tra le proprietà magnetiche delle due forme di
emoglobina possono essere utilizzate per visualizzare l’irrorazione e
quindi l’attività del cervello.
La risonanza magnetica funzionale per immagini
(fMRI)
Le tecniche di risonanza magnetica nucleare individuano i segnali
che si originano dai protoni delle molecole d’acqua.
I segnali dei protoni dell’acqua vengono alterati dalle proprietà
magnetiche dell’emoglobina.
E’ possibile produrre immagini che rivelano le differenze nelle
quantità relative di deossiemoglobina e ossiemoglobina, e quindi
l’attività di diverse parti del cervello
La risonanza magnetica funzionale per immagini
permette di evidenziare le aree del cervello che si
attivano in risposta ai diversi composti odorosi e di
ricostruire la sequenza temporale di attivazione di
particolari regioni
Il gusto
Una congestione nasale riduce il senso dell’olfatto e anche la
capacità di sentire il sapore del cibo.
L’olfatto aumenta la nostra percezione dei sapori (gusto)
I due sensi presentano tuttavia molte differenze:
a) Il gusto ci permette di riconoscere composti
distinguiamo tramite l’olfatto (es.: sale, zucchero).
che
non
b) Possiamo distinguere migliaia di odori mentre la capacità di
sitinguere i sapori è molto minore
I cinque gusti fondamentali
Amaro
Dolce
Acido
Salato
Umami
(il sapore del glutammato, in giapponese “squisitezza”)
I cinque gusti fondamentali
Amaro
Acido
Composti potenzialmente dannosi o tossici
Dolce
Salato
Umami
Composti potenzialmente nutrienti
Le molecole che costituiscono i gruppi fondamentali
riconosciuti dal gusto sono chimicamente molto
diverse tra loro
Ione idrogeno = acido
Ione sodio = salato
Glutammato = umami
I sapori percepiti come amari o dolci hanno strutture estremamente
variabili
Composti con sapore dolce
Le diversità di specificità tra i cinque sapori sono dovute ai
diversi meccanismi biochimici coinvolti
I sapori vengono percepiti da strutture
specializzate dette bottoni gustativi
Le papille gustative contengono numerosi bottoni gustativi
L’identificazione di una subunità α di una proteina G
trimerica espressa nei bottoni gustativi, la
gustducina, suggerì il coinvolgimento di recettori
7TM nella percezione del dolce e dell’amaro
Sezione di lingua marcata
con anticorpi fluorescenti
che riconoscono i bottoni
gustativi
Stessa sezione marcata con
anticorpi specifici per la
gustducina
Confrontando marcatori di DNA in soggetti con diversa sensibilità
al composto amaro
I ricercatori hanno mappato il gene che codifica per il recettore di
questo composto in una regione del cromosoma 5
Il Progetto Genoma umano ha chiarito che in questa regione esiste
un gene che codifica per un 7TM che fu chiamato T2R-1
L’intero genoma umano codifica per 50-100 membri
della famiglia dei recettori 7TM dell’amaro
Regioni costanti (blu) e variabili (rosso)
nei recettori del sapore amaro
I recettori identificati sono davvero recettori
dell’amaro?
Prove a favore:
a) I geni che li codificano sono espressi nelle cellule sensoriali del
gusto, lì dove è espressa la gustducina.
b) Cellule che esprimono singoli membri di questa famiglia
rispondono a composti specifici.
Esempio.
Cellule che esprimono mT2R-5 reagiscono se esposte alla
cicloesimide.
Topi insensibili alla cicloesimide presentano una mutazione
puntiforme nel gene che codifica il recettore mT2R-5.
c) La cicloesimide stimola specificamente il legame di analoghi del
GTP alla gustducina, in presenza del recettore mT2R-5
Ogni cellula che funziona da recettore gustativo
esprime molti membri della famiglia delle
proteine T2R
•
Siamo
in
grado
di
distinguere odori lievemente
diversi tra loro perché ogni
composto odoroso attiva un
gruppo esclusivo di neuroni.
•
Molti
tipi
di
sapore
stimolano gli stessi neuroni,
e pertanto noi percepiamo
unicamente il sapore amaro
e non distinguiamo per
esempio la cicloesimide dal
chinino.
Una famiglia di recettori 7TM risponde ai
composti dolci
Prove a favore:
a) I composti dolci presentano una grossa variabilità strutturale
b) I topi in cui il gene per la gustducina è modificato perdono gran
parte della capacità di percepire sia il sapore dolce che il
sapore amaro.
c) Recentemente è stato identificato un piccolo gruppo di recettori
7TM che risponde ai composti dolci.
Non è chiara la ragione biochimica di questa osservazione ma, per il
riconoscimentom dei composti dolci è necessaria l’espressione
simultanea di due membri di questa famiglia nella stessa cellula.
I sapori salati vengono identificati
prevalentemente tramite il passaggio di
ioni sodio attraverso canali.
L’amiloride è un composto che attenua il gusto di sale
Canali per il sodio sensibili all’amiloride sono responsabili della
percezione del sapore salato
Gli ioni sodio che passano attraverso questi canali producono una
significativa corrente transmembrana.
L’amiloride interrompe il passaggio della corrente; ciò spiega
l’effetto di questo composto sul gusto.
Il 20% della risposta al sodio permane in presenza di amiloride,
suggerendo che esistano altri canali ionici che contribuiscobno
alla percezione del sale.
Schema della struttura di 1 delle 4 subunità che
costituiscono i canali del sodio sensibili all’amiloride
I sapori acidi sono prodotti dagli effetti degli
ioni idrogeno sui canali
•
Come quelli salati anche i sapori acidi sono identificati tramite
interazioni dirette con i canali ionici. Gli ioni che entrano sono ioni
idrogeno.
•
In assenza di alte concentrazioni di sodio, gli ioni idrogeno
possono attraversare i canali del sodio sensibili all’anmiloride e
produrre una corrente transmembrana
•
Gli ioni idrogeno non sono percepiti solo per il passaggio diretto
attraverso la membrana ma possono anche attivare o bloccare
altri canali (es. blocco canali K+).
•
L’effetto complessivo è quello di indurre una variazione della
polarizzazione della membrana nei neuroni sensori che viene
percepita come una sensazione di sapore acido
L’umami, il sapore del glutammato, è percepito
da un tipo specializzato di recettori del
glutammato
•
Il
glutammato
è
ampiamente
dal
organismo,
anche
neurotrasmettitore.
usato
nostro
come
•
Esistono
diverse
classi
di
recettori per il glutammato. Una
di tali classi è costituita dai
recettori
metabotropici,
proteine 7TM, con grandi domini
amminoterminali
probabilmente
responsabili del legame del
glutammato
Il gusto dell’’umami
•
Il gene che codifica per un
recettore
metabotropico
del
glutammato, mGluR4, è espresso nei
bottoni gustativi.
•
Questa molecola è priva della
regione che codifica i primi 309 aa
dell’mGluR4
cerebrale,
che
comprende la maggior parte del
dominio ad alta affinità per il
glutammato, e pertanto mostra una
ridotta affinità per Glu, adeguata
ai livelli dell’aa nella dieta
Il recettore responsabile della percezione del sapore del Glu
sembra essersi evoluto modificando l’espressione di un gene per
il recettore del Glu già esistente.
La vista
La vista è basata sull’assorbimento della luce da parte di cellule
fotorecettrici dell’occhio
Queste cellule sono sensibili alla luce in una regione relativamente
ristretta dello spettro elettromagnetico, cioè quella con lunghezza
d’onda compresa tra 300 e 850 nm
Le cellule fotorecettrici
I vertebrati hanno due tipi di cellule fotorecettrici, i coni e i
bastoncelli (nella retina umana 3x106 coni e 1 x 108 bastoncelli).
I coni funzionano alla luce intensa e sono responsabili della
percezione dei colori, i bastoncelli funzionano con luce debole, ma
non percepiscono i colori.
Un bastoncello è sensibile a un singolo fotone e al cervello servono
meno di 10 stimoli per registrare un lampo di luce….
I bastoncelli sono strutture sottili e allungate.
Il segmento più esterno dei bastoncelli è specializzato per la
fotorecezione e contiene in sacchi avvolti da membrana detti dischi
le molecole fotorecettrici.
Nei bastoncelli la molecola fotorecettrice è la rodopsina
La rodopsina è formata dalla proteina opsina, un
membro della famiglia dei recettori 7TM, legata al
gruppo prostetico 11-cis retinale
Il massimo di assorbimento della rodopsina è incentrato
sui 500 nm
La rodopsina assorbe la luce in modo molto efficiente
nella parte centrale dello spettro visibile!
Il colore della rodopsina e la sua reattività alla luce
dipendono dalla presenza dell’11-cis-retinale
L’ 11-cis retinale essendo un poliene, è un potente
fotorecettore; i sui legami singoli e doppi alternati
costituiscono una lunga rete elettronica insatura che
conferisce alla molecola capacità cromofore
Il gruppo aldeidico dell’11-cis-retinale forma una base
di Shiff con il gruppo ε amminico della lisina 296
(7 elica TM) della opsina
L’ 11-cis retinale libero assorbe a 370 nm
La base di Shiff non protonata assorbe a 380 nm
La base di Shiff protonata a 440 nm.
•
•
Il massimo di assorbimento della rodopsina intorno a 500 nm indica
che il retinale sia presente sotto forma di base di Shiff protonata.
Altre interazioni con la proteina (es. interazioni ioniche con residuo di
Glu vicino) spostano ulteriormente il massimo di assorbimento
L’assorbimento della luce induce una isomerizzazione
dell’11-cis-retinale in tutto-trans-retinale
L’ isomerizzazione causa uno spostamento dell’atomo di azoto della base di
Schiff di circa 5 Å.
L’energia luminosa di un fotone è trasformata in movimento atomico
La
trasformazione
della
rodopsina in matarodopsina II,
in cui il retinale è nella
configurazione tutto trans e la
base di Shiff è deprotonata,
attiva
un
processo
di
trasduzione
del
segnale,
analogo a quello indotto dal
legame di un ligando a altri
recettori 7TM.
Come altri recettori 7TM
attivati, la rodopsina attiva una
proteina G eterotrimerica detta
transducina.
Trasduzione del segnale visivo
La subunità α della
trasducina attiva una
cGMP
fosfodiesterasi
rimuovendo una subunità
inibitrice.
La diminuzione della
concentrazione del
cGMP provoca la
chiusura dei canali
ionici controllati dal
cGMP,
iperpolarizzazione
della membrana e
segnale nervoso.
L’assorbimento di un singolo fotone è amplificato in
modo da portare a un’iperpolarizzazione della
membrana sufficiente a generare la trasmissione
del segnale
La capacità della nostra vista di percerire movimenti
continui a circa 1000 fotogrammi al secondo è
dovuta:
a) Alla capacità del sistema visivo di rispondere in
pochi millisecondi a variazioni di luce e colore
b) Alla capacità di bloccare altrettanto velocemente
il segnale e di far tornare il sistema allo stato
iniziale.
Veloce blocco del segnale visivo
X
Una serina/treonina chinasi
fosforila
la
rodopsina
attivata. La fosforilazione
favorice il legame di una
proteina
(arrestina)
che
impedisce
ulteriori
interazioni con la trasducina
X
La subunità α
della trasducina
è
dotata
di
attività
GTPasica;
la
fosfodiesterasi
è inattivata
Il livello di cGMP
deve
essere
aumentato
per
riaprire
i
canali
ionici dipendenti dal
cGMP.
Attivazione
Guanilato ciclasi
L’abbassamento del livello di calcio coordina il ritorno allo stato
iniziale
Lo ione Ca2+ regola la guanilato ciclasi inibendone l’attività
Al buio Ca2+ e Na+ entrano nei bastoncelli attraverso i canali
controllati dal cGMP
Uno scambiatore (4Na+Ð 1K+Ï dipendente) espelle lo ione Ca2+
bilanciando l’influsso.
In seguito allo stimolo luminoso l’ingresso di Ca2+ attraverso i canali
controllati da cGMP si ferma, ma l’efflusso attraverso lo scambiatore
continua.
La visione dei colori è realizzata da 3 recettori dei coni,
omologhi alla rodopsina
Come la rodopsina, le proteine fotorecettrici dei coni sono membri
della famiglia dei recettori 7TM e utilizzano l’11-cis-retinale come
cromoforo.
Nell’uomo esistono 3 diversi fotorecettori proteici con assorbimanto
massimo a 426, 530 e 560 nm
Questi valori corrispondono alle regioni blu, verde e rossa dello
spettro
Sequenze dei pigmenti visivi
Analisi delle sequenze dei fotorecettori:
•Ognuno dei fotorecettori dei coni ha una sequenza identica per il
40% a quella della rodopsina.
•Il fotorecettore del blu è per il 40% identico ai fotorecettori del
verde e del rosso.
•I fotorecettori del verde e del rosso sono identici tra loro per più
del 95%
•I fotorecettori del verde e del rosso sono derivati da un processo
evolutivo recente.
Confronto tra le sequenze amminoacidiche dei fotorecettori del
verde e del rosso
= aa identici
= aa aa diversi
= 3 aa diversi responsabili delle
differenze negli spettri di assorbimento
Le principali differenze tra i pigmenti verde e rosso di incontrano a
livello di 3 residui (180, 277 e 285).
Nel pigmento verde: Ala, Phe, Ala; nel rosso, Ser, Tyr, Thr.
I gruppi -OH aggiunti a ciascun aa nel pigmento rosso reagiscono con
lo stato fotoeccitato del retinale abbassando la sua energia e
spostando lo spettro di assorbimento della luce verso la regione del
rosso a minore energia.
Evoluzione dei pigmenti visivi
Nella linea evolutiva dei primati i pigmenti rosso e verde si sono
evoluti circa 35 milioni di anni fa.
I mammiferi come i cani e i topi che si sono separati dai primati in
precedenza hanno solo 2 fotorecettori , per il verde e per il blu (non
distinguono bene i colori!)
Gli uccelli, invece, hanno 6 pigmenti diversi e pertanto hanno una
percezione dei colori molto acuta.
Riarrangementi genici tra i geni per i pigmenti verde
e rosso provocano la “cecità ai colori”
I geni per i pigmenti verde e rosso sono adiacenti l’uno all’altro nel
cromosoma X umano e sono altamente omologhi.
Sono possibili eventi di ricombinazione omologa ineguale tra queste
regioni cromosomiche
Eventi di ricombinazione che determinano la “cecità ai
colori”
Se l’evento di ricombinazione avviene tra geni uno dei cromosomi
perderà un gene mentre l’altro acquisterà un gene.
In accordo con questa ipotesi: 2% dei cromosomi umani X porta un
unico gene per un pigmento, il 20% ne portano 2, il 50% 3, il 20% 4,
e il 5% di più.
Una persona priva del gene per il pigmento verde avrà problemi a
distinguere il rosso e il verde: la forma più comune di cecità ai
colori.
Eventi di ricombinazione che determinano la “cecità ai
colori”
Se l’evento di ricombinazione avviene all’interno dei geni si generano
geni che codificano ibridi dei recettori del verde e del rosso.
Il massimo di assorbimento dei pigmenti ibridi è intermedio tra quello
dei pigmenti rosso e verde. La regione C-terminale di un recettore
contiene gli aa più importanti per lo spettro di assorbimento del
fotorecettore
Una persona con questi geni ibridi e priva dei geni normali non è
spesso in grado di distinguere chiaramente i colori.