Introduzione
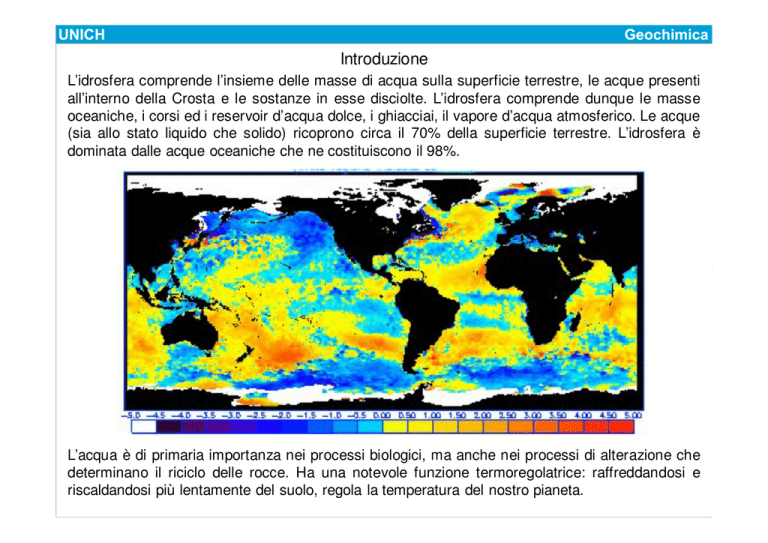
L’idrosfera comprende l’insieme delle masse di acqua sulla superficie terrestre, le acque presenti
all’interno della Crosta e le sostanze in esse disciolte. L’idrosfera comprende dunque le masse
oceaniche, i corsi ed i reservoir d’acqua dolce, i ghiacciai, il vapore d’acqua atmosferico. Le acque
(sia allo stato liquido che solido) ricoprono circa il 70% della superficie terrestre. L’idrosfera è
dominata dalle acque oceaniche che ne costituiscono il 98%.
L’acqua è di primaria importanza nei processi biologici, ma anche nei processi di alterazione che
determinano il riciclo delle rocce. Ha una notevole funzione termoregolatrice: raffreddandosi e
riscaldandosi più lentamente del suolo, regola la temperatura del nostro pianeta.
PROPRIETÀ CHIMICO FISICHE DELL’ACQUA
L’acqua è presente sulla Terra allo stato solido, liquido e vapore. Le trasformazioni da una forma
all’altra è chiamato passaggio di stato. L’acqua è l’unica sostanza in cui il lo stato solido è meno
denso dello stato liquido: infatti il ghiaccio galleggia sull’acqua liquida. La densità massima
dell'acqua è raggiunta a 4 °C, perché il volume molare dell'acqua aumenta all'abbassarsi della
temperatura, con conseguente diminuzione della densità. La sua molecola ha proprietà inusuali
quando si confrontano con quelle di molecole simili in struttura o dimensione come NH3, HF or
H2S:
•
•
•
•
punto di ebollizione più alto
punto di fusione più alto
tensione superficiale più elevata
più alto calore di vaporizzazione
Tutte queste proprietà indicano che le interazioni tra le singole molecole d'acqua devono essere
insolitamente più forti. Le eccezionali proprietà chimico-fisiche e la maggior parte di quelle
chimiche dell'acqua sono legate alla sua polarità elettrica e alla possibilità di formare legami a
idrogeno intermolecolari.
STRUTTURA DELL’ACQUA E LEGAME AD IDROGENO
La molecola H2O ha una struttura tetraedrica, l'angolo di legame della
molecola d'acqua è di 104,5°, che determina un’asimmetria nella
distribuzione di cariche elettriche, per la differenza di elettronegatività
tra H ed O. Questo conferisce una forte caratteristica ionica al legame
OH che comporta a sua volta un momento di dipolo elevato. La
molecola d'acqua è una molecola fortemente polare.
Le proprietà uniche dell'acqua si originano dalle interazioni tra
l'H di una molecola e il doppietto solitario di elettroni di un'altra
molecola d'acqua. Questa interazione è chiamata legame ad
idrogeno. Queste interazioni possono originarsi in tutte le
molecole in cui sia presente un H su un gruppo donatore (-OH o –N-H) ed un doppietto solitario su un gruppo accettore
(O=C, O-H). L’importante è che nel gruppo donatore ci sia
un'appropriata differenza di elettronegatività. L'energia di un
legame ad idrogeno è dell'ordine di 20 kJ/mol mentre quella di
un legame O-H è 460 kJ/mol. A causa della sua polarità
l'acqua da buone interazioni con gli ioni, rendendola un buon
solvente.
DIAGRAMMA DI STATO DELL’ACQUA
Le condizioni di temperatura e
pressione in cui le fasi solida, liquida e
gassosa di una sostanza esistono
contemporaneamente in equilibrio tra
loro è detta PUNTO TRIPLO (T). Per
l'acqua il punto triplo viene usato come
riferimento di temperatura, avendo
fissato per convenzione che questi è a
273,16 K (ossia 0,0075 °C); la
pressione al punto triplo dell'acqua è di
611,2 Pa, (0,006 atm; 4,58 mmHg)
valore molto basso, se si considera
che al livello del mare la pressione
atmosferica vale mediamente 101.300
Pa (1 atm; 760 mmHg). Nel
diagramma sono riportati i punti di
ebollizione (E) e di fusione (F) a livello
del mare (1 atm).
Diagramma di stato dell’acqua
Da notare che il la temperatura di
fusione dell’acqua (stato solido
liquido) diminuisce con la pressione.
CICLO IDROGEOLOGICO
ACQUA OCEANICA
Gli oceani sono il maggior reservoir d’acqua, la massa degli oceani seppur grande rappresenta solo il 0.02% della massa terrestre.
La temperatura, densità e salinità sono i parametri
fondamentali nello studio e descrizione delle acque oceaniche.
La temperatura superficiale degli oceani varia in maniera irregolare poiché
dipende dalla latitudine, dalla prossimità ai continenti, dalle correnti superficiali.
La temperatura varia con la profondità come illustrato in figura 1:
lo strato superficiale (100 m) presenta una temperatura costante, e risente
solo di variazioni stagionali. Segue uno strato, termoclino, ove la temperatura
diminuisce bruscamente fino ad una profondità di circa 1000 m. A profondità
maggiori diminuisce solo leggermente nello strato omotermico profondo.
Temperatura superficiale: 26-30 maggio 2006
Figura 1
ACQUA OCEANICA
La salinità esprime il peso in grammi dei sali disciolti in un Kg d’acqua dopo che ioni
bromuro e ioduro sono stati completamente sostituiti da equivalente quantità di cloruri e
dopo che tutti i carbonati sono trasformati in ossidi.
Più semplicemente oggi la salinità si determina con la misura della
conducibilità elettrica, dalla quale note temperatura e pressione si
ricava la salinità.
La salinità media degli oceani è 34.5‰ (g/Kg) ma essa varia in
superficie e in profondità. In generale la salinità aumenta
velocemente da 100 m a 500 m ove si raggiunge il suo massimo
per poi decrescere fino a 900 m (Aloclino). A profondità maggiori
di la salinità tende a rimanere costante con la profondità.
Sat. Aquarius
Ago-Sept 2011
se si fa evaporare 1 kg di acqua di
mare, rimangono 35 g di sali
ACQUA OCEANICA
Anche la densità varia con la profondità: incrementa fino a
circa 1000 m (Picnoclino) per poi stabilizzarsi.
La densità dipende dalla:
1. Salinità
2. Temperatura
3. Pressione
La temperatura è il parametro che più influenza la densità:
acqua a salinità maggiore può galleggiare su acqua meno
densa se questa è più fredda.
La densità media degli oceani è ρ = 1.02476 g/cm3 a 20°C.
termoclino
ACQUA OCEANICA:STRATIFICAZIONE E CIRCOLAZIONE
Il movimento delle correnti superficiali è
indotto dai venti, mentre la circolazione
profonda
è indotta dalla differenza di densità,
conseguenza
di
diversa
salinità
e
temperatura (acque con maggiore salinità
sono più dense analogamente a basse
temperature la densità è maggiore). Inoltre le
differenze di densità e temperatura
dell’acqua oceanica determinano la sua
stratificazione: l’acqua più densa e/o più
fredda è sovrastata da acqua più calda.
L’acqua profonda ha una salinità costante del
35‰ (a 3°C), mentre l’acqua superficiale ha
salinità
e
temperatura
variabile.
Il
mescolamento
completo
delle
acque
oceaniche richiede dai 1000 ai 2000 anni ed
è innescato dai venti che spingono le acque
superficiali più calde verso i poli, qui si
raffreddano e affondano tornando poi verso
l’equatore.
CORRENTE DEL GOLFO
Global Warming: Scioglimento dei ghiacci artici,
immissione nel N-Atlantico di acqua dolce e
migrazione verso sud della corrente del Golfo.
Come
conseguenza
l’azione
mitigante della corrente del Golfo
sui venti freddi provenienti da
Nord Ovest non si estende più fino
al Nord Atlantico e l’Europa
continentale
subisce
un
inasprimento
delle
condizioni
meteo con brusco calo delle
temperature.
COMPOSIZIONE DELL’ACQUA MARINA
Contributi importanti alla composizione dell’acqua oceanica vengono dalle
1. Acque dolci fluviali (HCO3-, Ca2+, SiO2, SO42-, Cl-, Na+, Mg2+ e K+ per un totale medio
stimato in 98 g/l per anno).
2. Atmosfera (H, He, O, CO2)
3. Circuiti idrotermali (SiO2, SO42-, Mg2+, Ca2+ etc.)
4. Uomo (Inquinanti in genere, organici ed inorganici)
Tali apporti concorrono a determinare la salinità dell’acqua marina, cioè la quantità e le specie
di ioni in essa disciolti.
acque dolci
idrotermalismo
Inquinamento
COMPONENTI PRINCIPALI
(o conservativi: a scala globale in concentrazione costante e rapporti costanti tra loro)
Concentrazione degli ioni in acqua marina con salinità del 35 ‰
Componenti principali espressi come percentuale
COMPONENTI MINORI (o in traccia)
Sono gli elementi che meno abbondanti dei precedenti ma importanti per i processi biologici:
• nutrienti: quali ammonio, nitriti, nitrati, fosforo organico e fosfati;
• gas disciolti: azoto, ossigeno, argon,
• oligoelementi: vanadio e altri metalli che si possono accumulare negli organismi.
COMPOSIZIONE DELL’ACQUA MARINA
La composizione dell’acqua marina si è mantenuta pressoché costante negli ultimi 570 Ma, per il
raggiungimento di un equilibrio chimico-biologico.
Gli elementi chimici nell’acqua oceanica subiscono l’effetto di diversi cicli che coinvolgono
sedimenti organici ed inorganici e la biosfera.
La COMPOSIZIONE DELL’ACQUA MARINA non è governata dalla solubilità, ma piuttosto dalla velocità
di apporto e rimozione dei componenti chimici durante i processi di chimico fisici di
formazione dei sedimenti, o gli equilibri di scambio ionico.
Tra i meccanismi più efficaci (e probabili):
•Incorporazione nei sedimenti per scambio ionico
•Formazione dei carbonati
•Riduzione dei solfati
•Precipitazione di SiO2 come opale e chert
•Seppellimento di acque interstiziali
•Formazione di evaporiti
•Rimozione degli ioni H+ e OH-
hydrothermal vents
GAS DISCIOLTI IN ACQUA
Tra atmosfera ed idrosfera vi è un continuo scambio, per diffusione lungo la superficie di
contatto di questi due serbatoi o sfere geochimiche.
Tra i gas disciolti in acqua marina i più
abbondanti sono O, N, CO2. La
solubilità dell’ossigeno è direttamente
proporzionale alla temperatura e
subisce quindi variazioni con la
latitudine, profondità e stagioni.
Importanti fattori che influiscono sulla
solubilità dell’ossigeno e anidride
carbonica sono:
• la circolazione dell’acqua
• l’attività di fotosintesi
• ossidazione
della
sostanza
organica.
In figura sono rappresentate le variazioni di
concentrazione di O2 e CO2 in funzione della
profondità.
PCO2
CO2 ED ACIDO CARBONICO
Di particolare importanza è la solubilità della CO2 in acqua, perché partecipa ai complessi equilibri
che portano alla formazione delle rocce carbonatiche e ai processi di alterazione chimica.
Formazione di acido carbonico:
[1] CO2 + H2O ↔ H2CO3
L’acido carbonico è un acido debole che si ionizza:
[2] H2CO3 ↔ H++ HCO3anione carbonato
[3] HCO3- ↔ CO32- + H+
anione bi-carbonato
L’equilibrio delle reazioni di solubilità della CO2 in acqua è governato dal pH e dalla
pressione di CO2 nell’atmosfera e/o nell’acqua.
La CO2 che si scioglie in acqua determina la presenza contemporanea di H2CO3, HCO3-,
CO32- . Quali di queste specie sarà predominante in soluzione acquosa dipende dal pH
della soluzione.
Oceani
(7.6-8.1)
In figura: frazioni molari delle specie carbonatiche: acido carbonico, ione bicarbonato e ione
carbonato, in acqua pura rispetto al pH.
FORMAZIONE DEI CARBONATI
Il carbonato di calcio in acqua marina precipita
biologicamente (essenzialmente come scheletro di
organismi planctonici) anche se l’acqua di mare è vicina
la punto di saturazione del CaCO3.
[1] Ca2++2HCO3-
CaCO3+H2O+CO2
Il carbonato precipitato (reazione [1]
da sinistra a
destra) è generalmente calcite o più raramente
aragonite (polimorfo della calcite).
Buona parte dei gusci formati nelle zone superficiali
viene ridisciolto in profondità poiché la pressione
parziale di CO2 è maggiore (reazione [1] procede
da destra a sinistra).
La profondità alla quale la velocità di dissoluzione
eguaglia la velocità di rifornimento di materiale
calcareo è chiamata: profondità di compensazione
della calcite (CCD).
I sedimenti pelagici di acqua profonda sono
caratterizzati dall’assenza di carbonato, quindi sono
argillosi o silicei.
calcari selciferi
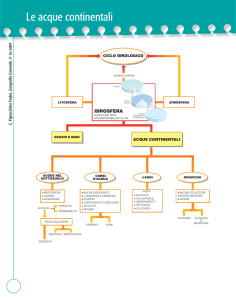
ACQUE CONTINENTALI
Le acque meteoriche sotterranee vengono definite "vadose" per distinguerle sia da quelle acque
che si formano direttamente nel sottosuolo (origine endogena) per particolari alterazioni delle
rocce profonde e che sono chiamate "giovanili", sia dalle acque "fossili" che sono il residuo di
laghi, paludi e mari estinti in epoche geologicamente passate ed ora colmati da sedimenti.
ACQUE CONTINENTALI
Le acque continentali contengono elementi chimici provenienti
dall’alterazione della crosta terrestre. Il complesso delle alterazioni
chimiche che dissolve i minerali viene chiamato weathering.
Il processo di formazione dei suoli, dei sedimenti (sensu lato) e di
mineralizzazione delle acque, è prodotto dall’alterazione di tipo:
1. meccanica – frammentazione della materia
2. chimica – dissoluzione o trasformazione dei solidi in
minerali diversi.
Entrambi i processi di alterazione generalmente operano in sinergia:
• più piccoli sono i frammenti maggiore è la superficie disponibile per
l’attacco chimico;
• più velocemente si indebolisce il frammento di roccia, più veloce
sarà l’alterazione chimica.
Sia l’idrosfera che l’atmosfera concorrono poi all’alterazione e
trasporto di materia:
• l’idrosfera trasporta la materia in forma sospesa e disciolta.
• l’atmosfera fornisce CO2 e O2 per l’alterazione.
ACQUE CONTINENTALI: COMPOSIZIONE CHIMICA
Oceano
Fiumi
Acque
sotterranee
(mg/l)
Na+
470
0.3
1.2
K+
10
0.06
0.07
Ca2+
20
0.8
2.5
Mg2+
110
0.7
0.8
Cl-
550
0.2
0.9
SO42-
56
0.1
0.9
HCO3-
2
1
3.0
8.2
--
7.4
35000
120
350
pH
TDS
In tabella sono riportate le specie ioniche (soluti) contenuti
nell’acqua marina (in mg/l), acqua continentale fluviale e
sotterranea. TDS = total dissolved salts = somma dei sali
disciolti).
la differenza principale è il contenuto dei sali disciolti:
acqua oceanica >> acqua sotterranea > acqua fluviale.
Nelle acque continentali non vi è un ordine nella concentrazione delle specie ioniche come per le
acque oceaniche, anche se i metalli alcalino terrosi > alcalini e lo ione bicarbonato è
predominante.
Le curve di distribuzione di alcune specie chimiche ioniche presenti nelle acque continentali
mostrano un elevata variabilità.
Elementi che nelle rocce sono generalmente in traccia (< 1% in peso) come U, Mn (Ni, Cu, Pb,
Hg) sono anche poco abbondanti nelle acque e si trovano quindi nella parte sinistra del
diagramma.
L’intervallo di concentrazione per alcune specie è piccolo (es. U), mentre per altre come Ca2+,
Mg2+, HCO3-, K+, Na+ SO42-) è molto ampio e riflette la variabilità della disponibilità di questi
elementi nelle rocce e l’affinità di questi elementi ad essere trasportati come soluti nell’acqua,
senza formare delle fasi solide. Per contro l’ Al anche se abbondante nelle rocce è poco solubile
in acqua e forma idrossidi che precipitano.
FATTORI CHE REGOLANO LA COMPOSIZIONE CHIMICA
DELLE ACQUE CONTINENTALI
La composizione chimica dell’acqua continentale è il risultato di processi chimico-fisici di
interazione acqua-roccia e sono influenzati dall’atmosfera e dalla biosfera.
Il passaggio in soluzione degli elementi costituenti una roccia dipende dalle proprietà chimiche
(fattori interni) degli elementi stessi e dalle condizioni chimico-fisiche dell’ambiente (fattori esterni).
Fattori interni che determinano l’affinità di un elemento per una soluzione acquosa o una fase
solida:
1. Potenziale di ionizzazione (rapporto tra la carica ed il raggio ionico)
2. Elettronegatività
SOLVATAZIONE
La natura dipolare dell’acqua determina che ogni catione
in soluzione sia circondato da molecole d’acqua con
formazione di complessi acquosi.
In generale il numero delle molecole d’acqua di
solvatazione è funzione della carica del catione: a parità
di carica, minore è il raggio ionico (potenziale di
ionizzazione maggiore), maggiore sarà il numero delle
molecole d’acqua solvatanti.
MOBILITÀ IN ACQUA DEGLI ELEMENTI IN FUNZIONE DEL POTENZIALE IONICO
Metalli alcalini e alcalino terrosi hanno
rapporto carica/raggio (C/R)<3 tendono
ad essere solvatati e formare idrossidi
solubili. Generalmente questi cationi
formano composti con HCO3-, SO42-, Cl-,
F- anch’essi molto solubili. L’elevata
solubilità ne determina l’elevata mobilità
geochimica: possono essere trasportati a
molta distanza dal loro luogo di origine.
All’aumentare di C/R>3 i cationi esistono
in soluzione legati a gruppi ossidrili OH- o
O2-. Si formano ioni complessi quali
Fe(OH)2+, Fe(OH)4-, Al(OH)2+, Al(OH)4-, e
composti insolubili AlOH3, Fe2O3, MnO2,
TiO2. La mobilità geochimica di questi
cationi è notevolmente minore del gruppo
precedente.
Gli ioni con C/R>10 hanno un forte potere
polarizzante e formano legami covalenti
con O2-, formando ossianioni solubili quali:
CO32-, SO4-, PO43-, NO3- Questi ioni sono
molto mobili.