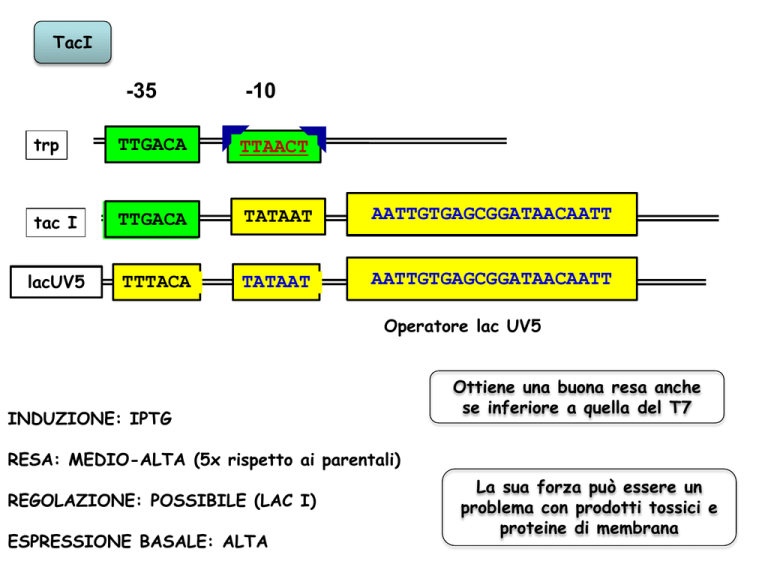
TacI
-35
-10
trp
TTGACA
TTAACT
tac I
TTGACA
TATAAT
AATTGTGAGCGGATAACAATT
lacUV5
TTTACA
TATAAT
AATTGTGAGCGGATAACAATT
Operatore lac UV5
INDUZIONE: IPTG
Ottiene una buona resa anche
se inferiore a quella del T7
RESA: MEDIO-ALTA (5x rispetto ai parentali)
REGOLAZIONE: POSSIBILE (LAC I)
ESPRESSIONE BASALE: ALTA
La sua forza può essere un
problema con prodotti tossici e
proteine di membrana
AraBAD
dirige l’espressione dell’operone ARA è strettamente
regolabile, e rappresenta un’utile alternativa per la
produzione di proteine eterologhe in E. coli
Arabinosio: molto economico compatibile con le procedure GMP
AraC
Gene eterologo
+
l’espressione basale praticamente assente se manca l’arabinosio e c’è
glucosio, compensa la relativa debolezza strutturale del promotore
CTGACG -- 18 -- TACTGT araBAD
TTGACA -- 17 – TATAAT
consensus
INDUZIONE: ARABINOSIO, DOSE DIPENDENTE
3
RESA: MODULABILE
REGOLAZIONE: STRETTA
ESPRESSIONE BASALE: BASSA
0,001%
ARA
ARA
+
1%
rhaPBAD
INDUZIONE: RAMNOSIO
RESA: MEDIA
REGOLAZIONE: COMPLESSA E STRETTA
L-ramnosio
ESPRESSIONE BASALE: BASSA
RhaR
RhaS
RhaT
RhaB
RhaA
RhaD
RhaR attivatore trascrizionale 1,
RhaS regola positivamente tutto il
regulone (catabolismo: BAD e trasporto
RhaT)
Il regulone, però, è anche soggetto
alla repressione da catabolita
i tempi per l’induzione e la raccolta del
prodotto vanno scelti accuratamente
tetA
INDIPENDENTE DAL CEPPO E DALLO STATO METABOLICO
INDUTTORE POCO COSTOSO
INDUZIONE: ANIDROTETRACICLINA
RESA: MEDIO-ALTA
REGOLAZIONE: STRETTA
ESPRESSIONE BASALE: BASSA
TetR
regolazione molto stretta + livelli di espressione alti
Il gene del repressore è sul plasmide: il sistema è indipendente
dal tipo di ceppo
Gene eterologo
L’induzione avviene con basse concentrazioni di
ANIDROTETRACICLINA
N(CH3)2
CH3
35
OH
O
OH
OH
100
OH
O
O
CONH2
1
1
A-TET
TET
A-TET
TET
Efficienza di legame Azione antibatterica
la piena induzione (~50 ng/ml) non ha effetto sulla crescita di E. coli
Sistema usato con successo per la produzione di
molte proteine (Fab, tossine..)
Cellule non indotte
Cellule indotte
=
1
100
PROMOTORI FAGICI
Un’alternativa ai promotori regolati di geni
metabolici è stata cercata nei promotori fagici
LAMBDA
T 7
λPL
il promotore-operatore del fago Lambda OL/PL,
assicura livelli di espressione medio-alti
29-30
repressore cI857
Mutante termosensibile
: mutazione CT in corrispondenza
della base 37742
42
repressore cI857
Mutante termosensibile
<30 °C cI857 è funzionale
λPL
Gene
eterologo
λPL
Gene
eterologo
Lpl è costututivo
λPL va considerato costitutivo
può essere impiegato per le proteine suscettibili alla proteolisi che
sarebbero degradate a temperature più vantaggiose per la crescita
Un’alternativa all’uso del mutante termosensibile è
mettere cI sotto il controllo di PTrp
Melassa e idrolisato acido di caseina
Economico e praticamente privo di triptofano
repressore cI
λPL
Gene
eterologo
Aggiunta di triptone al mezzo di coltura
(digesto triptico di caseina, particolarmente ricco di triptofano)
repressore cI
λPL
Gene
eterologo
T7 RNA polimerasi
LA RNA POLIMERASI DI T7 E’ PIU’ VELOCE DI QUELLA DI
E. COLI E RICONOSCE PROMOTORI DEL TUTTO DIVERSI
Per questo sistema serve un ospite che esprima la T7 RNA
polimerasi, in modo regolato
Il più usato è BL21 (DE3)
BL21
DE3
Un ceppo reso lisogeno con il mutante DE3 di Lambda
L’espressione guidata da T7 può provocare a volte un certo
grado di aggregazione delle proteine prodotte
Possibili soluzioni
Abbassare la
velocità di
produzione
Induzione
modulando IPTG (25-100 µM
invece di 1 mM)
Abbassare la
temperatura di
crescita
Con questi sistemi la crescita può
cessare dopo l’induzione: è molto
importante scegliere bene i tempi
Nonostante la regolazione stretta, una certa attività basale può
sfuggire, specialmente in terreni ricchi
Cmr
p15
Un controllo ulteriore si
può esercitare con il gene
del lisozima di T7
pLysS
pLysE
Presente su pLysE e pLysS
Il lisozima si lega direttamente
alla T7 RNA polimerasi,
abbassandone l’attività
T7 LSZM
Prom
Tet
Ma rallenta la crescita dell’ospite perché taglia un legame
specifico nel peptidoglicanoe rende le cellule più fragili
L’unica differenza tra pLysE e pLysS è l’orientamento di T7 LSZM
Ma è una differenza
importante
In pLysE il gene è trascritto
dal promotore Tet, forte
pLysE
La quantità di lisozima è
eccessiva
LE CELLULE DIVENTANO
FRAGILI E LISANO
In pLysS il gene è trascritto da un promotore debole A VALLE del
gene, insieme a tutto il plasmide
La quantità di lisozima è
idonea
p15
Cmr
pLysS
T7 LSZM
Prom
Tet
prom
T7Φ 3.80
l’espressione basale di T7 RNA polimerasi non è di solito un problema
grave, ma lo può diventare se il prodotto è tossico
BL21
DE3
BL21
DE3
BL21
DE3
BL21
DE3
BL21
DE3
L’altro svantaggio è una certa variabilità dell’espressione dei
trasformanti che rende necessario esaminarne un numero elevato
Per risolvere questo problema sono stati
proposti alcuni approcci alternativi
L’IMPIEGO DEL BATTERIOFAGO CE6
Per eliminare del tutto l’espressione basale, si possono
usare ospiti privi del gene della T7 RNA polimerasi, e
infettarli, al momento opportuno, con il fago litico CE6.
Il processo litico di λCE6 è ostacolato dalla mutazione “Sam”
(A G in 45352) che porta alla perdita di funzionalità della
proteina di lisi GPS
La T7 RNA polimerasi è clonata all’interno del gene
int, in modo che sia diretta da λPL e λPI, ed è
controllata da CI857
Quando CE6 infetta la cellula la T7 RNA polimerasi sintetizzata de novo trascrive
il DNA bersaglio con un’efficienza elevatissima
il sistema è meno efficiente
dell’uso di ceppi lisogeni (DE3)
Ma prima dell’infezione, non c’è una polimerasi
che possa trascrivere il gene bersaglio
+T7 POL
CE6 si propaga nel ceppo LE392 che ne permette il ciclo
litico, perché sopprime la mutazione Sam7
LA CREAZIONE DI UN PROMOTORE IBRIDO T7/LAC
+1
Operatore lac
Gene eterologo
La trascrizione basale è bloccata da LacI
l’IPTG usato per l’induzione della T7 RNA polimerasi blocca anche
l’operatore avviando la trascrizione del gene bersaglio;
lacI
Nei vettori che impiegano questo sistema, il gene lacI si trova
spesso sul plasmide, per garantire una regolazione stretta
T7/lac può essere abbinato all’uso di pLysS
TERMINATORI
A valle del MCS, sui vettori di espressione, c’è spesso
un terminatore forte, rho indipendente, che garantisce
il messaggero corretto rilascio dal ribosoma
Sono palindromi seguite da una serie di A
(U all’estremità 3’ del messaggero)
T7
rrnD
<<<<<<<:::<:<<:-:--:-:>>:>:::>>>>>>>
AACCCCTTGGGGCCTCTAAACGGGTCTTGAGGGGTTTTTTG
<<<<<<<<<<<<<<<<<<---->>>>>>>>>>>>>>>>>>
AAAACAAAAGGCTCAGTCGGAAGACTGGGCCTTTTGTTTT
Il terminatore impedisce che geni a valle di quello di
interesse, e nello stesso orientamento, possano essere
trascritti dal promotore forte
Gene eterologo
Gene a valle
Gene eterologo
Gene a valle
In alcuni plasmidi, per esempio, il gene che codifica la
β-lattamasi, può essere trascritto dal promotore T7
BLA
S
S
Questo avrebbe l’effetto indesiderato di
eliminare con molta rapidità l’agente di
selezione, permettendo alle cellule
sensibili (prive di plasmide) di prendere il
sopravvento
BLA
Per lo stesso motivo può essere conveniente
avere un terminatore forte anche A MONTE
della cassetta di espressione, per evitare che
trascrizioni indebite coinvolgano il gene di
interesse
particolarmente consigliabile quando
ci sono altri promotori orientati
nello stesso senso della ORF da
esprimere, anche se lontani
BLA
DOVE CONVIENE LOCALIZZARE IL PRODOTTO?
Citoplasma?
OGNI COMPARTO HA I SUOI
PREGI E I SUOI DIFETTI
Periplasma?
LE DESTINAZIONI Più
FREQUENTI SONO
CITOPLASMA E
PERIPLASMA
Membrana esterna?
CITOPLASMA:
Ambiente riducente
Vantaggi
RESE MOLTO ALTE
ERRORI DI FOLDING
Svantaggi
FORMAZIONE DI CORPI
D’INCLUSIONE
MANCANZA DI ATTIVITA’
BIOLOGICA
POSSIBILE MANCATO O
INCOMPLETO REFOLDING
IN VITRO
IN VIVO IL FOLDING FISIOLOGICO DELLE
PROTEINE È ASSISTITO DA CHAPERONINE
Il primo a intervenire
è un fattore d’innesco
associato al ribosoma
Ruota in modo corretto i
legami dei residui di prolina
Una volta fuori dal ribosoma, DnaK rimuove piccole zone
idrofobiche ripiegate in modo sbagliato
GRO E-L
GRO S
controlla l’ingresso
formano camere molecolari
di ripiegamento
su alcuni vettori, sono presenti i geni che codificano
DnaK/DnaJ o GroEL/GroES,
Che promuovono l’isomerizzazione e istradano al comparto di destinazione
Le probabilità di successo però dipendono
strettamente dalla natura della proteina eterologa
Altri problemi:
mancata formazione di ponti disolfuro
esposizione all’azione delle proteasi
MANIPOLARE IL GENOTIPO
DELL’OSPITE PIU’ CHE LE
CARATTERISTICHE DEL VETTORE
PERIPLASMA
Molto ossidante
Sono presenti enzimi che catalizzano la formazione
e il riarrangiamento dei ponti disolfuro
destinazione idonea per le
proteine che possono essere
secrete
ALTRI VANTAGGI:
NELLA MAGGIOR PARTE DEI VETTORI
DI ESPRESSIONE E’ PRESENTE UNA
SEQUENZA SEGNALE
MINORE
INCIDENZA DI
PROTEOLISI
MINORE CONCENTRAZIONE DI
PROTEINE
PROTEINA ETEROLOGA
SEQUENZE SEGNALE DIDERMICHE
CIRCA 25 AA (17-18 25-27)
LA LUNGHEZZA DEL PEPTIDE E’ CRITICA:
il sito di taglio per la peptidasi segnale-II
deve venire a trovarsi sulla superficie
esterna della membrana citoplasmatica, dove
è situato l’enzima
E’ CRITICA ANCHE LA STRUTTURA
M K K F L V L F L A L L Y
P S S
ALMENO 1 RESIDUO AA+ (K,R) NEI PRIMI 7
ZONA CENTRALE MODERATAMENTE
IDROFOBICA: L,V,I
C-TER: RICCA IN S e A
FREQUENTE P (-6)
TIPICO A (-3, -1) = SEGNALE PER LA
PEPTIDASI A-X-A PIU’ RARO S/G
A H A
MOLTO USATE
PEL B (PECTATO LIASI)
ST-II (TOSSINA TERMOSTABILE)
ERW
ETEC
DSBA (OSSIDO-REDUTTASI)
OMPT (PROTEASI DI MEMBRANA)
PHO A (FOSFATASI ALCALINA)
K 12
MA SI POSSONO ANCHE USARE LEADER ARTIFICIALI
MIA-1/MIA-2: STESSA LEADER NUCLEOTIDI DIVERSI CON
STESSO CAI (COESPRESSIONE SULLO STESSO VETTORE)
MIAmax: LA PIU’ BELLA CHE CI SIA..
MIAperC: è stato inserito un sito di riconoscimento per «NcoI»
VANNO EVITATE LE AMBIGUITA’ NELLA LEADER CHE POTREBBERO
CAUSARE VARIABILITA’ NELLA PROTEINA ESPRESSA
MRTLTTLGLALLLAQPAVAAQAVLPQLQPYTAPAAWLTPVAPLRIADN
MRTLTTLGLALLLAQP- - -AQAVLPQLQPYTAPAAWLTPVAPLRIADN
MRTLTTLGLALLLAQPAVA AQAVLPQLQPYTAPAAWLTPVAPLRIADN
?
MRTLTTLGLALLLAQPAVAAQA
?
VLPQLQPYTAPAAWLTPVAPLRIADN
In questo caso particolare, il ritrovamento di un mutante in cui mancavano
i residui AQA e che non era funzionale, ha risolto il dubbio
MRTLTTLGLALLLAQPAQA
VLPQLQPYTAPAAWLTPVAPLRIADN
La presenza (o la bontà di una sequenza segnale progettata) possono
essere controllate con questo programma:
http://www.cbs.dtu.dk/services/SignalP/
Grandi proteine citoplasmatiche o mutanti da approcci combinatoriali possono
essere non traslocabili attraverso la membrana e restano intrappolate
SI PUO’ FARE QUALCOSA PER
MIGLIORARE LA SECREZIONE?
PER ESSERE TRASLOCATI, I PEPTIDI DEVONO ARRIVARE
VICINO ALLA IM IN RIPIEGAMENTO LASSO
CHAPERONINE GENERICHE (GroE-L, DnaK)
CHAPERONINE SPECIFICHE (SecB)
LE TRASFERISCONO A SecA SecYEG
Tentativi di inserire i geni per SecB, DNAK-J
e GroEL-ES sui vettori:
RISULTATI VARIABILI
INFLUENZA
SEQUENZA SEGNALE
STRUTTURA
SECONDARIA E
TERZIARIA
RICONOSCIMENTO
DALLE CHAPERONINE
PROVARE DIVERSE
LEADER +
CHAPERONINE
IPERESPRIMERE DsbC
DISOLFURO-ISOMERASI
IPERESPRIMERE Skp/OmpH: CHAPERONINA
A LARGO SPETTRO DI SUBSTRATO
SOVRACCARICO DELL’APPARATO DI
ESPRESSIONE
DIMINUIRE
L’ESPRESSIONE
AUMENTARE COMPONENTI
LIMITANTI PER IL PROCESSO
DI ESPORTAZIONE
Trasformare con prlA4 e secE, su plasmide
(geni per le principali proteine di trasporto)
UNA VOLTA PRODOTTA, LA
PROTEINA VA PURIFICATA
Per facilitare la purificazione delle proteine eterologhe
si è pensato di fonderle con altre proteine o parti di
proteine (carrier o TAG)
FUSIONE AL 5’
FUSIONE AL 3’
TAG
MCS
MCS
TAG
Diversi vettori commerciali contengono già la sequenza che
codifica il TAG, preceduta o seguita da siti di restrizione
per clonare il gene di interesse in frame con il TAG
il TAG si sceglie in base alle esigenze e
alla strategia di purificazione
AFFINITA’ PER UN LIGANDO
Permette di purificare il TAG,
che porta con sé la proteina
TAG
GENE
MBP: proteina che lega il maltosio
CBP proteina che lega la chitina
GST glutatione transferasi
Poly-HIS “coda” di istidine, si lega al Nickel
CARATTERISTICHE
CROMATOGRAFICHE
DYKDDDDK
migliorare la risoluzione nel corso di
tecniche di separazione particolari; è
composto di aminoacidi polianionici
“FLAG”
IMMUNOREATTIVITA’
Epitopi scelti in base alla facile disponibilità di
anticorpi con elevata affinità che li possano legare
soprattutto peptidi corti, spesso di origine virale
particolarmente utili per l’allestimento di
western blot e per l’immunoprecipitazione












