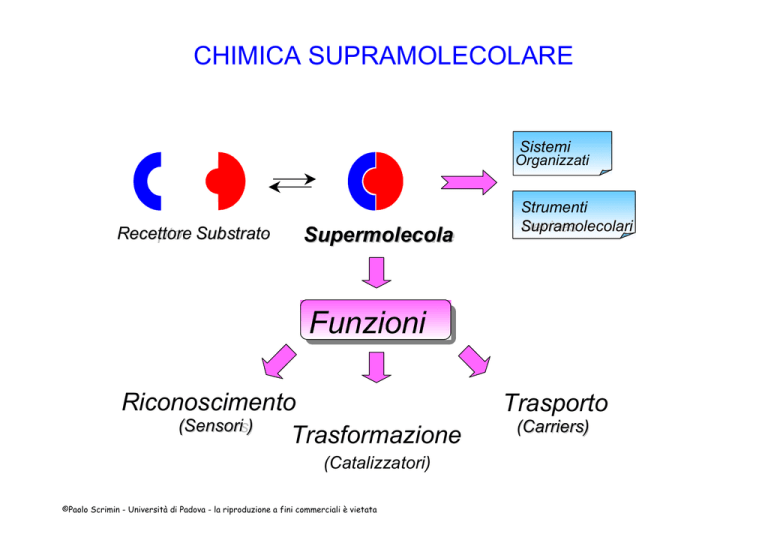
CHIMICA SUPRAMOLECOLARE
Sistemi
Organizzati
Recettore
Receptor Substrato
Substrate
Supermolecola
Supermolecule
Strumenti
Supramolecolari
Devices
Funzioni
Riconoscimento
(Sensori
Sensors)
Trasformazione
(Catalizzatori)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Trasporto
(Carriers)
Definizioni
La Chimica Supramolecolare è la chimica del legame intermolecolare
e prende in esame le strutture e le funzioni di nuove entità chimiche
che si formano in seguito all’associazione tra due o più specie
chimiche diverse
J.-M- Lehn, premio Nobel 1987
La Chimica Supramolecolare può essere definita come la chimica
“oltre la molecola”, la chimica delle interazioni intermolecolari.
In una supramolecola le informazioni sono conservate sotto
forma di aspetti strutturali specifici.
F. Voegtle, Università di Bonn
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Le radici
Agli inizi del secolo
Emil Fisher introduce
il concetto di chiavetoppa per spiegare
l’enorme selettività
nelle interazioni tra
le proteine e i loro
substrati
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
L’idea originale di Fisher era che la proteina avesse
una forma complementare a quella del substrato
substrato
enzima
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
complesso
enzima substrato
L’idea era geniale per quel tempo anche se non
completamente esatta: la proteina può aggiustare
la sua conformazione in relazione alla sua interazione
con il substrato
substrato
enzima
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Complesso
enzima/substrato
Cram, Lehn e Pedersen hanno cominciato a trasferire i principi
della chimica delle macromolecole al mondo molto più semplice
delle molecole con il quale hanno a che fare di solito i chimici
Eteri corona
Criptandi
Queste sono supramolecole
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Concetti sui quali si basa la chimica supramolecolare
Interazioni deboli: non si devono formare legami covalenti
(le interazioni in gioco sono: elettrostatiche, idrofobe,
legame ad idrogeno, tra nuvole π, di coordinazione)
quindi reversibili
Complementarietà delle forme, delle proprietà delle superfici,
delle cariche tra le molecole che si vogliono far interagire:
si parla di recettore molecolare in analogia al recettore biologico
quindi selettività
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Tra i primi esempi di sistemi di riconoscimento vi sono stati
gli eteri corona
1.2-1.5 Å
12-corona-4
selettivo per
Li+ (1.36 Å)
1.7-2.2 Å
2.6-3.2 Å
15-corona-5
selettivo per
Na+ (1.90 Å)
18-corona-6
selettivo per
K+ (2.66 Å)
Mano a mano che la dimensione aumenta la loro conformazione
diviene più flessibile: lo ione che si complessa induce una
modificazione conformazionale
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Applicazioni degli eteri corona: solubilizzazione di sali
in solventi non acquosi
Es: K2MnO4 non è solubile in Toluene; per aggiunta dell’etere
corona 18-corona-6 si ottiene una soluzione di permanganato
di potassio in toluene.
18-corona-6
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Vi sono in natura molecole relativamente piccole
che si prestano molto bene per prendere in esame
i concetti della chimica supramolecolare.
Un esempio è costituito dalle ciclodestrine
Le ciclodestrine sono degli oligomeri ciclici costituiti
da 6-8 unità glucosidiche; sono quindi derivati degli zuccheri
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Sono solubili in acqua ma presentano una cavità poco
polare all’interno della quale possono “ospitare” una molecola
idrofoba
ciclodestrina vuota
Complesso
ciclodestrinasubstrato
supramolecola
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
L’interazione di una ciclodestrina con un substrato
avviene sulla base di processi simili a quelli che si
osservano nelle proteine:
-esse infatti sono selettive nel riconoscimento di una
molecola (la loro cavità ha una dimensione precisa e
poco flessibile);
-il processo di riconoscimento è assolutamente reversibile
e non avviene mediante la formazione di legami covalenti
-è soggetta ad inibizione da parte di molecole che abbiano
una maggiore affinità per la ciclodestrina del substrato
stesso
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Selettività
O-
Complessazione dei derivati
fenolici A, B e C con α-ciclodestrina
A
NO2
Molecola
logK
3.36
3.07
ca. 0
A
B
C
O-
B
NO2
OO-
C
NO2
NO2
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Per questa ragione le ciclodestrine possono essere usate
per la complessazione selettiva di principi attivi di farmaci
(dei quali tra l’altro consentono una più lunga conservazione) o
per la separazione di miscele di molecole mediante cromatografia.
In questo caso il riconoscimento può anche essere chirale!
+
Prima esce il naftalene (che non si complessa)
poi il benzene (che si complessa)
Anche se avessimo funzionalizzato la nostra colonna
cromatografica con una proteina avremmo potuto
separare una miscela di molecole sulla base delle loro
affinità per la proteina stessa!
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Ancora una volta, quindi, l’analogia con i
sistemi enzimatici è molto elevata
substrato
enzima
Inibitore
competitivo
substrato
Inibitore
non
competitivo
enzima
Una ciclodestrina è soggetta
ad inibizione competitiva
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
enzima
L’analogia tra il modo di agire di questi recettori molecolari
e le proteine può essere spinta oltre: per esempio nel caso
della ciclodestrina si possono eseguire reazioni di trasformazione
del substrato come con un enzima
O
OR
OH
O
OR
OH
Il primo processo è la complessazione del substrato alla ciclodestrina
(chimica enzimatica: complesso enzima/substrato)
O
OR
OH
O
O
-ROH
Il secondo processo è costituito dall’attacco di un -OH della ciclodestrina
all’estere per dare un intermedio (chimica enzimatica: succede lo stesso
in una esterasi serinica)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Adesso però bisogna idrolizzare l’intermedio altrimenti
non si ricicla più il catalizzatore…ma questo è un problema
O
O
O
O- OH
OH-
In un enzima questo non succede!!
E’ possibile utilizzare questi recettori molecolari per preparare
enzimi sintetici che catalizzano anche processi per i quali
non esista un catalizzatore naturale?
Si, se siamo in grado di soddisfare tutti i requisiti di un
catalizzatore enzimatico: complessazione reversibile del
substrato e riciclo del catalizzatore
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Vi sono altri sistemi sintetici che possono
operare come recettori molecolari.
Ad esempio i calixareni.
Complesso tra calix-6-arene e C60
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
OR
OR RO
OR
…oppure i ciclofani
NR
NR
RN
RN
X
X
X
X
Complesso tra un ciclofano e il naftalene
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Sistemi supramolecolari
possono essere anche
ottenuti usando ioni metallici
come elementi per l’assemblaggio
dei componenti: in questo esempio
due oligomeri si intrecciano per
dare una doppia elica. Anche in
questo caso le interazioni sono
“deboli” e reversibili
O
N
N
n
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
La chimica supramolecolare riguarda anche sistemi più complessi
che comportano l’interazione tra più di due molecole.
Anche in questo caso i vari elementi non devono essere tenuti
assieme da legami covalenti
Un esempio è costituito dagli aggregati di tensioattivi (o
saponi) che formano spontaneamente in acqua nanoparticelle
sferiche (micelle)
Un sapone o
tensioattivo
Una micella
(un sistema supramolecolare)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Si possono ovviamente
formare altre strutture
supramolecolari come ad
esempio emulsioni (il latte ne
è un esempio) o vescicole
(vedi più avanti)
L’anione di una molecola
di un acido grasso è un
sapone
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Una bolla di sapone:
un film di acqua
stabilizzato da un
“tensioattivo”
Anche nel caso delle micelle le singole unità di tensioattivo sono tenute
assieme da forze deboli come nei recettori molecolari.
Anche una micella può interagire con altre molecole organiche o con ioni:
le molecole organiche (idrofobe) interagiranno con la parte apolare
dell’aggregato mentre gli ioni interagiranno con la superficie (all’interfaccia
con l’acqua) dove si trovano le “teste” polari dei tensioattivi.
In questo caso però l’interazione non avviene sulla base della
forma e delle dimensioni ma solamente sulle base di interazioni
ioniche (per gli ioni) e idrofobe (per le molecole organiche):
non si può parlare di vero e proprio riconoscimento in quanto esso
è assai poco selettivo
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Tensioattivi cationici artificiali (non esistono in natura) di solito
si aggregano per dare: a) micelle se hanno una sola catena
idrocarburica legata al gruppo ammonico quaternario, b) vescicole
se hanno due catene idrocarburiche legate al gruppo ammonico
quaternario
X-
Si aggrega per
dare micelle
X-
La formazione di aggregati per ogni
tensioattivo avviene solamente al di
sopra di una precisa concentrazione detta
concentrazione critica di aggregazione;
al di sotto di quella concentrazione ci sono
solo monomeri.
Si aggrega per
dare vescicole
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Zona polare
acqua
micella
Diametro 3-6 nm
Zona apolare
Il naftalene
(idrofobo) si
complessa con
la micella; allo
stesso modo lo
sporco (solitamente
molecole poco
solubili in acqua)
va a finire nella
micella…. in questo
modo operano i
detersivi (chimica
supramolecolare
di ogni giorno)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Aggregati di tensioattivi possono essere considerati come piccoli
reattori supramolecolari.
La reattività si basa su due aspetti fondamentali:
1. La carica della testa polare del tensioattivo e la natura del
controione ad essa associato;
2. La capacità della parte idrocarburica dell’aggregato di complessare
molecole poco polari.
X- N+
Un tensioattivo cationico
concentra sulla superficie
dell’aggregato anioni, quindi
anche ioni OH-: all’interfaccia
aggregato/acqua il pH sarà
più elevato rispetto a quello
della soluzione anche in
presenza di un tampone
-O
O
O S
Y+
O
Un tensioattivo anionico
concentra sulla superficie
dell’aggregato cationi, quindi
anche ioni H+: all’interfaccia
aggregato/acqua il pH sarà
più basso rispetto a quello
della soluzione anche in
presenza di un tampone
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Conseguenze: il pH sulla superficie di un aggregato micellare è
diverso da quello della soluzione in funzione della carica dei
tensioattivi usati per preparare le micelle.
Esempio: L’indicatore blu di bromotimolo è giallo in ambiente acido
mentre è blu/verde in ambiente basico; a pH vicino alla neutralità
il colore è intermedio e poco intenso.
O
giallo
micelle anioniche
O
S
O
CH3
Br
C
micelle cationiche
OH
blu
CH(CH3)2
CH3
Br
CH(CH3)2
OH
Blu di bromotimolo;
pKa = 7
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Conseguenze: il fatto che il pH sulla superficie di un aggregato
micellare sia diverso da quello della soluzione in funzione della
carica dei tensioattivi usati per preparare le micelle ha delle
implicazioni anche sulla reattività; una reazione con lo ione
OH- (base) sarà più veloce in presenza di un aggregato di
tensioattivi cationici che di tensioattivi anionici.
Esempio: il cristallo di violetto reagisce con OH- per dare una specie
incolore secondo l’equazione:
CH3
CH3
N
CH3
N CH3
CH3 +
N
CH3
+
C
HO
-
H2O
CH3
N
C OH
CH3
N CH3
CH3
N
CH3
blu
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
CH3
incolore
In funzione delle diverse condizioni di reazione si ottengono i
seguenti risultati:
Condizioni di reazione
Osservazione sperimentale
1) Base + tensioattivo anionico
2) Base + nessun tensioattivo
3) Base + tensioattivo cationico
nessuna reazione
reazione lenta
reazione molto veloce
Però:
Condizioni di reazione
Osservazione sperimentale
4) Base + nessun tensioattivo + NaCl
3) Base + tensioattivo cationico + NaCl
reazione lenta (come 2)
reazione meno veloce di 3
Tutte le osservazioni si possono spiegare sulla base della concentrazione di
OH- all’ineterfase micella/acqua e della competizione tra OH- e altri anioni
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Un lipide è un “sapone” biologico. In genere i lipidi si aggregano
per dare luogo a sistemi diversi dalle micelle: le membrane.
Il sistema più semplice è quello costituito da una singola membrana
di due strati di lipidi che si chiude per dar luogo a una vescicola o liposoma
Fosfolipidi
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Una vescicola tagliata a metà
(diametro da 20 a 400 nm)
Ogni membrana è
costituita da un doppio
strato di lipidi (lo
spessore è di poco più
di 3 nm)
Sistemi più complessi
di liposomi sono
caratterizzati da molti
strati di membrane
Aggregati di lipidi sono
usati nella cosmesi
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Ovviamente, i lipidi sono tra i costituenti principali delle membrane
biologiche. Una membrana separa una soluzione acquosa
da un’altra (per esempio l’interno dall’esterno della cellula).
Una membrana biologica è un “sistema supramolecolare” naturale.
Anche tensioattivi sintetici posso assemblarsi spontaneamente
per dare membrane (e vescicole)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Tensioattivi cationici possono interagire con il DNA e dare luogo ad un
complesso supramolecolare; il DNA ricoperto di tensioattivi diventa lipofilo e
può attraversare la membrana cellulare: terapia genica
DNA ricoperto di tensioattivo (mascherato)
Membrana
cellulare
DNA che attraversa la membrana
Un tensioattivo
cationico può
dunque
interagire con
il DNA e farlo
entrare dentro
la cellula
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
La impermeabilità di una membrana può essere modificata da
parte di molecole dette ionofori. Uno ionoforo può “mascherare”
lo ione trasformandolo in una specie lipofila come nel caso
precedente del DNA oppure creare canali nella membrana.
Un sistema supramolecolare artificiale che crea canali in una
membrana è quello costituito da piccoli peptidi ciclici (7-9 ammino
acidi di configurazione alternata) che si impilano spontaneamente
uno sopra l’altro.
Pila di peptidi ciclici
vista lungo l’asse del
canale che formano in
una membrana
Vista laterale: i peptidi sono
tenuti assieme da legami ad idrogeno
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Sistemi supramolecolari possono essere usati come sensori
Riconoscimento molecolare come input
La complessazione di uno ione o molecola
porta ad una variazione misurabile delle
proprietà fisiche del recettore molecolare
Riconoscimento molecolare come output
La complessazione di uno ione o molecola
viene regolata da uno stimolo esterno
(es: luce)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
Esempi di “sensori” di cationi
Non fluorescente
La complessazione comporta una
variazione di colore (assorbimento
a lunghezze d’onda diverse)
©Paolo Scrimin - Università di Padova - la riproduzione a fini commerciali è vietata
La complessazione “accende”
la fluorescenza












