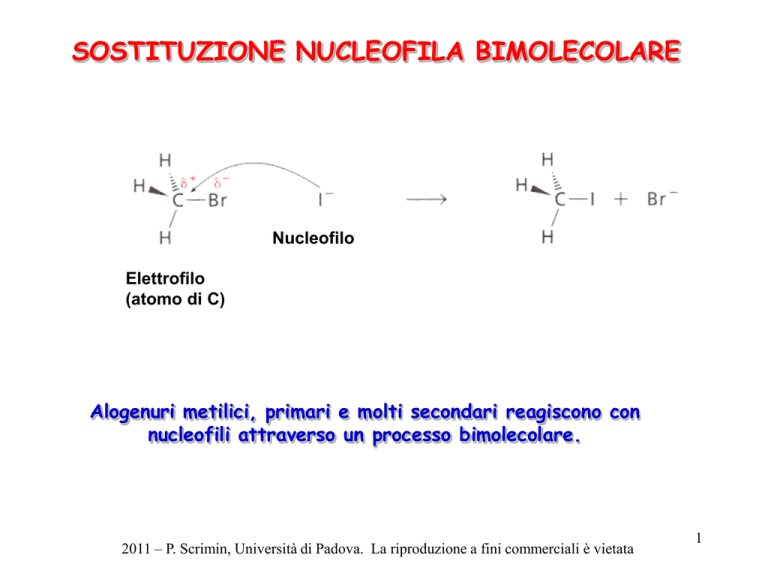
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
Nucleofilo
Elettrofilo
(atomo di C)
Alogenuri metilici, primari e molti secondari reagiscono con
nucleofili attraverso un processo bimolecolare.
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
1
Processo a 10 e-, improbabile per un carbonio elettrofilo
Ci sono 10 elettroni sul Carbonio!
Meccanismo concertato
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
2
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
La velocità di reazione con meccanismo SN2 decresce
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
3
Decorso stereochimico di una reazione SN2
Produzione di prodotti a configurazione opposta a partire da
reagenti enantiopuri
Paul Walden
Quale è il prodotto principale per le due reazioni?
Indicare la configurazione assoluta dei prodotti
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
4
Effetto solvente – solvente polare protico
Lo ione sodio interagirà con il solvente attraverso
interazioni ione-dipolo
La reazione di sostituzione sarà
rallentata
In un solvente protoco, un nucleofilo sarà coinvolto nella formazione di
legami ad idrogemo: queste interazioni ne diminuiranno la nucleofilicità.
Poichè la velocità di una reazione SN2 dipende anche dalla
concentrazione del nucleofilo, questi solventi diminuiranno
significativamente la velocità della reazione.
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
5
Effetto solvente – solvente polare aprotico
In un solvente polare aprotico vi sarà una stabilizzazione del catione
via interazioni dipolo-dipolo mentre l’anione (nucleofilo) non formerà
legami idrogeno con il solvente. Anche le interazioni ione/ione saranno
meno importanti. Questo comporta una maggior densità di carica
negativa sul nucleofilo (maggior concentrazione). Quindi la reazione
sarà più veloce.
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
6
Solventi
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
7
Al contrario in reazioni SN1
si avrà aumento della reattività in solventi polari protici
L’intermedio carbocationico
è stabilizzato dall’interazione
con il dipolo del solvente
Anche il gruppo uscente è
stabilizzato, questa volta
mediante la formazione di
legami idrogeno
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
8
Sintesi di ammine via processo SN2
Bromoetano
Amminoetano bromidrato
Il prodotto iniziale è un sale di ammonio
Bromoetano
Amminoetano
Ammina libera
Dietilammina bromidrato
NH3 in eccesso (16 equiv.)
EtOH-H2O
Bromoetano
NaOH (per neutralizzare
il sale d’ammonio)
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
9
Ciclizzazione di -aloammine
Velocità del processo dipende dalla dimensione del ciclo. La
ciclizzazione è favorita in soluzioni diluite
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
10
SN1 verso SN2
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
11
Che tipo di meccanismo (SN1 o SN2) vi aspettate per le seguenti
trasformazioni? Che prodotti vi attendete?
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
12
Reattività degli alcoli
OH- è un cattivo gruppo uscente
perché è una base forte
Un modo per rendere un OH- un buon gruppo uscente è protonarlo
Mediante reazione acido-base
si genera l’alcol protonato
H2O è un buon gruppo
uscente perché è una base
debole
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
13
Solo HBr e HI forniscono sostituzioni nucleofile con alcoli primari
HCl in presenza di ZnCl2
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
14
ESTERI SOLFONICI
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
15
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
16
alcol
solfonato
alcol
prodotto di sostituzione
prodotto di sostituzione
Vantaggi dell’uso di solfonati (SN2):
• La reazione è stereospecifica
• Si evita la formazione di carbocationi intermedi
e quindi eventuali riarrangiamenti
• Si possono usare molti nucleofili
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
17
Come effettuereste le seguenti trasformazioni?
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
18
Conversione del gruppo OH in LG con reagenti a
base di zolfo e fosforo
• OH viene convertito in un buon gruppo uscente
• Forniscono il nucleofilo (alogenuro)
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
19
Reazione di Mitsunobu - meccanismo
DEAD = Dietil azodicarbossilato
20
Reazione di Mitsunobu – stereochimica (inversione)
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
21
Reattività degli eteri
Sintesi degli eteri (via sostituzione nucleofila)
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
22
Sintesi degli eteri
Gli alcoli si deprotonano difficilmente e questo motivo serve una base
forte (NaH, KH) in solvente polare aprotico.
Alternativamente possono anche essere usati metalli alcalini come Li, Na
e K, sfruttando una reazione di ossido riduzione con conseguente
produzione di H2.
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
23
Sintesi di eteri ciclici
Scrivere la struttura del prodotto principale delle seguenti reazioni:
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
24
Sintesi di epossidi (ossirani)
Stereochimica
ritenzione
inversione
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
25
Gli eteri possono essere scissi con HBr, HI, TMSI
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
26
Sostituzione nucleofila selettiva
Quale è il prodotto atteso della seguente reazione?
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
27
Trimetil iodo silano
Idrolisi del trimetilsilil etere porta ad ottenere gli alcoli corrispondenti
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
28
TMSI viene usato con eteri non simmetrici nei quali uno dei legami
C-O è meno reattivo
Quale è il prodotto atteso della seguente reazione?
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
29
Epossido (ossirani) – eteri ciclici
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
30
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
31
Controllo regiochimico della reazione
Sostituzione alla posizione meno sostituita -meno ingombrata
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
32
Apertura di anello nucleofila, acido catalizzata
opposta regiochimica
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
33
Controllo della regiochimica della sostituzione
pH 7
pH 3.8
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
34
Reazioni di sostituzione di tioli e tioeteri (solfuri)
La funzione tiolica (SH) si protona difficilmente e quindi non è un buon
gruppo uscente: infatti è meno basica dei corrispondenti derivati
ossigenati. Poiché i tioli sono basi deboli possono essere usati come
nucleofili in reazioni SN1. sono migliori nucleofili dei corrispondenti alcoli e
quindi possono essere utilizzati in soluzioni alcoliche.
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
35
I tioli sono più acidi dei
corrispondenti alcoli, per cui
possono essere deprotonati in
condizioni molto più blande
(basta NaOH)
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
36
Lo ione tiolato è un potente nucleofilo
Reagiscono normalmente con un meccanismo SN2
Proporre i prodotti delle seguenti reazioni:
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
37
Tioeteri (Solfuri)
I tioeteri sono dei nucleofili, non reagiscono con i nucleofili. In presenza
di metil ioduro, in soluzione eterea, si metila esclusivamente lo zolfo (che
è più nucleofilo) formando lo trimetilsolfonio ioduro. In presenza di un
nucleofilo si ha una reazione di alchilazione (metilazione) con uscita di
dimetilsolduro (buon gruppo uscente).
La stessa metilazione si sarebbe potuta ottenere per reazione diretta di
metil ioduro con l’ammina secondaria
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
38
Reazioni di sostituzione in ambiente biologico
Nell’ambiente biologico buoni gruppi uscenti
sono ioni fosfato [fosfato PO43-, pirofosfato,
P2O74-, trifosfato P3O105-] e gli analoghi
parzialmente protonati. La sintesi dell’
metionina è un buon esempio di reazione di
sostituzione in ambiente biologico.
39
Le reazioni di sostituzione nucleofila biologiche avvengono
via SN2 su sali di solfonio o esteri fosforici
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
40
N-metilazioni in ambiente biologico (S-adenosilmetionina)
Sintesi della fosfatidilcolina
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
41
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
42
Interazioni non covalenti tra le molecole dei substrati e gli
amminoacidi del siti attivo dell’enzima orientano i due
reagenti al fine di permettere la trasformazione
Interazioni elettrostatiche tra una
catena laterale protonata di una lisina ed
un carbossilato
Interazioni elettrostatiche tra la
catena protonata di una lisina ed il
fosfato carico negativamente
Un legame idrogeno tra il carbonile di un
funzione ammidica dello scheletro
polipeptidico e l’ammino gruppo della
metionina ne diminuisce la nucleofilicità
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
43
Un’altra trasformazione che utilizza la S-adenosilmetionina è la biosintesi
dell’adrenalina dalla norepinefrina. Proporre un meccanismo indicando il movimento
degli elettroni con le frecce
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
44
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
45
Esercizi
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
46
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
47
2011 – P. Scrimin, Università di Padova. La riproduzione a fini commerciali è vietata
48












