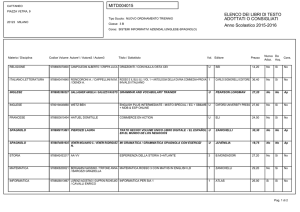
Capitolo 2
La chimica della vita
Copyright © 2006 Zanichelli editore
Atomi e molecole
2.1 Le proprietà caratteristiche dei viventi si
possono osservare a ogni livello della loro
D. Organo:
struttura gerarchica
muscolo delle ali
Le strutture biologiche hanno
un’organizzazione gerarchica
C. Cellule e tessuti:
Cellule muscolari all’interno
del tessuto muscolare
B. Organulo:
miofibrilla (solo nelle cellule
muscolari)
Figura 2.1
Copyright © 2006 Zanichelli editore
A. Molecola: actina
Actina
Miosina
Atomo
Atomi e molecole
2.2 La vita richiede circa 25 elementi che si
possono combinare tra loro per formare i
composti
Per la vita sono fondamentali circa 25 differenti
elementi chimici (sostanze che non possono essere
scomposte in altre sostanze mediante mezzi chimici
tradizionali).
Copyright © 2006 Zanichelli editore
Carbonio, idrogeno, ossigeno e azoto sono i quattro
elementi fondamentali per costruire la maggior parte
della materia vivente.
Tabella 2.2
Copyright © 2006 Zanichelli editore
• Gli elementi in tracce (oligoelementi) sono
essenziali almeno per alcuni organismi, ma
soltanto in minime quantità.
• Certi oligoelementi, come il ferro, sono
indispensabili per tutte le forme di vita, mentre
altri lo sono solo per alcune specie.
Copyright © 2006 Zanichelli editore
• Gli oligoelementi sono additivi comuni di cibo e acqua.
• Carenze alimentari in alcuni oligoelementi possono
causare diverse condizioni fisiologiche.
• Per esempio, una carenza o un eccesso di iodio
impediscono il normale funzionamento della ghiandola
tiroide, provocandone l’ingrossamento (gozzo).
Figura 2.2A
Copyright © 2006 Zanichelli editore
• Gli elementi chimici possono combinarsi insieme per
formare i composti.
• Un composto è una sostanza costituita da più
elementi combinati secondo un rapporto fisso.
Sodio
Figura 2.2C
Copyright © 2006 Zanichelli editore
Cloro
Cloruro di sodio
2.3 Gli atomi sono formati da protoni, neutroni
ed elettroni
L’atomo (il cui nome deriva dalla parola greca àtomos
che significa «indivisibile») è la più piccola unità di
materia che conserva le proprietà di un elemento.
Copyright © 2006 Zanichelli editore
Le particelle subatomiche
• Un atomo è costituito da protoni e neutroni situati
in un nucleo centrale.
• Il nucleo è circondato da elettroni organizzati in
gusci elettronici.
– –
+
+
2e–
+
+
Nuvola
elettronica
Nucleo
2 + Protoni
2
Figura 2.3A
Copyright © 2006 Zanichelli editore
Neutroni
2 – Elettroni
Numero di massa = 4
La diversità tra elementi
Gli atomi di ciascun elemento sono caratterizzati da uno
specifico numero di protoni, che rappresenta il numero
atomico.
Nuvola
elettronica
6e–
++
Nucleo
6 + Protoni
6
Figura 2.3B
Copyright © 2006 Zanichelli editore
Neutroni
6 – Elettroni
Numero di massa = 12
Gli isotopi
• Il numero di neutroni in un atomo può variare.
• Alcuni elementi presentano forme diverse di atomi
dette isotopi.
• Alcuni isotopi sono radioattivi.
Tabella 2.3
Copyright © 2006 Zanichelli editore
COLLEGAMENTI
2.4 Gli isotopi radioattivi possono essere utili ma
anche pericolosi
La ricerca scientifica
I biologi spesso usano i traccianti radioattivi
per seguire le trasformazioni chimiche subite
dalle molecole negli organismi.
Copyright © 2006 Zanichelli editore
La diagnostica medica
I traccianti radioattivi sono spesso usati nella diagnostica
medica in combinazione con sofisticate strumentazioni per
la realizzazione di immagini.
Figura 2.4A
Copyright © 2006 Zanichelli editore
Figura 2.4B
I pericoli della radioattività
• Nonostante le loro molteplici applicazioni positive,
l’esposizione incontrollata agli isotopi radioattivi
può essere nociva per gli organismi viventi.
• Le particelle e l’energia emesse dagli atomi
radioattivi possono spezzare i legami originari tra
gli atomi, formandone altri.
• Questi processi possono danneggiare molecole
importanti all’interno dell’organismo (in particolare,
il DNA).
Copyright © 2006 Zanichelli editore
2.5 La configurazione elettronica di un atomo ne
determina le proprietà chimiche
Gli elettroni in un atomo si dispongono in gusci elettronici
che possono contenere numeri diversi di elettroni.
Guscio elettronico più esterno (può contenere fino a 8 elettroni)
Guscio elettronico più interno (può contenere fino a 2 elettroni)
Elettrone
Idrogeno (H)
Numero atomico = 1
Figura 2.5
Copyright © 2006 Zanichelli editore
Carbonio (C)
Numero atomico = 6
Azoto (N)
Numero atomico = 7
Ossigeno (O)
Numero atomico = 8
• Quando due atomi con un guscio elettronico
incompleto reagiscono, ciascuno di essi mette
in comune (cede oppure riceve) elettroni, in
modo da occuparlo completamente.
• Queste interazioni solitamente fanno sì che gli
atomi vengano tenuti insieme da forze di
attrazione chiamate legami chimici.
Copyright © 2006 Zanichelli editore
2.6 I legami ionici sono interazioni che si stabiliscono
tra ioni di carica opposta
Quando gli atomi cedono o ricevono elettroni si creano
atomi carichi chiamati ioni.
–
Trasferimento
di elettroni
Na
Cl
Na
Atomo di sodio
Cl
Atomo di cloro
Figura 2.6A
Copyright © 2006 Zanichelli editore
–
+
Na
Na+
Ione sodio
–
Cl
Cl–
Ione cloro
Cloruro di sodio (NaCl)
• Due ioni aventi cariche opposte si attraggono.
• Se l’attrazione è abbastanza forte, si forma un
legame detto legame ionico.
• Per esempio, gli ioni sodio e gli ioni cloro si legano
per formare il cloruro di sodio, il comune sale da
cucina.
Na
+
–
Cl
Figura 2.6B
Copyright © 2006 Zanichelli editore
2.7 Mediante i legami covalenti gli atomi condividono
elettroni formando molecole
• Nei legami covalenti due
atomi mettono in comune
una o più coppie di elettroni
poste sui loro livelli
energetici più esterni,
formando molecole.
• Le molecole possono
essere rappresentate in
molti modi.
Tabella 2.7
Copyright © 2006 Zanichelli editore
2.8 Le reazioni chimiche consentono alle sostanze
di ricombinarsi
In una reazione chimica i reagenti (materiali di
partenza) interagiscono, cambiano l’organizzazione
degli atomi e formano il prodotto finale.
Figura 2.8A
Copyright © 2006 Zanichelli editore
2 H2
O2
2 H2 O
• Nelle cellule viventi avvengono migliaia di reazioni
chimiche che trasformano la materia.
• Per esempio, il beta-carotene viene convertito in
vitamina A.
CH 3
CH 3
CH 3
H2C
C
CH 2
H2C
CH
C
C
CH
CH 3
CH
CH
CH
C
C
CH
CH CH
C
CH 3 CH 3
CH
CH
C
CH 3
Beta-carotene
Figura 2.8B
Copyright © 2006 Zanichelli editore
CH
CH
CH
C
CH 3
CH
C
CH 3
CH 2
H2C
CH 2
C
CH 3
CH 2
CH 3
CH 3
O2
4H
2 CH 2
H2C
CH
C
C
CH
CH 3
H
C
C
CH
C
CH
CH
CH
C
CH 3 CH 3
Vitamina A
(2 molecole)
H
OH
Le proprietà dell’acqua
2.9 La molecola dell’acqua è polare
• Una molecola è non polare quando i suoi atomi
legati da legame covalente condividono gli
elettroni equamente.
• In un legame covalente polare la condivisione
degli elettroni tra gli atomi è asimmetrica e crea
una molecola polare (dotata cioè di poli con
cariche parziali opposte).
(–)
(–)
O
H
Figura 2.9 (+)
Copyright © 2006 Zanichelli editore
H
(+)
2.10 La polarità della molecola dell’acqua
consente la formazione del legame idrogeno
• Le estremità cariche delle
molecole d’acqua vengono
attratte dalle estremità
dotate di carica opposta
delle molecole vicine.
• Questa attrazione forma
legami deboli chiamati
legami idrogeno.
Figura 2.10A
Copyright © 2006 Zanichelli editore
Legame
idrogeno
(–)
(+)
H
(+)
O
(–)
H
(–)
(+)
(–)
(+)
2.11 I legami idrogeno sono responsabili della
coesione dell’acqua
• Grazie ai legami idrogeno, le molecole d’acqua
possono spostarsi dalle radici alle foglie di una
pianta.
• Gli insetti riescono a camminare sull’acqua grazie
alla tensione superficiale creata dalla coesione
delle molecole d’acqua.
Figura 2.11
Copyright © 2006 Zanichelli editore
2.12 I legami idrogeno regolano la temperatura
dell’acqua
La capacità dell’acqua di immagazzinare calore
regola la temperatura del corpo e il clima.
Copyright © 2006 Zanichelli editore
• Per rompere i legami idrogeno serve energia
(la rottura dei legami è accompagnata da
assorbimento di calore).
• Per questo, l’acqua è in grado di assorbire una
grande quantità di calore senza un grande
aumento nella temperatura.
• Mentre l’acqua si raffredda, un piccolo calo
nella temperatura libera una grande quantità di
calore.
Copyright © 2006 Zanichelli editore
• Quando una molecola d’acqua evapora, assorbe
energia.
• Questo permette il raffreddamento (abbassamento
di temperatura) per evaporazione.
Figura 2.12
Copyright © 2006 Zanichelli editore
2.13 Il ghiaccio è meno denso dell’acqua allo stato
liquido
I legami idrogeno tengono insieme le molecole nel
ghiaccio in modo meno denso che nell’acqua allo
stato liquido.
Legame idrogeno
Figura 2.13
Ghiaccio
I legami idrogeno sono stabili
Copyright © 2006 Zanichelli editore
Acqua allo stato liquido
I legami idrogeno si spezzano
e si formano continuamente
• Il ghiaccio è meno denso dell’acqua allo stato
liquido ed è per questo che galleggia.
• Il fatto che il ghiaccio galleggi, protegge i laghi
e gli oceani dal congelamento solido.
Copyright © 2006 Zanichelli editore
2.14 L’acqua è un solvente versatile
I soluti polari o carichi si sciolgono quando le
molecole d’acqua li circondano, formando soluzioni
acquose.
Na+
–
+
–
–
Cl
+
–
+
–
Ioni in
soluzione
Figura 2.14
Copyright © 2006 Zanichelli editore
Na+
Cl–
+
–
+
–
+
–
+
–
–
Cristallo
di sale
–
2.15 La chimica della vita è influenzata
dall’acidità e dalla basicità
• Un composto chimico che cede ioni H+ a una
soluzione è un acido.
• Un composto che è in grado di accettare ioni
H+ rimuovendoli da una soluzione è una base.
• L’acidità è misurata sulla scala del pH che va
da 0 (massima acidità) a 14 (massima basicità).
Copyright © 2006 Zanichelli editore
La scala del pH:
Scala del pH
0
1
Soluzione acida
OH –
OH –
OH –
H+ H+
–
OH – OH
H+ H+ H+
Soluzione neutra
OH
–
OH –
OH – H + OH –
OH – OH – –
OH
H+
Figura 2.15
Copyright © 2006 Zanichelli editore
Soluzione basica
NEUTRALITÀ
[H + ]=[OH –]
2
Succo di limone, succhi gastrici
3
Succo di pompelmo
4
Succo
di pomodoro
5
6
Urina
7
Acqua pura
Sangue umano
8
BASICITÀ in aumento
H+ H+
ACIDITÀ in aumento
+
H+ H
H + OH – H +
OH – H + H +
Acqua di mare
9
10
Bicarbonato
11
12
13
14
Ammoniaca
per uso domestico
Candeggina
per uso domestico
Schiuma detergente
per f orni
Acqua
• Il pH della maggior parte delle cellule è tenuto
vicino a 7 (neutro) dalle sostanze tampone.
• Le sostanze tampone contrastano i
cambiamenti di pH (accettando ioni H+ quando
sono presenti in eccesso e cedendoli se la loro
concentrazione diventa troppo bassa).
Copyright © 2006 Zanichelli editore