PIETRO OMODEO
Evoluzione della cellula
un approccio multidisciplinare
NATURALMENTE
1 scienza
NATURALMENTE
scienza
Segretario di redazione: Enrico Pappalettere ([email protected])
Direttore responsabile: Luciano Luciani
Impaginazione: Vincenzo Terreni
Registrato il 25 febbraio 1989 presso il Tribunale di Pisa al n. 6/89
Informazioni: 050 /7213020; fax: 06/233238204
I diritti di memorizzazione elettronica, di riproduzione e di adattamento totale
o parziale con qualsiasi mezzo (compresi microfilm, foto e scansioni digitali
e copie fotostatiche) sono riservati.
Immagine di copertina di Pietro Omodeo
www.naturalmentescienza.it
In copertina
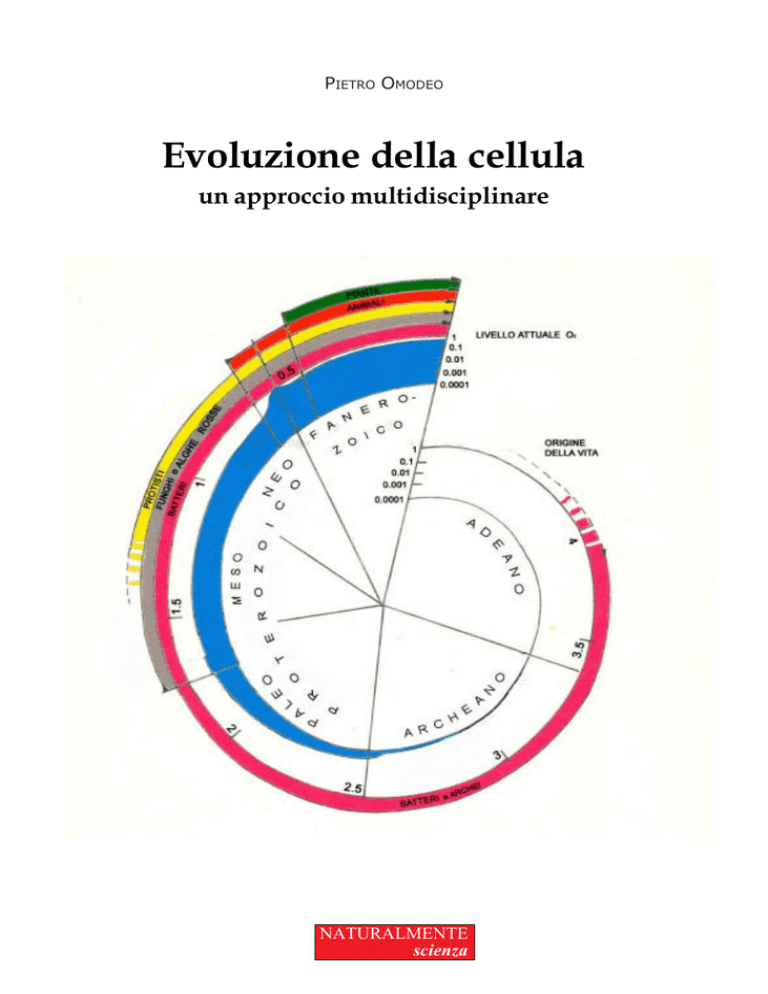
Fig. 1.1 - Schema della storia dei vari regni dei viventi sulla Terra. Gli archi colorati
indicano l’ordine di comparsa dei viventi. All’interno la crescita del contenuto di
ossigeno dell’atmosfera è espressa in scala logaritmica. Le date sono in miliardi di
anni.
2
Indice
6
Prefazione
Capitolo 1 - Introduzione
7
1.1. Perché questa ricerca?
7
1.2. I precedenti storici
10
1.3. Contributi recenti
Capitolo 2 - Metodi
12
2.1. Macroevoluzione e microevoluzione, cioè evoluzione progressiva
ed evoluzione adattativa
13
2.2. Interazione popolazione/ambiente
14
2.3. Evoluzione e dialettica
15
2.4. Impiego delle teorie dell’informazione e del controllo
15
2.5. Problemi particolari
16
2.6. Ancora sul metodo comparativo
Capitolo 3 - Esame comparativo dei primi tre compartimenti della
cellula
18
3.1. La membrana plasmatica dei procarioti
21
3.2. La membrana plasmatica degli eucarioti
23
3.3. Il sostegno della cellula procariote
25
3.4. Il sostegno della cellula nei bassi eucarioti
26
3.5. L’apparato enzimatico e il flusso di energia nella cellula procariote
28
3.6. Fotosintesi ossigenica, circolazione del Carbonio e dell’Azoto
31
3.7. Gli organelli sede del ricambio energetico della cellula eucariote
32
3.8. Problemi di dimensioni
Capitolo 4 - Il più grande salto evolutivo: la ristrutturazione del genoma
37
4.1. Il genoma dei procarioti e la sua replicazione
40
4.2. Perché il genoma dei procarioti è rimasto tanto piccolo?
42
4.3. Implicazioni del principio della non ripetibilità delle sequenze
nucleotidiche nei procarioti
42
4.4. Difficoltà relative al principio di Thomas
43
4.5. Il controllo dell’erogazione dell’informazione genetica e i suoi
problemi
3
45
47
4.6. La soluzione dei vincoli che inibiscono l’accrescimento del genoma
dei procarioti
4.7. Ripercussioni funzionali della ristrutturazione del genoma
Capitolo 5 - Il controllo del flusso di informazione genetica
48
5.1. Il lac-operone esempio di autocontrollo nella cellula batterica
50
5.2. Le priorità nella utilizzazione delle fonti energetiche della cellula
51
5.3. Autocontrollo sulla sintesi proteica
52
5.4. Regolazione cronologica dell’attività cellulare
55
5.5. Operoni e reguloni
56
5.6. Morfologia funzionale del gene operatore e delle proteine regolatrici
58
5.7. Chi controlla il controllore? ovvero: contare le molecole
Capitolo 6 - Comparsa del nucleo eucariote e scomparsa di altri vincoli
presenti nella biologia molecolare dei procarioti
60
6.1. L’involucro nucleare
62
6.2. Disaccoppiamento di trascrizione e traduzione dell’RNA messag
gero
63
6.3. Le modifiche del genoma richiedono ulteriori adattamenti strutturali
65
6.4. I presupposti della mitosi
65
6.5. L’accrescimento del genoma degli eucarioti
67
6.6. Quale impiego per l’ accresciuta capacità di memoria?
69
6.7. DNA ridondante, una memoria olografica?
70
6.8. Per concludere questa parte
Capitolo 7 - La cellula proto-eucariote
73
7.1. Origine delle cellule eucarioti
73
7.2. Digressione sulla semplicità primitiva o per regressione dei funghi
eumiceti
75
7.3. Rapporti filogenetici ed ecologici tra funghi eumiceti e alghe rosse
77
7.4. Altri proto-eucarioti?
78
7.5. Organizzazione funzionale della cellula proto-eucariote
Capitolo 8 - Cariologia e sessualità della cellula proto-eucariote
82
8.1. Cariologia della cellula proto-eucariote
4
82
86
87
89
90
91
8.2. Mitosi e citodieresi nelle alghe rosse
8.3. Presso gli eucarioti la sessualità implica la cariogamia e la
successiva meiosi
8.4. Il complesso sinaptonemale
8.5. La parasessualità
8.6. Tendenza alla multicellularità.
8.7. Conclusione
Capitolo 9 - Il passaggio da cellula proto-eucariote a cellula eucariote
93
9.1. Differenze funzionali tra cellule proto-eucarioti ed eucarioti
94
9.3. L’apparecchiatura per la motilità e le tassìe
95
9.4. L’apparato flagellare della cellula eucariote
96
9.5. Ipotesi sull’origine del flagello
98
9.6. I chitridi, prime cellule munite di flagello
98
9.7. L’acquisizione della contrattilità citoplasmatica
99
9.8. Evoluzione dell’apparato flagellare
100 9.9. L’apparato fototattico
Capitolo 10 - Trend evolutivi dei protisti
107 10.1 Mitosi e meiosi nelle cellule dei protisti
109 10.2 Tutto chiaro nell’evoluzione del genoma?
111 10.3 Endosimbiosi e trasferimento laterale dei geni
113 10.4 Tendenze alla multicellularità nei protisti
118 10.5 E per ultima venne l’apoptosi
120
Bibliografia
5
Prefazione
Ho seguito il problema dell’evoluzione della cellula durante molti
decenni. I decenni che hanno visto lo sviluppo della microscopia elettronica,
della microbiologia, della biologia molecolare e della genomica, che hanno visto
la nascita delle teorie dell’informazione e del controllo, nonché lo studio delle
antiche rocce che conservano i documenti della geocronologia e i fossili di
un’epoca tanto remota che ci si smarrisce nel tentativo di farsene un’idea.
Ho evitato di drogarmi con le novità, perché so che il lavoro dei biologi e
dei naturalisti che ci hanno preceduti ha fornito tante notizie che attendono di
essere comprese, rivalutate e utilizzate. So anche, però, che occorre saper
rinunciare, quando bisogna, a vecchie convinzioni accettate dalla comunità
scientifica e anche a idee che ci sono care.
Ho resistito alla tentazione di pubblicare conclusioni affrettate che il
susseguirsi delle scoperte poteva vanificare, limitandomi a pubblicare di
quando in quando i risultati che ritenevo, ed ancor adesso ritengo, sicuri.
Oggi, prima di tirare i remi in barca, credo opportuno pubblicare i risultati
della lunga ricerca che ho portato in forma riassuntiva al convegno sulla
macroevoluzione organizzato da Felicita Scapini a Firenze nel 2006.
Sono grato ai colleghi che mi hanno dato una mano e ringrazio in modo
particolare Marcello Buiatti, Giovanni Cercignani, Renato Fani, Simonetta
Gribaldo e mio figlio Eugenio che mi hanno aiutato a migliorare il testo;
Emilia Rota che mi ha aiutato a rintracciare la bibliografia e mi ha dato
sostegno nel redigere queste pagine Federico Marri che ha curato le immagini e
Gabriella Bonifazi per l’assistenza tecnica.
Ringrazio infine la redazione di NATURALMENTE che ha preparato il testo
per la stampa in modo impeccabile.
Siena, Settembre 2010
6
Capitolo 1
Nescio quo pacto antiquus
fit animus. Tito Livio
Introduzione
1.1. Perché questa ricerca?
La ricerca metodica degli avanzi fossili delle più antiche cellule è iniziata
intorno alla metà del Novecento. Non è stata impresa facile poiché le rocce
sedimentarie formatesi nei tempi più remoti e non modificate dal calore e da
altri agenti fisici sono rare e debbono essere studiate con apparecchiature
molto sofisticate. È risultato che i più antichi batteri sono riconoscibili in rocce
databili intorno a 3,45 miliardi di anni (Schopf & Barghoorn 1967, Schopf
2006, Brasier et al. 2006) e che sostanze di origine biogena sono ancor più
antiche, di circa 0,35 miliardi di anni. D’altra parte i più antichi fossili di animali
sono stati trovati in sedimenti datati 0,6 miliardi anni fa, la loro comparsa può
essere retrodatata a non più di 0,7 miliardi di anni1 mentre le piante superiori
sono comparse molto dopo2. Un semplice calcolo ci dice quindi che per circa
l’80% del tempo la vita sulla Terra è stata rappresentata solo da organismi
unicellulari e per circa il 20% anche da animali e piante (fig. di copertina). Tale
dato indica che l’evoluzione dei viventi ha coinciso per la maggior parte del
tempo con l’evoluzione della cellula, che è la più piccola e semplice struttura
che si deve considerare dotata di vita. Nonostante l’emergere di tante novità,
per molti decenni lo studio dell’evoluzione della cellula è stato compiuto
episodicamente, non in modo sistematico ed accurato come è avvenuto invece
per l’ evoluzione di animali e piante. Tanto è vero che nei più importanti trattati
di citologia se ne fa solo un breve cenno o non se ne parla affatto. Scelta non
giusta poiché l’evoluzione della cellula comprende eventi di estremo interesse,
qual è, ad esempio, il passaggio dall’organizzazione di tipo procariote
all’organizzazione di tipo eucariote del genoma. Fortunatamente recenti
ottime pubblicazioni hanno rilanciato l’intera questione3.
1.2. I precedenti storici
Verso la fine dell’Ottocento R. Altmann (1890) avanzò l’ipotesi che i
mitocondri, descritti come componenti delle cellule animali, fossero stati, in
7
origine, batteri endosimbionti di quelle cellule. L’idea venne approvata e
rilanciata da C. Mereschkowsky (1910), che la estese ai cloroplasti, organelli
delle cellule vegetali; secondo lui derivavano da alghe azzurre (oggi: cianobatteri). Entrambe le ipotesi sono state rifiutate, perché basate soltanto su vaghe
analogie di forma e dimensioni. Wallin (1922, 1927), tuttavia, ha riproposto
che la fusione di batteri con una cellula ospite era la principale fonte di novità
genetiche per la speciazione.
Infine, quando la genetica è giunta a riconoscere che esisteva un’ereditarietà
propria dei cloroplasti e dei mitocondri, e quando la microscopia elettronica
e la fisiologia cellulare hanno stabilito la struttura e le funzioni di detti organelli
cellulari, nonché la presenza in essi di DNA di tipo batterico, le idee rifiutate
sono apparse quasi profetiche e sono state rilanciate, soprattutto per merito
di Lynn Margulis.
continua ...
8
Capitolo 2
Metodi
La logica da adottare in un’indagine di tipo storico, qual è quella che riguarda
l’evoluzione della cellula, è la logica induttiva. Nel caso specifico questa logica
prescrive di ricercare documenti di ogni tipo relativi all’oggetto dell’indagine
e ogni indizio che paia utile a collegarli tra loro, entro un quadro funzionale
fornito dalla fisiologia cellulare ed entro un quadro cronologico fornito dagli
studiosi di una disciplina indipendente, la geocronologia.
2.1. Macroevoluzione e microevoluzione, cioè evoluzione progressiva ed evoluzione
adattativa
L’evoluzione della cellula per la sua vastità e durata andrebbe catalogata,
secondo i criteri in uso, come macroevoluzione. Tuttavia, intorno alla diade
macroevoluzione/microevoluzione sono sorte controversie che vertono su
tre questioni: dove termina la microevoluzione e dove incomincia la macroevoluzione?
Quali sono i processi coinvolti nell’uno e nell’altro caso?
Come viene innescata la macroevoluzione?
Le controversie sono nate, io credo, dal fatto che le due dotte parole sono state
introdotte nel lessico scientifico senza adeguata definizione, sicché ognuno le
ha usate a modo suo. Conviene quindi abbandonare le anticaglie e usare
termini e locuzioni più puntuali e criteri più stringenti, che conservino tuttavia
un po’ di elasticità.
Ho suggerito tempo addietro (1985) di parlare di evoluzione adattativa per i casi
in cui un più affidabile e meno costoso adeguamento della specie a nuove
condizioni ambientali è stato conseguito attraverso la somma di mutazioni
qualitative del patrimonio ereditario collettivo. In quella occasione ho anche
proposto di parlare invece di evoluzione per complessificazione o evoluzione progressiva
quando il processo evolutivo ha realizzato una complessificazione dell’organismo mediante mutazioni quantitative del patrimonio ereditario di una
specie, dando così un durevole vantaggio selettivo alla sua discendenza.
L’evoluzione adattativa per mutazioni qualitative puntiformi di geni strutturali e regolatori è quella che ha contribuito in larga misura all’evoluzione del
vasto insieme degli organismi procarioti ed è anche quella universalmente
accolta da tutti gli specialisti.
9
L’evoluzione progressiva -che è quella che un più numeroso pubblico cita
nell’osservare che il pesce è più evoluto dell’anfiosso e la quercia più del
muschio- avviene per aggiunte innovative di geni strutturali e regolatori al
patrimonio ereditario di una specie. Il repertorio delle modalità con cui ciò
avviene è molto vasto e Ohno (1970) ne ha dato un importante resoconto;
dopo di lui, Ohta ha chiarito che per questo tipo di mutazione i processi
selettivi entro le popolazioni procedono secondo le regole accertate dai molti
studi sulla genetica e l’ ereditarietà. In precedenza lo studio della sessualità nei
procarioti aveva reso noto che, mediante i fenomeni di trasformazione, un ceppo
batterico può acquisire geni di specie diverse. Altri studi hanno chiarito che,
presso i protisti, intere batterie di geni di un organismo endosimbionte
possono passare nel genoma della cellula ospitante.
Insomma, le “macromutazioni” tanto cercate nel passato sono state identificate in un incremento del numero di geni del patrimonio ereditario. È
opportuno quindi convincersi della validità delle tesi di Ohno che Gregory
Bateson (1979) così sintetizza: “Ogni passo dell’evoluzione è un’aggiunta di
informazione al sistema già esistente” e le terrò presenti durante questa
indagine.
continua ...
10
Capitolo 3
Esame comparativo dei primi tre
compartimenti della cellula
Al fine di non trascurare alcun fatto di rilievo relativo alla cellula, conviene
prendere in considerazione ciascun compartimento di cui essa è composta, le
funzioni che ciascun compartimento assolve, i materiali di cui esso è fatto.
I compartimenti funzionali che si individuano in ogni e qualunque cellula
sono quattro. Il primo è quello che delimita la cellula stessa e presiede ai suoi
scambi di materiali e di informazioni; si tratta della membrana plasmatica (o
cellulare) che consta di una doppia lamina lipidica contenente nel proprio
spessore molte e varie molecole proteiche con funzioni di trasduttori di
materiali e di energia, nonché di segnali chiave per il comportamento della
cellula. Il secondo è quello che presiede al metabolismo energetico e materiale
e consta di proteine con funzioni catalitiche e di molecole a base di pirofosfati
che possono immagazzinare e poi cedere un quanto di energia chimica.
Il terzo compartimento è quello che conferisce forma alla cellula e sostegno alle
sue strutture: se questo compartimento compare come scheletro interno
risulta formato da polimeri filamentosi di speciali proteine, se compare come
parete cellulare esterna può avere natura varia e composita.
L’ultimo compartimento è quello del genoma (o patrimonio genetico) che via
via immagazzina e dispensa l’informazione genetica e dispone degli strumenti
necessari alla produzione di tutti i materiali che provvedono alla crescita, alla
riparazione e alla riproduzione della cellula. Questo compartimento consta,
chimicamente, di polimeri degli acidi ribo- e deossiribonucleico (RNA, DNA)
e di molecole proteiche ad essi associate.
I quattro compartimenti, ripeto, esistono in tutte le cellule anche se non
sempre appaiono fisicamente separati ed anche se il confronto ci dice che la
loro composizione e la loro struttura sono mutate nel corso dell’evoluzione.
3.1. La membrana plasmatica dei procarioti
La disposizione dei gruppi idrofili su entrambe le facce della membrana
cellulare consente alla cellula di stabilire stretti rapporti fisici tanto col medium
acquoso circostante quanto col citosol interno e favorisce l’ingresso di molecole
dotate di cariche di entrambi i segni, quali sono gli amminoacidi. Favorisce
11
anche l’inserimento nel proprio interno di molecole proteiche o di porzioni di
molecole proteiche che sulla loro superficie presentino una forte prevalenza
di gruppi idrofobi.
D’altra parte la membrana lipidica si oppone al transito tanto di molecole
idrofile quanto di ioni metallici. All’ingresso e all’uscita di queste molecole e
di questi ioni indispensabili alla crescita e al funzionamento della cellula
provvedono speciali molecole o gruppi di molecole proteiche inserite nella
membrana stessa. In questa sede non è il caso di entrare nei dettagli ma è
certamente opportuno accennare al fatto che l’attività dei canali di trasporto
ionico per Na+ e K+ nonché il comportamento di alcuni altri ioni fanno sì che
cariche elettriche positive e negative si distribuiscano in modo asimmetrico
sulle due facce della membrana plasmatica e quindi compaia una differenza
di potenziale elettrico tra l’esterno e l’interno della cellula. Tale fenomeno
genera l’eccitabilità della cellula che risponderà in un qualche modo a ogni
variazione del potenziale transmembrana comunque provocata.
continua ...
12
Capitolo 4
Il più grande salto evolutivo: la
ristrutturazione del genoma
L’esame comparativo dei primi tre compartimenti cellulari rivela che:
1) La composizione della membrana plasmatica varia nella procellula in modo
cospicuo per quanto riguarda le specie dei lipidi, e in modo non evidente per
quanto riguarda le specie di proteine in essa presenti. Per l’eucellula l’evoluzione della membrana plasmatica è stata molto importante, sia per l’aumentata
varietà di molecole che intervengono nella composizione di detta membrana,
sia perché partecipa all’acquisizione di nuove importanti attività fisiologiche:
endocitosi, esocitosi, moto ameboide.
2) Il compartimento relativo alla protezione e al sostegno della cellula
eucariote ha subìto trasformazioni grandi: in vari casi rimane oscuro in quale
direzione sia avvenuta l’acquisizione delle varianti biochimiche. Presso le
piante superiori il ruolo della parete cellulare è divenuto decisivo anche per la
morfogenesi.
3) Il compartimento del metabolismo cellulare è molto vario per quanto
riguarda le sorgenti di energia che i batteri possono sfruttare, risulta invece
molto meno vario presso gli archei; e si restringe ancor più presso le cellule
eucarioti; queste, per ciò che riguarda l’organicazione dell’azoto, dipendono
da batteri e archei, mentre per la respirazione e per la fotosintesi dipendono
dall’endosimbiosi con specie batteriche. L’eucellula, peraltro, nel corso dell’evoluzione, è divenuta capace di ricavare energia dal substrato organico nel
modo più completo ed esente da sprechi.
Ciò stabilito, rimane da considerare il più grande salto evolutivo della storia
dei viventi: la ristrutturazione del genoma a seguito della quale esso diviene
capace di prestazioni assai superiori a quelle del genoma dei procarioti.
4.1. Il genoma dei procarioti e la sua replicazione
Il genoma batterico (fig. 4.1 a) consiste, tipicamente, di un cromosoma anulare
o di un cromosoma lineare formato da uno-otto milioni di coppie di
nucleotidi1 (bp) avente 0.25-2 millimetri di lunghezza, affiancato spesso da
uno o pochi minicromosomi anulari chiamati plasmidi, di dimensioni molto
varie, da 1.5 a 600 Kbp.
13
Il quoziente tra numero di nucleotidi e numero di geni è di regola superiore
a 1000.
Presso le specie di batteri divenute parassiti endocellulari, anche se lontane dal
punto di vista filogenetico, le dimensioni del cromosoma si riducono di circa
un ordine di grandezza, il valore più basso sinora riscontrato è quello di
Carsonella ruddii: 160 Kbp. Presso le procellule che svolgono attività ana
aboliche complesse a bassa resa energetica e che realizzano forme complicate
(cianobatteri, streptomiceti, batteri azoto-fissatori) il genoma può raggiungere
invece dimensioni maggiori, fino a 9 Mbp e oltre. Va notato che in questi ultimi
prevalgono i cromosomi lineari.
Il genoma degli archei (fig. 4.1 b) non differisce in modo evidente da quello
dei batteri: il numero di nucleotidi è mediamente minore di un terzo, il
A
quoziente tra numero di nucleotidi/numero di geni è spesso inferiore a 1000.
Importante è il rapporto del loro DNA con le molecole degli istoni (vedi § 4.6),
che negli archei sono comuni e talvolta formano nucleosomi, masserelle
globulari intorno alle quali si avvolge il DNA, si ritiene siano evoluti per difesa
contro la denaturazione termica.
continua ...
14
Capitolo 5
Il controllo del flusso di informazione
genetica
All’inizio dell’Ottocento il grande anatomista tedesco Samuel Thomas Sömmering chiedeva: “kann eine Flüssigkeit animirt sein?” chiedeva cioè : “ può
un flusso essere qualcosa di animato?”.
La polemica domanda di Sömmering derivava da considerazioni di ordine
filosofico e mistico, comunque la biologia moderna può dare ad essa una
risposta precisa che va a toccare il fondo delle conoscenze sulla vita: ogni
organismo vivente è sede di un perenne flusso di energia, materia ed
informazione, quest’ultimo dipende da materia ed energia e, a sua volta, regola
il proprio flusso e quello delle altre due grandezze fisiche. Proprio per queste
considerazioni la capacità di autoregolazione si situa tra le proprietà di base
di tutti i viventi.
Simile modo di intendere i viventi -e quindi anche la cellula- deriva da una folla
di nozioni relative alla fisiologia, alla genetica, alla termodinamica, alla teoria
dell’informazione ed ha trovato negli sviluppi della biologia molecolare conferme estremamente importanti che permettono di utilizzarlo in modo rigoroso e
produttivo per il problema che stiamo affrontando (v. Omodeo, 1996).
Lo scambio di informazioni tra il genoma e il citoplasma si svolge attraverso
una rete complessa di canali in modo assai preciso. Ciò fa sì che l’insieme dei
geni in cui è suddiviso il patrimonio ereditario non funzioni come un’accozzaglia di solisti, come diceva Dobzhansky, bensì come una disciplinata
orchestra.
In questo capitolo ne esamineremo due esempi molto istruttivi e questo esame
gioverà anche a valutare meglio quanto prima esposto.
5.1. Il lac-operone esempio di autocontrollo nella cellula batterica
Il primo modello riguardante il modo in cui il genoma dei batteri regola il
flusso di energia che di esso deriva, è scaturito dalle ricerche di F. Jacob e J.
Monod sul metabolismo del lattosio nel batterio Escherichia coli. Il modello è
stato pubblicato nel 1961, poco prima del completo chiarimento del codice
genetico e del modo in cui vengono sintetizzate le proteine; esso è stato
prontamente apprezzato per il suo valore e può essere così riassunto: in
15
condizioni di riposo la batteria dei geni strutturali (operone) che specifica un
gruppo di proteine che intervengono nel metabolismo del lattosio è preceduta
lungo il cromosoma da un gene regolatore, indicato come operatore il quale è
preceduto a sua volta da un altro gene indicato come promotore nel cui sito si
colloca la RNA-polimerasi (fig. 5.1A). In assenza di substrato la RNApolimerasi non può avanzare e provvedere alla trascrizione del gruppo di geni
strutturali poiché sul gene operatore è collocata una molecola proteica che
funge da repressore. Se però nella cellula entrano alcune molecole di lattosio -il
substrato su cui deve agire il gruppo di proteine enzimatiche- una di queste
molecole si lega al repressore che a seguito di ciò si deforma1 e si distacca
dall’operatore. La RNA-polimerasi trova così via libera ed effettua la trascrizione
dei geni che provvedono a produzione le proteine occorrenti sia alla introduzione del substrato nella cellula sia alla sua demolizione (fig. 5.1B).
continua ...
16
Capitolo 6
Comparsa del nucleo eucariote e
scomparsa di altri vincoli presenti nella
biologia molecolare dei procarioti
6.1. L’involucro nucleare
Il più vistoso attributo della cellula eucariote è il nucleo, costituito da un
involucro di notevole complessità contenente la cromatina . La sua origine è
stata ricostruita più volte da vari autori, me compreso, in modo simile
postulando alcune tappe successive:
1) L’introflessione della membrana plasmatica, questa introflessione si riscontra per le procellule che sono sede di una attività metabolica che richiede
un’ampia superficie di sostegno per i propri apparati enzimatici.
2) L’introflessione avrebbe avuto inizialmente la forma di una coppa e poi si
sarebbe chiusa come una palla, munita di un gran numero di pori nucleari,
varchi selettivi di grande complessità, attraverso i quali il genoma comunica
col citoplasma trasferendovi ribosomi, mRNA, tRNA, e ricevendo da esso sia
macromolecole proteiche sintetizzate nel citoplasma -tra le quali gli istoni
parte integrante della cromatina- sia varie specie di proteine che regolano
l’espressione genica.
3) In rapporto al ruolo di sostegno dell’apparato mitotico, l’involucro nucleare
ha acquisito un robusto strato interno formato da una rete di filamenti intermedi
(lamine nucleari) ed uno analogo esterno, meno robusto; questi filamenti
intermedi evolveranno in seguito acquistando ruoli sempre più importanti per
il sostegno della cellula.
La comparsa dell’involucro nucleare è facile da immaginare, meno facile è
capire perché, come e quando si sia differenziato il sistema di varchi selettivi
di grande complessità, ciascuno dei quali è formato da non meno di 50 specie
proteiche disposte secondo una precisa geometria ottagonale.
In effetti la ricostruzione proposta presenta un punto debole: un nucleo a
forma di coppa non ha bisogno di pori, di conseguenza l’idea che i pori
nucleari, che controllano in modo puntiglioso il traffico delle molecole che
entrano ed escono dal nucleo (uno dei più bei capitoli della fisiologia cellulare),
siano evoluti d’emblée subito dopo la chiusura della coppa ci lascia increduli.
17
Tanto più che ciascuna macromolecola abilitata ad entrare porta un segnale di
riconoscimento per l’ingresso (nuclear localization signal) mentre ciascuna macromolecola abilitata ad uscire porta un segnale diverso. Bisogna credere che
l’evoluzione dei pori e l’evoluzione dei segnali per il traffico abbiano
proceduto di pari passo e in tempi lunghi.
Conviene quindi supporre che gli eventi chiave per l’evoluzione della cellula
eucariote abbiano seguito un ordine diverso, che può essere il seguente: 1)
formazione della cromatina e conseguente comparsa di una nuova meccanica
per la separazione dei cromatidi, basata sul citoscheletro e assistita da proteine
motrici; 2) introflessione della membrana plasmatica in corrispondenza della
zona ove aderiscono i ribosomi deputati a produrre le strutture che provvedono all’ingresso e all’uscita di macromolecole: si forma così il reticolo
endoplasmico (di questo evento dovrebbe rimanere traccia nella composizione molecolare dei pori nucleari e del reticolo endoplasmico); 3) subentra
l’endosimbiosi col precursore dei mitocondri il quale conserva la propria
parete e con essa tutte le proprie prerogative genetiche; 4) segue lo sviluppo
del nucleo e il reciproco adattamento dei due simbionti durante il quale
evolvono i pori e i segnali di localizzazione nucleare delle molecole e si giunge
infine 5) al completamente dell’involucro nucleare che racchiude i cromosomi
lasciando fuori i microtubuli e alla perdita della parete da parte del batterio
endosimbionte (fig. 6.1).
continua ...
18
Capitolo 7
La cellula proto-eucariote
7.1. Origine delle cellule eucarioti
Secondo la tesi discussa e accolta all’ inizio di questo libro, la prima cellula
eucariote sarebbe derivata da quella di un archeo che aveva inglobato una
cellula batterica capace di utilizzare l’ossigeno per la respirazione cellulare. A
favore della proposta che la cellula ospitante sia stata quella di un archeo
depongono molte caratteristiche che accomunano il dominio degli archei a
quello degli eucarioti (altre, meno rilevanti, vengono omesse): 1) alcune famiglie
di proteine sono condivise da archei ed eucarioti, ma mancano o sono poco
rappresentate nei batteri; 2) la struttura della RNA polimerasi nei batteri consta
di 4 subunità, mentre negli archei è costituita da 8-12 subunità, come negli
eucarioti, in questi ultimi, peraltro, se ne conoscono tre varianti che coesistono
entro la medesima cellula; 3) la tripletta di mRNA che dà inizio alla traduzione
in tutti gli organismi è AUG, ma negli archei e negli eucarioti essa specifica
l’amminoacido metionina, mentre nei batteri specifica l’amminoacido Nformil-metionina; 4) la composizione dei ribosomi degli archei somiglia di più
a quella degli eucarioti che a quella dei batteri (v. Lecompte et al. 2002); 5) negli
archei si rinvengono istoni le cui molecole somigliano a quelle degli eucarioti e
che, come queste, in alcune specie formano nucleosomi attorno ai quali si
avvolge il DNA (fig. 4.4); le proteine istoniche sono rare presso i batteri.
È da sperare che il rinvenimento e lo studio di altre specie di archei rivelino
che nel loro citoplasma sono presenti altre proteine che sono proprie degli
eucarioti e svolgono in essi ruoli determinanti, soprattutto nella dinamica della
mitosi: tubulina e dineina Se ciò accadrà, la tesi, di per sé solida, potrà essere
accolta come fatto accertato. Si ripresentano a questo punto le domande: quali
erano le caratteristiche della prima cellula eucariote? Quali delle tante eucellule
oggi note conserva meglio queste caratteristiche? Per rispondere a queste
domande bisogna prima sciogliere il nodo della posizione da assegnare ai
funghi nella scala evolutiva.
7.2. Digressione sulla semplicità primitiva o per regressione dei funghi eumiceti
Molti autori ritengono che la cellula dei funghi eumiceti abbia l’organizzazione
più semplice tra gli organismi eucarioti, altri autori non sono espliciti a questo
19
proposito, ma non sollevano obiezioni. Tuttavia, sulla primitività di questo
tipo di cellula (come già detto al § 2.5) quasi tutti i citologi dissentono e
sostengono che la semplicità organizzativa e funzionale è dovuta ad evoluzione regressiva da antenati prossimi al regno animale e più evoluti dei protisti.1
Certo, fenomeni di regressione sono noti da tempo presso molti animali
parassiti. Il caso più clamoroso riguarda i crostacei endoparassiti del genere
Sacculina i quali allo stadio vegetativo somigliano al micelio dei funghi. Questi
animali, tuttavia, conservano integro nel proprio patrimonio genetico l’apparato per una morfogenesi da crostaceo, ed in effetti dalle uova schiudono
semplici nauplii i quali si trasformano in larve cipridiformi, tipiche dei
Cirripedi. Casi di regressione meno vistosi riguardano i Branchiuri, crostacei
ectoparassiti dei pesci, i quali conservano solo un’incerta affinità con i
Copepodi. Altri casi ancora riguardano i Pentastomidi derivati da artropodi
prossimi ai crostacei e i Mizostomi, anellidi policheti parassiti di echinodermi,
qualche mollusco, molti insetti. Questi animali, però, conservano sempre tratti
strutturali propri della famiglia o dell’ordine a cui appartengono. Altrettanto
accade per Orobanche, Rafflesia e Cuscuta, generi di piante erbacee incapaci di
fotosintesi parassite di altre piante.
continua ...
20
Capitolo 8
Cariologia e sessualità della cellula protoeucariote
8.1. Cariologia della cellula proto-eucariote
Nei funghi e nelle alghe rosse il nucleo della cellula è piccolo, contiene un
nucleolo di forma globulare, o discoidale, talvolta adeso all’involucro nucleare; questa struttura, che non ha precedenti nella procellula, è sede dell’assemblaggio dei ribosomi. I ribosomi della proto-eucellula somigliano a quelli degli
archei, hanno dimensioni pressoché eguali e sono composti da un maggior
numero di filamenti di RNA e di molecole proteiche dei ribosomi batterici.
Vengono estrusi attraverso i pori dell’involucro nucleare e vanno poi a
decorarne la superficie esterna; vanno inoltre a fissarsi sulle cisterne del reticolo
endoplasmico.
I cromosomi aderiscono, mediante il centromero, alla parte interna dell’involucro nucleare; sono numerosi, sottili e molto piccoli, quasi invisibili al
microscopio ottico; durante la mitosi si condensano in modo limitato. Il
genoma ha dimensioni modeste negli eumiceti: 9.2-88.6 Mbp (fig. 6.5)1 e
nelle alghe rosse cianidioficee: 14-47 Mbp; nelle specie parassite le
dimensioni possono essere minori. Le conjugali hanno cromosomi piccoli,
condensati, talvolta con centromero diffuso; la loro genomica è ignota.
Gli introni, di regola, mancano, o la loro presenza è eccezionale.
8.2. Mitosi e citodieresi nelle alghe rosse
8.2.1. Nelle cellule delle alghe rosse la mitosi si svolge interamente all’interno
dell’involucro nucleare; questo processo inizia subito dopo la fase S (cioè di
sintesi del DNA) e per questo motivo i cromosomi risultano formati da due
cromatidi solo nel breve intervallo tra fase S e mitosi. All’inizio della profase
i pori nucleari migrano verso i due poli del nucleo ove si forma una
protuberanza conica (Dave & Godward, 1982). In corrispondenza di questa
protuberanza (fig. 8.1) compare una struttura anulare a simmetria ottogonale
che racchiude una masserella centrale; il diametro di questa struttura, che ha
nomi diversi, varia, ma di poco, da specie a specie ed anche nel corso della
mitosi. I pori nucleari situati presso i poli si dilatano e si trasformano in piccole
finestre attraverso le quali i tubuli del fuso mitotico penetrano nel nucleo
21
mettendosi in rapporto con i cromosomi dicromatidici in corrispondenza del
centromero che è un tratto specializzato del DNA che contiene l’istone H3
modificato. Quindi i cromosomi, piccoli e numerosi, si dispongono a formare
una piastra equatoriale. Alla fine della metafase scompaiono gli anelli polari e
all’anafase il nucleo si allunga, i cromatidi si separano, mentre il nucleolo si
divide a sua volta. Durante la telofase il nucleo si strozza al centro, presumibilmente per l’intervento di filamenti di actina. Questa dinamica risulta molto
importante, poiché rende la divisione nucleare indipendente dalla crescita
della parete cellulare che invece interviene in modo decisivo per la citodieresi
dei batteri e delle zygmematali. Va anche notato che questa dinamica rende
possibile la comparsa di cellule plurinucleate, inesistenti nelle zygmematali,
ma comuni presso le alghe rosse e i funghi eumiceti. Infine la parete cresce a
mo’ di diaframma, verso il centro della cellula. Nelle specie unicellulari il
diaframma si chiude del tutto e le due cellule figlie si distaccano. Nelle specie
multicellulari filamentose la chiusura del diaframma si arresta, come detto
prima, per l’interposizione di materiale citoplasmatico, residua quindi un foro
che mette in comunicazione le cellule adiacenti.
continua ...
22
Capitolo 9
Il passaggio da cellula proto-eucariote a
cellula eucariote
9.1. Differenze funzionali tra cellule proto-eucarioti ed eucarioti
L’evoluzione da proto-eucellula a eucellula, che corrisponde alla comparsa dei
protisti, è contraddistinta in primo luogo dalla evoluzione dei flagelli e della
contrattilità citoplasmatica. L’evoluzione coinvolge anche l’aumento delle
dimensioni del genoma e quindi la complessità cellulare, specialmente la
complessità relativa alle strutture sensoriali e ai rispettivi programmi comportamentali: le tassie. Cambia anche, definitivamente, la parete cellulare che, ad
eccezione di alcune chlorococcali primitive, è sempre aperta o manca del tutto
Seguire le linee evolutive della cellula dei protisti è impegnativo a causa dei
molti trend evolutivi e della complessità che la cellula può raggiungere anche
a causa dei non rari fenomeni di endosimbiosi. Per tale motivo in questa sede
verranno approfondite la comparsa e l’evoluzione delle strutture di sostegno,
l’evoluzione della contrattilità e della motilità, insieme agli sviluppi dell’apparato sensoriale che le accompagnano; l’evoluzione di mitosi e meiosi. Si
concluderà trattando la comparsa e il trend evolutivo dell’apoptosi.
9.2. Il sostegno della cellula nei protisti più evoluti
Del sostegno della cellula proto-eucariote fornita sempre di un guscio ben
chiuso è stato detto; nelle molto più grandi cellule dei protisti più evoluti
questo sostegno è diverso.
In Chlamydomonas e generi affini la cellula è racchiusa in un sottile guscio
cellulosico aperto all’apice anteriore per l’uscita dei flagelli. Negli euglenoidini, nei ciliati e in alcuni gruppi minori, in luogo del guscio esterno esiste
una pellicola proteica piuttosto robusta situata sotto la membrana plasmatica.
Questa pellicola negli euglenoidini è formata da moduli strutturali che
determinano l’architettura elicoidale della cellula (fig. 9.1). Nei ciliati la
pellicola dà sostegno alle innumerevoli “ciglia” che ricoprono questi
organismi. Nei protisti e in particolare in quelli a struttura ameboide, il
sostegno è interno ed è formato da cilindri di tubulina e da lunghi filamenti
di actina che si accorciano o allungano assecondando la morfologia varia ed
incerta delle loro cellule.
23
Altri protisti mostrano la più straordinaria fioritura di strutture che dànno
sostegno e protezione alla cellula. Il guscio di molti Sarcodini filosei nonché
la capsula centrale degli Eliozoi sono fatti di chitina. Gli Eliozoi sono muniti
di spicole radiali di silice o di Stronzio solfato. I Foraminiferi hanno un guscio
calcareo, mentre Radiolari e Diatomee sono provvisti di uno scheletro
rispettivamente di silice e di silicati.
Nella cellula dei protisti lo scheletro interno è formato da actina, filamenti
intermedi, nonché da tubulina, tra loro connessi mediante speciali proteine, in
modo da costituire sia una robusta impalcatura che definisce la forma della
cellula stessa, sia una rete tridimensionale che collega i vari distretti cellulari.
Nelle cellule ameboidi che producono pseudopodi e in quelle munite di
delicati filopodi (Eliozoi ad es.) i cilindri di tublina e i filamenti di actina si
allungano gradatamente e si accorciano bruscamente in rapporto alla cattura
del cibo.
È da notare, infine, che solo in casi eccezionali la cellula in fase vegetativa è
chiusa del tutto entro un guscio inestensibile, sicché il suo contenuto idrico
deve essere sempre controllato attivamente dai vacuoli pulsanti o dalle pulsule,
nel caso dei dinoflagellati.
continua ...
ribosomi
2μm
lente
lente
corpuscolo
basale
micro
tubuli
24
rumposoma
materiale
elettron-opaco
Capitolo 10
Trend evolutivi dei protisti
10.1 Mitosi e meiosi nelle cellule dei protisti
La mitosi nelle cellule dei protisti procede in molti modi diversi e curiosi che
Raikov (1982) ha diligentemente classificati e denominati. Le modalità più
aberranti riflettono con ogni probabilità particolari adattamenti alla crescita
della massa del genoma: si riscontrano nei tricomonadini, nei polimastigini,
nei dinoflagellati, nei ciliati e nelle amebe. Riferirò solo i casi che hanno un
significato per le grandi linee dell’evoluzione.
Presso i protisti eteroconti la mitosi procede per lo più secondo lo schema della
pleuromitosi chiusa o semiaperta che è proprio dei funghi eumiceti; compare
però una variante: molto spesso al corpo polare è associato un centriolo (fig.
10.1); questo tipo di mitosi non esiste nelle cellule delle piante e degli animali.
La eumitosi con lacerazione più o meno ampia dell’ involucro nucleare, e
assenza di corpi polari, ricorda la mitosi delle zygnematali; la ritroviamo
presso i protisti isoconti nei quali agli apici del fuso si situa spesso un
centriolo. Infine, merita attenzione il fatto che in alcune specie di protisti
polimastigini e nei dinoflagellati il fuso si forma all’esterno dell’involucro
nucleare e che i cromatidi vengono trascinati da molecole che solcano
l’involucro (fig. 10.2).
Questa modalità della mitosi è forse primitiva.
Presso le cellule degli animali si affermerà stabilmente la eumitosi con un
centriolo associato a materiale amorfo per formare il centrosoma; presso le
piante superiori centrioli e flagelli si formano solo nei gameti delle gimnosperme inferiori -cicadee e Ginkgo biloba-, poi spariscono, e la eumitosi si svolge
in assenza di involucro nucleare e di centrioli (fig. 10.3).
Presso gli Apicomplessi, i Polimastigini e i Dinoflagellati la meiosi è di tipo
one step che si svolge con una sola divisione che separa le coppie di cromosomi
monocromatidici. Questa peculiarità pone questi protisti nella linea di discendenza delle alghe rosse e delle zignematali. Presso gli altri protisti la meiosi è
di tipo two steps: una prima divisione separa le coppie di cromosomi bicromatidici (tetravalenti) mentre la seconda separa i bivalenti in cromosomi monocromatidici. Questo tipo di meiosi persiste negli animali e nelle piante senza
modifiche.
25
continua ...
26
Bibliografia
Abrahamson S., Bender M.A., Conger A.D., Wolff S. (1973) Uniformity of radiationinduced mutation rates among different species. Nature 245:460-462.
Akifyev A.P., Grishanin A.K. (2005) Some conclusion on the role of redundant
DNAand the mechanism of eukaryotic genome evolution inferred from studies of
chromatin diminution in Cyclopida. Russian Journal of Genetics 41:366-377.
Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P., (2002) Molecular
biology of the cell. Garland Science, N.Y. Usa.
Altmann R. (1890) Die Elementarorganismen und ihre Beziehungen zu den Zellen.
Leipzig.
Andersson J.O. (2008) Genomic evolution of anaerobic protists: metabolic adaptation via gene acquisition. In: Katz L.A. & Debashish Bhattacharya, (eds.) “Genomic
and evolution of microbial eukaryotes”, Oxford U.P. Oxford, New York.
Attardi G., Amaldi F. (1970) Structure and synthesis of ribosomal RNA. Annual Rev.
Biochem 39:183-228.
Bateson G. (1979) Mind and nature: a necessary unity. E.P. Dutton, N.Y.
Bhaud Y., Defacque H., Guillebault D., Lennon J.F., Moreau H., Soyer-Gobillard
M.O. (2000) Morphology and behaviour of dinoflagellate chromosomes during the
cell cycle and mitoses. J. Cell Science 113: 1231-1239.
Beermann S. (1977) The diminution of heterochromatic chromosomal segments in
Cyclops (Crustacea, Copepoda). Chromosoma 60:297-344.
Beermann S., Meyer G.F. (1980) Chromatin rings as products of chromatin
diminution in Cyclops furcifer. Chromosoma 77:277-284.
Bonner J.T. (1959) The cellular slime molds. Princeton University Press.
Brasier M., McLoughlin N., Green O., Wacey D. (2006) A fresh look at the fossil
evidence for early Archaean cellular life. Phil Trans. R. Soc. B 361: 887-902.
Brawley S.H., Sears J.R. (1982) Septal plugs in a green alga. Amer. J. Bot. 69:455-463.
Britten R.J., Davidson E.H. (1969) Gene regulation for higher cells, a theory. Science
165: 349-357.
Bryant N.J., Stevens T.H. (1998) Vacuole biogenesis in Saccharomyces cerevisiae: protein
transport pathways to the yeast vacuole. Microbiol. Mol. Biol. Rev. 62: 230-247.
Butterfield N.J. (2000) Bangiomorpha pubescens n.gen. n.sp. implication for the
evolution of sex multicellularity, and the Mesoproterozoic/Neoproterozoic radiation of eukaryotes. Paleobiology 26: 386-404.
Cain R.F. (1972) Evolution of the fungi. Mycologia 64: 1-14.
Cavalier-Smith Th. (1991) The evolution of cells. In :Evolution of life (S.Osawa e
T Honjo) pp.271-304 Tokyo Springer V.
Cavalier-Smith Th. (1993) Kingdom Protozoa and its 18 Phyla. Microbiological
Reviews 57: 953-994.
27
Cavalier-Smith Th. (2002) The neomuran origin of archaebacteria, the negibacterial
root of the universal tree and bacterial megaclassification. Int. J. System. Evol.
Microbiol. 52: 7-76.
Cavalier-Smith Th.(2006a) Cell evolution and Earth history: stasis and evolution.
Phil. Trans. R. Soc. B. 361: 969-1006.
Chatton E.(1920)Les peridiniens parasites. Morfologie, reproduction, éthologie.
Arch.Zool.Exp.Gén. 59:1-475
Dave A.J., Godward M.B.E. (1982) Ultrastructural studies in the Rhodophyta. I.
Development of the mitotic spindle poles in Apoglossum ruscifolium Kylin. J. Cell Sci.
58: 345-362.
Davidson E.H., Britten R.J. (1979) Regulation of gene expression: possible role of
repetitive sequences. Science 204: 1052-1059.
Demoulin V. (1985) The red algae-higher fungi phylogenetic link: the last ten years.
BioSystems 18: 347-356.
De Rosa M., Gambacorta A. (1994) Archaeal lipids. In: Chemical methods in
prokaryotic systematics. M. Goodfellow & A.G.O Donnel editors, John Wiley, New
York, pp: 199-264.
Dodge B.O. (1914) The morphological relationships of the Florideae and the
Ascomycetes. Bull. Torrey Bot. Club 41: 157-202.
Dodge J.D., (1965) Chromosome structure in the dinoflagellates and the problem of
mesokaryotic cells. Excerpta Medica, International Congress Series 91: 339-345
Dodge J.D. (1973) The fine structure of algal cells. Academic Press, New York.
Dodge J.D., Bibby B.T. (1973) The Protocentrales I. A comparative account of fine
structure etc. Bot. J. Linnean Soc. 67: 175-187
Dreyfus M. (2009) Killer and protective ribosomes. Progr. Molec. Biology Translat.
Science. 85:423-466.
Ehrenberg C.G. (1838) Die Infusorientierchen als vollkommen Organismen. Leipzig.
Embley T.M. (2006) Multiple secondary origins of the anaerobic lifestyle in
eukaryotes. Phil. Trans. R. Soc. B 361:1055-1067.
Esser C., Ahmadinejad N., Wiegand C., Rotte C., Sebastiani F., Gelius-Dietrich G.,
Henze K., Kretschmann E., Richly E., Leister D., Bryant D., Steel M.A., Lockhart
P.J., Penny D., Martin W. (2004) A genome phylogeny for mithochondria among á–
proteobacteria and a predominantly eubacterial ancestry of yeast nuclear genes. Mol
Bio Evol., 21: 1643-1660
Fani R. (2009) L’origine e l’evoluzione degli operoni
Fedo Ch., Whitehouse M., Kamber B.S. (2006) Geological constraints on detecting
the earliest life on Earth: a perspective from the Early Archaean (older than 3.7Gyr)
of southwest Greenland. Phil. Trans. R. Soc. B. 361: 851-867.
Fedonkin M.A., Gehling J.G., Grey K., Narbonne G.M., Vickers-Rich P. (2007)
“The rise of animals”, John Hopkins Univ. Press, Baltimore.
28
Galbraith A.M., Bullard S.A., Jiao K., Nau J.J., Malone R.E. (1997) Recombination
and the progression of meiosis in Saccharomyces cerevisiae. Genetics 146: 481-489.
Gibbs S.P. (1981) The chloroplasts of some algae groups may have evolved from
endosymbiotic eukaryotic algae. Ann. New York Acad Sci 361:193-208
Gillot M.A., Gibbs S.P. (1980) The cryptomonad nucleomorph: its ultrastructure and
evolutionary significance. J. Phycol. 16: 558-568.
Goodwin B.C. (1963) Temporal organization in cells. A dynamic theory of cellular
control processes. N.Y. London.
Grell K.G. (1973) Protozoology. Berlin-Heidelberg-New York, Springer.
Greuet C. (1970) Ultrastructure de l’ocelle du Dinoflagellé Nematodium comparée à
celles d’autres représentants de la famille des Warnowiidae. In : “Actes du 7eme
Congrès Intern. de Microscopie electronique ”, Grenoble 3: 385.
Grey K. (2007) The world of the very small, fueling the animalia. In Fedonkin et al..
Gribaldo S., C. Brochier-Armanet (2006) The origin and evolution of Archaea: a state
of the art. Phil.Trans.R.Soc. B 361: 1007-1032.
Grossman A.R., Schaefer M.R., Chiang G.G., Collier J.L. (1993) The phycobilisome,
a light-harvesting complex responsive to environmental conditions. Microbiol. Rev.
57: 725-749.
Gualtieri P., Barsanti L., Passarelli V. (1989) Absorption spectrum of a single isolated
paraflagellar swelling of Euglena gracilis. Biochimica et Biophysica Acta 993: 293-296.
Hackett J.D., Anderson D.M., Erdner D.L., Bhattacharya D., (2004) Dinoflagellates:
a remarkable evolutionary experiment. Am.J.Botany 91: 1523-1534.
Hackett J.D., Bhattacharya D. (2008) The genome of dinoflagellates. In: “Genomics
and Evolution of microbial Eukaryotes”, L. Katz & D. Bhattacharya eds. Oxford
U.P., Oxford & New York, pp. 48-63.
Hansche P.E. (1975) Gene duplication as a mechanism of genetic adaptation in
Saccharomyces caerevisiae. Genetics 79: 661-674.
Huang J., Kissinger J.C. (2008) Horizontal and intracellular gene transfer in the
Apicomplexa: the scope and functional consequences. In : “Genomics and evolution
of microbial eukaryotes”. L.Katz & D. Bhattakarya eds. Oxford U. P., Oxford &
New York
Jacob F., Monod J. (1961) Genetic regulatory mechanisms in the synthesis of
proteins. J. Mol. Biol. 3: 318-356.
Kawach O., Sommer M.S., Gould S.B., Voss Ch., Zauner S., Maier U.-G., (2008)
Nucleomorpha: remnant nuclear genomes. In: “Genomics and evolution of microbial eukaryotes”. L.Katz & D. Bhattakarya eds. Oxford U. P., Oxford & New York
Kazama F:Y: (1972) Ultrastructure and phototaxis of the zoospores of Phlyctochytrium
sp. an estuarine Chytrid. J. gen. microbiol. 71:555-566.
Kenneth W.F., Saranak J., Patel N., Zarilli G., Okabe M., Kline T., Nakanishi K.
(1984) A rhodopsia is the functional photoreceptor for phototaxis in the unicellular
Eukaryote Chlamydomonas. Nature 311: 756-759.
29
King G.C. (2006) The cytology of the desmids: the chromosomes. New Phytologist
59: 65-72
Kirby R. (2004) Prokaryote genetics. http//greenplanet.eolss.net/Eolss/ogn/mss/
CO3/E6-51.
Konings W.N., Albers S.W., Koning S.M., Driessen A.J.M., (2004) Survival strategies
and membrane properties of Bacteria and Archaea in extreme environnments. http/
/greenplanet.eolss.net/Eolls/ogn/mss/CO3/E6-73
Lecompte O., Ripp R., Thierry J-C., Moras D., Poch O. (2002) Comparative analysis
of ribosomal proteins in complete genomes : an example of reductive evolution at
the domain scale. Nucleic Acids Res. 30: 5382-5390.
Ludwig M., Gibbs S.P. (1987) Are the nucleomorph of chryptomonads and
Chlorarachnion the vestigial nuclei of endosymbionts? Ann. N.Y. Acad. Sc. 503: 198211.
Ludwig M., Gibbs S.P. (1989) Evidence that the nucleomorphs of Chlorarachnion
reptans (Chlorarachionophyceae) are vestigial nuclei: morphology, division and
DNA-Dapi fluorescence. J. Phycol. 25: 385-394.
Maas V. K. (1994) The arginine repressor of Escherichia coli. Microbiological reviews 54: 231-240.
Margulis L. (1971) Cytoplasmic genes: our Precambrian legacy. Stadler Symposia
vol. 1-2: 79-88.
Margulis L. (1980) Symbiosis as Parasexuality in: “Cellular Interaction in symbiosis
and parasitism” Academic Press, N.Y. pp. 263-273.
Margulis L. (1981a) Origin of species: acquired genomes and individuality. BioSystems 31: 121-125.
Margulis L. (1981b) Symbiosis in cell evolution. Life and its environment in the early
Earth. W.H. Freeman & Co San Francisco.
Martin W. (1999) A briefly argued case that mitocondria and plastidia are descendants of endosymbionts, but that the nuclear compartment is not. Proc. R. Soc. B 266:
1387-1395.
Melchior D.L. (1982) Lipid phase transitions and regulation of membrane fluidity in
prokaryotes. Current Topics in membranes and transport 17:263-303
Mereschkowsky C. (1910) Theorie der zwei Plasmarten als Grundlage der Symbiogenesis, einer neuen Lehre der Entstehung der Organismen. Biol. Centralblatt 30:
278-303, 321-367.
Moeus P.B. Rapport E. (1971) Spindles, spindles plaques, and meiosis in the yeast
Saccharomyces cerevisiae (Hansen). J. Cell Biology 50: 344-361.
Neumann J. von (1951) The general and logical theory of automata . In “Cerebral
mechanisms in behaviour.” Whiley, New York.
Ohno S. (1970) Evolution by gene duplication. Springer Verlag Berlin.
Omodeo P. (1975) Evolution of the genome considered in the light of information
theory. Boll. Zool. 42: 351-379.
30
Omodeo P. (1980) The photoreceptive apparatus of flagellated algal cells: Comparative morphology and some hypotheses on functioning. In: “Photoreception and
sensory transduction in aneural organisms”. F. Lenci & G. Colombetti eds, pp. 127153.
Omodeo P. (1985) Progressive evolution and increase of genetic information. In:
“International Symposium on Biological Evolution”. V. Pesce-Delfino ed. pp, 2338.
Omodeo P. (1994) Il più grande salto evolutivo nella storia dei viventi. In:
“Evoluzione biologica e i grandi problemi della biologia”. Acc. Naz. Lincei.
Contributi del Centro linceo interdisciplinare, n. 89, pp. 93-111.
Omodeo P. (1996) What is a living being? History of a longstanding question and its
temptative repliles. In : “Defining life: the central problem in the biology” . M.
Rizzotti ed. University of Padova. pp. 187-198.
Omodeo P. (1998) Impiego del concetto di informazione in genetica. In : “
Informazione nelle scienze della vita”. B. Continenza & E. Gagliasso ed. Franco
Angeli Roma.
Omodeo P. (2004) Characteristics of living beings. http//green planet.eolss.net/
Eolss/Logn/mss/CO3/E6
Omodeo P. (2010) The biggest evolutionary jump: restructuring of the genome.
Cytologija 52, 10:3-22.
Piccinni E., Mammi ( 1978) Motor apparatus of Euglena Gracilis: ultrastructure of the
basal portion of the flagellum and paraflagellar body. Boll. Zool. 45:405-414
Piccinni E., Omodeo P. (1975) Photoreceptors and phototactic programs in Protista.
Boll. Zool. 42: 57-79.
Pickett- Heaps J.D. (1975) Green algae. Sinauer Ass. Sunderland Mass. pp. 604.
Pontecorvo G., Roger J.A., Hemmons L.M., MacDonald K.D., Buffon A.W.J. (1953)
The genetics of Aspergillus nidulans. Adv. Genet. 5: 141-238.
Powell M.J. (1980) Mitosis in the aquatic fungus Rhizophydium spherotheca (Chytridiales). Am. J. bot. 67: 839-853.
Raikov I.B. (1982) The protozoan nucleus, morphology and evolution. SpringerVerlag, Wien New York
Rascio N., Mariani P., Dalla Vecchia F., Trevisan R., (1991) The vegetative thallus
of Pterocladia capillacea (Gelidiales, Rhodophyta). I. An ultrastructural and Cytochemical Study. Botanica marina 34: 177-185.
Rascio N., Mariani P., Dalla Vecchia F., Trevisan R. (1991) The vegetative thallus of
Pterocladia capillacea (Gelidiales, Rhodophyta). II. Pit connections. Botanica marina
34: 187-194.
Razin Sh. (1982) Sterols in Mycoplasma membranes. Curr. Topics in Membr. Transp.
17:183-205
Riva M.C., Lake J.A. (2004) The ring of life provides evidence for a fusion origin of
eukaryotes. Nature 431:152-155.
31
Rizzo P.J., (1981) Comparative aspects of basic chromatine proteins in dinoflagellates. BioSystems 14:433-443
Rizzo P.J., (1991)The enigma of the dinoflagellate chromosomes. J. of Protozoology
38.246-252
Roger A.J., Hug L.A., (2006) The origin and diversification of eukaryotes: problems
with molecular phylogenetics and molecular clock estimation. Phil. Trans. R. Soc. B.,
361:845-850.
Scannerini S., Bonfante-Fasolo P. (1990) Plant and mycorrhizal fungi. Coevolution
or independent evolution? “ IV International colloquium on endocytobiology and
symbiosis”. Endocytobiology IV INRA, Paris.
Scannerini S., Bonfante-Fasolo P. (1991) Bacteria and bacteria-like objects in
endomycorrhizal fungi (Glomaceae). In: “Symbiosis as a source of evolutionary
innovation”. L. Margulis & R. Foster eds. The MIT Press, Cambridge MA, USA pp.
273-287.
Schopf J.W. (2006) Fossil evidence for Archaean life. Phil. Trans. R. Soc. B 361: 869885.
Schopf J.W., Barghoorn E.S. (1967) Alga-like fossils from the early Precambrian of
South Africa. Science 156: 508-512.
Slobodkin L.B., (1980), Growth and Regulation of Animal Populations, 2nd enlarged
edition. Dover Press, 234 pp.
Stanier R.Y., Doudoroff M., Adelberg E.A., (1970) “ The microbial world” Prentice
Hall Inc. ed.
Steiner G. (1984) in: M. Pandolfi (curatore) “I Rinogradi di Harold Stümpke”.
Stetter K.O. (2004) Hyperthermophilic microorganismus. In Extremophiles, G.
Gerday & N. Glansdorff editors, in Encyclopaedia of life support systems (EOLSS),
Oxford U.K. [http://www.eolss.net]
Stümpke H. v. Steiner Gerholf.
Taylor F.J.R. (1978) Problems in the development of an explicit hypothetical
phylogeny of the lower eukaryotes. BioSystems 10: 67-89.
Taylor F.J.R. (1979) Symbionticism revisited: a discussion of the evolutionary impact
of. intracellular symbiosis. Proc. R. Soc. London B. 204: 267-286.
Taylor F.J.R. (1980) Of dinoflagellate evolution. BioSystems 13: 65-108
32