Le vescicole di trasporto trasportano un cargo
da un compartimento cellulare ad un altro
Le proteine di rivestimento guidano la
formazione di queste vescicole polimerizzando
sulla superficie delle membrane della cellula
Differenti proteine di rivestimento
sono implicate nella gemmazione
di vescicole dai differenti
compartimenti
Vescicole di endocitosi che gemmano dalla
membrana cellulare sono rivestite da clatrina
La biogenesi dei lisosomi avviene con vescicole
rivestite da clatrina che gemmano dal TGN
Vescicole che gemmano dal reticolo
endoplasmatico sono rivestite dalle proteine
COPII
le proteine COPI rivestono le vescicole che
gemmano dal Golgi verso il Golgi oppure verso
il reticolo endoplasmatico nel traffico retrogado
Le vescicole di trasporto traghettano
un cargo da un compartimento
cellulare ad un altro.
Le proteine di rivestimento guidano la formazione delle vescicole:
vescicole rivestite da clatrina si formano a livello della membrana plasmatica
vescicole rivestite da COPII gemmano dal reticolo endoplasmatico (RE)
vescicole che gemmano dal Golgi sono rivestite da COPI reclutata dalle
GTPasi della famiglia ARF
Copy coats: COPI mimics clathrin and COPII - Cell. 2010 Jul 9;142(1):19-21. doi: 10.1016/j.cell.2010.06.031 - Hughson FM.
La Clatrina, COPI e
COPII guidano la
formazione di vescicole
di trasporto quando
polimerizzano sulle
membrane cellulari
L'unità di assemblaggio
della gabbia di clatrina
è il triskelion, con le tre
catene pesanti della
clatrina unite da un
nodo centrale
La struttura della gabbia formata da COPII è notevolmente
diversa, l’unità di assemblaggio non è un triskelion ma un
eterotetramero formato da quattro subunità lineari, due Sec13
e due Sec31
Copy coats: COPI mimics clathrin and COPII - Cell. 2010 Jul 9;142(1):19-21. doi: 10.1016/j.cell.2010.06.031 - Hughson FM.
Trasporto
bidirezionale
tra RER e Golgi
mediato da
COPI e COPII.
Le proteine che
debbono restare
nel RER hanno la
sequenza K/HDEL
che viene riconosciuta
da un recettore.
La fusione delle
vescicole è mediata
dalle proteine
v-SNARE (vescicolari)
e t-SNARE (del target)
che ancorano i carrier
al loro compartimento target di destinazione.
Organization of the ER–Golgi interface for membrane traffic control - Nat Rev Mol Cell Biol. 2013
Jun;14(6):382-92. doi: 10.1038/nrm3588 - Brandizzi F, Barlowe C.
COPI, COPII e le rotte del traffico
anterogrado e retrogrado sono
generalmente conservati in tutti gli
eucarioti, mentre l'organizzazione
dell'interfaccia RER-Golgi varia
notevolmente in specie diverse
Sono infatti variabili sia la distribuzione
dei siti di gemmazione di COPII sul RER,
che la natura delle stesse vescicole di
trasporto e la dipendenza da componenti
citoscheletriche
Organization of the ER–Golgi interface for membrane traffic control - Nat Rev Mol Cell Biol. 2013 Jun;14(6):382-92. doi: 10.1038/nrm3588 Brandizzi F, Barlowe C.
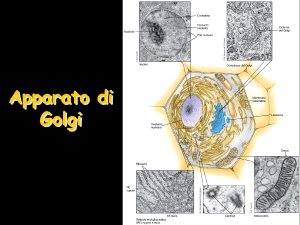
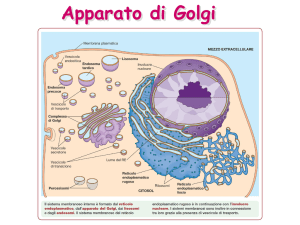
Apparato di Golgi
Apparato di GOLGI
Nella zona cis del Golgi è presente un enzima che
lega un fosfato al mannosio della catena di 14
zuccheri che era stata aggiunta agli enzimi lisosomali
mentre entravano nel RER durante la loro sintesi
Nella zona mediale ci sono enzimi che
(i) modificano le serie di 14 zuccheri
legate nel RER (N-glicosilazione)
(ii) iniziano la O-glicosilazione
aggiungendo uno zucchero alla
volta
Nella zona trans sono realizzate ulteriori ramificazioni
e reazioni di capping (incappucciamento con
galattosio, acido sialico, solfatazione e fucoso) sulle
catene glucidiche sia N-linked che O-linked
Nella zona TGN (trans-Golgi network) avviene il
completamento del capping, lo smistamento delle
glicoproteine ai recettori per la secrezione regolata
oppure per la secrezione costitutiva oppure per la
membrana cellulare o per la formazione dei lisosomi
Il flusso nel Golgi da cis a trans è controbilanciato dal
trasporto retrogrado che riporta al compartimento
giusto le proteine erroneamente trasportate
La glicosilazione delle proteine è una modificazione
post-traduzionale onnipresente in tutti i viventi
Le complesse strutture dei glicani svolgono ruoli
biologici e fisiologici cruciali, contribuiscono al
ripiegamento delle proteine ed al controllo della
qualità, permettono il riconoscimento biologico e
conferiscono un ulteriore livello di contenuto
informativo alle strutture polipeptidiche sottostanti
Le strutture di oligosaccaridi sulla superficie cellulare
influenzano le interazioni delle cellule con l'ambiente
extracellulare, fornendo ligandi per l'adesione
cellulare, per le interazioni con varie macromolecole
e per l’invasione dei patogeni
Vertebrate protein glycosylation: diversity, synthesis and function - Moremen Ket al. - Nature Reviews Molecular Cell
Biology, 13, 448-462, 2012 - doi: 10.1038/nrm3383
I glicani associati a recettori sulla superficie
cellulare possono modulare direttamente il signalling
delle proteine e le dinamiche dell’endocitosi
Ruoli più generali dei proteoglicani comprendono
contributi alla sorveglianza immunitaria, alle reazioni
infiammatorie, alle reazioni autoimmuni, all'azione degli
ormoni ed alle metastasi tumorali
Le strutture dei glicani legati alle proteine possono
essere molto complesse, con numerose possibilità di
ramificazione e di conseguenza hanno una diversità
strutturale molto maggiore di quella degli acidi
nucleici lineari o delle strutture polipeptidiche
Vertebrate protein glycosylation: diversity, synthesis and function - Moremen Ket al. - Nature Reviews Molecular Cell
Biology, 13, 448-462, 2012 - doi: 10.1038/nrm3383
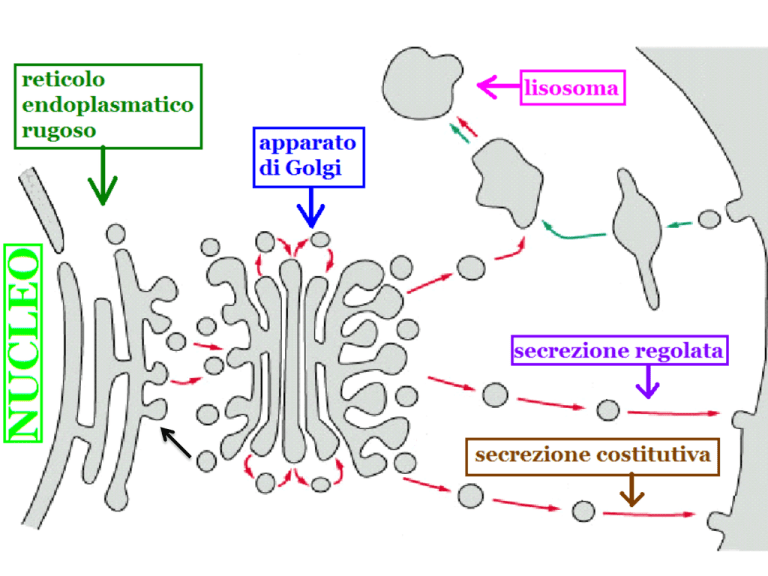
Secrezione costitutiva e secrezione regolata
All’interno della vescicola = verso l’esterno della cellula
Matrice
extracellulare
Apparato di GOLGI
Nella zona cis del Golgi è presente un enzima
che lega un fosfato al mannosio della catena di
14 zuccheri che era stata aggiunta agli enzimi
lisosomali mentre entravano nel RER durante
la loro sintesi
Gli enzimi lisosomali non vengono
generalmente modificati nell’attraversamento
delle zone mediale, trans e TGN
mannoso-6-fosfato: guida enzimi dal Golgi al lisosoma
Cis Golgi
network (CGN)
Fosforilazione
per formare
M6P
RER
enzima
lisosomale
(precursore)
Trans Golgi
network (TGN)
Lisosoma
Clatrina
Fosfatasi
a pH 5
Enzima
maturo
Recettore di M6P
Rimozione del
fosfato e …
Ritorno al Golgi del recettore di M6P attivazione per
proteolisi
clatrina
Gli enzimi lisosomali sono fosforilati sullo
zucchero mannosio nella zona cis del
Golgi.
Questo permette loro di evitare altre
modificazioni nelle zone
mediale e trans Golgi, e
di essere riconosciuti da
recettori nel TGN
La proteina più abbondante della membrana lisosomiale è LAMP1 che arriva ad
essere il 50% delle proteine presenti; è coinvolta nel traffico lisosomiale
Signals from the lysosome: a control centre for cellular clearance and energy metabolism - Nat Rev Mol Cell Biol. 2013 May;14(5):283-96. doi: 10.1038/nrm3565 - Settembre et al.
All’interno deI
lisosoma sono
contenute alcune
centinaia di
idrolasi acide
specifiche verso
molti substrati
La loro membrana
contiene proteine
per trasportare
sostanze da e
verso il lume,
pompe di protoni per acidificare il lume lisosomiale e
proteine per la fusione del lisosoma con altre strutture
Lisosomi : organuli subcellulari con
funzione digestiva, funzionano come
centro di riciclaggio di materiali che
provengono
sia
dall’esterno
che
dall’interno della cellula
tutto quello che finisce dentro il lisosoma
viene tagliato in piccoli pezzi (idrolisi) e
quindi inviato nel citosol cellulare per
essere riutilizzato
Principali funzioni dei Lisosomi
I lisosomi possono ricevere materiali
provenienti da:
- esterno (endocitosi)
- interno (autofagia)
- oppure possono riversare all’esterno i loro
enzimi fondendosi con la membrana plasmatica
(es. cellule della linea ematopoietica,
osteoclasti, melanociti, varie cellule cancerose,
nei meccanismi cellulari di difesa da parassiti,
per la funzione piastrinica nella coagulazione,
nel rilascio delle idrolasi dall’acrosoma degli di
spermatozoi durante la fecondazione, ecc.
Signals from the lysosome: a control centre for cellular clearance and energy metabolism - Nat Rev Mol Cell Biol. 2013
May;14(5):283-96. doi: 10.1038/nrm3565 - Settembre et al.
extracellulare
extracellulare
Fecondazione
Impianto
Invasione
DIGESTIONE
DIGESTIONE
Materiale esogeno
intracellulare
intracellulare
Materiale endogeno
extracellulare
extracellulare
Fecondazione
Impianto
Invasione
• le cellule tumorali invasive, con rapide
divisioni cellulari ed invasività, sono
DIGESTIONE
fortemente
DIGESTIONEdipendenti dai lisosomi
Materiale esogeno
• la trasformazione e la progressione del
cancro portano a drammatici
intracellulare
cambiamenti
del volume lisosomiale,
intracellulare
della loro composizione e della
distribuzione intracellulare
Materiale endogeno
Cancer-associated lysosomal changes: friends or foes? - Kallunki et al. - Oncogene (2013) 32, 1995–2004
Alcuni micobatteri patogeni liberano sostanze che
impediscono alla vescicola di fagocitosi di fondersi con i
lisosomi, originano patologie con lunghi tempi di incubazione,
come la tubercolosi o la lebbra
Le patologie lisosomali derivano
da accumulo di materiale
indigeribile
Le malattie lisosomali sono
malattie genetiche dovute ad errori
del metabolismo che
si manifestano fin
dall’infanzia
Sebbene le malattie lisosomali
siano individualmente rare,
come gruppo hanno una
frequenza stimata intorno ad 1
su 5.000 nati
Che modalità di trasmissione hanno?
esempio => Tay-Sachs, malattia genetica dovuta alla
mancanza dell’enzima lisosomale esosaminidasi A
l’esosaminidasi A è implicata nella demolizione della
parte glicidica di un glicolipide chiamato ganglioside
senza tale enzima, il ganglioside parzialmente
degradato si accumula, specialmente nel sistema
nervoso
la sintomatologia comprende un progressivo ritardo
nello sviluppo, paralisi, cecità e morte entro i primi
3-4 anni di vita
Indice delle principali malattie lisosomali
• disordini del metabolismo del glicogeno
• disordini del metabolismo dei glicolipidi
• disordini del metabolismo dei mucopolisaccaridi
• disordini del metabolismo di oligosaccaridi/glicoproteine
• disordini degli enzimi della biogenesi dei lisosomi
• disordini del trasporto attraverso la membrana lisosomale
• altri disordini
All’azione anti-infiammatoria di alcuni
composti, ad esempio il Cortisone,
contribuisce la stabilizzazione della
membrana dei Lisosomi
Composti che rendono più “fragile” la
membrana dei Lisosomi possono avere un
effetto teratogeno
La loro funzione appare sempre più ampia,
intervengono in processi come secrezione,
signalling, riparazione della membrana plasmatica,
metabolismo energetico, sistema immunitario
Il ruolo essenziale dei lisosomi nell’autofagia mette
questi organuli al crocevia di diversi processi cellulari,
con implicazioni significative per la salute e la malattia
Uno stesso fattore di trascrizione, TFEB, che regola
biogenesi dei lisosomi ed autofagia in risposta a
stimoli ambientali, come la fame, sta diventando
interessante per fornire nuove strategie terapeutiche
per modulare la funzione lisosomiale nelle malattie
Signals from the lysosome: a control centre for cellular clearance and energy metabolism - Nat Rev Mol Cell Biol. 2013
May;14(5):283-96. doi: 10.1038/nrm3565 - Settembre et al.
Signals from the lysosome: a control centre for cellular clearance and energy metabolism - Nat Rev Mol Cell Biol. 2013
May;14(5):283-96. doi: 10.1038/nrm3565 - Settembre et al.
• Le cellule sane utilizzano l'autofagia come un meccanismo
generale di pulizia e di sopravvivenza allo stress
• L'autofagia inizia con la crescita di una membrana di
isolamento per l'azione coordinata delle proteine ATG: ne
risulta la formazione dell'autofagosoma
L’autofagosoma si forma rapidamente e si fonde con i lisosomi
Disregolazione dell’autofagia si osserva in varie patologie
umane, quali malattia di Crohn,
Nov 2014
Gen 2014
cancro e neurodegenerazione
La biogenesi di alcuni miRNA
regola e controlla l’espressione
di alcune proteine necessarie
per l’autofagia
MVB =MultiVesicular Body
Autofagia e apoptosi spesso si escludono a vicenda: l’induzione
dell’autofagia blocca l’induzione dell’apoptosi, le caspasi attivate
nel corso dell’apoptosi bloccano il processo autofagico
In alcuni casi i due processi coesistono portando ad una
eccessiva distruzione di citoplasma e quindi ad una morte per
autofagia
La P53 nel citosol inibisce l’autofagia, quando trasloca nel
nucleo attiva geni per l’autofagia e successivamente l’apoptosi,
quando migra sui mitocondri induce mitofagia ed apoptosi
Gen 2014
Inibizione di apoptosi e anoikis (apoptosi indotta da “senza casa”) da parte
dell’autofagia
DISC, death-inducing signalling complex; PTP, permeability transition pore
Lisofosphatidilcolina = LPC
Interferire con le relazioni tra autofagia e apoptosi ha importanti
conseguenze patofisiologiche
Impatto dell’autofagia nella rimozione delle cellule morte e nell’attivazione
del sistema immunitario