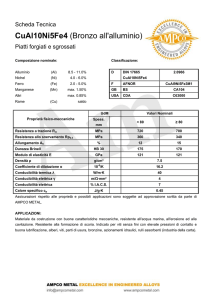
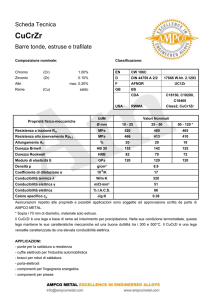
CONDUTTIMETRIA
•
•
La conduttimetria è lo studio della conducibilità (nel nostro caso verrà utilizzata per la
determinazione della conducibilita' di soluzioni elettrolitiche acquose).
Le applicazioni analitiche della conduttimetria si basano sul fatto che la conducibilita' di una
soluzione elettrolitica dipende dalla concentrazione delle specie ioniche in essa presenti.
La legge di Ohm
V=RI [V=potenziale (V), R=resistenza (#), I=intensità di corrente (A)]
dove
•
•
1
G
1L
R=
S
R=
[R= resistenza (#) G=conduttanza (#-1)]
[)=conducibilità specifica (#-1·cm-1), L/S=costante di cella (cm-1)]
Le proprietà di trasporto delle soluzioni elettrolitiche (cenni)
Una specie carica in soluzione si può muovere secondo i tre meccanismi già discussi di convezione,
diffusione e migrazione. In questo contesto ci occuperemo solo delle grandezze che descrivono la
migrazione di ioni in soluzione sottoposti ad un campo elettrico.
La resistenza (o la conduttanza) di una soluzione elettrolitica dipende:
•
•
dalle caratteristiche della cella di conducibilità con cui si esegue la misura, rappresentate
dalla costante di cella L/S
dalle caratteristiche della soluzione, tramite la conducibilità specifica ) che rappresenta le
proprietà di trasporto globali di una soluzione elettrolitica e che dipende dalle mobilità ui
degli ioni (velocità sotto gradiente di potenziale unitario espresse in (cm/s)/(V/cm)) e dalla
loro concentrazione. La ) può essere definita come la carica che attraversa in 1 s un cubo di
lato 1 cm tra le cui facce opposte vi sia la ddp di 1 V.
z+
Nel caso di un eletttrolita binario C + A di concentrazione c (nella equazione c è espressa in
mol/cm3) la conducibilità specifica è data da:
= Fz+
+
cu+ + Fz-
-
z
cu-
(generalizzando per un elettrolita qualsiasi
= Fzici ui
dove ci= c
i i)
dove F è la costante di Faraday (96485 C/eq) e ; il grado di dissociazione, quindi la conducibilità
specifica dipende dalla concentrazione sia direttamente (attraverso c) che indirettamente (attraverso
il grado di dissociazione e la mobilità).
1
In particolare:
•
Conducibilità specifica
•
per gli elettroliti forti la curva ) vs c presenta un massimo in quanto a concentrazioni basse
predomina l’effetto di c (tratto ascendente della curva in cui la conducibilità aumenta
all’aumentare di c), mentre a concentrazioni alte predominano gli effetti di ; e u (tratto
discendente della curva in cui all’aumentare di c diminuiscono sia il grado di dissociazione
che la mobilità determinando la diminuzione della conducibilità specifica)
Per gli elettroliti deboli la curva ) vs c ha un andamento pressoché pianeggiante in quanto le
mobilità sono costanti mentre gli effetti di aumento di concentrazione e diminuzione del
grado di dissociazione si compensano a vicenda.
H2SO4
CH3COOH
concentrazione
Conducibilità specifica
Per soluzioni elettrolitiche diluite (u costante) si può assumere che la conducibilità sia
proporzionale alla concentrazione.
H2SO4
CH3COOH
concentrazione
2
Misure di conducibilità
Nei conduttimetri da laboratorio le misure di conducibilità vengono eseguite mandando una
tensione alternata (per minimizzare polarizzazione e reazioni agli elettrodi), rilevando la corrente e
ricavando la resistenza utilizzando la legge di Ohm.
Si chiama cella conduttimetrica l’insieme comprendente gli elettrodi attraverso i quali viene
trasmessa al liquido la corrente di misura, le parti isolanti che delimitano la porzione di soluzione
percorsa dalla corrente di misura e infine le ulteriori parti (isolanti e non) che servono per l’unione
meccanica delle parti principali, per la tenuta ermetica, per il collegamento al circuito esterno ecc.
Qualsiasi cella conduttimetrica è caratterizzata dalla propria costante di cella L/S(cm-1) o S/L (cm)
che nel caso di forme geometriche particolarmente semplici teoricamente potrebbe essere calcolata
dalla lunghezza L e sezione attiva S del conduttore, mentre nel caso di forme complicate
bisognerebbe ricorrere ad un integrale. In realtà, a causa soprattutto della geometria non ideale delle
linee di corrente e dell’uso di superfici conduttrici complesse, è molto meglio determinare la
costante di cella misurando la R o la G di una soluzione standard a ) nota con precisione e
ricavando quindi L/S dalla relazione (R = L/S oppure (/G = L/S
Rappresentazione schematica delle linee di corrente fra i due elettrodi di
una cella conduttimetrica in cui viene mostrato che si incurvano verso
l'esterno
Nella routine di laboratorio si richiede la frequente rideterminazione della costante di cella (che può
variare con il tempo e con l’uso rispetto a quella indicata dal commerciante) mediante la misura della
3
conduttanza a temperatura nota di uno standard operativo adatto alla cella che si deve utilizzare e di
conducibilità nota con precisione (le modalità operative per la determinazione della costante di cella
saranno riportate nella descrizione delle esperienze di laboratorio).
Per le celle di uso corrente (con L/SC1) gli standard correntemente usati sono soluzioni di KCl 0,1 o
0,01 m (molale cioè moli di soluto/Kg di solvente).
Per le soluzioni standard di KCl 0,1 e 0,01 m il National Institute of Standards and Technology USA
raccomanda I seguenti valori di conducibilità specifiche, tabulati in funzione della temperatura:
Conducibilità specifiche in µS cm-1 di alcune soluzioni standard
(ITS 90 temperature scale)
T (°C)
KCl 0.01 m
KCl 0. 1 m
0
772.921
7116.85
5
890.961
8183.70
10
1013.95
9291.72
15
1141.45
10437.1
18
1219.93
11140.6
20
1273.03
11615.9
25
1408.23
12824.6
30
1546.63
14059.2
35
1687.79
15316.0
40
1831.27
16591.0
45
1976.62
17880.6
50
2123.43
19180.9
dati interpolabili con la polinomiale
dati interpolabili con la polinomiale
2
3
2
3
T =a + b T°C + c T°C + d T°C
T = a + b T°C + c T°C + d T°C
a = 772.920, b = 23.0842,
a = 7116.86, b = 208.997
c = 0.107736, d = 0.000584333
c = 0.898677, d = 0.00507414
Le soluzioni di KCl per la determinazione della costante di cella dovrebbero essere preparate
utilizzando:
• KCl purissimo per analisi essiccato in stufa e lasciato raffreddare in essiccatore
• Acqua bidistillata (o deionizzata bollita di fresco per eliminare la CO2 e raffreddata in
recipiente protetto da tubo di calce sodata) di conducibilità trascurabile rispetto a quella
della soluzione standard che si vuole preparare (comunque al di sotto di 1-2 µS/cm a 25°C).
Durante la preparazione non va esposta all’aria per evitare l’assorbimento di CO2 o di altre
impurezze.
Dopo la preparazione le soluzioni standard devono essere protette con tubo a calce sodata e hanno
validità limitata (qualche mese)
Correzione della temperatura: il controllo della temperatura è estremamente importante perchè la
conducibilità varia sensibilmente con T.
Se non è possibile termostatare le soluzioni alla temperatura di riferimento a cui si possiedono i dati
tabulati (di solito 25°C), è possibile, conoscendo il valore della temperatura attuale, riportare le
misure alla temperatura di riferimento con un calcolo mediante una polinomiale (vedi tabelle KCl).
Molti conduttimetri sono in grado di effettuare direttamente questa correzione purchè si forniscano
le seguenti informazioni: T di riferimento, T attuale, valore del coefficiente di temperatura (noto a
priori o determinabile al momento), con l’assunzione che l’intervallo tra T attuale e T di riferimento
sia sufficientemente piccolo da poter stimare lineare l’incremento della conducibilità con la
temperatura.
4
Titolazioni conduttimetriche
Nelle titolazioni conduttimetriche viene misurata la variazione di conducibilita' della soluzione che
si sta titolando in funzione del volume di titolante aggiunto. Affinche' una titolazione possa essere
seguita per via conduttimetrica, e' necessario che l'aggiunta della soluzione titolante provochi una
variazione della conducibilita'.
Un tipico allestimento per una titolazione conduttimetrica e' mostrato nella figura.
Allestimento sperimentale per una titolazione conduttimetrica.
In pratica, la titolazione viene condotta normalmente, salvo che nella soluzione da titolare viene
introdotta una cella conduttimetrica: dopo ogni aggiunta di soluzione titolante, si riporta in una
tabella il corrispondente valore di conducibilita' letto sul conduttimetro. Al termine della misura, si
costruisce una curva di titolazione riportando in grafico la conducibilita' in funzione del volume di
titolante. Dal grafico si determina il punto finale.
In generale nelle titolazioni per neutralizzazione, precipitazione, ecc. ci si possono attendere
cambiamenti di conducibilità che si possono sfruttare per seguire il decorso della reazione e
soprattutto individuare il punto finale.
Ovviamente si può eseguire una titolazione conduttimetrica seguendo della soluzione la
conducibilità specifica o anche solo la conduttanza, che è ad essa proporzionale () = G·L/S).
La temperatura deve essere pressochè costante, ed è preferibile che anche il volume della soluzione
non cambi troppo durante la titolazione.
A differenza delle curve di titolazione potenziometriche,
• i punti di equivalenza non corrispondono a flessi, ma ad angoli d’intersezione tra tratti rettilinei.
L’accuratezza del metodo è tanto maggiore quanto più acuto è l’angolo d’intersezione, e quanto
maggiore è la correlazione lineare dei punti sperimentali;
• non hanno particolare senso accurate misure vicino al punto di equivalenza, anzi, a causa di
idrolisi, dissociazione, o solubilità del prodotto della reazione nei pressi del punto di equivalenza il
5
grafico di titolazione in tale zona risulta arrotondato e quindi il punto di equivalenza si valuta
estrapolando i tratti rettilinei e valutandone il punto d’intersezione.
I vantaggi delle titolazioni conduttimetriche rispetto a quelle colorimetriche e potenziometriche
sono:
• Il metodo è accurato tanto in soluzioni diluite che concentrate
• Il metodo funziona bene in casi altrimenti critici come titolazioni di acidi deboli con
basi deboli e titolazioni di acidi debolissimi come fenoli, acido borico...
Rispetto alle colorimetriche
• Il metodo funziona anche con soluzioni torbide
Esempio: Acido forte titolato con base forte
(ad esempio HCl con NaOH)
Nel primo tratto la conducibilità cala perchè lo
ione H+ (il più mobile, °H+ 350 1cm2mol 1)
1
viene sostituito da Me+ ( °Me+ 40/80
cm2
mol 1); dopo il punto di equivalenza ricresce al
crescere dell’eccesso di OH ( °OH
198
1
cm2 mol 1).
La titolazione è molto semplice, ma lo sono anche
le corrispondenti colorimetrica e potenziometrica;
risulta competitiva se le soluzioni sono scure o
molto diluite (badando però, nel secondo caso, ad
eliminarne la CO2).
Esempio: Acido forte titolato con base debole
(ad esempio H2SO4 con NH3)
Nel primo tratto la conducibilità cala perchè lo
ione H+ (il più mobile, °H+ 350 1cm2mol 1)
viene sostituito da NH4+; dopo il punto di
equivalenza resta pressochè costante (cala
leggermente per la diluizione) perchè NH3 in
eccesso ha su di essa un’influenza trascurabile
rispetto al sale (NH4)2SO4 .
Go
punto finale
Vtit
punto finale
Vtit
Go
Esempio. Acido debole con Ka 10 5 titolato con
Go
base forte
(ad esempio CH3COOH con NaOH)
Il primo tratto arrotondato è dato dal fatto che G tende
a calare perchè AcONa formatosi reprime la
ionizzazione di AcOH ancora presente, ma presto
ricresce al crescere della forza ionica del sale.
La curva è piuttosto difficile da interpretare .
Un acido meno debole (ad es. con Ka 10 3) titolato
con la base forte darebbe una curva più a V,
intermedia tra questa e quella di un acido forte, quindi
meglio utilizzabile.
Esempio. Acido debole con Ka
10 5 titolato
Go
con base debole
acido forte
acido debole
acido molto debole
punto finale
Vtit
6
acido debole
(ad esempio CH3COOH con NH3)
In questo caso la curva è più facilmente
utilizzabile rispetto alla precedente (si distingue
più facilmente il punto equivalente)
Esempio. Miscela di acido forte ed acido
debole con base forte (a) o debole (b)
(ad esempio HCl+CH3COOH
con NaOH o con NH3)
Viene naturalmente titolato prima l’acido
forte, poi quello debole.
G prima cala mentre Na+ sostituisce H+,
poi cresce piano al crescere della forza
ionica del tampone acetato, poi cresce
velocemente con l’eccesso di OH .
Go
punto finale
acido forte
punto finale
acido forte+
debole
Vtit
Con ragionamenti analoghi si possono spiegare i grafici di titolazioni per precipitazione, per
scambio ecc. seguite conduttimetricamente.
7