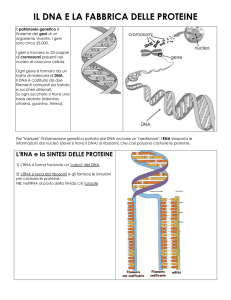
La trascrizione
Dal DNA alle proteine
Il flusso dell’informazione genetica da
DNA a RNA (durante la fase che
chiamiamo trascrizione) e
successivamente da RNA a proteine
(attraverso la fase che chiamiamo
traduzione) avviene in tutte le cellule
viventi. Questo concetto così
fondamentale e ampio è stato definito
Dogma Centrale della biologia
molecolare.
Differenti efficienze di espressione genica
I geni codificati dal DNA non vengono trascritti e tradotti in modo omogeneo.
Infatti a seconda di quelle che sono le necessità della cellula (spesso legate alla
funzione da essa svolta nel tessuto e nell’organismo di appartenenza), alcuni
geni sono espressi molto più efficientemente ch altri. Questa regolazione fine
dell’espressione genica porta ad avere nell’esempio più proteina A che B.
Struttura dell RNA
RNA, come il DNA, è un polimero
lineare composto da quattro nucelotidi
legati insieme attraverso legami
covalenti detti fosfodiesterici. Ci sono
tuttavia delle differenze di natura
chimica tra le due molecole. 1) i
nucleotidi sono ribo-nucleotidi, ossia
contengono lo zucchero ribosio. 2) al
posto della Timina, troviamo l’Uracile
che differisce dalla Timina per
l’assenza di un gruppo-CH3.
La trascrizione assicura che il filamento letto venga copiato in maniera
fedele, solo quando esiste un appaiamento ottimale tra la base di RNA
che deve essere inserita nel polimero e la base presente sul filamento di
DNA che funziona da stampo, il ribonucleotide viene legato
covalentemente alla molecola di RNA nascente. Nella figura, la sequenza
di colori del RNA è complementare a quella del filamento stampo di DNA.
Teoricamente non si ammettono errori.
I principali tipi di RNA prodotti dalle cellule
Nella cellula esistono diversi tipi di RNA, tra questi spiccano sicuramente tre
tipi: l'RNA messaggero (mRNA) che porta il codice genetico sul sito della
sintesi proteica. L'RNA transfer (tRNA) è costituito da piccole molecole a forma
di trifoglio, ciascuna delle quali porta uno specifico aminoacido. A ogni codone
dell'mRNA (un codone è la sequenza di tre basi azotate, specifica per ogni
aminoacido) corrisponde un anticodone del tRNA. Infine, l'RNA ribosomiale
(rRNA) è il principale costituente dei ribosomi, i microscopici organuli cellulari
su cui avviene la sintesi proteica.
.
RNA polimerasi
Tuttavia, la molecola destinata a gestire
questo processo: RNA polimerasi,
compie almeno un errore ogni 104
nucleotidi copiati in RNA (la DNA
polimerasi è molto più accurata,
facendo un errore ogni 107 nucleotidi).
Nonostante questa ridotta accuratezza,
se un ribonucleotide non corretto viene
aggiunto all’ RNA in crescita, la
polimerasi può tornare indietro ed il
sito attivo dell’enzima può scindere il
nucleotide con una reazione che è
l’opposto di quella di
polimerizzazione. L’enzima si ferma
maggiormente su un nucleotide
sbagliato di quanto faccia su un
nucleotide aggiunto correttamente. Le
RNA pol possono dare inizio ad una
catena senza bisogno di alcun primer.
Da un lato si ha una minore
accuratezza sull’inizio del processo,
dall’altro il processo può essere più
veloce.
Trascrizione
The biosynthesis of RNA, called
transcription, proceeds in much the same
fashion as the replication of DNA and also
follows the base pairing principle. Again, a
section of DNA double helix is uncoiled and
only one of the DNA strands serves as a
template for RNA polymerase enzyme to
guide the synthesis of RNA. After the
synthesis is complete, the RNA separates
from the DNA and the DNA recoils into its
helix.
The transcription of a single RNA strand is
illustrated in the graphic on the left. One
major difference is that the heterocyclic
amine, adenine, on DNA codes for the
incorporation of uracil in RNA rather than
thymine as in DNA. Remember that
thymine is not found in RNA and do not
confuse the replacement of uracil in RNA
for thymine in DNA in the transcription
process. For example, thymine in DNA still
codes for adenine on RNA not uracil, while
the adenine on DNA codes for uracil in
RNA.
Note that the new RNA (red) is identical to
non coding DNA with the exception of
uracil where thymine was located in DNA
RNA polimerasi
L’enzima si muove gradualmente lungo il filamento svolgendo l’elica di DNA ed
usando uno dei due filamenti come stampo per la generazione di un filamento
di RNA. Quindi il filamento di RNA neoformato è una copia del filamento di
DNA .
La Trascrizione nei batteri.
L’ RNA polimerasi
è un complesso
multiproteico contenente un fattore detto
sigma che è staccabile L’RNA pol si possono
attaccare solo debolmente al DNA. Tuttavia
quando l’RNA pol incontra una particolare
sequenza di DNA definita sequenza
promotore vi si attacca con forza ed inizia la
trascrizione. Questa particolare sequenza
viene riconosciuta tramite il fattore sigma.
Dopo questo fenomeno la pol apre il DNA
per un breve tratto ed uno dei due filamenti
inizia a svolgere il ruolo di stampo. Dopo la
sintesi dei primi ribonucleotidi il fattore
sigma si stacca e la trascrizione avanza
rapidamente fino a che la pol incontra un
segnale sul DNA detto terminatore che la fa
prima fermare e poi staccare (preceduto da
una sequenza simmetrica che formerà una
“forcina”). Nei batteri il segnale terminatore
è una serie di A e T preceduta da una
sequenza simmetrica.
Non tutte le sequenze hanno le caratteristiche per essere riconosciute dal fattore sigma, la serie
delle caratteristiche che una sequenza deve avere per essere riconosciuta è definita consenso.
La sequenza precisa di questa consenso determina la forza del promotore ossia la capacità di
attrarre le polimerasi. I promotori dei geni più abbondanti sono più forti dei promotori dei
geni più rari. Alla stessa maniera dei promotori, anche i terminatori contengono una vasta
gamma di sequenze. Nelle cellule eucariotiche la situazione è simile. Le sequenze dei
promotori solitamente sono asimmetriche. Poiché il DNA ha due filamenti due molecole di
RNA potrebbero essere trascritte da qualsiasi posizione usando ciascun filamento di DNA
come stampo. L’unica imposizione è che la trascrizione avvenga in direzione 5’>3’ e che
quindi sia sempre lo stampo 3’>5’ ad essere impiegato. Chiaramente le direzioni saranno
opposte. La scelta del filamento stampo per ciascun gene è determinata dalla posizione e
dall’orientamento del promotore
Una differenza sostanziale tra i batteri e le cellule eucariotiche è rappresentata dal fatto che
i procarioti hanno solo una RNA polimerasi mentre gli eucarioti ne possiedono tre: l’ RNA
polimerasi I, II e III. Nonostante esse abbiano certe sub-unità in comune, esse trascrivono
geni diversi. Le RNA polimerasi I e III trascrivono geni che codificano RNA transfer,
RNA ribosomali e piccoli RNA. L’ RNA polimerasi II trascrive la maggioranza dei geni
che codificano proteine.
La pol II eucariotica e quella batterica sono
strettamente correlate ma ci sono almeno due
differenze sostanziali tra questi enzimi:
1) Mentre la pol batterica più il fattore sigma
possono iniziare la trascrizione su uno stampo di
DNA anche in vitro e senza altre proteine, la pol
II eucariotica richiede l’aiuto di diverse proteine
accessorie per iniziare a trascrivere. Queste
proteine vengono dette Fattori trascrizionali
generali.
2) negli eucarioti l’inizio della trascrizione deve
tenere in conto lo stato di compattamento della
cromatina.
Per iniziare la trascrizione di un gene la RNA
pol II richiede molti fattori generali della
trascrizione (proteine) che servono per
piazzare la pol sul promotore, iniziare la
trascrizione e rilasciare la pol dal promotore
quando inizia la trascrizione TFIID serve per
iniziare l’attacco del complesso di trascrizione
ad una sequenza di DNA ricca di T ed A definita
TATA box piazzata 25 basi dall’inizio della
trascrizione. Altri fattori vengono poi assemblati
per consentire l’inizio della trascrizione
formando un complesso d’inizio che guida la pol
II sul promotore dopo di che il fattore TFIIH
permette alla pol II di accedere al punto di inizio
sullo stampo di DNA. La trascrizione in una
cellula eucariotica richiede un numero maggiore
di proteine tra cui proteine regolatrici dette
attivatori trascrizionali che legandosi a
specifiche sequenze di DNA aiutano la pol II a
posizionarsi sul punto iniziale della trascrizione.
Per iniziare la trascrizione deve esistere un
complesso poli proteico detto mediatore
necessario a regolare le diverse proteine
attivatrici richieste per questo processo.
Questi dati provengono da approfondite analisi fatte in vitro con un numero ristretto di
proteine. La situazione in vivo si complica maggiormente in quanto serve un ulteriore
complesso detto mediatore che permette alle proteine attivatrici di comunicare
adeguatamente sia con le TFII che con la pol II. Inoltre, l’inizio della trascrizione richiede il
reclutamento di enzimi che modifichino la cromatina, compresi complessi di rimodellamento
della cromatina e istone acetilasi. Una volta iniziata la trascrizione la pol II si muove a scatti
fermandosi su alcune sequenze e accelerando su altre. Una volta che la pol II trascrive il DNA
si associa con fattori di allungamento che la aiutano a mantenere la trascrizione e a non
bloccarsi su nessuna sequenza.
Negli
eucarioti
la
trascrizione
rappresenta solamente un primo
passaggio
nella
trasmissione
dell’informazione dal DNA alle
proteine. Dopo che il filamento di RNA
è stato trascritto viene sottoposto a
modificazioni covalenti ad entrambe le
estremità e alla rimozione delle
sequenze introniche. Quest’ultimo
fenomeno si chiama splicing dell’ RNA
messaggero. Questa modificazione
permette inoltre di generare diverse
proteine
dallo
stesso
gene
semplicemente modificando lo schema
dello splicing! Le modificazioni dell’
estremità di una molecola di RNA
riguardano l’ aggiunta di un cappuccio
al 5’ della molecola definito Cap e di
una coda di poly A all’estremità 3’
Le estremità 5’ e 3’ di un RNA procariotico non sono modificate,
mentre quelle che si trovano sull’ mRNA eucariotico vengono
modificate. Inoltre l’RNA procariotico contiene molto spesso le
istruzioni per codificare diverse proteine contemporaneamente.
Mentre gli mRNA eucariotici solitamente contengono
l’informazione per una sola proteina.
RNA pol II negli eucarioti
Molti enzimi depuati a modificare
l’RNA nascente viaggiano sopra la RNA
pol II, Per esempio ci sono proteinchinasi in grado di aggiungere più di
cento gruppi fosfato, questi gruppi
consentirebbero ad un numero
selezionato di proteine di “saltare a
bordo” della RNA pol II quando la
trascrizione è avviata. Tra queste
molecole spiccano le proteine
destinate a modificare il 5’ dell’ RNA
nascente. Il cappuccio in 5’ che viene
messo alla molecola di RNA nascente è
molto importante poiché permette di
identificare questi RNA rispetto ad altri
che svolgono funzioni diverse.
Non appena si sono prodotti i primi nucleotidi l’mRNA viene dotato di un cap attraverso una
serie si tre modificazioni:1) una fosfatasi toglie il fosfato in 5’. 2) una guanil transferasi
attacca una GMP in modo inusuale ossia 5’-5’. 3) un a metil transferasi metila la G in
posizione 7 sulla guanina. Nel nucleo questi cap sono associati ad un complesso proteico
detto CBC. Anche le estremità 3’ dei mRNA sono modificate. Sulla coda della pol II
viaggiano altri due complessi detti fattore di stimolazione del taglio (CStF) e fattore di
specificità del taglio e della poliadenilazione (CPSF). Quando questo complessi trovano la
sequenza adeguata sull’RNA innescano altre proteine che per prima cosa tagliano il
messaggero, quindi la poly-A polimerasi inizia a trasferire nucleotidi A alla catena di RNA.
Dopo che l’estremità 3’ è stata tagliata la pol II continua ancora a valle la trascrizione del
DNA. Presto però la pol II si stacca e questo RNA viene degradato.
5’Cap
3’ polyA
Splicing di un trascritto primario. L’RNA messaggero viene prodotto nel nucleo cellulare, sul modello di un
filamento di DNA, per mezzo di un enzima denominato RNA polimerasi DNA dipendente. Sempre nel nucleo,
l’mRNA primitivo così costituitosi viene sottoposto ad un rimaneggiamento, detto splicing, che consiste
essenzialmente nell’eliminazione degli introni, privi di funzione codificante. L’mRNA maturo viene trasferito nel
citoplasma e sistemato sui ribosomi dove viene letto.
Apparentemente la rimozione degli introni rappresenta un notevole sforzo energetico per la cellula eucariotica.
Per spiegare l’esistenza di questo notevole dispendio di energia, gli scienziati hanno ipotizzato che la presenza
di una successione di esoni/introni possa facilitare la generazione di nuove proteine funzionali dagli stessi geni.
Tutto questo permetterebbe di avere varianti proteiche nuove provenienti da sequenze codificanti di DNA
comuni. Un esempio ci viene dalla α-Tropomiosina che è soggetta a diversi schemi di splicing in cellule diverse.
Splicing dell’RNA
A differenza dei batteri dove le sequenze dei geni sono continue, negli eucarioti le
sequenze che codificano i geni sono interrotte da sequenze intercalanti non codificanti
dette Introni (scoperti nel 1977). Queste sequenze vengono rimosse dall’ RNA tramite una
reazione detta splicing dell’ RNA. L’RNA precursore dell’ RNA messaggero o detto premRNA viene sottoposto a due reazioni sequenziali necessarie alla rimozione dell’ introne.
Queste reazioni sono di trasferimento di fosfato o transesterificazione, esse rimuovono
l’introne come un cappio e congiungono le due estremità di un esone.
Questo processo è molto complesso e
richiede la presenza di sequenze di
RNA addizionali e più di 50 proteine
che idrolizzano molte molecole di ATP.
Nel primo passaggio una A dell’introne
reagisce con il suo OH in 2’ con il P
della catena del DNA che gli sta a
monte proprio al confine introne-esone.
L’estremità 5’ dell’ introne si unisce
covalentemente con questa A e si forma
un cappio, successivamente i due esoni
si avvicinano e si saldano tra loro.
Solo tre blocchi di sequenza sull’Introne sono essenziale per la sua rimozione, il
resto non essendo vincolato può essere occupato da qualsiasi nucleotide. In rosso
è indicata la A che è fondamentale per dare via alla realizzazione del cappio. GU
all’inizio dell’introne e AG alla fine sono doppiette invarianti, ossia presenti in tutti
gli introni. Il resto delle basi è suscettibile a variazioni anche se le sequenze
riportate nella figura sono quelle più facilmente trovate. Le distanze in nucleotidi
tra il 5’ ed il 3’ dell’introne sono le più disparate, si va da poche basi a migliaia!!
Il meccanismo di splicing
Il complesso di piccoli RNA e proteine
riconosce i segnali all’inizio ed alla fine
dell’introne, avvicina le due estremità
e possedendo attività enzimatica
permette lo svolgimento delle reazioni
di taglio dell’Introne. Alcune molecole
servono per riconoscere i punti in cui
“manovrare” l’introne, poi queste
molecole cedono il passo ai piccoli
RNA U1 e U2 che insieme al terzo
piccolo RNA U6 producono una
distorsione nel RNA necessaria ad
avvicinare le due estremità
dell’introne. A questo punto una serie
di reazioni enzimatiche si succedono a
catena, portando all’eliminazione
dell’introne. Anche se non sono
indicate nella figura altre proteine
entrano nel processo rendendolo
particolarmente efficiente ed efficace.
Le molecole chiave dello splicing sono molecole di RNA dette snRNA o piccoli RNA nucleari si
chiamano U1, U2, U4, U5 e U6 si complessano con proteine per formare gli snRNP. Queste
molecole riconoscono i confini Introne-Esone e partecipano alla chimica dello splicing. U1
riconosce il sito 5’ e si scambia con U6 mentre BBP e poi U2 riconoscono il sito di ramificazione
sull’introne. U2 forza la A a disappaiarsi e la attiva per l’attacco al sito di splicing in 5’ dove
avviene il primo trasferimento di fosfato. Il secondo avviene tra i due esoni che vengono
avvicinati da U5. Tutti i riarrangiamenti e le reazioni che avvengono nello splicesoma richiedono
l’idrolisi di un gran numero di molecole di ATP.
Le modificazioni che partendo dal pre-mRNA portano all’mRNA maturo avvengono nel
nucleo della cellula. Una volta terminato lo splicing e le modificazioni al 5’ e al 3’della
molecola, l’ mRNA deve essere trasferito nel citosol. Nel nucleo potrebbe confondersi con i
resti dell’RNA intronico che devono essere degradati. Il trasporto dell’ mRNA è un
processo molto selettivo che richiede l’intervento delle proteine del poro nucleare.
Sembrerebbe che per essere trasportato l’ mRNA debba essere associato a proteine del
cappuccio, ma soprattutto che proteine dette proteine ribonucleari nucleari eterogenee
(hnRNP) si associno al pre mRNA. Inoltre, è necessario che lo splicing sia stato
completato ed infine che ci siano segnali adeguati sulla coda della molecola. Solo quando
tutti questi segnali sono presenti l’mRNA può attraversare il complesso del poro nucleare
ed entrare nel citosol.
….. ma alcuni RNA non servono per codificare proteine. Si tratta di RNA che possiedono
funzioni alternative all’interno della cellula. Gli RNA più abbondanti (80% dell’RNA) sono
quelli ribosomali che formano il nucleo del ribosoma necessario alla traduzione proteica.
Questi rRNA sono trascritti dall RNA pol I. Per ottenere un numero molto grande di rRNA la
cellula eucariotica possiede copie multiple dei geni che codificano per l’rRNA (circa 200
copie per genoma aploide nell’uomo). Gli rRNA non vengono cappati e poliadenilati. Ci sono
quattro tipi di rRNA negli eucarioti definiti dalla loro velocità di sedimentazione espressa in
Svedberg. Gli rRNA 18S, 5,8S e 28S sono prodotti dalla modificazione di un rRNA
precursore di grosse dimensioni, mentre l’rRNA 5S è prodotto dalla RNA pol III che
trascrive un gene localizzato in una regione diversa del genoma.
Lo svedberg (simbolo S) è un'unità di misura del
tasso di sedimentazione che non fa parte del
Sistema Internazionale. Uno svedberg,
dimensionalmente uguale ad una unità di tempo,
è pari a 10-13 secondi. L'unità prende il nome dal
fisico e chimico svedese Theodor Svedberg,
vincitore del Premio Nobel per la chimica nel
1926 per il suo lavoro sulla chimica dei colloidi
e l'invenzione dell'ultracentrifuga.
Nell'ultracentrifugazione, il tasso di
sedimentazione di una particolare
macromolecola è calcolato dividendo la velocità
di sedimentazione costante (espressa in m/s) per
l'accelerazione applicata (espressa in m/s2) e
moltiplicando poi per 1013.
Nucleolo
Il nucleolo è la più grande fabbrica di
ribosomi della cellula. Si tratta di un
grosso aggregato di macromolecole
comprendenti gli stessi geni che
codificano per gli rRNA, i precursori
degli rRNA e le molecole mature
situato nel nucleo ma non separato da
menbrane. Inoltre contiene tutte le
molecole che sono necessarie per la
maturazione degli RNA ribosomali. I
geni codificanti per l’rRNA sono
distribuiti in 10 gruppi ciascuno
disposto vicino alla punta di 5 coppie
di cromosomi diversi. Quando la
cellula entra in mitosi i cromosomi si
condensano ed il nucleolo si
distrugge. Dopo la mitosi la
cromatina ritorna al suo stato naturale
ed il nucleolo si riforma.
The nucleolus is a prominent sub-nuclear structure that is not bound by a membrane and resides
within the nuclear matrix. Though known to exist since the eighteenth century, the primary
function of the nucleolus was not discovered until the 1960s. It is now been determined that
nucleoli manufacture the subunits that combine to form ribosomes, the cell's protein-producing
factories. Accordingly, the size of nucleoli depends upon the ribosomal requirements of the type
of cell in which they are found. In cells that produce large amounts of protein, and thus call for
significant numbers of ribosomes, the size of the nucleolus is considerable, sometimes
occupying as much as 25 percent of the total volume of the nucleus.
Summary
1.
2.
3.
4.
5.
6.
name(s): nucleolus
location: roughly in centre of nucleus.
appearance: approximately spherical but with an illdefined edge
size: about 1 micrometer in diameter
function: production of ribosomal components
Other RNAs are modified within nucleolus, for
example tRNAs are modulated in this region of the
nucleous
La traduzione negli eucarioti.
La conversione dell’informazione contenuta nell’ mRNA in proteina viene definita traduzione.
Poichè il DNA è scritto con un alfabeto fatto di quattro lettere mentre le proteine sono scritte
con un alfabeto fatto da venti lettere Per questa ragione la sequenza nucleotidica di un
messaggero deve essere tradotta in proteina seguendo determinate regole. Queste regole sono
state decifrate negli anni ’60 e rappresentano il codice genetico. Se l’RNA e un polimero fatto
di 4 lettere si potrebbe pensare che ciascun amminoacido possa essere codificato da una
tripletta di tre lettere. In questo modo le possibili combinazioni sarebbero 4X4X4=64, ben
maggiori delle venti combinazioni necessarie. Per questa ragione alcune triplette non
dovrebbero essere usate o il codice genetico dovrebbe presentare un fenomeno di ridondanza,
ossia diverse triplette dovrebbero codificare per lo stesso amminoacido. Ciascuna tripletta si
chiama codone e rappresenta o un amminoacido o un segnale di stop al processo di traduzione.
Codone
Nella traduzione proteica
una sequenza di nucleotidi
viene tradotta in in una
sequenza di amminoacidi.
In line di principio una
sequenza di RNA può
essere letta in ognuno dei
tre quadri di lettura.
Ovviamente ciò dipende
dalla base scelta per la
partenza, ma esiste un
codice di punteggiatura
che permette solo uno dei
tre quadri di lettura
La tripletta codificante sull’ mRNA non si lega direttamente all’ amminoacido ma ad una
molecola adattatore che può riconoscere tramite un suo sito il codone e presentare all’altra
estremità l’amminoacido. queste molecole si chiamano RNA transfer o tRNA e sono lunghe
poco più di 80 nucleotidi e sono sintetizzati dalla RNA pol III. Queste molecole si ripiegano
nello spazio in modo complesso ed assumono una forma a L. Una delle due estremità contiene
l’anticodone che riconosce il codone sull’ mRNA mentre l’ atra estremità è usata per tenere
legato l’amminoacido.
Ciascuna molecola di tRNA si lega ad
uno dei 20 aa che rappresenta il suo
partner ideale. L’enzima che catalizza
questa reazione è l’amminoacil-tRNA
sintetasi. Ovviamente per evitare errori
il sistema possiede dei meccanismi di
sicurezza che fanno si che ci siano
meno di un errore ogni 40000
accoppiamenti.
Poiché il codice genetico è ridondante, ossia
codoni diversi possono specificare per lo stesso
amminoacido, bisogna che ci sia più di un tRNA
per molti amminoacidi o che alcuni tRNA
possano appaiarsi con più di un codone. In effetti
si verificano entrambe le condizioni. Alcuni
amminoacidi hanno più di un codone ed alcuni
tRNA sono costruiti in modo da tollerare un
appaiamento “sbagliato” in terza posizione.
Questo appaiamento sbagliato spiega come mai
ci siano tanti codoni alternativi per una stesso
amminoacido che differiscono solamente in terza
posizione. Gli esseri umani hanno 497 geni per i
tRNA ma, fra di essi sono rappresentati
solamente 48 diversi anticodoni.
Osservando la tabella si nota che i primi due aa sono vincolanti per
specificare l’aa, mentre il terzo può cambiare senza creare ambiguità
nella scelta dell’aa da inserire nella proteina nascente. Per esempio phe
necessita di 2 U per essere inserita nella proteina, la terza base può
essere una qualunque tra U, C, A o G che la scelta non verrà modificata.
Amminoacidi
Gli amminoacidi che compaiono nelle
proteine di tutti gli organismi viventi sono 20
(anche se evidenze recenti suggeriscono che
questo numero potrebbe aumentare fino a
23, vedi più sotto) e sono sotto il controllo
genetico, nel senso che l'informazione del
tipo e della posizione di un amminoacido in
una proteina è codificata nel DNA. Talvolta,
nelle proteine compaiono anche altri
amminoacidi, più rari, detti occasionali che
vengono prodotti per modifiche chimiche
successive alla biosintesi della proteina, che
avviene sul ribosoma.
In natura sono stati finora scoperti oltre 500
amminoacidi diversi che non fanno parte di
proteine e svolgono ruoli biologici diversi.
Alcuni sono stati addirittura trovati nelle
meteoriti. Piante e batteri sono in grado di
biosintetizzare amminoacidi particolari, che
possono essere trovati, per esempio, negli
antibiotici peptidici, ad esempio la nisina e
l'alameticina L'acido 1-amminociclopropan1-carbossilico (ACC) è un semplice
amminoacido ciclico disostituito che funge
da intermedio nella sintesi dell'etilene, che
per gli organismi vegetali è un ormone.
La reazione fondamentale durante la sintesi proteica è la formazione di un legame covalente tra
un gruppo carbossilico all’estremità di una catena polipeptidica in crescita e un gruppo
amminico libero su di un amminoacido libero in arrivo.
Il messaggio dell’ RNA viene decodificato sui ribosomi dove avviene la sintesi proteica. Il
ribosoma è una macchina molto complessa formata da più di 50 proteine e da alcune
molecole di RNA ribosomale (che sono responsabile della sua struttura globulare e delle sue
funzioni biologiche). Queste strutture sono edificate nel nucleolo e poi trasportate nel citosol
dove espletano la loro funzione di macchine per la sintesi proteica. Il ribosoma è costituito
da due subunità che normalmente non sono connesse tra loro. Una normale cellula
eucariotica contiene milioni di ribosomi nel suo citosol. Alcuni sono liberi nel citosol, altri
sono ancorati a membrane del reticolo endoplasmatico.
membrana citoplasmatica
golgi
nucleo
mitocondrio
ribosomi
Siti di legame del ribosoma
Ciascun ribosoma ha tre siti di legame per i tRNA (E, P e A), più unsito di
legame per il mRNA. I siti della sub-unità maggiore ingaggiano i tRNA e
consentono alla catena polipeptidica di allungarsi man mano il ribosoma
scorre l’mRNA.
Un ribosoma contiene quattro siti di legame: uno per il
mRNA e tre per i tRNA denominati siti A, P ed E.
Un tRNA che porta un amminoacido nuovo da aggiungere
alla catena si lega in A in modo che due tRNA siano ora
adiacenti.
L’estremità carbossilica dell’ amminoacido situato sul tRNA
in P si stacca tramite una reazione enzimatica dal suo tRNA e
viene unita all’ estremità amminica dell’ amminoacido situato
in A tramite una attività catalitica sdella subunità maggiore
detta peptidil transferasi. Insieme a questo fenomeno i tRNA
vengono spostati in E e P.
Una serie di cambiamenti conformazionali sposta l’ mRNA
esattamente di tre nucleotidi in modo tale che il sito A sia di
nuovo libero e pronto a ricevere un nuovo tRNA
La fine del messaggio di codifica è fornita da tre codoni detti
di stop. Questi codoni non hanno nessuna controparte su
tRNA; ci sono fattori di rilascio che si legano a ciascun
ribosoma in cui nel sito A ci sia un codone di stop
Quando la traduzione inizia le due subunità si assemblano sul mRNA la subunità minore
serve per far si che i tRNA si adattino ai codoni dell’ mRNA mentre la subunità maggiore
catalizza la formazione dei legami peptidici che uniscono gli amminoacidi dell proteina
nascente. Infine quando il ribosoma incontra un segnale di stop rilascia la proteina e le due
subuntà si staccano. Queste subunità possono essere usate in seguito per una nuova
traduzione.
Il sito di inizio e quello di fine della traduzione
rappresentano due aspetti fondamentali del processo di
traduzione. La traduzione di un mRNA inizia sempre
dal codone AUG che codifica per un Metionina. Il
codone AUG viene riconosciuto da un tRNA iniziatore
che porta la Met, le met successive nella catena
polipeptidica verranno portate da un tRNA diverso. Il
tRNA iniziatore è l’unico che si può legare in assenza
di mRNA alla subunità ribosomale minore insieme ai
fattori di inizio eucariotici eiF. Questi fattori si
legano all’mRNA ed iniziano a scandagliare la
molecola dal 5’ cap in direzione 3’ fino a che non
incontrano un AUG. Quindi i fattori di inzio si
dissociano la subunità maggiore si aggrega ed inizia la
traduzione. Le sequnze a monte ed a valle dell’AUG
influenzano il ribosoma nella scelta del primo codone,
nel 90% dei casi il primo AUG che il ribosoma
incontra è quello da cui inizia la traduzione.
La fine del messaggio avviene quando il ribosoma
incontra uno dei tre segnali di stop della traduzione:
UAA; UAG; UGA che sono stati chiamati codoni
di stop. Questi codoni non si appaiano ad un tRNA
ma si legano a fattori detti di rilascio. Quando in
posizione A entra un fattore di rilascio la peptidil
transferasi è costretta a legare una molecola di
acqua all’ultimo amminoacido. Questa reazione
libera l’estremità della catena peptidica e il
ribosoma si separa rilasciando l’mRNA.
La sintesi della proteine prevede inizi multipli da parte dei ribosomi su ciascuna
molecola di mRNA. Non appena il ribosoma ha tradotto una parte sufficiente di
proteina l’estremita 5’ dell’RNA viene nuovamente agganciata da un altro ribosoma.
Le molecole di mRNA si trovano nel citosol sotto forma di poliribosomi definiti
anche polisomi che altro non sono che grossi complessi composti da parecchi
ribosomi agganciati ad una molecola di mRNA