Effetti collaterali
indesiderati
L’obiettivo principale della vaccinazione è quello di
proteggere il maggior numero possibile di persone dalle malattie, prevenibili con i vaccini, ma insieme di
tentare di ridurre al massimo possibile l’insorgenza di
effetti collaterali. Va riconosciuto che i vaccini hanno
fatto scomparire il vaiolo dalla faccia della Terra, la
polio dall’emisfero occidentale e hanno ridotto la morbilità e la mortalità di molte malattie infettive, ma che
nel contempo hanno causato sia effetti collaterali lievi,
sia reazioni gravi ed eccezionalmente letali.
Tutti i vaccini entrati in commercio nei Paesi occidentali sono tuttavia sicuri ed efficaci, ma nessun vaccino è completamente sicuro ed efficace in tutte le persone.
L’obiettivo da raggiungere nello sviluppo di un vaccino è infatti quello di avere a disposizione un farmaco
che sia al massimo efficace e che abbia la percentuale
più bassa di eventi avversi.
Mentre per un farmaco “salvavita” eventuali effetti
collaterali gravi sono sopportabili, essi non sono tollerabili in seguito all’uso di un vaccino, la cui finalità è
di tipo precipuamente preventivo. Ne consegue che gli
effetti collaterali, come incidenza e come gravità, vanno sempre considerati nella valutazione del rapporto
costi/benefici (Spier RE, 2004).
I mezzi di comunicazione hanno, come si sa, una
fortissima presa sulla popolazione e quindi ogni notizia,
da essi riportata, porta a notevoli conseguenze, riuscen-
9
C a p i t o l o
Effetti collaterali lievi
e gravi, precauzioni
e controindicazioni
do spesso a modificare comportamenti, anche radicati
da anni. Ne consegue che le notizie riguardanti i danni
da vaccini dovrebbero corrispondere esattamente alla
verità e non dovrebbero essere il frutto dell’emotività
o peggio ancora di false informazioni (Cohn V, 1996).
A questo proposito il dottor Freed scrive: “Alla luce
delle prove scientifiche disponibili sui vaccini, il problema per i media è di come riportare i rari eventi contrari senza alterare la percezione del rischio reale”.
Durante il periodo immediatamente successivo all’introduzione di una nuova vaccinazione, l’incidenza degli
effetti collaterali può essere difficilmente valutata: è
solo con l’estensione dell’uso all’intera popolazione,
durante molti anni, che potremo avere la giusta dimensione del problema, insieme alla comparsa di qualche
reazione grave e rara. Accade con i vaccini quello che
succede normalmente con l’introduzione nella pratica
di un nuovo farmaco: sono necessari anni, almeno 5, o
meglio 10, per poter conoscere bene la sua tolleranza.
Secondo l’OMS gli eventi avversi sono fondamentalmente riconducibili a errore programmatico, a reazioni
indotte dal vaccino stesso direttamente, o precipitate dal
vaccino o da eventi coincidenti o da modalità sconosciute. La stessa OMS gioca un ruolo essenziale nella valutazione della sicurezza dei vaccini (Duclos P, 2004;
Global Advisory Committee on Vaccine Safety, 2006).
Per ridurre i tempi di conoscenza e per avere un’esatta dimensione degli effetti collaterali è necessario mettere in atto in tutto il Paese una rete di sorveglianza
subito dopo l’entrata in commercio del vaccino (per la
definizione di caso vedi tabella 9.6).
È da tener presente che l’insorgenza di sintomi e
segni dopo la somministrazione di un vaccino non significa necessariamente che l’origine di questi sia sem-
Gli organismi internazionali per la sicurezza dei vaccini
Gli organismi internazionali che sono interessati alla sicurezza dei vaccini sono in primo luogo l’OMS, poi l’Istituto di Medicina degli Stati
Uniti e infine la Brighton Collaboration (Bonhoeffer J et al, 2009).
Quest’ultimo organismo si basa sulla collaborazione volontaria internazionale per stabilire le definizioni standardizzate di caso per i diversi eventi spiacevoli, successivi alla vaccinazione. La Brighton Collaboration è sorta nel 2000, con la creazione di gruppi di lavoro, composti
da volontari internazionali, esperti nella sicurezza dei vaccini, da medici pratici, farmacisti, appartenenti alla Sanità pubblica e all’immissione in commercio dei vaccini. Al gennaio 2009, ben 27 definizioni di caso sono state completate. A queste definizioni è possibile accedere
on line al seguente indirizzo: www.brightoncollaboration.org.
BARTOLOZZI_09.indd 135
14/05/12 09:51
136
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
pre da attribuire al vaccino: non sempre post hoc significa propter hoc. I primi 2 anni di vita, che corrispondono al periodo durante il quale vengono iniziate tutte
le vaccinazioni, comprendono un’età in cui con grande
frequenza si verificano alcune situazioni cliniche, come
la diarrea acuta, le convulsioni in corso di febbre e gli
episodi infettivi, in genere febbrili. Perché l’associazione fra vaccinazione e sintomi clinici risulti abbastanza
sospetta, è necessario che essa compaia entro un determinato periodo di tempo e che, almeno per i vaccini
costituiti da virus vivi attenuati, venga isolato il ceppo
vaccinale dal paziente. Per poter ipotizzare una situazione di causa/effetto non è sufficiente infatti ritrovare
il poliovirus attenuato del vaccino nelle feci dei vaccinati, ma è necessario reperirlo nel liquor o nel cervello.
Un metodo ottimo per dimostrare l’associazione fra un
evento clinico negativo con la somministrazione di un
vaccino specifico è infatti offerto dalla raccolta dei dati epidemiologici (Chiappini E et al, 2006): una più alta
incidenza di un particolare evento patologico fra i soggetti che hanno ricevuto un vaccino specifico, in confronto al restante della popolazione di età analoga e
nella stessa sede geografica, suggerisce una relazione
precisa. L’incidenza di una sofferenza meningea fra i
vaccinati contro la parotite in diverse contee del Regno
Unito, ha permesso di trovare un collegamento fra la
somministrazione di un nuovo ceppo di virus attenuato
(Urabe AM/9) contro la parotite e l’irritazione meningeale. Vale, come esempio, anche quanto è avvenuto negli
Stati Uniti una trentina di anni fa, quando dopo la vaccinazione contro l’influenza, utilizzando un ceppo di
origine suina A, New Jersey, 1976, comparvero una quarantina di casi di sindrome di Guillain-Barré, contro un
numero limitatissimo nella popolazione non vaccinata.
In effetti una reazione grave può essere anche dovuta
a sostanze diverse dagli antigeni specifici del vaccino,
cioè a sostanze presenti comunque nella preparazione:
ormai in letteratura sono numerosi i casi di shock anafilattico, legato alla gelatina, o agli antibiotici (neomicina, kanamicina, streptomicina), mentre effetti collaterali meno gravi sono stati attribuiti ai conservanti, agli
adiuvanti o ad altri componenti il terreno di coltura sul
quale è cresciuto l’agente infettivo. In particolare il timerosal (un conservante contenente mercurio), pur essendo in grado d’indurre reazioni tipo ipersensibilità
ritardata, non determina effetti collaterali importanti. È
stato descritto anche qualche caso di shock anafilattico
al latex, presente all’esterno della fiala, con il quale
l’ago era entrato fortuitamente in contatto.
Va a questo punto ricordato che la riluttanza dei
genitori ad accettare le vaccinazioni per i propri figli
risiede principalmente nel timore che, con la vaccinazione, possano insorgere complicazioni. Purtroppo anche alcuni medici e rarissimi pediatri sono riluttanti a
propagandare le vaccinazioni o sono addirittura contrari alle pratiche vaccinali. Un comportamento del genere non ha giustificazione, anche se sappiamo che pure
i vaccini, come d’altra parte ogni farmaco, sono da
BARTOLOZZI_09.indd 136
considerare in minima parte come non sufficientemente sicuri. Sebbene il rischio di complicanze sia abbastanza basso, quando il loro uso è diffuso tra la popolazione, è possibile che, con incidenza diversa vaccino
da vaccino, possano comparire effetti spiacevoli.
Il modo più semplice per prevenire la maggior parte
delle reazioni avverse è l’identificazione, durante la
raccolta dell’anamnesi prevaccinale (vedi capitolo 6)
delle diverse precauzioni e controindicazioni. Per compiere appieno il proprio dovere il pediatra o il Servizio
di vaccinazione deve avvertire i genitori ed eventualmente i pazienti, sull’utilità di riferire qualunque possibile reazione o effetto collaterale, insorti in vicinanza
della vaccinazione e di tale intensità da richiedere l’intervento del medico.
La comparsa di effetti spiacevoli, successivi alla somministrazione di un vaccino, rappresenta anche per il
medico vaccinatore un elemento importante, che spesso
limita la sua azione a favore delle vaccinazioni. Troppo
spesso la paura del rischio, spesso sovrastimato, lega le
mani del pediatra o del medico generico. In una ricerca,
eseguita negli Stati Uniti su 1236 medici, è risultato che
ben il 32% di essi sovrastimava il rischio della vaccinazione contro la pertosse e ben il 13% contro il morbillo, sopravvalutando gli effetti di una potenziale contestazione da parte dei familiari.
Coloro che somministrano il vaccino debbono essere
in grado di riconoscere e trattare le reazioni allergiche
gravi, compresa l’anafilassi: debbono essere infatti
sempre disponibili i materiali necessari per il trattamento immediato delle reazioni da ipersensibilità. È importante che dopo la vaccinazione i pazienti rimangano in
osservazione per 15-30 minuti, per prendere immediatamente provvedimenti nel caso compaia una reazione
allergica grave.
Gli effetti collaterali (altrimenti detti effetti collaterali spiacevoli) possono essere da lievi e di poco conto a
gravi e pericolosi perfino per la vita (tabella 9.1).
In rari casi l’effetto collaterale spiacevole è legato al
fatto che non sono state seguite le comuni norme relaTabella 9.1 Classificazione delle reazioni avverse a vaccinazione
Qualità di reazione
Sede e tipo della reazione
Locali
•Nel punto di inoculo
Generalizzate
•Con coinvolgimento sistemico (febbre)
Allergiche
•Anafilassi e manifestazioni allergiche di
altro tipo
Composite
•Associazione di una reazione locale con
una reazione generalizzata o di più
reazioni a carattere sistemico
Multiple
•Reazioni con caratteristiche analoghe in
occasione di diverse somministrazioni
dello stesso vaccino nello stesso
soggetto
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
137
Interazione fra vaccini e farmaci
Viene riportato in letteratura il caso di una bambina di 14 anni trattata con carbamazepina per convulsioni complesse parziali, che, a distanza di 13 giorni dalla vaccinazione antinfluenzale, presenta un episodio di nausea e vomito, seguito da vertigine e sonno profondo per
3 ore (Robertson WC, 2002). Viene portata in stato letargico al dipartimento di emergenza dell’ospedale, dove viene trovato un livello di
carbamazepina nel sangue di 27,5 mcg/mL, contro livelli di 8,2-12,4 mcg/mL dei mesi precedenti. Nei giorni successivi, con infusioni, la ragazza migliora e i livelli di carbamazepina tornano nei limiti usuali. È probabile che il vaccino contro l’influenza interferisca con il metabolismo della carbamazepina, che viene trasformata dal CYP3A4, uno degli enzimi della superfamiglia del citocromo P450.
tive alla via e alla sede della somministrazione. Fare
per via intradermica o sottocute un vaccino con idrossido di alluminio, la cui somministrazione dovrebbe
essere fatta unicamente per via intramuscolare, produce
di sicuro effetti collaterali spiacevoli.
Non va dimenticata l’esistenza di un altro rapporto
fra vaccinazione e comparsa di effetti collaterali più o
meno gravi, dovuti alle conseguenze che la vaccinazione può avere sul metabolismo di un farmaco (in generale un farmaco antiepilettico, come fenitoina, fenobarbitale, carbamazepina e altri).
È ormai evidente che gli effetti collaterali ai vaccini,
per quanto riguarda la loro intensità e la loro frequenza,
sono legati strettamente alle caratteristiche genetiche
del soggetto vaccinato, soprattutto per l’estremo polimorfismo delle risposte citochimiche. Per questo è stata di recente avvertita la necessità d’identificare una
nuova branca della vaccinologia, alla quale è stato dato
il nome di adversomica, riguardante gli effetti dell’immunogenetica sulle manifestazioni collaterali spiacevoli dopo vaccinazione (Poland GA et al, 2009).
Notifica di reazioni avverse
Da tutto quanto abbiamo detto deriva la necessità che
ogni tipo di sintomatologia, insorta temporalmente in
rapporto con la vaccinazione, debba essere reso noto
tempestivamente, perché, unito ad altre segnalazioni,
possa servire da guida per l’identificazione di una reazione contraria, magari non precedentemente riportata.
L’obbligo del medico vaccinatore di osservare e comunicare i risultati di efficacia e di sicurezza di un
vaccino in tutti i pazienti immunizzati, è presente in
tutte le legislazioni sanitarie (Salmaso S, 1998).
Un buon sistema di sorveglianza deve rispondere a
numerosi requisiti:
• deve fornire un mezzo per scoprire nuovi effetti collaterali, non precedentemente collegati al vaccino
• deve aiutare nel determinare il numero delle reazioni
collaterali
• deve permettere la raccolta e l’analisi delle informazioni sugli effetti collaterali al vaccino
• deve aiutare nel valutare il rischio potenziale degli
effetti collaterali e quindi nello stabilire, vaccino per
vaccino, il rapporto rischio/beneficio.
Anche nel nostro Paese, già con la circolare del 25
giugno 1979, n. 41 sono state emanate le disposizioni
BARTOLOZZI_09.indd 137
per la notificazione delle reazioni collaterali, spiacevoli ai vaccini. Penso sia inutile sottolineare l’importanza
di tale rilevazione, elemento essenziale per la prosecuzione della lotta contro le malattie infettive, per le quali è a disposizione un vaccino. Nella circolare viene
sottolineata la necessità di comunicare solo i casi nei
quali sia insorta un sintomatologia obiettiva, in qualche
modo collegabile al vaccino, senza tener conto delle
lamentele di quelle madri “eccessivamente allarmiste”
che finirebbero per vanificare qualunque sforzo teso a
valutare e controllare gli effetti indesiderati legati alla
somministrazione del vaccino.
La tempestività della notifica è essenziale per l’adozione di eventuali provvedimenti. A questo proposito
così si esprime la circolare:
“La tempestività della notifica è essenziale per l’adozione di eventuali provvedimenti, perché, unita ad
altre segnalazioni, possa essere di guida per l’identificazione di una reazione contraria, magari non precedentemente segnalata”.
La segnalazione spontanea è una comunicazione relativa all’insorgenza di una reazione avversa, che si
sospetta si sia verificata dopo la vaccinazione. La qualità e la completezza delle informazioni riportate sono
fondamentali (tabella 9.2).
È stato pubblicato successivamente un nuovo modello di segnalazione di reazione avversa a farmaci e vaccini, che va compilato in ogni sua parte (figura 9.1).
La scheda compilata va inviata al responsabile della
Farmacovigilanza della struttura sanitaria di appartenenza (ASL), secondo i successivi adempimenti, ai
sensi del DL 95/2003.
Nel Decreto Ministeriale è riportata anche una scheda per la comunicazione degli effetti indesiderati da
parte del cittadino, da trasmettere anche questa al responsabile della Farmacovigilanza della ASL (figura
9.2): sembra che ci si avvicini sempre di più al sistema
VAERS degli Stati Uniti, ma purtroppo questa scheda
è pochissimo, o per niente, usata nel nostro Paese.
Dopo la promulgazione della legge 25 febbraio 1992,
n. 210, relativa all’indennizzo dei soggetti danneggiati
da complicanze di tipo irreversibile, in seguito all’uso
di sangue o emoderivati, o di vaccini, il numero delle
segnalazioni di effetti indesiderati è andato progressivamente aumentando.
L’art. 3, comma 5, della stessa Legge demanda esplicitamente al medico vaccinatore (facente parte della
14/05/12 09:51
138
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.2 Suggerimenti relativi alla descrizione di sospetta reazione avversa a vaccino (DM 12 dicembre 2003)
Locale
Reazione locale estesa
Ascesso sterile
Ascesso settico
Necrosi/ulcerazione
Anestesia/parestesia
Altro
Generale
Adenopatia
Artralgia
Artrite cronica
Anestesia/parestesia
Convulsioni afebbrili
Convulsioni febbrili
Encefalopatia
Febbre ≥39,5 °C
Ipersensibilità immediata
Altre manifestazioni di ipersensibilità
Sanità pubblica o pediatra di famiglia) il compito di
redigere l’apposita scheda informativa, con le informazioni riguardanti gli eventuali effetti collaterali attribuibili alle vaccinazioni.
L’art. 7 affida alle Regioni la raccolta dei dati sulle
eventuali complicanze da vaccino, sull’attuazione di
progetti d’informazione della popolazione e sui vantaggi e i rischi della vaccinazione.
In effetti tale compito richiede la conoscenza da parte del medico vaccinatore dei diversi effetti collaterali,
che possono comparire in seguito alle varie vaccinazioni, e delle diverse incidenze e gravità che ciascuno di
essi può presentare.
La notifica quindi di un evento avverso alle vaccinazioni rappresenta un dovere per i medici del Servizio
sanitario, sia che facciano parte dei Servizi per le vaccinazioni, sia che si tratti di medici di libera scelta.
Una vasta esperienza della Regione Veneto, durata
oltre 15 anni, mediante l’istituzione di un Canale Verde, è stata ricca di risultati nella prevenzione e nel mo-
Ipotonia-iporesponsività
Meningite/encefalite
Neurite brachiale
Pianto persistente
Paralisi flaccida acuta
Porpora trombocitopenica
Shock anafilattico
Sindrome di Guillain-Barré
Vomito e/o diarrea gravi
Altro
nitoraggio degli eventi avversi dopo vaccinazione (Zanoni G et al, 2003; Zanoni G et al, 2009a): l’esperienza potrebbe essere utilmente ripresa in altre regioni.
La conoscenza degli effetti collaterali dopo vaccinazione permette di conoscere alcuni elementi essenziali
per la prosecuzione della vaccinazione:
• le caratteristiche dei vaccini somministrati
• l’analisi degli aspetti operativi del programma vaccinale
• la frequenza dell’evento riscontrato, se cioè esso sia
isolato o faccia parte di un cluster
• la possibilità che eventi simili si ritrovino nella popolazione non vaccinata.
Nonostante questi proponimenti si rileva come il numero delle segnalazioni sia relavitamente basso, per cui
viene sospettata una notevole sottostima della frequenza reale degli eventi avversi.
Dall’esame delle segnalazioni è possibile stabilire
alcuni elementi fondamentali, come il rilievo dello stes-
Il sistema VAERS per la rilevazione degli eventi avversi
Mentre il sistema italiano di rilevazione degli eventi avversi è affidato in pratica agli addetti ai lavori, in USA le notifiche degli eventi avversi sono lasciate alla libera iniziativa della popolazione; il Department of Health and Human Service (DHHS) ha stabilito nel 1988 che sia
il Vaccine Adverse Event Reporting System (VAERS) a predisporre uno specifico sistema per la raccolta e l’analisi delle notifiche di tutti gli
eventi avversi, associati con la somministrazione di tutti i vaccini, in commercio in USA, per tutti i gruppi di età (Chen RT et al, 1994; Rosenthal S e Chen R, 1995; Chen RT et al, 1997). Dall’1 novembre 1990 VAERS è divenuto pienamente operativo.
La popolazione degli USA è stata incoraggiata a comunicare tutti gli eventi avversi, clinicamente significativi, dopo la somministrazione dei
vaccini, per controllare la possibilità che l’evento avverso possa essere casualmente in associazione con la vaccinazione. Il bisogno di notificare può derivare da fattori diversi, anche solo dalla sua insorgenza temporale in connessione con la vaccinazione e dalla mancanza di
altre cause ovvie, che spieghino la sua insorgenza (Braun MM e Ellenberg SS, 1997). Fra il gennaio 1994 e il gennaio 2001 sono stati notificati in USA 60.600 casi, 49 dei quali dovuti a errori nella somministrazione dei vaccini. L’errore più frequentemente riscontrato fu la
somministrazione sbagliata di un vaccino (per esempio dT invece di DTPa) in 15/49, seguito da errori riguardanti l’intervallo fra le dosi
(10/49) o la via di somministrazione (0/49) o la extraimmunizzazione (9/49) (Varricchio F, 2002).
La modulistica attestante le reazioni avverse più comuni dopo la vaccinazione e le modalità per la notifica vengono distribuite annualmente ai medici che più spesso somministrano vaccini, i quali consegnano ai genitori del vaccinando i moduli per la notifica al VAERS degli
eventi avversi. Quando le notifiche giungono al VAERS, esse sono riviste e viene loro assegnato un codice per la computerizzazione. Sia il
Center for Diseases Control and Prevention (CDC), che il Food and Drug Administration (FDA) hanno accesso diretto ai dati del VAERS, con
un controllo mensile delle diverse notifiche. Non vi è dubbio che con questo sistema di raccolta la qualità delle informazioni cliniche possa
essere insufficiente; d’altra parte un aumento del numero degli eventi avversi, riportati per un dato vaccino, può essere dovuto a un’aumentata distribuzione e uso del vaccino piuttosto che a un vero aumento della percentuale degli eventi avversi.
Il principale limite del VAERS è la generale incapacità di determinare se un vaccino causa di sicuro l’evento avverso riportato; la maggior
parte delle notifiche infatti non contiene dati clinici e di laboratorio specifici del vaccino. Le notifiche del VAERS sono essenzialmente notifiche di casi clinici non controllati, utili per generare delle ipotesi, ma non tali da provarle. Ne deriva che altri studi sono necessari per
valutare queste ipotesi e stabilire se un determinato evento avverso possa essere causato da uno specifico vaccino e, ammesso che lo sia,
quale ne sia la frequenza (Goodman MJ e Nordin J, 2006).
Negli Stati Uniti sono presenti numerosi altri gruppi che s’interessano della sicurezza dei vaccini (Fischer MC, 2008).
BARTOLOZZI_09.indd 138
14/05/12 09:51
139
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Scheda unica di segnalazione di sospetta reazione avversa (ADR)
(da compilarsi a cura dei medici o degli altri operatori e da inviare al Responsabile di farmacovigilanza
della struttura sanitaria di appartenenza)
1. iniziali Pz.
2. data di nascita
3. sesso
4. data insorgenza reazione
6. descrizione della reazione ed eventuale diagnosi*
* se il segnalatore è un medico
5. origine etnica
codice segnalazione
7. gravitÀ della reazione
grave
� decesso
� ospedalizzazione e prolungamento
ospedaliero
� invaliditÀ grave o permanente
� ha messo in pericolo di vita
� anomalie congenite/deficit nel neonato
non grave
8. eventuali esami di laboratorio rilevanti per adr (riportare risultati e date in cui gli
accertamenti sono stati eseguiti)
10. azioni intraprese (specificare)
in caso di sospensione compilare i campi da 16 a 19
9. esito
risoluzione completa adr il __/__/__
risoluzione con postumi
miglioramento
reazione invariata o peggiorata
decesso il __/__/__
� dovuto alla reazione avversa
� il farmaco può avere contribuito
� non dovuto al farmaco
� causa sconosciuta
non disponibile
INFORMAZIONI SUL FARMACO
11. farmaco(I) sospetto(i) (nome della specialità medicinale*)
A) _________________________________________________________ 12. LOTTO ___________________ 13. dosaggio/Die _______________
14. via di somministrazione ________________________________ 15. durata dell’uso: dal _______________ al _______________
B) _________________________________________________________ 12. LOTTO ___________________ 13. dosaggio/Die _______________
14. via di somministrazione ________________________________ 15. durata dell’uso: dal _______________ al _______________
C) _________________________________________________________ 12. LOTTO ___________________ 13. dosaggio/Die _______________
14. via di somministrazione ________________________________ 15. durata dell’uso: dal _______________ al _______________
* Nel caso di vaccini specificare anche il numero di dosi e/o di richiamo e l’ora della somministrazione
16. il farmaco È stato sospeso?
A: sì / noB: sì / noC: sì / no
17. la reazione È migliorata dopo la sospensione?
A: sì / noB: sì / noC: sì / no
18. il farmaco È stato ripreso?
A: sì / noB: sì / noC: sì / no
19. sono ricomparsi i sintomi dopo la risomministrazione?
A: sì / noB: sì / noC: sì / no
20. indicazioni o altro motivo per cui il farmaco È stato usato:
A:
B:
C:
21. farmaco(i) concomitante(i), dosaggio, via di somministrazione, durata del trattamento
22. uso concomitante di altri prodotti a base di piante officinali, omeopatici, integratori alimentari, ecc. (specificare)
23. condizioni concomitanti predisponenti (se il farmaco sospetto è un vaccino riportare l’anamnesi ed eventuali vaccini somministrati nelle quattro
settimane precedenti alla somministrazione)
INFORMAZIONI SULla segnalazione
24. qualifica del segnalatore
25. dati del segnalatore
� medico di medicina generale
� pediatra di libera scelta
nome e cognome
� medico ospedaliero
� farmacista
indirizzo
� specialista
� altro
tel e fax
26. data di compilazione
27. firma del segnalatore
28. codice asl
29. firma del responsabile
di farmacovigilanza
e-mail
Figura 9.1 Scheda unica di segnalazione di sospetta reazione avversa
BARTOLOZZI_09.indd 139
14/05/12 09:51
140
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Comunicazione di effetti indesiderati dei farmaci
(da compilarsi a cura del Cittadino e da trasmettere al Responsabile di Farmacovigilanza
della struttura sanitaria d’appartenenza – ASL)
1) Quale reazione indesiderata ha osservato? _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
2)Quando? _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
3) Quanto è durata? _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
4) Quali medicinali stava
prendendo?
5) Quante6) Da quanto
volte al dì? tempo?
7) Per quale disturbo?
a)fiale _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
b)supposte _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
c) uso locale _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
d) per bocca _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
e) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
f) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
8)Il farmaco le è stato prescritto?SÌNO
9)L’aveva già preso in passato?SÌNO
10)Ha mai avuto la stessa reazione?SÌNO
11)Con quale medicinale? _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
12)Chi è il suo medico curante? (Cognome, nome, indirizzo e telefono)
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
13)Lo ha informato?SÌNO
14)Come è stata curata la reazione?
– sospeso il medicinaleSÌNO
– ridotto la doseSÌNO
– altro (specificare) _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
15)Adesso la reazione è scomparsa? (barrare la risposta desiderata)
SÌ completamenteNON del tuttoNO
Indirizzo e numero di telefono del paziente
DATA
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
FIRMA
Figura 9.2 Modello di scheda per la comunicazione di effetti indesiderati, da inoltrare da parte del cittadino
BARTOLOZZI_09.indd 140
14/05/12 09:51
141
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
so evento dallo stesso Servizio vaccinale o nella stessa
area o la possibilità che tutte o buona parte delle persone vaccinate abbiano avuto gli stessi sintomi.
In ogni parte del mondo sono sorti dei sistemi (OMS,
Europa, Regno Unito, Australia e altri Paesi) di sorveglianza passiva molto attivi, che, pur molto diversi l’uno dall’altro, prevedono tutti le revisioni sistematiche
(Price D et al, 2004; Buttery J et al, 2006; Letourneau
M et al, 2008; Zanoni G et al, 2009; Netterlid E et al,
2009).
Gli studi di coorte sono risultati i migliori per l’analisi sequenziale della sicurezza dei vaccini (McClure
DL et al, 2008).
Riscontrata l’esistenza di effetti collaterali al vaccino
è necessario stabilire se:
• il vaccino non sia stato somministrato scorrettamente
• se sia stato proprio il vaccino a indurre l’effetto collaterale
• se l’evento non sia dovuto soltanto a una coincidenza
temporale e infine
• se non sia possibile esprimere un giudizio su una relazione causale.
Nell’ipotesi che possa esistere un legame fra la vaccinazione e un evento avverso, è necessario eseguire
alcune ulteriori ricerche per confermare o rifiutare il
sospetto: la metodica caso-controllo è quella più spesso
dimostratasi utile (Smeeth L et al, 2002).
Nella tabella 9.3 sono riportate le manifestazioni da
notificare e l’intervallo di tempo massimo che può trascorrere dalla vaccinazione.
Tabella 9.3 Manifestazioni da notificare, successive alla vaccinazione
Tipo di vaccino
Manifestazione
Vaccino contro il tetano, nelle
sue diverse combinazioni:
DTPa, DTPw, DTP-Hib,
DT, Td, T
Vaccino contro la pertosse,
nelle sue diverse
combinazioni:
DTPa, DTP, DTP-Hib, P
A. Anafilassi o shock anafilattico
B. Neurite brachiale
C. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti
Vaccino contro morbilloparotite-rosolia, nelle
diverse combinazioni:
MPR, MR, M, R
Vaccino contro la rosolia,
nelle diverse combinazioni:
MPR, MR, R
Vaccino contro la varicella
Vaccino inattivato contro la
polio (IPV)
Vaccino contro l’epatite B
Vaccino contro l’Hemophilus
influenzae tipo b
Vaccino pneumococcico
coniugato 13-valente
Vaccino coniugato contro il
meningococco C
Vaccino contro i
papillomavirus
BARTOLOZZI_09.indd 141
Intervallo di tempo
dalla vaccinazione
•7 giorni
•28 giorni
•Senza limite temporale
•Vedi foglietti illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Encefalopatia (o encefalite)
•7 giorni
C. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
D. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Encefalopatia o encefalite
•15 giorni
C. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
D. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Artrite cronica
•42 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•30 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Malattia da Hib a esordio improvviso
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
A. Anafilassi o shock anafilattico
•7 giorni
B. Qualsiasi complicanza o sequela (compresa la morte) degli eventi precedenti •Senza limite temporale
C. Eventi riportati come controindicazioni a dosi ulteriori di vaccino nei foglietti •Vedi foglietti illustrativi
illustrativi
14/05/12 09:51
142
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.4 Valutazione degli effetti collaterali dopo vaccinazione: associazione temporale o associazione causale?
Cronologia della somministrazione del vaccino e inizio dell’evento
avverso
Conoscenza precedente della tossicità del vaccino
Sintomi e segni in accordo con una specifica sindrome clinica, la
cui associazione con la vaccinazione abbia una forte possibilità
biologica (per esempio l’anafilassi)
I risultati di laboratorio confermano l’associazione (per esempio,
l’isolamento del virus del vaccino contro la varicella dalle lesioni
cutanee in un paziente con esantema varicelloso, dopo
vaccinazione)
I sintomi ricompaiono alla somministrazione successiva del vaccino
Studi clinici controllati o studi epidemiologici hanno mostrato che
esiste un maggior rischio di un evento avverso fra i soggetti
vaccinati in confronto ai non vaccinati (controllo)
Nella tabella 9.4 sono riportati gli elementi utili per
differenziare le associazioni temporali dalle associazione causali, per la valutazione di un effetto collaterale.
Molto importante per la pratica quotidiana è stabilire
quali siano le reazioni avverse dopo le quali è possibile continuare la vaccinazione e quali siano invece gli
effetti collaterali gravi che controindicano la prosecuzione della profilassi (Tozzi AE, 2004).
Fra le complicazioni dopo la vaccinazione che possono richiedere modifiche allo schema vaccinale vanno
comprese:
• le manifestazioni anafilattiche
• l’encefalopatia/encefalite
• la trombocitopenia
• le convulsioni
• la febbre superiore a 40 °C
• gli episodi d’ipotonia-iporesponsività
• la meningite sierosa
• la sindrome di Guillain-Barré
• la neurite brachiale dopo vaccinazione contro il tetano
in adulti.
Definizione di caso
Il continuo progresso sulla sicurezza delle vaccinazioni
rende necessario il confronto fra i dati clinici raccolti
dal sistema di sorveglianza. Ovviamente per permettere
la confrontabilità dei dati raccolti è necessario disporre
di definizioni, ben standardizzate, per le singole evenienze. Pertanto di grande interesse pratico è l’esatta
definizione di caso, alla quale riferirsi nella notifica
dell’effetto avverso che abbiamo rilevato.
Nella tabella 9.5 viene riportato l’ultimo aggiornamento, rilasciato dal Ministero della Salute, che comprende molte situazioni, che non erano presenti negli
elenchi precedenti.
Nella figura 9.3 viene riportato in modo schematico
il flusso della farmacovigilanza, secondo il Decreto
Ministeriale 12 dicembre 2003. Il numero delle segnalazioni avverse in Italia dagli anni 2003 al 2006 (intorno alle 6000 per anno) è riportato nella figura 9.4,
mentre la gravità delle reazioni avverse notificate è
nella tabella 9.6. Esiste inoltre uno studio Hera per la
sorveglianza postmarketing delle vaccinazioni nel primi
2 anni di vita, riguardante gli anni 1999-2004 (Rapporto Istisan 2007/34).
Nuovo flusso di segnalazione per farmacovigilanza
D. Lvo 95/2003; D.M. 12 dicembre 2003
Medici e altri operatori sanitari operanti sul territorio, nelle ASL,
in Aziende Ospedaliere, in IRCCS, in presidi ospedalieri e cliniche private,
in aziende farmaceutiche
Scheda
di segnalazione
di ADR
Tempestivamente
Responsabile
di farmacovigilanza
della struttura
Feedback al
segnalatore
Inserimento dati
e codifica dati entro 7 gg
Azienda
farmaceutica
Banca Dati Nazionale
con simultanea visibilità dei dati*
http://www.ministerosalute.it/medicinali/farmacovigilanza/farmacovig:jps
Ministero
della Salute
* Per utenti abilitati
BARTOLOZZI_09.indd 142
Regione
EMEA
Figura 9.3 Rappresentazione
schematica del flusso per la Farmacovigilanza (D. Lvo 95/2003;
DM 12 dicembre 2003)
14/05/12 10:46
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
143
Tabella 9.5 Definizione di caso
Anestesia/parestesia
Vanno segnalate le condizioni che perdurino per più di 24 ore
Artrite cronica
Può essere presa in considerazione in un soggetto senza storia di artropatia nei 3 anni precedenti la vaccinazione
sulla base di: comparsa di artrite acuta (gonfiore articolare) che sia insorta tra i 7 e i 42 giorni seguenti la
vaccinazione antirosolia; persistenza di segni obiettivi di artrite intermittente o continua per più di 6 mesi dopo la
vaccinazione; risposta anticorpale al virus della rosolia. L’artralgia o rigidità articolare senza gonfiore non è
considerata artrite cronica
Convulsioni
Attacchi di spasmi tonico-clonici, o di altri attacchi epilettici dell’infanzia (per esempio spasmi infantili, tic di salaam)
con durata variabile da alcuni minuti a più di 15 minuti, in assenza di lesioni neurologiche preesistenti.
A seconda della temperatura corporea, le convulsioni vanno distinte in febbrili o afebbrili
Encefalite
Quadro clinico a inizio acuto, con insorgenza entro 1-4 settimane dalla somministrazione del vaccino, caratterizzato
da convulsioni, alterazione dello stato di coscienza, cambiamenti evidenti del comportamento per almeno 2
giorni, che non si risolvano entro 24 ore, accompagnati da segni di infiammazione cerebrale, con evidenti
alterazioni del liquor, in assenza di cause dimostrabili
Encefalopatia
Quadro clinico a inizio acuto, con insorgenza entro 72 ore dalla somministrazione del vaccino, caratterizzato da 2 o
più dei seguenti sintomi: convulsioni, alterazioni dello stato di coscienza e/o cambiamenti evidenti del
comportamento per almeno 2 giorni, segni neurologici focali, che non si risolvano entro 24 ore
Ipotonia/
iporesponsività
Nei bambini di età inferiore ai 24 mesi, episodi che si manifestano con diminuzione o perdita acuta del tono
muscolare, perdurante per almeno 10 minuti, accompagnata da cianosi o da pallore, o da mancata risposta agli
stimoli ambientali, o da torpore prolungato, o da arresto respiratorio, in un periodo di tempo compreso tra 0 e
24 ore dalla vaccinazione. Da non confondere con la lipotimia o con stato post-convulsivo
Manifestazioni
di ipersensibilità
immediata
Orticaria, rinite, asma, broncospasmo, edema della glottide, angioedema, che si manifestino entro pochi minuti
dalla somministrazione del vaccino, in assenza di stato di shock
Meningite/encefalite
Quadro clinico di meningite, con insorgenza entro 15 giorni dalla somministrazione del vaccino; la sintomatologia
può essere sfumata e subdola, oppure molto simile a quella dell’encefalite: quadro clinico a inizio acuto, con
insorgenza entro 1-4 settimane dalla somministrazione del vaccino, caratterizzato da convulsioni, alterazione dello
stato di coscienza, cambiamenti evidenti del comportamento per almeno 2 giorni, che non si risolvano entro 24
ore, accompagnati da segni di infiammazione cerebrale, con evidenti alterazioni del liquor, in assenza di cause
dimostrabili
Neurite brachiale
Quadro clinico, con insorgenza entro 2-28 giorni dalla somministrazione di un vaccino costituito di anatossina
tetanica, caratterizzato da disfunzione limitata all’estremità superiore del plesso brachiale (tronco, dermatomeri)
senza coinvolgimento di altre strutture del sistema nervoso periferico (radice nervosa o singolo nervo periferico) o
centrale (midollo spinale). Un dolore profondo, continuo, spesso severo alla spalla e alla radice del braccio
annuncia di solito questa condizione. Il dolore è seguito, a distanza di giorni o di settimane, da debolezza e
atrofia dei gruppi muscolari dell’estremità prossimale. La perdita di sensibilità può accompagnare il deficit
motorio, mentre la debolezza è un dato necessario perché sia fatta la diagnosi. La neurite può essere presente sia
dallo stesso lato sia dal lato opposto rispetto al punto in cui è stata eseguita l’iniezione; talvolta è bilaterale,
colpendo entrambe le radici degli arti superiori
Paralisi flaccida acuta
Paralisi flaccida a inizio improvviso che si manifesti in un periodo di tempo compreso fra 4 e 30 giorni dalla
somministrazione di OPV nel soggetto vaccinato e tra 4 e 75 giorni dopo contatto, persistente anche dopo 60
giorni dal suo manifestarsi
Pianto persistente
Pianto inconsolabile, che si prolunghi ininterrottamente per un periodo superiore alle 3 ore, durante le quali il
bambino non si alimenta e non dorme, oppure pianto o grido di alta e inconsueta tonalità
Porpora
trombocitopenica
Quadro clinico con insorgenza entro 2 mesi dalla somministrazione di vaccini contenenti il virus morbilloso,
caratterizzato da una conta piastrinica sierica inferiore a 50.000/mL. La porpora trombocitopenica non include casi
di trombocitopenie associate ad altre cause, come ipersplenismo, disordini autoimmunitari (compresi alloanticorpi
da pregresse trasfusioni), mielodisplasie, malattie linfoproliferative, trombocitopenia congenita o sindrome
emolitico-uremica; non include casi di porpora trombocitopenica immune mediati, per esempio, da infezioni virali
o fungine, da tossine o da farmaci, né casi di trombocitopenia associati a coagulazione intravascolare disseminata
come si osservano nelle infezioni batteriche o virali
Reazione locale estesa Area di arrossamento, indurimento, tumefazione con diametro superiore a 5 cm, estesa fino alla radice dell’arto
Shock anafilattico
Reazione allergica con stato di shock (insufficienza circolatoria, ipotensione arteriosa, polsi periferici deboli o
assenti, alterazione del livello di coscienza, sudorazione) con o senza broncospasmo e/o laringospasmo o edema
della glottide, che si manifesti immediatamente dopo l’inoculazione del vaccino
Sindrome di GuillainBarré/poliradicolonevrite
Paralisi flaccida a inizio acuto, simmetrica, ascendente, rapidamente progressiva, con perdita di sensibilità periferica
in assenza di iperpiressia. L’esame del liquor evidenzia una dissociazione albumino-citologica.
L’associazione al vaccino è ritenuta probabile in caso di sindrome di Guillain-Barré insorta entro 60 giorni dalla
somministrazione del vaccino
BARTOLOZZI_09.indd 143
14/05/12 09:51
144
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
negli esseri umani. Il gruppo di lavoro consiste di numerosi partecipanti appartenenti ai Paesi sviluppati e in
via di sviluppo, che inizialmente raccoglie le informazioni disponibili nella letteratura sui principali effetti
collaterali dei vaccini e, dopo un’accurata valutazione,
giunge alla definizione di caso clinico, emanando delle
linee guida per la raccolta e l’elaborazione dei dati
(Bonhoeffer J et al, 2002; Bonhoeffer J et al, 2004;
Kohl KS et al, 2008; Bonhoeffer J et al, 2009a).
7000
6000
5000
4000
totali
farmaci
vaccini
3000
2000
1000
0
2003
2004
2005
2006
* dati aggiornati al 29 gennaio 2007
Figura 9.4 Numero di segnalazioni di reazioni avverse per
anno (modificata da AIFA, 2007)
A cura dell’Istituto Superiore di Sanità è stata pubblicata nel 2009 una Guida alle Controindicazioni alle vaccinazioni (Rapporto Istisan 2009/13), redatta dai migliori
cultori della materia del nostro Paese: le più importanti
situazioni patologiche sono prese singolarmente in esame
e vengono considerate nei confronti della vaccinazione.
In campo internazionale la Brighton Collaboration,
un istituto indipendente volontario, è sorta per facilitare lo sviluppo, la valutazione e la divulgazione delle
informazioni di alta qualità, riguardanti i vaccini usati
Effetti collaterali lievi
Da un punto di vista semantico, come reazioni indichiamo effetti collaterali frequenti e lievi, della durata di pochissimi giorni, a esito favorevole, mentre come complicazioni sono indicate manifestazioni tali da assumere una
propria coloritura clinica, a carico del sistema nervoso
centrale per esempio. Esse possono avere sequele o eccezionalmente avere esito fatale. Nelle fasi preparatorie
all’introduzione in commercio del vaccino, il vaccino
viene usato in un numero relativamente basso di soggetti (qualche centinaio); perciò in questa fase (Fase II) vengono soprattutto riscontrati gli effetti collaterali lievi e
frequenti. Come vedremo, il rilievo delle reazioni gravi e
rare è possibile solo quando l’uso del vaccino venga esteso a tutta la popolazione (milioni di soggetti - Fase IV).
Tabella 9.6 Gravità delle reazioni avverse ai vaccini in Italia nell’anno 2006 (AIFA, 2007)
Codice ATC
Classe terapeutica
Gravi
Non gravi
Non indicato
1
4
0
Vaccini batterici
J07AE
Vaccini colerici
J07AG
Vaccini Hemophilus influenzae di tipo b
0
1
0
J07AH
Vaccini meningococcici
8
49
7
J07AJ
Vaccini pertussici
18
315
15
J07AL
Vaccini pneumococcici
24
138
12
J07AM
Vaccini tetanici
5
142
6
J07AP
Vaccini tifoidei
1
5
0
J07AX
Altri vaccini batterici
0
4
0
Vaccini virali
J07BA
Vaccini dell’encefalite
0
5
0
J07BB
Vaccini influenzali
37
102
3
J07BC
Vaccini epatitici
3
43
4
J07BD
Vaccini morbillosi
43
287
13
J07BF
Vaccini poliomielitici
2
15
2
J07BG
Vaccini rabici
0
3
0
J07BK
Vaccini varicellosi
4
39
5
J07BL
Vaccini della febbre gialla
1
16
0
47
288
19
Vaccini a componente mista (batterica e virale)
J07C
BARTOLOZZI_09.indd 144
14/05/12 09:51
145
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Le reazioni locali lievi insorgono a distanza di 12-48
ore dall’inoculazione e sono fra l’altro rappresentate da
lieve dolore, tumefazione e infiltrazione in sede d’inoculazione, e impotenza funzionale. L’evoluzione è
senz’altro favorevole, perché la sintomatologia scompare in 1-2 giorni. Poiché la loro comparsa è legata direttamente al vaccino o ad alcuni componenti la preparazione (adiuvante per esempio), esse avvengono di frequente, sono prevedibili, ma non sono prevenibili.
Gli effetti collaterali lievi generalizzati sono diversi da
un vaccino all’altro e sono fra loro associati nei modi più
vari. Febbre non superiore a 39 °C, cefalea, anoressia,
vomito, diarrea o stipsi fanno parte delle reazioni generali; anche la comparsa di un esantema dopo la vaccinazione contro il morbillo e di una tumefazione della linfoghiandola regionale vanno comprese fra le manifestazioni
lievi, che possono comparire a breve distanza (qualche
ora) dalla vaccinazione, o dopo 7-10 giorni (figura 9.5).
La percentuale d’insorgenza degli effetti collaterali
lievi aumenta in rapporto al numero delle dosi somministrate, mentre il numero degli effetti collaterali di
media o di estrema entità diviene con il numero delle
dosi progressivamente meno frequente (tabella 9.7).
Febbre
La febbre è l’effetto collaterale spiacevole più frequente
dopo una vaccinazione: essa è presente praticamente, in
modo maggiore o minore, per qualsiasi tipo di vaccino.
È più frequente quando la vaccinazione venga fatta nel
lattante e nel bambino piccolo (Tapiainen T e Heininger
U, 2005). Abbiamo già visto, nel capitolo 6, l’importanza della lunghezza dell’ago: più corto è l’ago e maggiore
è la frequenza e l’intensità degli effetti collaterali locali
e della febbre; anche la presenza nel vaccino di adiuvanti in linea di massima aumenta la frequenza e l’intensità
degli effetti collaterali spiacevoli, compresa la febbre.
Effetti del vaccino
Desiderabili
Non desiderabili
• Immunogenicità
• Efficacia
Effetti collaterali lievi
• Dovuti all’azione diretta
del vaccino o dei suoi
componenti
• Sono relativamente
frequenti
• Sono spesso predicibili
Reazioni gravi
• Retromutazione
• Insufficiente
attenuazione
• Immunodeficienza
• Anafilassi
• Non sono prevedibili
• Rarissime o eccezionali
Figura 9.5 Effetti dell'uso del vaccino
La febbre viene definita come un’elevazione della
temperatura corporea, al di sopra dei limiti normali. Il
gruppo di lavoro della Brighton Collaboration Fever
afferma fin dall’inizio che la comparsa di febbre, dopo
la somministrazione di un vaccino con componenti
inattivati o vivi attenuati, può essere temporalmente
associata alla somministrazione del vaccino, ma non
necessariamente al risultato della vaccinazione.
La febbre da vaccino viene definita come l’elevazione della temperatura, corrispondente a ≥38 °C (Kohl
KS et al, 2008). Anche se nelle linee guida per la raccolta, l’analisi e la presentazione della febbre si tiene
conto dell’intervallo di tempo fra l’esecuzione della
vaccinazione e l’inizio della febbre, nella definizione
non si tiene conto dello spazio temporale (Marcy SM
et al, 2004).
Tabella 9.7 Incidenza delle più comuni reazioni avverse di lieve entità (Ipponi A e Bencivenni L, 2003)
Vaccino
Reazione locale
(dolore, gonfiore, rossore)
Febbre
Irritabilità, malessere
e sintomi aspecifici
BCG
Comune *
–
–
Epatite A
Fino al 50%
Epatite B
Bambini fino al 5%
Adulti fino al 30%
1-6%
–
Hib
5-15%
2-10%
–
Meningococco polisaccaridico
Fino al 71%
–
–
Morbillo-parotite-rosolia (MPR)
Fino al 10%
Fino al 5%
Fino al 5%
Pneumococco polisaccaridico
30-50%
–
–
Poliomielite (IPV)
Nessuno
Inferiore all’1%
Inferiore all’1%
Tetano o difterite-tetano
Fino al 10% **
Fino al 10%
Fino al 25%
Difterite-tetano-pertosse (DTP) ***
Fino al 50%
Fino al 50%
Fino al 60%
* La vaccinazione con BCG causa una reazione locale che compare 2-3 settimane dopo la vaccinazione con una papula, che si ulcera e guarisce dopo diversi mesi,
lasciando una cicatrice.
** La percentuale delle reazioni locali è superiore in occasione dell’iniezione di richiamo (fino al 50-85%).
*** Con il vaccino a cellula intera; con il vaccino acellulare le incidenze sono inferiori di molte volte.
BARTOLOZZI_09.indd 145
14/05/12 09:51
146
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Nella pratica corrente è molto diffuso l’uso del paracetamolo sia come preventivo che come trattamento diretto della febbre, ma questa pratica, tuttavia questo uso
non è confermato dalla letteratura. Secondo una recente
pubblicazione l’uso profilattico del paracetamolo ridurrebbe le risposte anticorpali agli antigeni, contenuti in
molti vaccini (Prymula R et al, 2009): la ragione di questa ridotta risposta all’antigene risiede nell’effetto antiprostaglandine dei farmaci anti-febbrili, che riduce la
produzione di citochine in seguito alla stimolazione dei
toll-like recettori. È evidente d’altra parte che questo effetto limitante la risposta anticorpale al vaccino ha evidenti conseguenze per quei vaccini per i quali la risposta
anticorpale è appena accettabile, mentre non riguarda
quei vaccini per i quali la risposta anticorpale sia molto
al di sopra del correlato di protezione, fissato dall’OMS.
La descrizione delle reazioni locali prevede una lunga serie di manifestazioni, per le quali la Brighton Collaboration ha previsto un apposito modulo di notifica
(Gidudu J et al, 2008):
• estesa tumefazione dell’arto
• ulcerazione (necrosi)
• sensazione di calore.
• ascesso
• atrofia
• cellulite
• eritema
• nodulo (ciste o granuloma)
• ematoma
• indurimento
• dolore, spesso insieme ad alterazioni funzionali dell’arto
• modificazioni della pigmentazione
• prurito
• esantema costituito da vescicole, bolle, pustole, orticaria, dermatite
Talvolta è interessato l’arto nel quale è stata eseguita la
vaccinazione (418/497, 84,1%), ma altre volte sono interessati anche altri arti (79/497, 15,9%). Nella gran parte
dei casi (279/418, 66,7%) è interessata solo la parte prossimale, più di rado l’intero arto (73/418) o l’intero arto
senza mano o piede (66/418). La tumefazione insorge
nella maggior parte dei soggetti entro 1 giorno dalla vaccinazione; l’età dei pazienti va da 0,1 a 91 anni. È frequente l’associazione con altri segni d’infiammazione;
può avvenire con tutti i tipi di vaccino (figura 9.6). Da
tener presente che si tratta di valori assoluti, che quindi
non tengono conto del numero delle dosi somministrate.
Tumefazione della sede di iniezione, che può
estendersi fino al rigonfiamento dell’intero arto
Nella maggior parte dei casi la tumefazione è limitata
alla sede dell’iniezione o nella parti a essa vicine, ma
in qualche caso può estendersi all’intero arto (Kohl KS
et al, 2007a).
In una ricerca, condotta sui dati VAERS (Woo EJ et
al, 2003) la tumefazione dell’arto viene suddivisa in tre
gruppi:
• tumefazione dell’intero arto (dall’anca al piede o dalla
spalla alla mano)
• tumefazione prossimale e distale dell’arto
• tumefazione prossimale (dall’anca al ginocchio e dalla
spalla al gomito).
N. casi
100
90
80
70
60
50
40
30
20
10
PNC
IPV
JEV
HBHEPB
YF
DTPaH
LYME
TYP
VARCEL
RAB
MMR
HEPA
DT
Hib
TTOX
DTPH
ANTH
FLU
HEPB
Td
DTP
PPV
DTPa
0
Vaccino
ANTH = vaccino contro l’antrace; DT = anatossina difterica e tetanica per bambini; DTPa = anatossina difterica
e tetanica e pertosse acellulare per bambini; DTPaH = anatossina difterica e tetanica e pertosse acellulare + Hib
per bambini; DTP = anatossina difterica e tetanica e pertosse per bambini; DTPH = anatossina difterica e tetanica e pertosse + Hib per bambini; FLU = vaccino contro l’influenza; HEPA = vaccino contro l’epatite A; HEPB =
vaccino contro l’epatite B; Hib = vaccino contro l’Haemophilus influenzae tipo b; IPV = vaccino inattivato contro
la poliomielite; JEV = vaccino contro il virus dell’encefalite giapponese; LYME = vaccino contro la malattia di
Lyme; MMR = vaccino vivo contro morbillo, parotite e rosolia; PNC = vaccino coniugato eptavalente contro lo
pneumococco; PPV = vaccino polisaccaridico 23-valente contro lo pneumococco; RAB = vaccino contro la rabbia;
Td = anatossina tetanica e difterica (per adulti); TTOX = anatossina tetanica; TYP = vaccino contro il tifo; VARCEL
= vaccino vivo contro la varicella; YF = vaccino contro la febbre gialla.
BARTOLOZZI_09.indd 146
Figura 9.6 Distribuzione di casi di tumefazione dell’arto dopo somministrazione di un vaccino monocomponente, a seconda del tipo di vaccino, secondo VAERS (modificata da
Woo EJ et al, 2003)
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
È sempre consigliabile misurare la circonferenza
dell’arto, in corrispondenza dell’ampiezza massima.
In uno studio con gli ultrasuoni, relativamente recente (Marshall HS et al, 2006), il fenomeno è stato
studiato in 12 bambini di 4-6 anni, in occasione dell’ultima dose di vaccino DTPa: è stato osservato che la
tumefazione è a carico sia del tessuto sottocutaneo, che
della massa muscolare dell’arto interessato, esteso al di
là dell’arrossamento e della tumefazione, rilevabile
all’ispezione. L’espansione del sottocutaneo e del tessuto muscolare andò dall’11% al 281%, rispetto all’altro arto. La ripetizione dell’indagine con ultrasuoni
dopo 48-96 ore ha dimostrato una risoluzione maggiore della tumefazione del muscolo, in confronto alla riduzione del tessuto sottocutaneo. Non è stata rilevata
nessuna differenza significativa nell’estensione della
tumefazione fra i bambini che avevano ricevuto DTPa
a dose piena e quelli che avevano ricevuto il vaccino
dTpa a dosi ridotte, per adolescenti e adulti.
Da tutto questo si ricava che la tumefazione è da
attribuire a edema del sottocutaneo e del muscolo: non
è stato mai notato un versamento articolare. Le caratteristiche della tumefazione sono in accordo con un
angioedema, piuttosto che con una cellulite infiammatoria, data la frequente assenza di febbre e di dolore,
insieme alla rapida scomparsa della tumefazione.
Risulta da altre ricerche che la tumefazione dell’arto
è più frequente dopo la vaccinazione con vaccino pneumococcico 23-valente, e con i vaccini DTP e DTPa
(alla terza-quarta dose). L’evoluzione del quadro clinico
è sempre favorevole, nell’arco di qualche giorno.
Nodulo in sede di iniezione
Non è rara la comparsa di un nodulo in sede d’iniezione, caratterizzato da una consistenza dura, a volte da
dolore e prurito, ma spesso anche senza essere accompagnato da alcun sintomo o segno.
Un gruppo di lavoro della Brighton Collaboration si
è interessato di questo fenomeno (Rothstein E et al,
2004; Kohl KS et al, 2007c). L’aspetto clinico ben demarcato del nodulo è sufficiente per differenziarlo dalle comuni tumefazioni acute che compaiono a breve
intervallo di tempo dall’iniezione. È infatti necessario
147
un periodo di osservazione di circa una settimana per
porre la diagnosi di nodulo in sede d’iniezione. Viene
ammesso che il nodulo possa progredire verso un
ascesso sterile. Esso comunque può persistere per mesi
dopo la vaccinazione.
Il nodulo postvaccinazione viene definito come una
tumefazione ben delimitata di tessuto, di consistenza
dura, corrispondente alla sede d’iniezione. È possibile
che vi sia una tumefazione più molle che circonda la
massa del nodulo, specialmente nel periodo iniziale del
suo sviluppo. Non deve essere presente eritema o termotatto positivo.
Ascesso in sede di iniezione
L’ascesso è una raccolta di materiale purulento, localizzata nei tessuti molli, insorta nella sede d’iniezione.
L’ascesso può essere sterile o batterico: non è ben precisata l’origine dell’ascesso sterile.
Gli ascessi sono in generale poco comuni, sia quelli
batterici (stafilococchi, streptococchi e Clostridia), sia
queli sterili: essi hanno un’incidenza complessiva di 1
caso su 100.000-160.000 iniezioni (Simon PA et al,
1993).
Cellulite
La cellulite è un’infiammazione della cute: essa rappresenta un evento raro dopo l’immunizzazione. Essa può
essere dovuta a tecniche d’iniezione non sicure per
quanto riguarda la sterilità o a cattiva conservazione del
vaccino, specialmente se si tratti di una confezione
multidose. L’identificazione dell’agente infettivo permette un più preciso trattamento antibiotico (Halperin
S et al, 2007).
Cheloide
Per cheloide s’intende una cicatrice che si estende al di
là dei limiti della ferita originale. I cheloidi in generale
si sviluppano nei soggetti con la pelle scura, che presentino una certo grado di tendenza familiare. È osservato dopo la vaccinazione con BCG, dopo la vaccinazione vaiolosa e dopo la vaccinazione con epatite B, con
vaccino del morbillo e MPR, con DTP, dT, epatite A,
Reazioni locali come risposta al dolore
Il dottor Giovanni Ara (Dipartimento di Prevenzione di Biella) riporta, in una lettera a Forum di Pediatria on line (24 giugno 2009), un
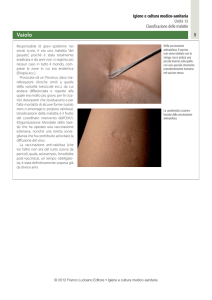
caso di grande interesse.
Poco dopo la somministrazione di Infanrix Hep B, eseguita sul lato mediale della coscia, nella sede d’inoculo comparve un’eruzione cutanea
di tipo orticarioide, simile a buccia di arancia, di colorito rosso-violaceo. Rapidamente la reazione si estende a tutta la coscia con modesto
aumento della stessa. Dopo un’ora e mezzo tutto passa, senza che venisse fatta alcuna cura.
D’accordo con la madre fu deciso di eseguire la seconda somministrazione in ospedale: dopo l’inoculo, l’arto inferiore si gonfiò in pochi
secondi, diventando edematoso e assumendo un colorito violaceo. Il piede non venne interessato dalla reazione. Senza alcuna cura, dopo
2 ore tutto passò.
La madre, per niente spaventata, acconsentì di eseguire il terzo inoculo del vaccino dopo due mesi (allora si facevano 4 dosi nel primo
anno). Il primario ebbe un’idea geniale, con il consenso della madre: usò una siringa vuota, con la quale fece l’iniezione. Poco dopo l’estrazione dell’ago, la coscia del lattante si gonfiò in modo simile a quello della prima somministrazione: tutto passò dopo 45 minuti.
Le successive inoculazioni vennero sempre eseguite in ospedale e ogni volta la reazione fu sempre minore.
BARTOLOZZI_09.indd 147
14/05/12 09:51
148
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
meningococco polisaccaridico tetravalente e febbre gialla. In qualche paziente il cheloide insorge qualunque sia
il tipo di vaccino usato (Coop CA et al, 2007).
Sindrome della gamba macchiata
Si tratta di una rara evenienza con la quale viene descritta la colorazione di una o di ambedue le gambe, in
toto o a macchie rosse, blu o viola, con o senza tumefazione (Kemmeren JM et al, 2009). Gran parte di questi casi è legata alla vaccinazione, entro 48 ore dall’immunizzazione: in circa la metà dei casi la colorazione
compare dopo la vaccinazione con DTP-IPV-Hib; frequente l’associazione con il pianto intenso. Per lo più
la sintomatologia inizia dopo la prima o la seconda
vaccinazione: essa scompare dopo 4-12 ore. La sua
incidenza diminuisce con le successive vaccinazioni.
Si tratta probabilmente di una reazione vasomotoria
con distribuzione sia omo- che contro-laterale.
Pianto persistente, inconsolabile
Il pianto dei bambini è una reazione comune alla stimolo doloroso.
Dopo la somministrazione parenterale di un vaccino
sono stati descritti molti tipi di pianto. Più spesso il
pianto inizia poco dopo l’iniezione e dura 0,5-2 minuti con la caratteristiche tipiche del pianto del bambino,
che genitori e personale di assistenza definiscono “normali”. Altre volte il pianto assume caratteristiche particolari, che lo differenziano dal pianto “normale” perché è prolungato, persistente, inusuale, a tonalità alta,
protratto, non controllabile e inconsolabile. Da qui alcune interpretazioni erronee di chi ha udito questo pianto, come la definizione di “pianto cerebrale”. La sua
durata può essere di qualche minuto, di ore o ancora
più prolungata (Bonhoeffer J et al, 2004a).
Come riportato nella tabella 9.5 per pianto persistente, inconsolabile si deve intendere un pianto che si
prolunghi ininterrottamente per un periodo superiore
alle 3 ore, entro 24 ore dalla vaccinazione, durante le
quali il bambino non si alimenta e non dorme, oppure
pianto o grido di alta e inconsueta tonalità.
Nella pubblicazione fondamentale del dottor Greco
(Greco D et al, 1996) vengono riportati 15 casi su 27.474
dosi (0,055%) dopo l’uso del vaccino DTPa contro 54
casi su 13.520 dosi di DTP intero (0,4%). Oggi il pianto prolungato non viene più considerato come una “reazione neurologica”, ma come una reazione molto intensa al dolore. Non viene ritenuto che questa manifestazione si possa ripresentare alle successive dosi di vaccino.
L’incidenza viene calcolata in un caso su 100060.000 vaccinazioni.
Episodio ipotonico-iporesponsivo (HHE)
Poiché per Hypotonic-Hyporesponsive Episode (HHE)
s’intende comunemente un gruppo eterogeneo di manifestazioni cliniche, si è resa necessaria un’esatta definizione del quadro (Braun MM et al, 1998), che, se-
BARTOLOZZI_09.indd 148
condo un workshop tenutosi in USA nel 1997, è caratterizzato dai seguenti criteri d’inclusione:
• insorgenza improvvisa di flaccidità o ipotonia, ridotta
responsività, pallore o cianosi
• età inferiore ai 10 anni
• insorgenza dell’evento entro 48 ore dalla vaccinazione
• durata dell’episodio da 1 minuto a 48 ore, con un numero più elevato fra 6 e 30 minuti.
Il quadro viene comunemente definito come stato di
shock, sindrome shock-simile, collasso, reazione collassiale e altro.
Secondo il gruppo di lavoro della Brighton Collaboration (Bonhoeffer J et al, 2004c; Vermeer-de Bondt PE et
al, 2006; Buettcher M et al, 2007) per HHE s’intende
l’inizio improvviso d’ipotonia muscolare e ridotta responsività o non responsività, associate a pallore o cianosi.
Fra i criteri di esclusione sono ricordati:
• la presenza di un’altra causa conosciuta
• la presenza di orticaria, di respiro fischiante o di anafilassi durante la manifestazione
• la comparsa di sonno
• il normale colorito della cute.
Dall’esame della letteratura a disposizione è possibile concludere che l’HHE va considerata generalmente
come una sindrome benigna, autolimitantesi, di natura
non ricorrente, in seguito alla quale, in accordo con i
genitori, è possibile proseguire la vaccinazione. Va sottolineato ai genitori che la HHE non ha alcuna influenza negativa sulla crescita e sullo sviluppo del bambino
(van der Maas NAT et al, 2009).
Se riduciamo il limite massimo di età per una HHE
ai 2 anni (invece che a 10 come in precedenza riportato) è molto probabile che l’HHE, che si manifesta nei
soggetti di età superiore, è più facilmente una sindrome
vaso-vagale piuttosto che una HHE, quando compaia
entro 5 minuti dalla vaccinazione.
Dopo la vaccinazione con il vaccino DTP intero l’incidenza di questi episodi è stata dello 0,67%, contro lo
0,007% dopo DTPa (1 caso su 27.474 dosi) (Greco D et
al, 1996). È stato sufficiente passare dalla somministrazione del vaccino DTP intero al vaccino DTP acellulare per
ridurre di molte volte i ricoveri in ospedale per convulsioni febbrili, dopo la vaccinazione (Le Saux N et al, 2003).
In uno studio (Heijbel H et al, 1997) furono seguiti nel
tempo 101 bambini che avevano sviluppato HHE: tutti
alla distanza di 18 mesi dall’evento mostrarono uno sviluppo neurologico normale. Ad analoghe conclusioni
giunse uno studio olandese (Vermeer-de Bondt PE et al,
1998), che riportò una bassa incidenza di episodi simili in
occasione della ripetizione delle dosi di vaccino intero
contro la pertosse: venne quindi concluso da questi autori
che non era necessario sospendere la somministrazione di
ulteriori dosi e che non era necessario prendere particolari precauzioni, in occasione delle successive vaccinazioni.
In uno studio su 66 bambini che avevano sofferto di
HHE, la maggior parte di essi (59 bambini) venne sot-
14/05/12 09:51
149
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
toposta a un’ulteriore vaccinazione con il vaccino DTPa
e nessuno di essi presentò un nuovo episodio di HHE
(Goodwin H et al, 1999).
In una pubblicazione (DuVernoy TS et al, 2000) furono esaminati i casi di HHE notificati in USA attraverso VAERS: 215 pazienti, tutti a evoluzione benigna.
L’età media fu di 4 mesi, con un intervallo medio dalla vaccinazione di 210 minuti. I casi si ridussero di
numero con il passaggio dal vaccino DTP al vaccino
DTPa; è risultato che l’HHE si può presentare anche in
occasione di altre vaccinazioni con preparati non contenenti il vaccino contro la pertosse. In molti casi i
genitori si erano rifiutati di continuare qualsiasi tipo di
vaccinazione, altre volte avevano accettato di lasciar
vaccinare il proprio figlio solo con alcuni vaccini, diversi da quello che aveva scatenato l’HHE. Fuorché in
un caso, non furono riportate manifestazioni simili in
seguito alle successive vaccinazioni.
Sincope
A volte la reazione generale che consegue al vaccino
non è strettamente legata al vaccino stesso, quanto alle
conseguenze psicologiche della sua somministrazione.
La più diffusa fra queste è la sincope, cioè una reazione vaso-vagale (o vaso-depressiva), conseguenza
diretta della paura o dello stress emotivo, e seguita da
un’improvvisa ipotensione, quasi sempre con perdita di
conoscenza e stato di abbandono a terra. Negli USA,
nel corso degli anni dal 1990 al 1995, ne sono stati
riportati 697 casi, dopo vaccinazione, soprattutto in
soggetti in età al di sotto dei 20 anni (massima incidenza fra i 10 e i 19 anni, in piena età adolescenziale) e
nei soggetti di sesso femminile. La maggior parte delle
sincopi insorse a breve distanza dalla vaccinazione (figure 9.7 e 9.8).
Nella tabella 9.8 sono riportati i casi di sincope negli
Stati Uniti dal 2002 al 2004 e dal 2005 al 2007: anche
in questi anni la sincope è risultata più frequente nell’adolescente, soprattutto di sesso femminile. Bisogna ricordare a questo proposito che nel triennio 2005-2007
sono stati introdotti in commercio tre nuovi vaccini,
tutti da usare in epoca adolescenziale (tetravalente meningococco coniugato, dTpa e papillomavirus).
In molti casi è possibile prevenire la comparsa della
sincope; per evitarla, negli adolescenti, i medici vaccinatori debbono procedere alla vaccinazione con il paziente sdraiato sul lettino e debbono riconoscere immediatamente i primi segni della sincope per provvedere
a mantenere il paziente in posizione supina, con le
gambe sollevate al fine di arrestarne l’evoluzione.
Esantema
L’esantema è il terzo evento avverso più frequente,
dopo la febbre e le reazioni in corrispondenza della
iniezione.
Esso è caratterizzato da modificazioni della cute e
delle mucose, con numerosa diversa morfologia: dalle
BARTOLOZZI_09.indd 149
macule, alle papule, alle vescicole, alle bolle, fino alle
pustole (Beigel J et al, 2007).
In casi relativamente rari è possibile la comparsa,
dopo vaccinazione con agenti vivi attenuati ma anche
dopo la somministrazione di altri vaccini (DTPa, Hib e
altri), di manifestazioni cliniche tipo sindrome di Gianotti-Crosti, legata alla presenza di immunocomplessi
e presentatasi a distanza di giorni dalla somministrazione del vaccino (Patrizi A et al, 1990; Velangi SS e
Tidman MJ, 1998; Tay YK, 2001; Ara G, 2003). È
molto probabile che la manifestazione non si ripresenterà alla successiva somministrazione.
Alopecia
Fra le reazioni lievi va ricordata anche la perdita di
capelli (alopecia) dopo la vaccinazione di routine (Wise RP et al, 1997). Sono stati raccolti, fra il 1984 e il
1995 dalle notifiche a VAERS, 60 pazienti con alopecia
in seguito a vaccinazione, inclusi 16 pazienti che presentano lo stesso fenomeno in occasione della rivaccinazione, di cui 4 valutati come definitivi e 12 come
possibili o probabili.
Dei 60 casi, 46 avevano ricevuto il vaccino contro
l’epatite B, sia come vaccino siero-derivato che come
vaccino DNA ricombinante. I soggetti di sesso femminile sono stati quelli più spesso colpiti. L’intervallo di
tempo fra la vaccinazione e la comparsa dei sintomi,
come l’estensione e la reversibilità della perdita dei
capelli variò ampiamente da un caso all’altro. È possibile concludere che può esistere un’associazione, peraltro molto rara, fra vaccinazioni e perdita dei capelli. Gli
autori propendono, come causa, l’insorgenza di un
meccanismo di tipo immunologico, indotto dal vaccino.
Dopo questa segnalazione in letteratura non sono comparse altre descrizioni simili.
Bombatura della fontanella
Il rilievo di una bombatura della fontanella anteriore
dopo la vaccinazione è un evento abbastanza raro: esso
si presenta in lattanti di pochi mesi, entro 18 ore dalla
vaccinazione e dura 3 giorni; la febbre è molto frequente (Freedman SB et al, 2005; Bartolozzi G, 2006).
Qualsiasi vaccino si è dimostrato in grado di determinarla.
L’alopecia dopo la vaccinazione contro l’epatite B
Fra i casi riportati da Wise (Wise RP et al, 1997) ve ne è uno
esemplificativo. Il giorno dopo aver ricevuto la prima dose di
vaccino contro l’epatite B, un’infermiera di 30 anni presentò una
lieve perdita di capelli, artralgia, stanchezza e debolezza che
durarono 1 settimana. Il giorno dopo la seconda dose di vaccino
contro l’epatite B, la donna presentò una nuova perdita di capelli, di tipo ricorrente, e 2 settimane dopo artralgie ricorrenti,
stanchezza e debolezza. L’alopecia durò qualche mese, finché
ricomparvero i capelli, che per una metà avevano un aspetto
sottile; successivamente comparvero capelli normali.
14/05/12 09:51
150
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
180
Femmine
Maschi
160
140
N. casi
120
100
80
60
40
20
0
<1
1-3
4-6
7-9
10-19 20-29 30-39 40-49 50-59
Età (anni)
Figura 9.7 Distribuzione dei
casi di sincope per età e sesso
(modificata da Braun MM et al,
1997)
60
400
350
323
N. casi
300
250
200
150
93
100
38
50
0
5
10
15
11
9
20
25
26
30
1
1
4
0
0
5
35
40
45
50
55
60
Figura 9.8 Tempo intercorso
fra la sincope, insorta entro
un'ora, e la vaccinazione (modificata da Braun MM et al,
1997a)
Tempo (min)
Tabella 9.8 Sincope dopo vaccinazione (CDC, 2008)
Caratteristiche
dei casi
Sesso
Femmine
Maschi
Sesso non noto
Fascia di età
5-10 anni
11-18 anni
19-49 anni
50-64 anni
≥65
Gravità dell’evento
Grave
Non grave
BARTOLOZZI_09.indd 150
2002-2004
2005-2007
N. casi
%
N. casi
%
124
79
0
61,1
38,9
0
359
96
8
77,5
20,7
1,8
24
96
(F = 49; M = 47)
59
13
11
11,8
47,3
6,9
62
29,1
6,4
5,4
32
287
(F = 229; M = 58)
114
12
18
24,6
2,6
3,9
20
183
9,9
90,1
33
430
7,1
92,9
14/05/12 09:51
151
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Stanchezza
È bene in primo luogo differenziare la “stanchezza acuta” transitoria che può seguire qualsiasi vaccinazione
dalla sindrome della stanchezza cronica che talvolta
può far seguito a un’infezione. La differenziazione si
basa soprattutto sulla sua durata: mentre per la “stanchezza acuta” la durata va da meno di 1 settimana a un
massimo di 1 mese, nella sindrome da stanchezza cronica la durata va da 6 mesi in poi (Jones JF et al, 2007).
Viene definita “stanchezza” la percezione della mancanza di energia o come una sensazione di mancanza di forza che colpisce l’attività mentale e fisica, che si differenzia dalla sonnolenza o dalla mancanza di motivazione.
Psicosi collettiva
Molto interessante l’episodio riportato a questo proposito da D’Argenio (D’Argenio P et al, 1996).
Il 28 e il 29 settembre 1995, gli studenti di seconda e
terza media di un piccolo paese dell’Italia del Sud, furono vaccinati con il vaccino ricombinante contro l’epatite B. Nei successivi 2 giorni, 7 dei 24 ragazzi vaccinati presentarono reazioni collegabili alla vaccinazione. I
sintomi più frequentemente osservati furono: capogiri,
mal di testa, senso di debolezza e parestesie, insorte
circa mezz’ora dopo la vaccinazione, quando i ragazzi
tornarono nelle loro classi. Due ragazzi ebbero anche
ipotonicità e iporiflessia: di 5 ragazzi visitati al pronto
soccorso, 4 vennero ricoverati in ospedale per accertamenti. Da un’attenta disamina è risultato che il quadro
non poteva essere attribuito al vaccino, ma piuttosto alla
paura della vaccinazione. Viene concluso che “quando
venga eseguita la vaccinazione in un gruppo di ragazzi,
il gruppo può andare incontro a reazioni emotive collettive”, per cui si rende necessario discriminare sempre
attentamente le reazioni spiacevoli ai vaccini dalle reazioni emotive alla vaccinazione. Un fenomeno del genere è stato rilevato anche in Australia, in una scuola, durante la vaccinazione con HPV (Buttery J, 2007).
Sofferenza dei muscoli e delle articolazioni
Nel 2002 è stato descritto da autori francesi (Cherin O
e Gherardi RK, 2000) un quadro particolare, legato alla
somministrazione di un vaccino, adiuvato con alluminio,
conosciuto sotto il nome di miofascite macrofagica,
caratterizzata da granulomi postvaccinali, contenenti alluminio e da artromialgie, accompagnate da astenia cronica. Negli ultimi anni questa sindrome non è stata più
descritta, per cui, anche in base all’indeterminatezza del
quadro clinico, il Vaccine Safety Advisory Committee
dell’OMS ha ritenuto che non vi siano basi per raccomandare un cambiamento nell’uso corrente dell’alluminio come adiuvante. Questo punto di vista è stato riconosciuto da altri esperti (François G et al, 2005).
Nel 2007 sono stato riportati problemi all’articolazione scapolo-omerale, insorti in due anziani dopo la somministrazione nel deltoide rispettivamente del vaccino
antinfluenzale e del vaccino pneumococcico 23-valente
BARTOLOZZI_09.indd 151
(Bodor M e Moltalvo E, 2007). I sintomi, caratterizzati da dolore e impotenza funzionale erano scomparsi
dopo la somministrazione locale di corticosteroidi. Viene sospettata la comparsa di una borsite sottoacromiale con successiva tendinite del bicipite.
Gli autori suggeriscono di evitare di eseguire l’iniezione nel terzo superiore del muscolo deltoide, per evitare l’introduzione del vaccino nella borsa sottoacromiale, presente in questa sede.
Reazioni gravi
Per chiarire le varie situazioni, che si incontrano nello
studiare il rapporto fra il vaccino e le reazioni gravi,
sono stati adottati criteri che vanno da una totale assenza di collegamento a reazioni gravi nelle quali il rapporto è sicuramente stabilito:
• non ci sono prove per stabilire una relazione causale
• ci sono prove insufficienti per accettare o per escludere una relazione causale
• ci sono prove per escludere una relazione causale
• ci sono prove per accettare una relazione causale
• ci sono prove per stabilire di sicuro una relazione causale.
Per alcuni vaccini sono stati presi in esame i più conosciuti eventi evversi (tabella 9.9) (Stratton KR et al, 1994).
In altre parole la correlazione di una reazione indesiderata al vaccino può essere:
• impossibile
• improbabile
• possibile
• probabile
• convincente.
Nella tabella 9.10 viene riportata l’incidenza delle
reazioni gravi dopo la somministrazione dei diversi
vaccini. Anch’esse possono essere locali o generali.
Le reazioni gravi sono rare o eccezionali e purtroppo
non sono prevedibili (e quindi non sono nemmeno prevenibili), perché, almeno quelle generali, sono legate quasi sempre a situazioni specifiche del soggetto vaccinato.
Le reazioni locali gravi sono rappresentate dalla
contrattura muscolare, dalla lesione di un nervo, che si
trovi in vicinanza della sede dell’iniezione, dalla rottura dell’ago e dall’indesiderata introduzione del vaccino all’interno di uno spazio articolare. Per le iniezioni, praticate alla natica, può essere colpito il nervo
sciatico popliteo esterno, che conferisce al bambino
un’andatura steppante, per lesione del nervo sciaticopopliteo esterno.
Fra le reazioni generali gravi ricordiamo quelle che si
osservavano dopo la vaccinazione contro la pertosse con
vaccino intero, la comparsa di una paralisi flaccida dopo
la vaccinazione antipolio con virus vivi attenuati, in un
soggetto immunocompromesso, la neurite brachiale, la
sindrome di Guillain-Barré, la trombocitopenia e altri.
14/05/12 09:51
152
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.9 Conclusioni sulle possibili associazioni fra eventi avversi gravi e vaccinazione (Stratton KR et al, 1994)
Nesso di causalità
DT/dT
Morbillo
Parotite
OPV/IPV
HepB
Hib
Prove insufficienti
per stabilire
una relazione
causale
Nessuno
Nessuno
Neuropatia
Convulsioni
Mielite trasversa
(IPV)
Trombocitopenia
(IPV)
Anafilassi (IPV)
Nessuno
Nessuno
Prove inadeguate
per accettare o
escludere una
relazione
causale
Convulsioni
Spasmi infantili
Mal. demielinizzanti
Artrite
Eritema multiforme
Encefalopatia
PESS
Convulsioni
Sordità sensoriale
Neurite ottica
Mielite trasversa
Sindrome G-B
Trombocitopenia
DMID
Mielite traversa
Encefalopatia
Sindrome G-B
Meningite
SIDS
asettica
Sordità
sensoriale
DMID
Sterilità
Trombocitopenia
Anafilassi
Sindrome G-B
Malattie
demielinizzanti
del SNC
Artrite
SIDS
Sindrome G-B
Mielite trasversa
Trombocitopenia
Anafilassi
SIDS
Prove per
escludere una
relazione
causale
Encefalopatia
Spasmi infantili
SIDS
Nessuno
Nessuno
Nessuno
Nessuno
Malattia da Hib
Prove per
accettare una
relazione
causale
Sindrome di G-B
Neurite brachiale
Anafilassi
Nessuno
Sindrome di G-B
Nessuno
Malattia da Hib
dopo vaccino
non coniugato
Prove per
stabilire come
certa una
relazione
causale
Anafilassi
Nessuno
Trombocitopenia
Anafilassi
Morti in soggetti
immunocompromessi
VAPP
Immunocompromessi
Anafilassi
Nessuno
DT = vaccino contro la difterite e il tetano; dT = vaccino contro la difterite e il tetano tipo adulto; OPV = vaccino contro la poliomielite tipo Sabin (per via orale);
IPV = vaccino inattivato contro la polio, tipo Salk; HepB = vaccino contro l’epatite B; Hib = vaccino contro l’Haemophilus influenzae tipo b; PESS = panencefalite
subacuta demielinizzante; DMID = diabete mellito insulino-dipendente; SIDS = morte improvvisa del lattante in culla; Sindrome G-B = sindrome di Guillain-Barré; SNC
= sistema nervoso centrale; VAPP = poliomielite acuta postvaccinazione.
Febbre ≥40 °C
Anche la febbre, uguale o superiore a 40 °C, viene
considerata fra le reazioni gravi; essa è stata riscontrata molto più di frequente dopo vaccinazione con DTP
intero che dopo DTPa (2,4% contro lo 0,32%) (Greco
D et al, 1996).
Poliomielite paralitica, associata alla vaccinazione
antipolio
La comparsa di un effetto collaterale grave di questo
tipo può essere in primo luogo dovuta a una riacquisizione della virulenza, per la comparsa di fenomeni
di retromutazione in un ceppo virale vivo attenuato: è
quanto avveniva in oltre i due terzi dei casi di poliomielite paralitica dopo vaccinazione orale. Nel terzo
rimanente la poliomielite paralitica da vaccino orale è
dovuta all’incapacità, per lo più su base ereditaria, da
parte del vaccinato, di montare un’adeguata risposta
immune, cellulare e/o umorale: anche l’uso del vaccino orale in un soggetto, infettato con il virus dell’immunodeficienza umana (e quindi con una immunoincompetenza acquista), poteva avere le stesse conseguenze. Ma la reazione grave può essere anche dovuta
eccezionalmente a un’insufficiente attenuazione di
ceppi virulenti: è quanto avvenne una cinquantina di
anni fa (1955) nell’incidente Cutter (dal nome dell’a-
BARTOLOZZI_09.indd 152
zienda farmaceutica produttrice del vaccino) quando
vennero registrati 204 casi di polio in soggetti di recente vaccinati.
Per l’OPV è stato ormai accertato un legame con la
poliomielite paralitica: l’incidenza è di 1 caso ogni
650-700.000 prime dosi. In caso di poliomielite paralitica in un soggetto immunocompetente l’intervallo
massimo consentito è di 30 giorni, quando si consideri
il paziente direttamente vaccinato, mentre è di 70 giorni per i contatti. In caso di vaccinazione antipolio di un
soggetto immunodeficiente l’intervallo di tempo si allunga ai 6 mesi, mentre per una poliomielite acquisita
in comunità non esiste un intervallo massimo.
Per l’IPV non esiste nessuna prova che la vaccinazione sia collegata a reazioni anafilattiche, a mielite
trasversa o a trombocitopenia. D’altra parte non ci sono
prove sufficienti per accettare o respingere un rapporto
fra vaccinazione con IPV e sindrome di Guillain-Barré
(Rantala J et al, 1994).
Convulsioni generalizzate
Le convulsioni sono episodi d’iperattività neuronale
che si manifestano con contrazioni muscolari improvvise e involontarie. Esse si possono manifestare anche
come disturbi sensoriali, modificazioni autonomiche e
alterazioni del comportamento con interessamento o
perdita della coscienza.
14/05/12 09:51
153
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.10 Incidenza delle reazioni rare di grave entità (Ipponi A e Bencivenni L, 2003)
Vaccino
Reazione
Intervallo di tempo
Incidenza relativa
per un milione di dosi
BCG
Linfoadenite suppurativa
Osteite
Tubercolosi disseminata
2-6 mesi
1-12 mesi
1-12 mesi
100-1.000
1-700
2
Epatite A
Non riportata
–
–
Epatite B
Anafilassi
Sindrome di Guillain-Barré
ora
1-6 settimane
1-2
5
Febbre gialla
Encefalite
Reazione allergica/anafilassi
7-21 giorni
0-1 ora
500-4000 nei bambini <6 mesi
5-20
Hib
Non riportata
–
–
Meningococco
polisaccaridico
Anafilassi
–
1
Morbillo (MPR) *
Convulsioni febbrili
Trombocitopenia
Shock anafilattico
Encefalite
5-12 giorni
15-35 giorni
0-1 ora
–
333
33
1-50
1
5-12 giorni
0-500
–
Molto rara
Parotite
In rapporto al ceppo (Urabe AM/9)
Pneumococco
polisaccaridico
Anafilassi
Poliomielite OPV
IPV
Polio paralitica (VAPP)
Non riportata
4-30 giorni
-
1,4-3,4 **
–
Rosolia
Artralgia
Artrite cronica, artropatia
5-12 giorni
Mesi
Frequente in donne adulte
Molto rara
Tetano
Neurite brachiale
Anafilassi
2-28 giorni
0-1 ora
5-10 in adulti
1-6
Tetano-difterite
DTP
Uguale a tetano monocomponente
Convulsioni
Shock anafilattico
Encefalopatia
0-3 giorni
0-1 ora
0-3 giorni
570***
20
0-1
* Le reazioni (eccetto l’anafilassi) non compaiono se il soggetto è già stato immunizzato e ha risposto all’immunizzazione (95%). È difficile che i bambini di 5-6
anni abbiano un attacco di convulsioni febbrili.
** Il rischio di VAPP è più alto dopo la prima dose.
*** Le convulsioni sono sempre di origine febbrile.
Per quanto riguarda il rapporto con la vaccinazione è
estremamente importante stabilire se la convulsione è
stata veramente presente oppure no e se la febbre è
insorta prima, anche poco prima, dell’inizio della convulsione. L’accertamento del tipo di convulsione è di
secondaria importanza ai fini della definizione della
sicurezza del vaccino, per cui, per la definizione di
caso, non ha alcuna importanza il reperto dell’EEG.
Le convulsioni febbrili sono un particolare sottogruppo delle crisi convulsive generalizzate. Le convulsioni
iniziano dopo poco tempo dalla vaccinazione e sono
determinate dalla febbre e non dal vaccino. La loro
prognosi è identica a quella delle altre convulsioni febbrili, cioè si tratta di una prognosi benigna. Si tratta per
lo più di convulsioni febbrili semplici, caratterizzate da
crisi tonico cloniche della durata non superiore ai 15
minuti, in lattanti e bambini dai 3 mesi ai 6 anni. La
temperatura corporea supera i 38 °C. Non residuano
mai sequele neurologiche.
Viene definita convulsione generalizzata dopo vaccinazione una crisi caratterizzata da improvvisa perdita
BARTOLOZZI_09.indd 153
della coscienza e da manifestazioni motorie generalizzate, toniche, cloniche, tonico-cloniche o atoniche
(Bonhoeffer J et al, 2004b).
Con il vaccino DTPa il rischio di convulsioni febbrili è notevolmente ridotto, proprio in rapporto alla più
rara incidenza della febbre; nel Progetto Pertosse italiano (Greco D et al, 1996) su oltre 27.474 dosi di DTPa
è stato riscontrato un solo caso di convulsione febbrile
(0,07%), contro 3 casi su 13.520 dosi di DTP intero
(0,22%) (Le Saux N et al, 2003).
Una crisi convulsiva di tipo febbrile è una conseguenza relativamente frequente anche dopo la vaccinazione contro il morbillo (Patja A et al, 2000). È ormai
certo che una convulsione febbrile postvaccinazione
non aumenta le probabilità di una successiva epilessia
o di altre alterazioni neurologiche. La maggior parte
delle convulsioni dopo la vaccinazione contro il morbillo è del tipo “convulsioni febbrili semplici” e non
rappresenta per i bambini un fattore di rischio. Il rischio di avere convulsioni dopo la malattia naturale è
molto più elevato di quello che si corre con la vacci-
14/05/12 10:47
154
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
nazione contro il morbillo. Poiché il periodo d’insorgenza della febbre dopo la vaccinazione va dall’8° al
12° giorno, la prevenzione delle convulsioni febbrili è
possibile iniziando l’uso di antipiretici fra il 7° e il 10°
giorno dall’inoculazione, per 5-7 giorni prima dell’insorgenza della febbre. I bambini che siano già in trattamento con anticonvulsivanti debbono continuare ad
assumerli dopo la vaccinazione contro il morbillo. I
genitori dei bambini, che abbiano avuto una storia personale di convulsioni febbrili, vanno avvisati di un
minimo aumento del rischio di convulsioni dopo la
vaccinazione.
Sindrome di Guillain-Barré
Prove sufficienti per accettare un rapporto con le vaccinazioni sono state raccolte per la sindrome di Guillain-Barré, soprattutto in seguito alla vaccinazione
contro l’influenza e alla somministrazione di anatossina tetanica; l’incidenza è di 1 caso su 1.200.000 somministrazioni e il tempo massimo intercorso è di 8
settimane. La sindrome di Guillain-Barré dopo vaccinazione contro il tetano si manifesta unicamente
nell’adulto (Bakshi R e Graves MC, 1997): viene ricordato un uomo di 42 anni che ha presentato una
sindrome di Guillain-Barré in tre diverse occasioni,
dopo aver ricevuto anatossina tetanica. Nessun aumentato rischio di sindrome di Guillain-Barré è stato osservato dopo l’uso di vaccino DTP in bambini: viene
ritenuto che la malattia, ammesso che possa insorgere
nel bambino dopo la vaccinazione DTPa, deve essere
estremamente rara e di nessuna rilevanza per la salute
pubblica (Tuttle J et al, 1997). La decisione di usare
dosi ulteriori di vaccini contenenti l’anatossina tetanica in soggetti che avevano avuto una sindrome di
Guillain-Barré (entro 6 settimane da una precedente
somministrazione) si basa sui benefici della vaccinazione e sul rischio di ricaduta della sindrome. Per
esempio la vaccinazione sarebbe giustificata per bambini la cui immunizzazione primaria sia incompleta,
ma i richiami routinari non sarebbero indicati in un
adulto, che abbia già ricevuto 3 o più dosi.
Mentre è stato dimostrato che un tipo di vaccino
antinfluenzale (A/New Jersey/8/76 di derivazione suina), in uso una trentina di anni fa, aumentava di otto
volte il rischio di sindrome di Guillain-Barré nelle 5
settimane successive all’inoculazione (Schonberger LB
et al, 1979), studi successivi hanno messo in evidenza
che nella stagione 1992-1994 il rischio della malattia è
stato di 1,7 volte, corrispondente a un caso in più ogni
milione di vaccinati (Lasky T et al, 1998). Tutti i casi
riguardavano soggetti adulti.
L’argomento è stato trattato in un Recommendations
and Reports dell’MMWR (CDC, 2002), che conclude:
“i benefici potenziali della vaccinazione contro l’influenza nel prevenire le complicazioni, l’ospedalizzazione e la morte oltrepassano di molte volte i possibili rischi per la SGB associata alla vaccinazione”.
BARTOLOZZI_09.indd 154
Che cosa dice la letteratura sull’incidenza della SGB
dopo un’influenza? Le ricerche riportate fino a oggi
non indicano un evidente aumento nella SGB associata
all’influenza, anche se ne sono stati descritti dei casi
(come dopo ogni altra malattia infettiva); tuttavia non
ci sono studi epidemiologici che documentino una tale
associazione (CDC, 2002). D’altra parte è stato visto
che lo sviluppo di una sindrome di Guillain-Barré in
un soggetto che ne abbia già sofferto in precedenza è
più facile di quanto non sia nella popolazione in generale.
Per tutto questo la vaccinazione contro l’influenza in
un soggetto che abbia già avuto la sindrome di Guillain-Barré, va eseguita solo un attento esame del rapporto costo-beneficio.
Esistono prove per accettare una relazione causale fra
OPV e sindrome di Guillain-Barré (CDC, 1996). Una
maggiore incidenza di casi di Guillain-Barré è stata
riscontrata anche dopo vaccinazione con il vaccino norvegese contro il meningococco B (Nøkleby H, 2007) e
contro l’epatite B (Schessl J et al, 2006; Souayah N et
al, 2007).
Non è stata dimostrata una maggiore incidenza di
sindrome di Guillain-Barré nelle 6 settimane dopo
un’estesa campagna di vaccinazione contro il morbillo
e la rosolia (da Silveira CM et al, 1997; Patja A et al,
2001; Esteghamati A et al, 2008a). Anche nel Regno
Unito non è stata riscontrata alcuna associazione fra
vaccinazioni e sindrome di Guillain-Barré (Hughes RA
et al, 2006).
Encefalite, encefalopatia, meningoencefalite,
encefalomielite (ADEM)
Fra le reazioni gravi, la comparsa di encefalite e di
encefalopatia, con una frequenza inferiore a 1 caso su
un milione di dosi somministrate di vaccino contro il
morbillo, a un’attenta disamina è risultata non legata al
vaccino, anche se temporalmente connessa.
Tuttavia in USA fra il 1970 e il 1993 ben 48 bambini da 10 a 49 mesi hanno presentato, dopo la vaccinazione contro il morbillo, da sola o in associazione alla
parotite e alla rosolia, un’encefalopatia, in seguito alla
quale otto bambini morirono, mentre nel rimanente dei
pazienti si verificarono una regressione e un ritardo
mentale, epilessia, deficit motori e sensoriali e disordini
nei movimenti. L’inizio dei segni neurologici avvenne
8-9 giorni dopo la vaccinazione (Weibel RE et al, 1998).
Da allora non sono presenti in letteratura altre segnalazioni.
Un rapporto fra vaccino intero contro la pertosse ed
encefalopatia è stato già da molti anni escluso anche
per il vaccino antipertosse intero: a questo proposito
l’Istituto di Medicina degli Stati Uniti (IOM) ha concluso che i risultati sono insufficienti per stabilire se il
vaccino DTP intero aumenti il rischio complessivo per
disfunzioni croniche del sistema nervoso nei bambini
(compresa la malattia degli spasmi infantili). L’Istituto
14/05/12 09:51
155
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
di Medicina degli USA ha concluso inoltre di recente
che non vi sono prove che indichino che il vaccino
DTP intero possa causare mielite trasversa o altri più
sottili quadri neurologici (deficit di attenzione-iperattività, autismo infantile) o situazioni degenerative progressive.
Ben conosciuto è il rapporto fra meningoencefalite
lieve e benigna e ceppo Urabe AM9 della parotite:
l’incidenza è stata di 1 caso su 11.000 dosi e l’intervallo massimo di tempo è di 15 giorni (Miller E et al,
1993).
Anche l’encefalomielite acuta disseminata (ADEM)
può insorgere dopo una vaccinazione: si tratta di una
malattia infiammatoria demielinizzante del sistema nervoso centrale, che in generale viene considerata come
una malattia monofasica (Huynh W et al, 2008): nei tre
quarti di casi la malattia insorge dopo un’infezione o
dopo una vaccinazione. Essa può insorgere dopo la
somministrazione di diversi vaccini, come rabbia, difterite, tetano, polio, vaiolo, morbillo, parotite, rosolia,
encefalite giapponese, pertosse, influenza, epatite B
(Sejvar JJ et al, 2007). La Brighton Collaboration ha
preparato la definizione e ha stabilito le linee guida
(Rath B et al, 2010).
Paralisi del faciale
La Brighton Collaboration si è interessata anche alla
definizione di paralisi del faciale (di Bell) (Rath B et
al, 2007). Una sessantina di casi di paralisi del faciale
si sono avuti in Svizzera all’inizio degli anni 2000, in
seguito alla somministrazione per via nasale di un vaccino contro l’influenza adiuvato con l’enterotossina
termolabile dell’Escherichia coli.
Altri vaccini contro l’influenza, da usare per via nasale, non sono adiuvati e non si accompagnano a paralisi del faciale.
Neurite brachiale
Analogamente, sempre nell’adulto, è stato trovato un
aumentato rischio (di 5-10 volte in confronto alla popolazione in generale) fra vaccino contro il tetano e
neurite brachiale. La neurite brachiale, che ha un’incidenza di 1 caso su 100.000-200.000 somministrazioni
di anatossina tetanica, viene considerata attribuibile al
vaccino quando compare entro 28 giorni.
Porpora trombocitopenica idiopatica
Sono poco frequenti le segnalazioni di un rapporto fra
MPR e porpora trombocitopenica idiopatica (PTI): da
1 caso su 30.000-40.000 dosi (Finlandia, Svezia, Gran
Bretagna) (Rajantie J et al, 2007) a 1 caso su 100.000
(Canada e Francia) fino a 1 caso su 1.000.000 (USA);
comunque l’incidenza è nettamente inferiore a quella
che si osserva nella malattia naturale. Sulla base dell’esperienza risulta che l’incidenza della PTI è di poco
maggiore nei soggetti che avevano già sofferto di trom-
BARTOLOZZI_09.indd 155
bocitopenia, soprattutto se questa era insorta in seguito
alla prima vaccinazione contro il morbillo. L’intervallo
massimo di tempo è di 30 giorni. Il decorso clinico è
dei più benigni (Beeler J et al, 1996; Vlaka V et al,
1997).
La Brighton Collaboration ha stabilito esattamente la
definizione di caso e le linee guida per la raccolta dei
dati fra i bambini vaccinati (Wise RP et al, 2007): per
definire una trombocitopenia è necessario che le piastrine siano inferiori a 150 3 109 L.
Invaginazione intestinale acuta
L’invaginazione intestinale è la più comune causa di
ostruzione intestinale acuta del lattante e del bambino.
I vasi del segmento intestinale che s’invagina nel segmento distale vengono inizialmente compressi per cui
si presenta congestione venosa ed edema. Con il progredire dell’ostruzione, l’apporto di sangue può essere
compromesso e portare a un’ischemia intestinale. L’invaginazione intestinale non trattata è una condizione
potenzialmente mortale.
Nel 1999 l’uso del vaccino rhesus tetravalente contro
i rotavirus venne ritirato dal commercio perché associato temporalmente allo sviluppo dell’invaginazione. Il
rischio venne calcolato in una invaginazione su 46709474 lattanti vaccinati.
La diagnosi di certezza d’invaginazione intestinale si
basa (Bines JE et al, 2004):
• sulla dimostrazione della lesione intestinale da parte
del chirurgo
• oppure sulla dimostrazione dell’invaginazione con il
clisma di aria o liquido
• oppure sulla dimostrazione mediante gli ultrasuoni di
una massa intraddominale con aspetto caratteristico,
che venga ridotta dal clisma idrostatico, come dimostrato dagli ultrasuoni post-riduzione.
Con i due nuovi vaccini contro i rotavirus, l’invaginazione intestinale ha la stessa incidenza, presente nei
soggetti non vaccinati.
Trombocitopenia e vaccinazione MPR
In uno studio retrospettivo svolto nel Regno Unito sui bambini
ricoverati per porpora trombocitopenica idiopatica (PTI) nel secondo anno di vita è stata messa in evidenza una correlazione
significativa fra MPR e PTI (Miller E et al, 2001). Dodici su 28
casi sono esorditi entro 6 settimane dalla somministrazione di
MPR: in 9 di questi la PTI poteva, secondo un calcolo statistico,
essere attribuita all’MPR. Il rischio è stato valutato in un caso su
22.300 dosi di vaccino. Tuttavia è stato calcolato che il rischio di
PTI dopo vaccinazione è di circa 10 volte inferiore a quello correlato alle singole malattie specifiche. Inoltre la PTI dopo vaccinazione risulta meno grave che in quella successiva malattia
naturale. Secondo questa ricerca i bambini che avevano già
presentato una PTI non sono a rischio di una nuova PTI dopo la
somministrazione del vaccino MPR.
14/05/12 09:51
156
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Crisi di apnea nei nati pretermine
Capita con una certa frequenza che in nati pretermine
si verifichino episodi di apnea-desaturazione entro 72
ore dalla vaccinazione, senza alterazione del tracciato
ECG e in particolare del QT; la presenza nel pretermine di fattori di rischio (molto bassa età gestazionale,
durata più lunga della ventilazione meccanica, broncodisplasia, basso peso al momento della vaccinazione)
rende maggiormente possibile la comparsa degli episodi di apnea (Sánchez PJ et al, 1997; Lee J et al,
2006; Faldella G et al, 2007; Pourcyrous M et al, 2007;
Cooper PA et al, 2008). L’odds ratio degli episodi di
apnea nel pretermine è risultato di 2,41 nei confronti
del nato a termine. Essi si manifestano qualunque sia
il vaccino usato.
Altri ricercatori non hanno dimostrato aumento
nell’incidenza di apnea centrale in lattanti normali, che
hanno presentato febbre dopo la vaccinazione (Sanchez
PJ et al, 1997; Tappin DM et al, 1997).
Un comunicato AIFA (26 luglio 2007), riguardante
questo problema, conferma tutti i punti sopra esposti.
Infarto del miocardio e ictus
Mentre l’insorgenza d’infarto del miocardio o di ictus
dopo una malattia infettiva acuta è una evenienza rara,
ma ben conosciuta, dovuta a un temporaneo aumento
del rischio di eventi vascolari, la comparsa di un fenomeno cardio-cerebro-vascolare dopo la vaccinazione è
un evento mai riscontrato, anche quando la vaccinazione era stata eseguita in una persona anziana (Smeeth L
et al, 2004).
Pancreatite necrotizzante
Si tratta di una conseguenza grave della vaccinazione
contro l’epatite A o contro epatite A + B; è molto probabile che questa diagnosi sia sottostimata (Shlomovitz
E et al, 2007).
Ascessi freddi intramuscolari
A errore umano è attribuibile quanto accaduto in Iran
nel 2000-2001: in pochi mesi vengono osservati 153
casi di ascesso freddo muscolare a carico del quadricipite in bambini di pochi mesi, a distanza di 115±64
giorni dalla vaccinazione contro l’epatite B, eseguita in
epoca neonatale (Arshi S et al, 2003). Si trattava del
17,5% di 896 bambini studiati, cioè un numero elevato;
dal laboratorio di microbiologia dell’ospedale viene
isolato il Mycobacterium bovis. Fra i dati eclatanti vi
era quello che il 97% delle iniezioni erano state fatte
alla nascita e venivano eseguite dagli stessi membri
dello staff dell’ospedale. Un’accurata successiva intervista venne fatta con il personale dell’ospedale che
confessò che aveva usato la stessa siringa per iniettare
il vaccino BCG e il vaccino contro l’epatite B ai neonati. Vale anche in questo caso la considerazione generale fatta per il caso precedentemente riportato.
BARTOLOZZI_09.indd 156
Effetti collaterali
delle singole vaccinazioni
Con la migliore conoscenza degli effetti collaterali
spiacevoli, in seguito alla somministrazione di vaccini,
è risultato che uno stesso effetto può essere causato da
vaccini diversi, piuttosto che essere caratteristico di un
singolo vaccino (Chen RT, 1999).
Gli effetti collaterali lievi e gravi verranno trattati
successivamente nei capitoli dedicati ai diversi vaccini.
Assetto HLA e reattogenicità
Capita abbastanza spesso che vengano sollevate obiezioni prima d’iniziare o successivamente all’inizio delle vaccinazioni, per la presenza di un particolare assetto HLA, che farebbe prevedere l’insorgenza di complicazioni. Per limitare i danni di queste iniziative conviene per prima cosa accertare se il laboratorio che ha
eseguito le analisi sia accreditato a livello nazionale e
internazionale; se così non fosse i rilievi presentati non
avrebbero assolutamente alcuna rilevanza, né meriterebbero di essere presi in considerazione o tantomeno
discussi: una volta accertata la veridicità del rilievo
bisogna valutare la determinazione del rischio relativo.
Una delle più strette associazioni è quella riscontrata fra HLA B27 e spondilite anchilosante, per la
quale il rischio relativo è risultato di 69,1, cioè molto
elevato, secondo soltanto all’emocromatosi idiopatica
(HLA A3, B14) e alla narcolessia (DR2). Il rischio
relativo del 69,1 significa che un soggetto HLA B27
positivo ha una frequenza di 69,1 volte superiore di
presentare una spondiloartrite anchilosante, in confronto a quella della popolazione in generale. Nella pratica,
mentre nella popolazione caucasica la prevalenza generale dell’HLA B27 positività è del 7%, essa sale
all’80-90% nei soggetti con spondilite anchilosante.
D’altra parte l’associazione è indipendente dalla gravità della forma.
Nell’elenco delle associazioni vi è un centinaio di
malattie, nella maggioranza delle quali il rischio relativo è inferiore a 10. Nonostante questi studi avanzati,
ancora il meccanismo intimo di queste associazioni non
è conosciuto. Tuttavia, il valore clinico della tipizzazione dell’HLA per la diagnosi di malattia è limitato alla
sola spondilite anchilosante, anche se un certo legame
fra assetto HLA e malattia è stato dimostrato nel diabete mellito insulino-dipendente, nella malattia celiaca
e in alcune forme di artrite cronica giovanile. Ma, come
si sa, anche nella spondiloartrite anchilosante esistono
un 10% di falsi positivi e un 10% di falsi negativi.
Per esempio, l’associazione fra vaccinazione contro
la rosolia in donne adulte e comparsa di manifestazioni articolari (artralgia o artrite acuta) è rilevata in
presenza degli alleli DR2 e DR5. Ciò nonostante la
vaccinazione contro la rosolia viene ugualmente consigliata da tutti in donne adulte, dopo un’esatta valutazione dei rapporti costi/benefici.
14/05/12 09:51
157
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Voler predire l’eventuale comparsa di effetti collaterali, in seguito a una vaccinazione, in base all’assetto
HLA, rappresenta oggi un’evidente temerarietà, soprattutto per l’estrema rarità delle complicazioni gravi, che
impedisce di raccogliere una casistica sufficiente per
avvallare o per escludere un’associazione. Le dichiarazioni di non eseguibilità delle vaccinazioni appaiono
ancora più sospette, dal momento che in tutti i casi
esaminati, indipendentemente dalla naturale variabilità
dell’assetto HLA, la conclusione è invariabilmente la
stessa: il soggetto presenterebbe un rischio evidente se
sottoposto alle vaccinazioni. La monotonia delle conclusioni non è culturalmente accettabile.
Il Ministero della Sanità in data 7 aprile 1998 ha
diffuso una circolare dal titolo: “Valutazione delle caratteristiche del complesso maggiore d’istocompatibilità ai fini dell’esecuzione delle vaccinazioni”. Dopo
l’esposizione del problema da un punto di vista teorico
sui rapporti fra HLA e effetti collaterali in seguito alle
vaccinazioni, viene riportata la seguente conclusione:
“si ritiene [...] che l’estensione di controindicazioni
alle vaccinazioni, basate su valutazioni soggettive e
non suffragate da motivazioni scientifiche internazionalmente validate, sia un grave errore da evitare”.
Consigli ai genitori
dopo la vaccinazione
Una volta che sia stata eseguita la vaccinazione risulta
utile che il pediatra o l’assistente sanitaria parlino con i
genitori per illustrare loro le reazioni che possono insorgere nel bambino, delle quali in gran parte era già stato
discusso durante l’acquisizione del consenso informato.
Capita spesso che dopo la vaccinazione i bambini siano particolarmente irrequieti, sia per il dolore sofferto, sia
per un certo grado di dolenzia che ancora avvertono, sia
infine perché possono trovarsi in una condizione prefebbrile. In questi casi è consigliabile la somministrazione
di paracetamolo, che aiuta a lenire il dolore e a limitare
il rialzo febbrile, nel caso di questo si tratti. Se lo stato
d’irrequietezza si prolunga oltre le 24 ore, è necessario
rivolgersi al pediatra di famiglia o allo stesso servizio
vaccinale. Se la gamba o il braccio appaiono arrossati,
gonfi e caldi è opportuno applicare un panno pulito e
fresco sull’area dolente e infiammata. Se ci si rende conto che il bambino avverte molto dolore, perché reagisce
vivacemente alla minima pressione, questa può essere
una ragione in più per somministrare il paracetamolo.
Nel caso in cui la determinazione della temperatura
dimostra che il bambino ha la febbre, farlo bere il più
possibile, vestirlo in modo leggero, evitando che sia
troppo coperto, e consultare il pediatra di famiglia o
chiamare il centro vaccinale.
Per le successive vaccinazioni rispettare la data, scritta
sul libretto: i ritmi delle somministrazioni sono stati stabiliti sulla base di esperienze internazionali su migliaia di
bambini: essi sono quelli che offrono le migliori opportunità per difendere il bambino dalle malattie infettive.
BARTOLOZZI_09.indd 157
Le associazioni sospettate e non
confermate: le paure dei genitori
Capita con una certa frequenza che vengano attribuiti ai
vaccini eventi che con questi non hanno nessuna relazione
di causa/effetto, ma solo uno stretto rapporto temporale.
Esistono molte situazioni nelle quali l’associazione fra
una malattia e la vaccinazione con uno o un altro vaccino viene sospettata, ma non provata, per cui l’associazione può ritenersi assolutamente casuale (tabella 9.11).
Morte inspiegata dopo vaccinazione
Un esempio è quanto è avvenuto in Egitto nel dicembre
1999, in cui avvenne una concentrazione di casi mortali per grave acidosi metabolica, comparsa dopo la
vaccinazione con preparati diversi in bambini di un
villaggio rurale (Darwish A et al, 2002). Per timori
relativi alla possibilità di ulteriori decessi e per evitare
conseguenze deleterie sull’intero programma vaccinale
nazionale è stata immediatamente condotta un’indagine
da parte di esperti nazionali e internazionali (OMS). È
risultato che la causa dei decessi e di altri sintomi comparsi dopo la vaccinazione era da attribuire all’applicazione locale eccessiva di metanolo. Questo alcol viene
impiegato come antinfiammatorio e antipiretico, per cui
era stato usato per la prevenzione di eventuali eventi
avversi alle vaccinazioni in elevate quantità. I medici e
gli infermieri locali non erano consapevoli della tossicità del metanolo e non hanno preso quindi in nessuna
considerazione questa causa nella diagnosi differenziale e pertanto non hanno potuto offrire una terapia adeguata per la cura della grave sintomatologia presentata.
Tabella 9.11 Associazioni sospettate e non confermate
(Campion EW, 2002)
Vaccino
Eventi avversi non confermati
Etilmercurio
Disordini pervasivi dello sviluppo
(autismo)
Morbillo (MPR)
Autismo e difetti dello sviluppo
neurologico
Morbo di Crohn
Difterite-tetano-pertosse (DTP)
Morte improvvisa del lattante
Epilessia
Haemophilus influenzae tipo b
(Hib)
Diabete mellito
Antipolio inattivato (IPV)
Poliomielite paralitica
Infezione da simian virus 40
Epatite B
Sclerosi multipla
Carbonchio
Stanchezza
Sindrome della guerra del Golfo
Malattia di Lyme
Artrite infiammatoria cronica
Vaccinazioni multiple (vaccini
combinati)
Effetti immunologici non ben
definiti per l’interazione di
vaccini diversi
Rotavirus
Paralisi del faciale
14/05/12 09:51
158
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
La combinazione di pratiche mediche tradizionali
con interventi di medicina moderna possono avere conseguenze cliniche gravi da non sottovalutare nel momento d’introduzione di programmi vaccinali e del
loro monitoraggio.
Sono state studiate alcuni anni fa (2006) presso l’EMA (European Medical Agency) 6 morti improvvise
e inaspettate (Sudden Unexected Deaths, SUD) dopo
vaccinazione con un vaccino esavalente, avvenute in
Germania e in Austria. Si trattava di bambini nel secondo anno di vita, vaccinati con una dose di richiamo;
la morte è avvenuta entro 48 ore dalla somministrazione del vaccino; il numero dei casi osservati ha superato le dimensioni dell’atteso, sulla base dell’incidenza
della SUD. I casi non avevano le caratteristiche della
morte improvvisa in culla (SIDS), dalla quale si discostavano anche per i reperti autoptici. L’EMA è tornata
più volte sull’argomento, senza tuttavia raggiungere la
sicurezza che le sei morti fossero in qualche modo
collegate alla vaccinazione: in una prima riunione
dell’aprile 2003 ha concluso che “non ci sono sufficienti informazioni per concludere per un’associazione”; questa posizione è stata successivamente riaffermata in altre riunioni (novembre 2003 e aprile 2005),
cui ha fatto seguito la conclusione di una “mantenuta
fiducia per i due esavalenti” (Zepp F, 2005; Schmitt
H-J et al, 2006).
Autoimmunità e vaccinazioni
Una questione che si presenta spesso è il sospetto che
possa esistere una qualche connessione fra le vaccinazioni e le manifestazioni cliniche dell’autoimmunità.
Nonostante tante discussioni non esiste al momento
attuale nessuna prova a favore dell’ipotesi che un qualche vaccino possa indurre una malattia autoimmune
(sclerosi multipla, malattia di Crohn o altro). Il rischio
della vaccinazione rimane quindi al momento attuale
nell’ambito delle ipotesi filosofiche (Schattner A, 2005).
L’autoimmuinità è un fenomeno nel quale l’organismo
sviluppa una risposta immune inadeguata diretta verso le
componenti antigeniche proprie (Tozzi AE e Celentano
LP, 2004). La presenza di questo fenomeno non si accompagna necessariamente alla comparsa di manifestazioni cliniche di malattia autoimmune. È quando la risposta autoimmune determina un danno tissutale specifico che ci troviamo in presenza della malattia.
Nella eziopatogenesi delle malattie autoimmuni
un’infezione virale rappresenta più di frequente una
causa scatenante della malattia in soggetti geneticamente predisposti (HLA).
La dimostrazione di un’associazione fra vaccinazioni
e malattie autoimmuni è molto difficile da ottenere:
l’associazione temporale per esempio non è assolutamente sufficiente per confermare questa relazione. Solo studi epidemiologici opportunamente disegnati possono essere in grado di dimostrare una vera associazione causale: è necessario stabilire che l’incidenza di
BARTOLOZZI_09.indd 158
malattie autoimmunitarie sia più frequente nelle persone vaccinate rispetto a quelle non vaccinate. Purtroppo
la maggior parte degli studi su questo argomento è in
realtà basata sulla descrizione di singoli casi o di piccole serie di casi. D’altra parte va rilevata la difficoltà
di condurre studi epidemiologici controllati in una situazione in cui il tempo di latenza fra la vaccinazione
e l’insorgenza della malattia può anche essere di anni
e in popolazioni nelle quali la maggioranza degli individui è stata vaccinata (Wraith DC et al, 2003; Tozzi
AE e Celentano LP, 2004).
La maggior parte degli studi ben condotti indica che
il rischio di malattia autoimmune non viene aumentato
dalle vaccinazioni. Nei casi in cui questa associazione
venga documentata, è evidente che il rischio è molto,
molto piccolo. È importante sottolineare che questo rischio, ammesso che esista, è nettamente inferiore a quello che si associa al superamento della malattia naturale.
Sebbene sia possibile ipotizzare che pazienti predisposti possano sviluppare una malattia autoimmune in
seguito a una stimolazione “grilletto”, nella maggior
parte dei casi un’infezione e molto di rado un vaccino,
non esistono al momento strumenti diagnostici in grado
di identificare i pazienti a rischio.
Molto spesso sorge il problema di vaccinare soggetti che abbiano già una malattia di tipo autoimmunitario. La maggior parte degli studi sono a favore della
vaccinazione in pazienti con malattie autoimmuni per i
pericoli maggiori che comporta l’acquisizione della
malattia, dalla quale il vaccino può difendere e per il
maggior rischio di acquisire le malattie infettive, caratteristico di queste persone (Wraith CD et al, 2003;
Schattner A, 2005; Glük T e Müller-Ladner U, 2008;
Duchet-Niedziolka P et al, 2009). Tuttavia il buon senso invita a non vaccinare soggetti che si presentino in
una fase acuta o acutissima della malattia: in questi
casi è sempre meglio attendere per vaccinare un periodo di defervescenza, affinché non vengano attribuite ai
vaccini situazioni patologiche che sono legate strettamente alla malattia di base.
Paralisi del faciale
Non è stato dimostrato un aumento del rischio di paralisi del faciale dopo vaccinazione contro i rotavirus (Hua
W et al, 2009), vaccino eptavalente coniugato contro lo
pneumococco (Center KJ et al, 2009) o altri vaccini.
Diabete mellito tipo 1
Classen ha ipotizzato anni fa che esistesse un’associazione fra vaccinazione contro l’Haemophilus influenzae tipo
b e diabete mellito tipo 1 (Classen DC e Classen JB,
1997). Ricerche successive a opera di autori finlandesi,
in uno studio durato più di 10 anni, su oltre 100.000
bambini non hanno trovato un aumentato rischio di diabete mellito non solo dopo la vaccinazione contro l’Hib,
ma nemmeno dopo ogni altro tipo di vaccinazione (Karvonen M et al, 1999).
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
159
Ad analoghe conclusioni giunge un workshop dedicato ai rapporti fra vaccinazioni nel bambino e diabete tipo
1 (Institute for Vaccine Safety, 1999). Successivamente
negli USA in un ampio studio caso-controllo non è stato trovato un aumentato rischio di diabete tipo 1 associato con nessuno dei vaccini routinariamente (epatite B,
Hib, pertosse intero, pertosse acellulare, MPR, varicella),
raccomandati per i bambini (DeStefano F et al, 2001).
Anche un lavoro danese non trova alcuna relazione
causale fra vaccinazioni dell’infanzia e diabete mellito
tipo 1 (Hviid A et al, 2004).
tempi relativamente brevi (Pichichero ME et al, 2002),
risulta quindi poco probabile che una esposizione così
breve a quantitivi così bassi di mercurio sia sufficiente
per provocare una leucemia nel bambino.
A questo proposito il Global Advisory Committee on
Vaccine Safety considera che l’ipotesi di un legame tra
vaccino contro l’epatite B e la leucemia linfoblastica
acuta non sia convincente (Global Advisory Committee
on Vaccine Safety, 2002).
Sclerosi multipla e vaccinazione contro l’epatite B
Gli studi su questo argomento superano il centinaio e
tutti sono concordi nel negare qualsiasi rapporto fra
etilmercurio e autismo. Il più recente (Tozzi AE et al,
2009) conferma questo concetto, anche con controlli a
distanza di 10 anni dalla vaccinazione, usando prove
neuropsichiatriche molto raffinate.
Uno studio nella popolazione di Montreal negli anni
ha permesso di scartare qualsiasi associazione fra disordini pervasivi dello sviluppo (autismo) ed esposizione
ad alti livelli di etilmercurio (Fombonne E et al, 2006).
La Corte Generale degli Stati Uniti ha negato il risarcimento dei danni a tre famiglie che avevano dichiarato
che le vaccinazioni dell’infanzia avevano causato l’autismo ai propri bambini.
Circa 12 anni fa scoppiò uno scandalo in Francia per
un sospetto rapporto fra vaccinazione contro l’epatite
B e sclerosi multipla: per un breve periodo di tempo
questa vaccinazione venne addirittura temporaneamente sospesa (1 ottobre 1998) per gli adolescenti e gli
adulti non a rischio (Chen RT et al, 2001).
Successive pubblicazioni hanno definitivamente dimostrato che non esiste alcuna associazione fra la vaccinazione contro l’HBV e lo sviluppo di sclerosi multipla e nemmeno che la vaccinazione aumenta il rischio a breve termine di ricaduta nella stessa malattia
(Ascherid A et al, 2001; Confavreux C et al, 2001).
Le conclusioni di un rapporto dell’Istituto di Medicina
degli Stati Uniti d’America sull’eventuale relazione
fra vaccinazione contro l’epatite B e le malattie neurologiche escludono l’ipotesi di un qualsiasi legame
causale: il Global Advisory Committee on Vaccine
Safety ritiene che non vi sono motivi per modificare
le indicazioni che raccomandano la vaccinazione universale contro l’epatite B per i neonati e per gli adolescenti (Global Advisory Committee on Vaccine Safety, 2002).
Anche successivamente è stato escluso che l’insorgenza e l’aggravamento della sclerosi multipla e di altre
malattie demielinizzanti del sistema nervoso centrale
possano avere un qualsiasi legame con la somministrazione di vaccini, sia quello contro l’epatite B, che quelli contro l’influenza, il tetano, il morbillo e la rosolia
(DeStefano F et al, 2003). In uno studio caso-controllo
in soggetti dai 18 ai 49 anni (450 ammalati di sclerosi
multipla o neurite ottica e 950 controlli), appaiati per
sesso, età e tipo di assistenza sanitaria è stato escluso
qualsiasi collegamento fra le affezioni e la vaccinazione.
Leucemia linfoblastica acuta e vaccino contro
l’epatite B
In un lavoro presentato nell’aprile 2002 a una riunione
dell’American Association for Cancer Research veniva
riportato un legame fra la vaccinazione contro l’epatite
B e la leucemia linfoblastica acuta in 334 ragazzi del
nord della California. I ricercatori pensavano a un rapporto con il timerosal contenuto nel vaccino. Poiché,
come vedremo, il mercurio contenuto nel timerosal è
etilmercurio, esso viene allontanato dall’organismo in
BARTOLOZZI_09.indd 159
Vaccinazioni (esposizione all’etilmercurio) e autismo
Vaccino MPR e autismo
Nel 1998 venne pubblicato su “Lancet” un lavoro
scientifico del dottor Wakefield (Wakefield AJ et al,
1998) che suggeriva l’esistenza di un legame fra la
somministrazione del vaccino trivalente morbillo-parotite-rosolia, e l’insorgenza di autismo, infiammazioni
intestinali e disordini dello sviluppo.
Sin dall’inizio la comunità scientifica si rese conto
che si trattava di una pubblicazione di nessun valore,
che poggiava su dati scientifici deboli, contraddetti da
studi ben più approfonditi (Dales L et al, 2001; Halsey
NA et al, 2001; Kaye JA et al, 2001; Fombonne E et
al, 2006; Hornig M et al, 2008).
Lo stesso direttore di “Lancet”, Richard Horton, pur
permettendo la pubblicazione, si è preparato una linea
di difesa contro le inevitabili critiche, affiancando al
lavoro il duro commento di due specialisti del CDC di
Atlanta. Essi, Robert Chen e Frank DeStefano, confutavano la tesi di un rapporto di causa/effetto tra il vaccino e la sindrome, mettendo in guardia sulle conseguenze nefaste della pubblicazione. È stato subito previsto che lo studio avrebbe generato un interesse mediatico acritico, facendo crescere nei genitori un pericoloso senso di sfiducia nei confronti dei vaccini in
generale e causando in particolare una caduta del tasso
di vaccinazione contro morbillo, parotite e rosolia
(Meldolesi A, 2004).
Purtroppo così è avvenuto: la copertura vaccinale per
morbillo, parotite e rosolia a un anno dall’uscita del
lavoro è passata dal 92% all’87%, toccando il minimo
storico dell’80% alla fine del 2002.
14/05/12 09:51
160
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
La successiva pubblicazione di dati tranquillizzanti
da parte di studiosi internazionali, le rassicurazioni delle società scientifiche, le dichiarazioni del Ministero
della Salute inglese e dello stesso Blair non sono bastate a disinnescare la bomba mediatica. Perché il caso
Wakefield venisse definitivamente chiarito, c’è voluta
l’inchiesta del “Sunday Time”. Brian Deer, un giornalista di quel quotidiano, ha infatti dichiarato che il lavoro pubblicato da Wakefield su “Lancet” non era solo
debole dal punto di vista scientifico, ma era anche pieno di ombre. In primo luogo il gastroenterologo Wakefield ha praticato procedure invasive sui 12 bambini in
esame senza l’autorizzazione del Royal Free Hospital
e per di più il suo lavoro presenta imbarazzanti connessioni con la campagna legale in corso contro le industrie produttrici del vaccino. Non solo Wakefield ha
arruolato gli stessi bambini coinvolti nelle cause, ma ha
persino ricevuto dallo studio legale in questione una
parte dei fondi stanziati dal Legal Aid Board, l’ente
governativo inglese che finanzia le azioni legali, intentate da persone in condizioni economiche disagiate, e
che ha contributo con l’incredibile cifra di 15 milioni
di sterline, di cui 55.000 sono finite nelle tasche del
dottor Wakefield. L’inchiesta sarebbe dovuta uscire il
mese di febbraio, ma “Lancet” viola l’impegno preso
con Deer e annuncia con due giorni di anticipo l’intenzione di far ritirare il lavoro, perché inficiato da un
“gravissimo conflitto d’interessi” (Meldolesi A, 2004).
Il direttore di “Lancet”, Horton, avrebbe potuto dissociare la propria rivista da quello studio ben prima, e per
ragioni scientifiche oltre che etiche (Horton R, 2004):
tuttavia è questa la prima volta che viene riconosciuto
nel Regno Unito che i legami con l’industria o con altre
attività, comprese quelle legali, vanno dichiarati quando
si sottopone un lavoro scientifico all’esame di una rivista
(negli USA questa norma è seguita da molti anni). Nel
giro di una settimana 10 firmatari hanno ritirato il proprio nome dallo studio contestato, ma fra questi non
compare Wakefield (Murch SH et al, 2004). Negli stessi
giorni un tribunale britannico respinge la richiesta di un
migliaio di presunte vittime dei sospetti effetti collaterali del vaccino, che richiedevano ulteriori fondi al Legal
Aid Board per portare avanti la causa.
La lunga storia del vaccino MPR sembra giunta al
suo epilogo.
Vaccinazioni e anestesia generale
Capita con una certa frequenza che anestesisti e chirurghi pediatri esprimano parere negativo sulla vicinanza
di un intervento chirurgico elettivo con una o un’altra
vaccinazione. Tutto è partito dalle risposte a un questionario di 296 membri dell’Associazione degli Anestesisti Pediatri del Regno Unito e dell’Irlanda (Short
JA et al, 2006).
Esistono tuttavia dati sicuri in proposito che negano
qualsiasi controindicazione alla vaccinazione, sia prima
che dopo anestesia e intervento chirurgico in un bam-
BARTOLOZZI_09.indd 160
bino: sono stati analizzati tutti gli articoli pubblicati dal
1970 al 2006 (Siebert JN et al, 2006) e sono state tratte queste conclusioni:
• nei bambini da poco vaccinati non deve essere posticipata l’anestesia
• nei bambini sottoposti a intervento chirurgico non
debbono essere posticipate le sedute vaccinali; tuttavia per evitare che vengano attribuiti alla vaccinazione
eventi avversi, dovuti a complicazioni post-operatorie,
viene consigliato di aspettare 2 giorni dall’intervento
per i vaccini inattivati e 14-21 giorni per i vaccini virali vivi attenuati
• il rischio dell’anestesia generale risulta essere lo stesso tra i bambini vaccinati da poco tempo e quelli non
vaccinati.
Vaccinazioni e rischio di malattie allergiche
Il numero delle malattie atopiche nei bambini è in continuo aumento, durante gli ultimi decenni: la ragione di
questo andamento epidemiologico non è completamente conosciuta, anche se è ovvio che questo aumento
dipende da fattori ambientali e non da un incremento
della predisposizione genetica. La moderna “ipotesi
igienica” sembra la più adatta a spiegare questo costante aumento.
I vaccini non spiegano l’aumentata prevalenza delle
malattie allergiche, anche se va ammesso che alcuni
bambini possono sviluppare molto raramente una reazione allergica al vaccino; tuttavia il rischio di non
vaccinare un bambino sorpassa il rischio, relativamente
modesto, d’indurre in rari casi manifestazioni allergiche. In altre parole esistono prove molto deboli per
sospettare un’associazione fra allergia e vaccinazione e
queste sono limitate a studi retrospettivi (Holt PG et al,
2003): nessuna prova prospettica ha mai confermato
questa associazione.
In particolare per l’asma bronchiale non è stata dimostrata un’associazione con DTP, OPV e MPR. La
dimostrazione di una debole associazione con i vaccini
contro l’Hib e il virus dell’epatite B sembra essere
dovuta principalmente a errori d’informazione (DeStefano F et al, 2002).
Morte improvvisa
Nel sospetto che la somministrazione accelerata di DTP
in bambini a 2, 3 e 4 mesi di età potesse facilitare la
comparsa della morte improvvisa (SIDS) sono stati
condotti numerosi studi che ne hanno dimostrata la
mancata associazione (Walker AM et al, 1987; Mitchell
EA et al, 1995; Brotherton JML et al, 2005; Traversa
G et al, 2006); fra questi è stato condotto anche uno
studio caso-controllo (Fleming PJ et al, 2001). Sulla
base dei risultati è stato affermato che l’immunizzazione con DTP e con altri vaccini non porta a un aumento nei casi di SIDS; anzi le vaccinazioni comportano
una protezione dalla malattia più che un rischio (Vennemann MMT et al, 2007).
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
In Germania si sono verificati nel corso del 2003, tre
casi di decessi, classificati come SUD (Sudden Anexpected Deaths), ovvero morti improvvise, notando
un’associazione temporale con la somministrazione di
un vaccino esavalente; si trattava di bambini del primo
anno di vita. Non possedendo una valida banca dati, lo
studio è stato commissionato all’ISS italiano, che ha a
disposizione numerose banche dati, in seguito all’utilizzo in Italia da anni di ben due esavalenti. Per quanto riguarda la SIDS, non è stato dimostrato alcun aumento d’incidenza dopo l’uso del vaccino esavalente
(Ottaviani G et al, 2006; Vennemann MMT et al, 2007).
Malattia infiammatoria cronica
Si è molto discusso anche della possibile associazione
della vaccinazione contro il morbillo con la malattia
infiammatoria cronica (Ekbom A et al, 1996): tuttavia
nessun collegamento, né sperimentale né clinico, è risultato a favore di un’associazione fra vaccinazione
contro il morbillo e malattie infiammatorie croniche
(Davis RL et al, 2001; Seagroatt V, 2005).
Rivaccinazione di bambini
con storia di effetti collaterali
alle precedenti vaccinazioni
Viene ritenuto che, a parte l’anafilassi e l’encefalopatia,
non esistono altre vere controindicazioni a continuare
la vaccinazione con il vaccino che ha causato inizialmente l’effetto collaterale (Gold M et al, 2000).
Su 469 bambini che avevano avuto un effetto collaterale dopo una o un’altra vaccinazione, 293 avevano
avuto quadri lievi e 176 avevano presentato conseguenze neurologiche (HHE, convulsioni, esantemi, altro) o
allergiche (anafilassi, trombocitopenia, broncospasmo
senza anafilassi) significative. In accordo con i genitori 421 su 469, vennero rivaccinati e solo un bambino
presentò un quadro neurologico significativo (HHE)
che non richiese il ricovero, risultò transitorio e scomparve spontaneamente (Gold M et al, 2000).
Reazioni allergiche
secondarie all’uso di vaccini
È importante ricordare che non esistono prove epidemiologiche che attestino l’origine delle malattie allergiche dopo vaccinazione (Koppen S, 2004), anzi secondo alcuni ricercatori (Grüber C et al, 2003) i bambini
con le più alte coperture vaccinali sembrano essere
transitoriamente protetti dallo sviluppo di atopia nei
loro primi anni di vita. D’altra parte è stato dimostrato
che la vaccinazione con i vaccini DTP, MPR e BCG
non aumenta in particolare il rischio d’insorgenza di
febbre da fieno (Bremmer SA et al, 2005).
BARTOLOZZI_09.indd 161
161
Tuttavia, i vaccini possono indurre alcune manifestazioni di tipo allergico in bambini suscettibili. Fra queste manifestazioni vanno ricordati: l’ipersensibilità di tipo immediato (reazioni di tipo I secondo Gellis e Coobs), come lo
shock anafilattico e l’angioedema, l’ipersensibilità di tipo
semi-tardivo, come il fenomeno di Arthus (reazione di
tipo III), che insorge poche ore dopo l’iniezione e infine
l’ipersensibilità di tipo ritardato (reazione di tipo IV) nella sede d’iniezione. Inoltre le vaccinazioni, eseguite nelle
prime età della vita possono modulare soprattutto il sistema immune (Kalaboka S e Annesi-Maesano I, 2007).
Quando si verifichi una manifestazione collaterale
alla somministrazione di un vaccino, rimane spesso
molto difficile differenziare una reazione allergica al
vaccino, nei suoi diversi costituenti, da una reazione
allergica ad allergeni ambientali (Dibs SD et al, 1997).
Le reazioni da ipersensibilità ai costituenti del vaccino possono essere dovute a diverse cause:
• antigeni che costituiscono la parte attiva del vaccino
• componenti del terreno di coltura, sul quale è stato
coltivato l’agente infettivo
• antibiotici (streptomicina, neomicina, kanamicina)
• gelatina, aggiunta come stabilizzante
• conservanti (timerosal, oggi non più presente nei moderni vaccini)
• adiuvanti
• latice, presente sulla superficie esterna della fiala, con
la quale l’ago sia venuto inavvertitamente in contatto.
Nessun pericolo a vaccinare un bambino, che abbia
avuto manifestazioni allergiche minori all’uovo o alle
proteine del pollo, con un vaccino, il cui virus sia stato coltivato su fibroblasti di embrione di pollo, come
per esempio:
• il vaccino contro il morbillo (escluso il vaccino costituito dal ceppo Edmonston-Zagreb. coltivato su cellule diploidi umane)
• il vaccino contro la parotite
• il vaccino per via nasale contro l’influenza
• il vaccino contro la febbre gialla.
Reazioni allergiche all’uovo
e agli antigeni a esso collegati
I quadri clinici, in soggetti allergici all’uovo, vanno
dalle più lievi manifestazioni di orticaria e di dermatite
pruriginosa alle forme gravi di tipo anafilattico.
I soggetti che hanno presentato forme di allergia all’uovo, sia quelle di tipo non anafilattico sia quelle anafilattiche gravi, sono a basso rischio di presentare nuove reazioni anafilattiche, in seguito alla somministrazione di
vaccini singoli o in combinazione. La prova cutanea con
il vaccino diluito non è predittiva di una reazione allergica alla vaccinazione (Red Book, 2009). Perciò i bambini
con allergia alle uova si possono vaccinare routinariamente con i vaccini MPR, senza dover fare una prova cutanea
14/05/12 09:51
162
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
preventiva (James JM et al, 1995; James JM et al, 1998).
Dopo la vaccinazione, il periodo di attesa va comunque
allungato dai classici 15-20 minuti a 30-90 minuti dopo
l’immunizzazione, tenendo sempre a disposizione tutto
l’armamentario necessario per affrontare un’anafilassi.
La questione è stata ripresa più volte, anche di recente (Khakoo GA e Lack G, 2000; Ballotti S et al, 2005;
Berti I e Longo G, 2010) per giungere alla conclusione
che in caso di un soggetto che abbia presentato chiari
segni di anafilassi in seguito all’ingestione di uova, il
vaccino MPR può essere somministrato, ma in ambiente protetto (ospedale pediatrico con intervento
dell’anestesista rianimatore). L’ambiente protetto è
consigliabile anche per soggetti con reazioni allergiche
lievi dopo ingestione di uova, ma che soffrano di asma
cronica grave in trattamento continuo con corticosteroidi. Nessuna precauzione per manifestazioni allergiche,
non di tipo anafilattico in bambini peraltro sani.
Quanto è stato detto per il vaccino contro il morbillo
vale anche per il vaccino contro la parotite e per quello contro l’influenza per via nasale, tutti vaccini i cui
componenti derivano da virus, che richiedono, per loro
moltiplicazione, i tessuti dell’embrione di pollo.
Per il vaccino contro la febbre gialla, invece, si può
manifestare, dopo l’inoculazione, una reazione allergica
immediata, inclusa una reazione di tipo anafilattico. La
prova cutanea con il vaccino contro la febbre gialla
viene ancora raccomandata infatti in soggetti che abbiano in precedenza presentato sintomi di ipersensibilità sistemica (orticaria, ipotensione, ostruzione delle
vie aeree superiori o inferiori) dopo ingestione di uova.
Manifestazioni meno gravi o localizzate di allergia al
pollo o alle uova non rappresentano invece una controindicazione alla somministrazione del vaccino contro
la febbre gialla, per cui non richiedono nemmeno un
controllo cutaneo dell’ipersensibilità.
Per quanto riguarda la vaccinazione contro l’influenza, va ricordato che esiste una norma nella legislazione europea (EMA) che limita la quantità di proteina uovo a 1 mg per dose; pertanto, poiché la quantità di proteina uovo, al di sopra della quale si può manifestare un quadro di anafilassi, corrisponde a ≥1,2 mg
(James JM et al, 1998a), è possibile praticare la vaccinazione senza alcun timore.
Tuttavia un soggetto, che abbia presentano i segni di una
reazione anafilattica alle uova va sottoposto alle seguenti
prove, prima di ricevere il vaccino della febbre gialla:
• prova del grattamento (scratch), dell’escoriazione
(prick) e della puntura: una goccia di una diluizione
1:10 del vaccino in soluzione fisiologica, viene messa
in contatto con un piccolo graffio o un’escoriazione o
con una puntura sulla faccia volare dell’avambraccio.
Vanno praticate inoltre prove di controllo presumibilmente positive (istamina) e negative (soluzione fisiologica). La prova viene letta dopo 15-20 minuti: una prova positiva è caratterizzata da un infiltrato di diametro
superiore a 3 mm, rispetto alla prova di controllo, ese-
BARTOLOZZI_09.indd 162
guita con la stessa tecnica, ma impiegando soluzione fisiologica. La prova di controllo con istamina deve dare,
come già detto, un risultato positivo. Se il risultato di
questa prova è negativo si passa alla prova intradermica
• prova intradermica: 0,02 mL di una diluizione 1:100
del vaccino in soluzione fisiologica sono iniettati per
via intradermica, accanto a 0,02 mL di soluzione fisiologica, per controllo, e d’istamina. Anche in questo
caso la lettura viene fatta dopo 15-20 minuti, per osservare l’eventuale presenza d’infiltrazione e di eritema, e
la si confronta con il controllo. Un infiltrato di 5 mm
o più, con eritema circostante, è considerato positivo.
Poiché in casi eccezionali è stata descritta una reazione anafilattica a evoluzione fatale, anche dopo una
prova cutanea, tipo prick, tutte le prove cutanee e le
eventuali successive procedure di desensibilizzazione
debbono essere eseguite da personale specializzato, in
grado di trattare l’anafilassi (fra l’altro deve essere a
disposizione una siringa contenente 0,3 mL di una soluzione di adrenalina all’1:1000).
Se ambedue le prove risultano negative, si può somministrare il vaccino. Se il bambino, con storia di anafilassi, ha una positività delle prove cutanee (prick o intradermo), esso va vaccinato utilizzando la tecnica di desensibilizzazione, sotto stretto controllo medico. È stato suggerito un protocollo per la somministrazione sottocutanea
delle seguenti dosi, in successione di 15-20 minuti:
• 0,05 mL di una diluizione 1:10
• 0,05 mL di vaccino non diluito
• 0,1 mL di vaccino non diluito
• 0,15 mL di vaccino non diluito
• 0,2 di vaccino non diluito.
Va ricordato che la maggior parte delle reazioni da ipersensibilità immediata, dopo la vaccinazione contro il morbillo e la parotite è dovuta ad altri componenti del vaccino, come la gelatina e la neomicina (Red Book, 2009).
Reazioni allergiche al mercurio
(timerosal)
Nella gran parte dei casi le rare manifestazioni allergiche
sono reazioni locali di tipo ritardato. Tuttavia, va sottolineato che, nonostante le prove intradermiche dimostrino ipersensibilità, quasi tutti i pazienti non hanno alcuna
reazione all’inoculazione di vaccini contenenti timerosal.
Merita ricordare che i vaccini entrati di recente in
commercio, sono privi di timerosal.
Reazioni allergiche agli
antibiotici contenuti nei vaccini
È sempre molto difficile, se non impossibile, stabilire
se vi sia stata una reazione allergica verso un antibiotico contenuto in un vaccino, anche se la manifestazione ha colpito un soggetto effettivamente allergico a
quell’antibiotico.
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Il vaccino contro la polio inattivato (IPV) contiene
minime quantità (tracce) di streptomicina, di neomicina
e di polimixina B; i vaccini vivi contro morbillo, parotite e rosolia, singoli o in associazione, e i vaccini contro
la varicella contengono anch’essi una quantità minima di
neomicina (25 mg). Soggetti allergici alla neomicina possono avere una reazione di tipo ritardato (papula eritematosa e pruriginosa in sede d’inoculazione) dopo 48-96
ore dalla somministrazione. Una tale risposta può essere
considerata lieve in confronto ai vantaggi della vaccinazione, per cui non deve essere considerata una controindicazione. Ma se la storia del vaccinando mette in evidenza reazioni anafilattiche alla neomicina è bene evitare vaccini che ne contengano anche minime quantità. Al
momento attuale non vi sono in commercio vaccini che
contengano penicillina o suoi derivati.
Reazioni da ipersensibilità verso
l’antigene immunizzante o verso
alcuni dei componenti il terreno
Sia verso il vaccino DTP, sia verso il vaccino contro il
colera, la peste o il vaccino ucciso contro il tifo, a cellula intera per via parenterale, è possibile che insorgano reazioni locali o più di rado sistemiche. In casi eccezionali con i vaccini DTP, DT, dT, si sono verificate
reazioni orticarioidi o di tipo anafilattico, durante le
quali sono stati dimostrati anticorpi specifici della classe IgE (Sakaguchi M et al, 1998). Sebbene sia sempre
molto difficile stabilire un rapporto di causa/effetto,
l’insorgenza di una reazione allergica grave di tipo anafilattico, controindica la prosecuzione della vaccinazione con lo stesso vaccino. Un semplice esantema orticarioide non controindica l’uso di dosi ulteriori. Da quando viene usato contro la pertosse il vaccino acellulare
(DTPa) queste reazioni sono eccezionali.
Un discorso a parte merita il vaccino contro il tetano:
soggetti che abbiano concentrazioni elevate di anticorpi
antitetano, in seguito alla somministrazione di frequenti
richiami, possono talvolta presentare un’aumentata gravità e incidenza delle reazioni, in seguito alla somministrazione di ulteriori dosi di vaccino contro il tetano.
Tuttavia in uno studio, 94 di 95 soggetti con storia di
sintomi da anafilassi, dopo una precedente dose di anatossina tetanica, si dimostrarono non reattivi alla prova
intradermo e tollerarono bene una somministrazione ulteriore di anatossina tetanica, senza incidenti. La 95a
persona ebbe eritema ed edema immediatamente dopo la
prova intradermo, ma tollerò senza manifestazioni di
alcun tipo una dose intera per IM. Nella pratica, reazioni cutanee lievi, non necessariamente dovute all’anatossina tetanica iniettata per via intradermo, sono abbastanza comuni. D’altra parte nella maggior parte dei vaccinati si sviluppa un’ipersensibilità ritardata senza conseguenze. Nonostante quanto sopra riportato, è doveroso
ricordare che in casi eccezionali possono avvenire gravi
BARTOLOZZI_09.indd 163
163
reazioni da ipersensibilità (con pericolo di morte) dopo
la vaccinazione con anatossina tetanica.
Se si sospetta che sia avvenuta una reazione anafilattica a una precedente dose di vaccino contro il tetano,
può essere utile praticare una prova intradermica con
anatossina tetanica, prima di decidere di sospendere la
vaccinazione contro il tetano.
Soggetti che hanno reazioni da ipersensibilità tipo
Arthus o febbre oltre i 39,4 °C, hanno usualmente alti
livelli sierici di antitossina tetanica e non dovrebbero
ricevere, anche in situazioni di emergenza, dosi di dT,
più frequentemente di una ogni 10 anni, come previsto
nei moderni protocolli.
Reazioni, tipo malattia da siero, sono state trovate nel
6% dei pazienti, dopo una dose di richiamo di vaccino
antirabbico, preparato su cellule diploidi umane: la reazione è stata collegata con una sensibilizzazione all’albumina umana, presente nel vaccino, strutturalmente
alterata dagli agenti adoperati per inattivare il virus.
Reazioni da ipersensibilizzazione dopo vaccinazione
contro lo pneumococco, contro l’Haemophilus influenzae e il meningococco sono estremamente rare.
La maggior parte delle reazioni alla vaccinazione
contro l’epatite B è di tipo lieve e consiste nella comparsa di edema e arrossamento nella sede d’iniezione o
di orticaria. L’incidenza delle reazioni anafilattiche in
soggetti che abbiano ricevuto il vaccino contro l’epatite B è di circa un caso su 600.000 dosi di vaccino;
sebbene nessuna delle persone che presentarono anafilassi sia morta, questo evento deve essere considerato
come potenzialmente fatale.
Le reazioni immediate di tipo anafilattico al vaccino
MPR sono estremamente rare: su centinaia di milioni di
dosi, VAERS (il sistema di rilevamento USA) ha rilevato solo 33 casi, ma solo 11 di questi casi avvennero
immediatamente dopo la vaccinazione e in persone che
avevano i sintomi caratteristici dell’anafilassi. In una
ricerca europea viene riportata un’incidenza di reazioni
allergiche di 1 caso su 450.000 dosi, ma, tenendo conto
solo di un evento che comporti un reale pericolo di vita,
solo di 1 caso su 8.000.000 di dosi di vaccino (Zent O
et al, 2002). In una ricerca eseguita negli Stati Uniti è
risultata una frequenza di anafilassi di 0,65 casi per ogni
milione di dosi di vaccino (Bohlke K et al, 2003). Ne
deriva che genitori e operatori sanitari possono essere
rassicurati riguardo all’anafilassi, associata ai vaccini.
Ciò non significa ovviamente che gli operatori sanitari
non debbano essere sempre pronti a fornire cure immediate se dovesse verificarsi un caso di anafilassi.
Secondo molti autori le prove cutanee non sono necessariamente predittive dell’ipersensibilità del vaccino.
Nel vaccino contro il morbillo o in quello contro
morbillo-parotite-rosolia, o in quello contro la varicella,
la presenza di gelatina usata come stabilizzante può
determinare una reazione di tipo anafilattico in soggetti con una storia di allergia alimentare alla gelatina di
origine bovina (Kelso JM et al, 1993, Singer S et al,
1999; Patja A et al, 2001; Pool V et al, 2002).
14/05/12 09:51
164
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Per quanto riguarda l’allergia al lievito di birra vi
sono alcune rarissime segnalazioni di manifestazioni
allergiche alla somministrazione del vaccino contro
l’epatite B in soggetti allergici al lievito di birra, in
quanto questo vaccino è ottenuto mediante la tecnica
DNA ricombinante utilizzando il Saccharomyces cerevisiae, il lievito usato per la fermentazione alcolica
della birra. In una rivista sull’argomento del 1998
(Grotto I et al, 1998), viene riportato un solo caso di
anafilassi e un solo caso di orticaria, dopo vaccinazione
contro l’HBV, in soggetti allergici al lievito di birra,
dopo centinaia di milioni di dosi di vaccino, in ogni
parte del mondo. In effetti proteine del lievito sono
contenute solamente in minime tracce in ogni lotto di
vaccino, ma la potenziale allergenicità di queste tracce
di proteine non è stata mai dimostrata nei soggetti riceventi il vaccino, nella maggioranza dei quali il dosaggio delle IgE specifiche non ha mostrato un aumento; anche nei casi in cui l’aumento era presente, esso
non era correlato a nessun evento clinico e solo eccezionalmente all’anafilassi (DiMiceli L et al, 2005).
Nei soggetti allergici al latice, per la contaminazione
del liquido vaccinale con tale allergene o per un contatto inavvertito dell’ago con il latice presente all’esterno
della fiala, è comparsa in letteratura una sola segnalazione di una reazione di tipo anafilattico (Lear JT e English
JS, 1995). Le modalità di contaminazione comprendono
anche la composizione dello stantuffo nelle siringhe preriempite e il cappuccio che ricopre l’ago (Bernardini R
et al, 1998; Bernardini R et al, 2004). Dall’esame dei
dati VAERS sono risultati 28 casi di reazioni da ipersensibilità immediata al latice dopo l’uso di un vaccino
(Russell M et al, 2004): tenuto conto dell’alto numero
di vaccinazioni negli Stati Uniti, si può calcolare che il
rischio di reazioni allergiche al latice sia molto basso.
Una storia di anafilassi dopo vaccinazione non è una
controindicazione assoluta alla vaccinazione (Seitz CS
et al, 2009).
Trattamento delle reazioni
allergiche gravi (anafilassi)
La rapidità dell’inizio e la gravità complessiva dell’anafilassi variano fortemente da un caso all’altro. La
Brighton Collaboration ha presentato qualche anno fa
la definizione di caso e le linee guida per la raccolta
dei dati (Rüggeberg JU et al, 2007).
In generale l’anafilassi inizia entro pochi minuti dopo
l’esposizione all’antigene: in generale più rapido è l’inizio e più grave è il decorso (Waibel KH, 2008): l’anafilassi è un’emergenza medica. Le principali manifestazioni sono:
• a carico della cute: prurito, rash, orticaria e angioedema (labbra e lingua gonfie)
• a carico dell’apparato respiratorio: voce rauca e stridore inspiratorio, tosse, respiro fischiante, dispnea e
cianosi
BARTOLOZZI_09.indd 164
• a carico dell’apparato cardiovascolare: polso molle e
frequente, ipotensione, aritmie, sincope, collasso, ipotonia, incontinenza
• a carico dell’apparato gastrointestinale: crampi, vomito, diarrea, e bocca asciutta.
Tutto il personale che somministra prodotti biologici
(siano essi medici o infermieri) deve essere sempre
preparato e pronto al trattamento dell’anafilassi.
Essere preparati non vuol dire solo avere a portata di
mano gli strumenti indispensabili per mantenere la pervietà delle vie aeree e i farmaci necessari per curare il collasso cardiocircolatorio, ma vuole anche dire avere dimestichezza con il loro uso e conoscere bene il loro impiego.
Il trattamento di emergenza delle crisi anafilattiche si
basa essenzialmente sul tipo di reazione presentata.
Tuttavia, qualunque sia il tipo di reazione anafilattica,
l’adrenalina rappresenta ancor oggi il farmaco di scelta
(tabella 9.12). Essa è disponibile come solfato, in fiale
da 1 mg/mL o in autoiniettori (Fastjekt da 0,165 mg per
bambini e da 0,33 mg per adulti) (Sicherer SH et al,
2007). Non esistono controindicazioni al suo uso, se
non nei soggetti anziani e in pazienti con ipertensione,
arteriopatie e malattie ischemiche di cuore (McLeanTooke APC et al, 2003).
Il trattamento di emergenza delle reazioni anafilattiche sistemiche si basa sul tipo di reazione: in tutti i
casi, l’adrenalina è il primo farmaco da usare. Poiché
le concentrazioni di adrenalina sono più elevate e raggiungono il massimo più rapidamente dopo iniezione
intramuscolare, non viene più raccomandata la somministrazione per via sottocutanea.
I sintomi lievi, come il prurito, l’eritema, l’orticaria
o l’angioedema si trattano con la somministrazione di
antistaminici (difenidramina cloridrato [galenico], idroxizina [Atarax] o altri), usati per via orale o parenterale (tabella 9.13). Se se ne vede la necessità può essere
fatta l’iniezione di adrenalina (vedi tabella 9.12), ripetuta eventualmente con una dose uguale o lievemente
Tabella 9.12 L'adrenalina nel trattamento dell'anafilassi
Somministrazione sottocutanea o intramuscolare
Adrenalina in soluzione acquosa 1:1000: 0,01 mg/kg per dose,
da ripetere ogni 10-20 minuti, fino a 3 dosi:
•lattanti: 0,05-0,1 mL
•bambini: 0,1-0,3 mL
•adolescenti: 0,3-0,5 mL
Somministrazione per via venosa
•0,1 mL/kg della soluzione 1:1000 di adrenalina viene diluita
1:10.000 con soluzione fisiologica
•La dose viene ripetuta dopo 5-15 minuti: usare eventualmente
un’infusione continua, da preparare diluendo 1 mL della
soluzione di adrenalina solfato 1:1000 con 250 mL di soluzione
glucosata al 5%, ottenendo una concentrazione di 4 mg/mL,
da infondere alla velocità di 0,1 mg/kg/min e aumentando
gradualmente fino a 1,5 mg/kg/min
Il mantenimento della pervietà delle vie aeree e la
somministrazione di ossigeno sono essenziali, oltre alla
somministrazione di adrenalina.
14/05/12 09:51
165
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.13 Altri farmaci usati nel trattamento dell’anafilassi (Red Book, 2009)
Farmaco
Dose
Antistaminici
(bloccanti H1):
difenidramina
idrossizina
Orale, IM, EV: 1-2 mg/kg ogni 4-6 ore
Orale, IM: 0,5-1 mg/kg ogni 4-6 ore
Farmaci bloccanti H2:
cimetidina
ranitidina
Corticosteroidi:
idrocortisone
metilprednisolone
prednisone
b2-agonista:
salbutamolo
Altri
dopamina
EV: 5 mg/kg lenti (in 15 minuti) ogni
6-8 ore
EV: 1 mg/kg lenti (in 15 minuti) ogni
6-8 ore
EV: 100-200 mg ogni 4-6 ore
EV: 1,5-2 mg/kg ogni 4-6 ore
Orale 1,5-2 mg/kg, singola dose
mattutina per 5 giorni
Soluzione nebulizzata 0,5% (5 mg/mL),
0,05-0,15 mg/kg per dose in 2-3 mL di
soluzione fisiologica, ogni 20 minuti
per 1-2 ore o di 0,5 mg/kg/h per
nebulizzazione continua
EV: 5-20 mg/kg/min. Mescolare 150 mg di
dopamina in 250 mL di soluzione
fisiologica o glucosio al 5% in acqua,
per ottenere una soluzione da
infondere alla velocità di 1 mL/kg/h,
corrispondenti a 10 mg/kg/min
inferiore entro 5 (ma anche meno se necessario)-15
minuti, secondo il controllo dei sintomi e della pressione arteriosa.
L’adrenalina deve essere iniettata prontamente in caso di anafilassi, cioè se il paziente presenta: sintomi
cutanei oppure due o più sistemi interessati (inclusa la
cute o l’apparato respiratorio) + sintomi gastrointestinali o cardiovascolari. Se il paziente ha già avuto precedenti reazioni allergiche verso prodotti biologici/siero, basta la comparsa di sintomi cardiocircolatori per
rendere necessaria la somministrazione dell’adrenalina.
Una volta che le condizioni del paziente siano migliorate e rimangano stabili, è possibile usare gli antistaminici per bocca ed eventualmente anche i corticosteroidi
(1,5-2 mg/kg di prednisone, fino a un massimo di 60
mg/die) per altre 24-48 ore.
Nelle forme gravi di anafilassi, nelle quali si possa
prevedere un pericolo per la stessa vita, il mantenimento
della pervietà delle vie aeree e l’ossigenoterapia è sempre d’obbligo. Immediatamente va somministrata l’adrenalina per via intramuscolare, mentre si cerca una via di
accesso venosa, in una soluzione 1:10.000, utilizzando
la soluzione fisiologica. La somministrazione di adrenalina per via venosa può accompagnarsi ad aritmie mortali, per cui è necessario un attento monitoraggio cardiaco. La somministrazione in flebo lenta è preferibile alla
somministrazione in bolo. Può essere utile la somministrazione di soluzione fisiologica o di Ringer lattato per
mantenere la pressione arteriosa a livelli adeguati.
BARTOLOZZI_09.indd 165
Nel broncospasmo può essere associato il salbutamolo nebulizzato (vedi tabella 9.13). La dopamina può
essere utile per mantenere la pressione arteriosa a livelli fisiologici. L’associazione anti-H1 e anti-H2 può risultare utile. I corticosteroidi, da non considerare come
farmaci di rapida risposta, possono trovare un’utile indicazione nei casi più gravi, dopo l’uso dell’adrenalina,
al di fuori dei casi lievi o di quelli che rispondano bene alla terapia: essi infatti non hanno un effetto immediato e non vanno considerati fra i farmaci principali.
Tutti i pazienti con crisi anafilattiche gravi necessitano di un periodo di controllo per alcune ore, perché
sono conosciuti casi di anafilassi bifasica o protratta
(oltre le 24 ore), che può essere attenuata dalla somministrazione di corticosteroidi.
Il trattamento di pazienti, in genere adulti, che ricevano per altre ragioni farmaci ad azione b-bloccante
adrenergica, richiede l’uso più aggressivo dell’adrenalina, per vincere il blocco recettoriale.
Alcuni esperti raccomandano l’uso di glucagone
per via venosa per migliorare le condizioni cardiovascolari, e le inalazioni di atropina per il trattamento
della bradicardia e del broncospasmo.
È necessario a questo punto ricordare quali debbano essere le caratteristiche dell’ambulatorio del pediatra di famiglia o dei servizi addetti alle vaccinazioni: è necessario avere costantemente a disposizione una fiala di adrenalina, come farmaco di prima
scelta, non necessariamente da mantenere in frigorifero. Da ricordare che questo farmaco ha una precisa
data di scadenza, che viene indicata dal farmacista,
quando la consegna in forma galenica. A parte questo
c’è una precisa indicazione alla necessità di mantenere pervie le vie aeree (sollevamento del mento e
inclinazione posteriore della testa) e di utilizzare il
pallone di Ambu.
La Società di Allergologia e Immunologia ricorda
oltre l’Ambu, nella strumentazione necessaria per l’uso
dei vaccini, la bombola di ossigeno (Società Italiana di
Allergologia e Immunologia, 1991), ma non bisogna
dimenticare la diversa incidenza dello shock anafilattico dopo la somministrazione dei vaccini contro le malattie infettive nei confronti di quello che fa seguito
all’immunoterapia specifica in soggetti allergici, nei
quali lo shock è circa 100 volte più frequente.
Controindicazioni
e precauzioni
Nella parte dedicata ai vaccini sono riportate le precauzioni e controindicazioni per i singoli vaccini.
In una ricerca sulle conoscenze dei medici nei confronti delle vere controindicazioni alle vaccinazioni è
risultato che i pediatri danno una risposta corretta alle
domande oltre quattro volte quelle fornite dai medici
generici (Cohen NJ et al, 2003).
14/05/12 09:51
166
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Controindicazioni e precauzioni
Controindicazione: presenza nel ricevente di una condizione che
aumenta fortemente il rischio di una grave reazione avversa. Il
vaccino non può essere somministrato quando vi sia una controindicazione.
Precauzione: presenza nel ricevente di una situazione che può
aumentare il rischio di una reazione avversa o che può compromettere la capacità del vaccino d’indurre immunità. È sempre
necessaria una precisa valutazione del rapporto rischi/benefici.
Una visita completa routinaria o la misurazione della
temperatura dei bambini che stiamo per sottoporre alla
vaccinazione non sono assolutamente necessarie per
soggetti che sembrino essere in buona salute. È invece
giusto domandare ai genitori se il bambino sia ammalato, pronti a rimandare la vaccinazione se egli appaia
essere affetto da una malattia moderata o grave o a
sottoporlo all’immunizzazione se la malattia è lieve e
non sia stata rilevata alcuna controindicazione.
Essenziale è pertanto l’anamnesi prevaccinale (vedi
capitolo 6).
La sola vera controindicazione, applicabile a tutti i
vaccini, è rappresentata dalla presenza nell’anamnesi
di una grave reazione allergica (anafilassi), in generale dopo la somministrazione della prima dose di un
vaccino; la grave reazione può essere dovuta alla componente vaccinica immunizzante o ad altre sostanze
contenute nel vaccino (gelatina, antibiotici).
Altre vere controindicazioni sono rappresentate da:
• somministrazione di vaccini vivi attenuati a soggetti
con grave immunocompromissione
• somministrazione di un vaccino vivo attenuato a una
donna in stato di gravidanza, per il possibile rischio
teorico per l’embrione e per il feto
• somministrazione di un vaccino vivo attenuato in un
bambino con malattia neurologica non stabilizzata.
Il rischio che il paziente corre se viene vaccinato, pur
in presenza di una precauzione, è minore di quello che
corre per la presenza di una controindicazione. In generale in presenza di una precauzione la vaccinazione
deve essere rimandata. Tuttavia, una vaccinazione può
essere eseguita, anche in presenza di una precauzione,
quando i benefici che ci si aspetta dalla vaccinazione
siano superiori ai rischi della reazione avversa.
Per esempio, ci vuole una certa cautela quando ci si
accinga a vaccinare con DTPa un bambino che, entro 48
ore dalla precedente dose di DTP intera o DTPa, ha manifestato una febbre ≥40,5 °C o ha avuto un pianto inconsolabile per 3 ore o più o ha presentato un quadro d’ipotonia-iporesponsività o infine ha presentato un attacco
convulsivo entro 3 giorni dalla dose precedente di DTP
intera o di DTPa. Tuttavia, la somministrazione di un vaccino contenente gli antigeni della pertosse va presa in considerazione se il rischio di pertosse sia, nel caso specifico,
aumentato, come può avvenire in corso di epidemia.
BARTOLOZZI_09.indd 166
Capita relativamente spesso di programmare una vaccinazione in un bambino, che malauguratamente proprio
quel giorno, ha la febbre con i segni di una malattia
acuta febbrile. Se il quadro clinico è lieve, con scarsa
febbre (≤38 °C), caratterizzato da un’infezione delle vie
aeree superiori, come una rinite o una faringite, non
esiste alcuna controindicazione o precauzione alla vaccinazione: il bambino viene quindi sottoposto alla pratica vaccinale programmata. Soprattutto se si tratta di
bambini che per l’età o per la loro frequenza al nido o
alla scuola materna si ammalino di frequente d’infezioni lievi delle vie aeree superiori. Rimandare la vaccinazione in questi bambini, come viene spesso consigliato,
vuol dire ritardare la vaccinazione al di là dell’età considerata ottimale, ammesso che successivamente il bambino venga ripresentato per la vaccinazione.
Ma se la malattia si presenta di gravità medio-alta,
se la febbre è di grado più elevato (>38 °C), se non è
ancora possibile porre una diagnosi molto probabile o
sicura, o se si pensa che essa possa avere un’evoluzione lunga, è necessario per vaccinare aspettare qualche
giorno dopo la guarigione: si tratta in effetti di una
precauzione. Bambini che presentino malattie febbrili,
moderate o gravi, nel periodo di programmazione delle
vaccinazioni, vanno seguiti con particolare attenzione
per sorprendere il momento adatto per eseguire la vaccinazione. Le precauzioni in bambini con malattia di
media entità o grave evitano che si sovrappongano effetti avversi dovuti al vaccino al quadro clinico della
malattia di base o che si sbagli ad attribuire al vaccino
segni o sintomi legati alla malattia sottostante.
È importante ricordare che, ogni volta che il pediatra
rimandi una vaccinazione, deve sempre sollecitare la
ripresa del vaccino il prima possibile.
Alcune delle situazioni che costituiscono una precauzione saranno esaminate nel prossimo capitolo 10, in
paragrafi specifici:
• gravidanza
• soggetti che abbiano ricevuto immunoglobuline IM o EV
• bambini che abbiano avuto reazioni alle precedenti
immunizzazioni
• dopo esposizione a particolari malattie
• malnutrizione
• malattie croniche e altro.
Recenti esperienze sulla risposta anticorpale al vaccino MPR in bambini che presentavano una lieve malattia, come un’infezione delle vie aeree superiori,
un’otite media, una diarrea, hanno dimostrato una buona risposta immunitaria, paragonabile a quella di soggetti perfettamente sani. Anche l’insorgenza degli effetti collaterali fu analoga a quella dei bambini sani (King
GE et al, 1996). Analoghe considerazioni valgono per
la vaccinazione contro la varicella.
Le linee guida per le precauzioni e le controindicazioni da osservare sono riportate nella tabella 9.14
(CDC, 1985; CDC, 1987; CDC 1996; CDC 2002; CDC
2006; CDC 2011).
14/05/12 09:51
167
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.14 Linee guida per le precauzioni* e le controindicazioni da osservare (CDC, 2011)
Vaccino
Controindicazioni
Precauzioni
DTPa
•Malattie neurologiche progressive, inclusi gli spasmi
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente infantili, l’epilessia non controllata, l’encefalopatia
progressiva. Differire la vaccinazione finché il quadro
•Encefalopatia (coma, perdita di conoscenza,
neurologico non si sia chiarito o si sia stabilizzato
convulsioni prolungate) non attribuibile ad altre
cause, entro 7 giorni dalla somministrazione di una •Febbre uguale o >40,5 °C entro 48 ore di una
precedente dose di DTP o DTPa
dose precedente di DTP o DTPa
•Episodio di ipotonia-iporesponsività entro 48 ore da
una dose precedente di DTP o DTPa
•Collasso o stato di shock (cioè episodio ipotonicoiporesponsivo) ≤48 ore dopo aver ricevuto la prima
dose di DTP/DTPa
•Convulsioni entro 3 giorni dalla dose precedente di
DTP o DTPa^
•Pianto persistente, inconsolabile per 3 ore o più
entro 48 ore dalla dose precedente di DTP o DTPa
•Sindrome di Guillain-Barré <6 settimane dopo la
precedente dose di vaccino contenente l’anatossina
tetanica
•Storia di una reazione d’ipersensibilità di tipo Arthus
dopo una precedente dose di vaccino contenente
anatossina tetanica; rimandare la vaccinazione di
almeno 10 anni dall’ultimo vaccino contenente
anatossina tetanica
•Malattia acuta moderata o grave con o senza febbre
DT, dT
•Sindrome di Guillain-Barré ≤6 settimane dopo una
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente dose precedente di vaccino contenente l’anatossina
tetanica
•Encefalopatia (coma, perdita di conoscenza,
•Storia di una reazione d’ipersensibilità di tipo Arthus
convulsioni prolungate) non attribuibile ad altre
dopo una precedente dose di vaccino contenente
cause, entro 7 giorni dalla somministrazione di una
anatossina tetanica; rimandare la vaccinazione di
dose precedente di DTP o DTPa
almeno 10 anni dall’ultimo vaccino contenente
anatossina tetanica
•Malattia da moderata a grave con o senza febbre
dTpa
•Grave reazione allergica a una precedente dose del
vaccino o a un suo componente
•Encefalopatia (coma, perdita di conoscenza,
convulsioni prolungate) non attribuibili ad altra
causa identificabile, entro 7 giorni dalla
somministrazione di una dose precedente di DTP/
DTPa
IPV
•Grave reazione allergica (anafilassi) a una
•Gravidanza
precedente dose del vaccino o a un suo componente •Malattia acuta da moderata a grave con o senza
febbre
MPR**, ***
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente
•Gravidanza
•Nota immunodeficienza grave (tumori liquidi o
solidi; trattamenti chemioterapici; immunodeficienze
congenite, terapia immunosoppressiva di lunga
durata^, infezione da HIV con forte
immunocompromissione)
Hib
•Malattia acuta da moderata a grave con o senza
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente febbre
•Età inferiore alle 6 settimane
Epatite B
•Grave reazione allergica (anafilassi) a una
•Lattante di peso <2000 grammi°
precedente dose del vaccino o a un suo componente •Malattia acuta da moderata a grave con o senza
febbre
Epatite A
•Grave reazione allergica (anafilassi) a una
•Gravidanza
precedente dose del vaccino o a un suo componente •Malattia acuta da moderata a grave con o senza
febbre
•Sindrome di Guillain-Barré ≤6 settimane dopo una
dose precedente di vaccino contenente l’anatossina
tetanica
•Malattia neurologica progressiva o instabile,
convulsioni non controllate, o progressiva
encefalopatia, finché non sia stato stabilito un
regime di trattamento e le condizioni si siano
stabilizzate
•Storia di una reazione d’ipersensibilità di tipo Arthus
dopo una precedente dose di vaccino contenente
anatossina tetanica; rimandare la vaccinazione di
almeno 10 anni dall’ultimo vaccino contenente
anatossina tetanica
•Malattia da moderata a grave con o senza febbre
•Recente somministrazione (≤11 mesi) di derivati del
sangue, contenenti anticorpi (la durata
dell’intervallo, dipende dalla dose somministrata)°°
•Storia di trombocitopenia o di porpora
trombocitopenica
•Necessità della prova alla tubercolina^^^
•Malattia acuta da moderata a grave con o senza
febbre
(continua)
BARTOLOZZI_09.indd 167
14/05/12 09:51
168
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.14 (continuazione)
Vaccino
Controindicazioni
Precauzioni
Varicella
•Somministrazione recente (≤11 mesi) di derivati del
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente sangue, contenenti anticorpi (l’intervallo di tempo
dipende dal prodotto)°°
•Nota immunodeficienza grave (tumori liquidi o
solidi; trattamenti chemioterapici; immunodeficienze •Malattia acuta da moderata a grave con o senza
febbre
congenite, terapia immunosoppressiva di lunga
durata^, infezione da HIV con forte
immunocompromissione)
•Gravidanza
Vaccino pneumococcico
coniugato eptavalente e
13-valente (PCV7 e
PCV13)
•Grave reazione allergica (anafilassi) a una
precedente dose di PCV7 e PCV13 o ad un vaccino
contenente anatossina difterica o a un suo
componente
Vaccino pneumococcico
23-valente non coniugato
•Grave reazione allergica (anafilassi) a una
•Malattia acuta da moderata a grave con o senza
precedente dose del vaccino o a un suo componente febbre
•Malattia acuta da moderata a grave con o senza
febbre
•Grave reazione allergica (anafilassi) a una
•Malattia acuta da moderata a grave con o senza
Vaccino meningococcico
precedente dose del vaccino o a un suo componente febbre
tetravalente coniugato,
•Storia di sindrome di Guillain-Barré (a meno che non
coniugato con anatossina
sia ad alto rischio per malattia meningococcica)
difterica (Menactra°°°)
Vaccino meningococcico
tetravalente
polisaccaridico non
coniugato
•Grave reazione allergica (anafilassi) a una
•Malattia acuta da moderata a grave con o senza
precedente dose del vaccino o a un suo componente febbre
Influenza inattivato
trivalente
•Grave reazione allergica (anafilassi) a una
•Sindrome di Guillain Barré meno di 6 settimane
precedente dose del vaccino o a un suo componente dopo una precedente dose di vaccino contro
l’influenza
•Malattia acuta da moderata a grave con o senza
febbre
Vaccino contro
papillomavirus
•Grave reazione allergica (anafilassi) a una
•Malattia acuta da moderata a grave con o senza
precedente dose del vaccino o a un suo componente febbre
•Gravidanza
Vaccino contro rotavirus
•Grave reazione allergica (anafilassi) a una
•Alterazione dell’immunocompetenza, oltre la SCID
precedente dose del vaccino o a un suo componente •Storia d’invaginazione
•Malattia gastrointestinale cronica
•Spina bifida o estrofia vescicale
•Malattia acuta da moderata a grave con o senza
febbre
Vaccino contro zoster
•Malattia acuta da moderata a grave con o senza
•Grave reazione allergica (anafilassi) a una
precedente dose del vaccino o a un suo componente febbre
•Soppressione dell’immunità cellulare
•Gravidanza
* Gli avvenimenti o le condizioni, definite come precauzioni, debbono essere considerati accuratamente. Debbono essere considerati accuratamente i benefici e i
rischi della somministrazione di uno specifico vaccino a una persona in queste circostanze. Se il rischio sembra superare il beneficio, il vaccino non deve essere somministrato; ma se il beneficio sembra superare il rischio il vaccino va usato. Va deciso caso per caso se meriti somministrare il vaccino DTPa a un bambino con disordine neurologico sottostante, provato o sospetto.
** Bambini infettati con HIV possono ricevere il vaccino contro il morbillo e la varicella se la conta dei linfociti CD4+ è >15%.
*** I vaccini MPR e varicella possono essere somministrati nello stesso giorno. Se questo non avviene è necessario che passino 28 giorni fra la somministrazione
dell’uno e dell’altro.
^ Paracetamolo o altro antipiretico può essere somministrato al bambino quando vi sia una storia personale o familiare di convulsioni, al momento della somministrazione del vaccino DTPa, per 24 ore (ogni 4 ore) per ridurre la possibilità d’insorgenza della febbre.
^^ Il vaccino MPR e quello contro la varicella possono essere somministrati nello stesso giorno. Se non sono somministrati nello stesso giorno vanno separati di ≥28
giorni. Se un soggetto vaccinato contro la varicella mostra dopo 7-25 giorni un esantema varicelliforme, bisogna evitare che abbia contatti con soggetti immunocompromessi.
^^^ La vaccinazione del morbillo può sopprimere temporaneamente la reazione alla tubercolina. Il vaccino del morbillo può essere somministrato nello stesso giorno
nel quale viene praticata la prova alla tubercolina. Se questo non avviene, la prova deve essere rimandata di 4 settimane o più dopo la vaccinazione. Se esiste urgenza per l’esecuzione della prova, è necessario ricordare che il vaccino può ridurre la reattività della prova.
° La vaccinazione contro l’epatite B va rimandata per i neonati che pesano meno di 2000 g, se la madre risulta HBsAg negativa al momento della nascita del lattante. (Questa regola vige per gli Stati Uniti, nei quali la prima dose viene somministrata alla nascita). La vaccinazione può iniziare a essere somministrata all’età cronologica di 1 mese o al momento in cui il lattante viene dimesso. Per i figli di madri HBsAg positive, la vaccinazione e le Ig immuni vanno somministrate entro 12 ore
dalla nascita, senza tener conto del peso.
°° La vaccinazione deve essere rimandata per un opportuno periodo di tempo, se sono stati somministrati prodotti che contengono immunoglobuline.
°°° Non in vendita in Italia.
BARTOLOZZI_09.indd 168
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Come precauzione prima della vaccinazione con DTPa
o MPR in soggetti che abbiano sofferto in precedenza di
convulsioni febbrili può essere utile la somministrazione preventiva di paracetamolo (Ipp MM et al, 1987;
Lewis K et al, 1988).
Di recente tuttavia viene negato ogni effetto limitante
le convulsioni con febbre, in seguito alla somministrazione preventiva di un antifebbrile.
In soggetti che abbiano malattie neurologiche in
evoluzione è buona norma attendere la stabilizzazione
del quadro clinico prima di procedere a qualsiasi vaccinazione, per non rischiare che venga addebitata al
vaccino un’evoluzione sfavorevole della malattia (Faldella G, 1998).
Per quanto riguarda la sclerosi tuberosa per molti
anni la vaccinazione di qualsiasi tipo era controindicata, ma in ricerche approfondite è risultato che le vaccinazioni, e in particolare il vaccino DTP, non sono controindicate in questa malattia (Jozwiak S et al, 1998).
In effetti nella trattatistica moderna la sclerosi tuberosa
non viene menzionata fra le malattie che controindicano la vaccinazione.
Nessuna precauzione per la vaccinazione di soggetti che
soffrano di sclerosi multipla (Confavreux V et al, 2001).
Molto è stato discusso sul comportamento da tenere nei
confronti delle vaccinazioni in bambini che abbiano superato una malattia di Kawasaki (Brogan PA et al, 2002).
A questo proposito vi sono due importanti questioni:
• quando siano state somministrate Ig per via venosa alla
dose di 2 g/kg è necessario aspettare 11 mesi prima della
somministrazione di vaccini vivi attenuati (precauzione)
• per evitare la comparsa di una recrudescenza della
malattia dopo la vaccinazione, viene consigliato dai
reumatologi pediatri di rimandare la vaccinazione di
almeno 3 mesi. Tuttavia, non esiste in letteratura nessuna pubblicazione che avvalli questa opinione.
L’uso dei vaccini nella sarcoidosi non si accompagna a
effetti collaterali gravi, pur essendo la sarcoidosi una malattia associata a difetti dell’immunità: tuttavia la risposta
anticorpale è molto ridotta o assente (Mert A et al, 2000).
False controindicazioni
Alcuni genitori, alcuni addetti all’assistenza non medici e purtroppo alcuni rari pediatri considerano, erroneamente, frequenti situazioni o circostanze, presenti nel
bambino da vaccinare, come vere e proprie controindicazioni: va riconosciuto che alla base di questo comportamento c’è spesso una completa ignoranza delle
vere controindicazioni e che spesso alla non conoscenza si supplisce con la fantasia o spesso con un apparente buon senso (Bartolozzi G, 1993) (tabella 9.15).
La Circolare del Ministero della Sanità del 26 marzo
1991, n. 9 (Norme per l’esecuzione delle vaccinazioni
(vere e false controindicazioni)), ne elenca le principali.
BARTOLOZZI_09.indd 169
169
• Allattamento materno: non costituisce una controindicazione alla vaccinazione del lattante, nemmeno
quando usavamo, per la vaccinazione contro la poliomielite, la via orale (OPV): non esiste quindi nessuna necessità d’interrompere l’alimentazione con latte
materno in occasione della vaccinazione. D’altra parte
nessuno dei virus vaccinici, ai quali eventualmente
venga sottoposta la madre, passa nel latte materno, se
non il virus della rosolia, anche se mancano le prove
che il latte di donne vaccinate contro la rosolia rappresenti un pericolo per il lattante.
• Gravidanza della madre o di altri conviventi: i virus contenuti nei vaccini MPR non vengono trasmessi
attraverso le goccioline di saliva o in altri modi. Sebbene il virus, contenuto nel vaccino contro la varicella,
possa eccezionalmente essere trasmesso dai vaccinati
ai contatti sani (soltanto per 4-5 volte si è verificata
con certezza questa possibilità, su centinaia di milioni
di dosi), la frequenza di questa trasmissione è molto,
molto rara per cui il vaccino non è controindicato in
figli o in contatti con donne in stato di gravidanza.
• Storia familiare di convulsioni in bambini che debbono essere vaccinati contro il morbillo (MPR) o contro
difterite, tetano e pertosse (DTPa): una storia familiare di convulsioni non rappresenta una controindicazione per l’immunizzazione, né rappresenta una ragione
per rimandare la vaccinazione. Tale affermazione vale
anche se sappiamo che i bambini con storia familiare
di convulsioni, hanno un maggior rischio di presentare
convulsioni in corso della febbre, insorta eventualmente
in seguito alla somministrazione di vaccini. La somministrazione di paracetamolo può risultare utile.
• Storia familiare di morte improvvisa del lattante
(SIDS) in bambini che stiano per essere sottoposti
alla vaccinazione DTP: numerosi studi hanno dimostrato che l’immunizzazione con DTP o DTPa non
causa la SIDS.
• Storia familiare di gravi conseguenze dopo una vaccinazione, non collegabili a un’immunodeficienza:
non esiste alcuna controindicazione. Nel caso in cui vi
fosse invece nei familiari un caso d’immunodeficienza
è necessario indagare in modo approfondito, sia il comparto umorale che quello cellulare del vaccinando.
• Storia personale di allergia non specifica o presenza di allergie fra i familiari: un’anamnesi personale
generica di manifestazioni di tipo allergico o la conoscenza in qualcuno dei familiari di vere e proprie
allergie, non rappresentano controindicazioni vere alle
vaccinazioni. Una storia personale di reazioni allergiche immediate e gravi o addirittura di una crisi anafilattica verso uno dei vaccini, rappresenta invece una
vera controindicazione per le successive somministrazioni di quel prodotto specifico.
• Storia personale di allergia alla penicillina o ad altri antibiotici, escluse le reazioni anafilattiche alla
14/05/12 09:51
170
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Tabella 9.15 False controindicazioni (CDC, 2011)
Vaccino
Controindicazioni
Per tutti i vaccini:
DTPa, DT, dT,
dTpa, IPV, MPR, Hib,
HBV, varicella,
rotavirus, PCVG13,
MCV4, MPSV4,
HPV, herpes zoster
•Malattia acuta con o senza febbre
•Reazione locale lieve o moderata (tumefazione, rossore, dolore) con febbre bassa o moderata dopo la dose
precedente
•Mancata esecuzione della visita in un bambino che sta bene
•Trattamento antibiotico in corso*
•Fase di convalescenza della malattia
•Nascita da parto pretermine
•Recente esposizione a una malattia infettiva
•Storia di allergia alla penicillina, altre allergie non legate al vaccino, parenti con allergie, immunoterapia con
estratti allergenici
DTPa
•Temperatura inferiore a 40,5 °C, irritabilità o lieve sonnolenza dopo la dose precedente di DTP/DTPa
•Storia familiare di convulsioni
•Storia familiare di morte improvvisa in culla
•Storia familiare di effetti collaterali dopo la somministrazione di DTP/DTPa
•Condizioni neurologiche stabili (come paralisi cerebrale, convulsioni ben controllate, ritardo di sviluppo)
dTpa
•Temperatura inferiore a 40,5 °C, irritabilità o lieve sonnolenza dopo la dose precedente di DTP/DTPa
•Collasso (cioè episodio ipotonico-iporesponsivo) entro 48 ore dalla precedente dose di DTP/DTPa
•Convulsioni entro 3 giorni dall’aver ricevuto la dose precedente di DTP/DTPa
•Pianto persistente, inconsolabile per più di 3 ore, entro 48 ore dopo la precedente somministrazione della dose di
DTP/DTPa
•Storia di esteso rigonfiamento dell’arto dopo la somministrazione di DTP/DTPa/dT e non fenomeno di Arthus
•Manifestazioni neurologiche stabili
•Storia di neurite brachiale
•Allergia al latice e non anafilassi
•Allattamento al seno
IPV
•Somministrazione in precedenza di una dose o più di OPV
MPR
•Prova alla tubercolina positiva
•Esecuzione contemporanea della prova alla tubercolina
•Allattamento al seno
•Gravidanza della madre del vaccinando o di altro familiare
•Il vaccinando è una donna in età feconda
•Membro della famiglia o altro coabitante immunodeficiente
•Infezione asintomatica o lievemente sintomatica da HIV
•Allergia alle uova
Epatite B
•Gravidanza
•Malattia autoimmune (per esempio LES o artrite reumatoide)
Varicella
•Gravidanza della madre o di un coabitante del vaccinando
•Membro della famiglia immunodeficiente
•Infezione asintomatica o lievemente sintomatica da HIV
•Immunodeficienza umorale (cioè agammaglobulinemia)
Pneumococco
polisaccaridico
23-valente
•Storia di malattia invasiva da pneumococco o di polmonite
Influenza
•Allergia non grave al latice (da contatto)
•Concomitante somministrazione di cumadin o di aminofillina
Papillomavirus
•Immunosoppressione
•Prova di Papanicolaou equivoca o non normale
•Conosciuta infezione da HPV
•Allattamento al seno
•Storia di condilomi acuminati genitali
Rotavirus
•Nascita pretermine
•Contatti familiari con immunocompromesso
•Contatto familiare con donne in gravidanza
Zoster
•Terapia con basse dosi di metotrexato (≤0,4 mg/kg/settimana), azatioprina (≤3 mg/kg/die) o 6-mercaptopurina (≤1,5
mg/kg/die) per il trattamento dell’artrite reumatoide, della psoriasi, della polimiosite, della sarcoidosi, della
malattia infiammatoria cronica o di altre malattie
•Personale di assistenza di pazienti con malattie croniche o alterazioni della immunocompetenza
•Contatti con pazienti con malattie croniche o alterazioni delll’immunocompetenza
•Incertezza nella conoscenza di varicella
* Farmaci antibatterici possono interferire con il vaccino orale contro il tifo Ty21a; alcuni farmaci antivirali possono interferire con il vaccino della varicella.
BARTOLOZZI_09.indd 170
14/05/12 09:51
171
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
neomicina e alla streptomicina o kanamicina: sia il
vaccino antipolio inattivato, che il vaccino MPR contengono minime quantità di neomicina e di streptomicina. Persone allergiche alla neomicina possono avere
una reazione locale di tipo ritardato (eritema, papule
pruriginose) dopo 48-96 ore dalla somministrazione di
questi vaccini: questa minima reazione in sede d’inoculazione non costituisce una controindicazione alla
prosecuzione della vaccinazione. Tutte le altre allergie
agli antibiotici denunziate non costituiscono controindicazioni alla vaccinazione.
• Storia personale di allergia alla carne o alle penne
di anatra, in un soggetto che debba essere vaccinato contro la rabbia: salvo un vaccino di scarso uso,
oggi nessun vaccino contro la rabbia contiene più antigeni di anatra. Gli ultimi vaccini oggi a disposizione
sono ottenuti in seguito alla coltivazione del virus della rabbia su cellule diploidi umane (HDCV).
• Storia personale di allergia, di tipo non anafilattico, all’uovo o agli antigeni a esso collegati: di questo
problema è già stato parlato nel paragrafo “reazioni allergiche all’uovo” in questo stesso capitolo. In breve
una storia del genere non controindica la vaccinazione.
• Storia personale di reazione a una precedente dose
di DTP, costituita da dolore, arrossamento o tumefazione in sede d’iniezione o da febbre inferiore a
40,5 °C: non costituisce una controindicazione.
• Somministrazione in atto o cessata da pochi giorni,
di uno dei comuni antibiotici (amoxicillina, eritromicina), usati in pediatria: è questo uno degli errori
più frequenti. Sembrerebbe da questo comportamento
che gli antibiotici fossero capaci d’inibire la crescita di un virus vivo attenuato. L’unico vaccino da non
somministrare in questi casi è quello contro la febbre
tifoide, costituito da un ceppo vivo e attenuato di Salmonella typhi.
• Trattamenti con corticosteroidi a basso dosaggio o
per applicazione locale (inalazione, uso dermatologico).
• Dermatosi, eczema o infezioni cutanee localizzate.
• Sindrome di Down.
• Antecedenti di ittero neonatale.
• Dopo il superamento di una malattia infettiva: probabilmente non è necessario aspettare la guarigione di
una malattia infettiva grave, comunque per sicurezza
vanno fatti passare 5-7 giorni, prima della vaccinazione.
• Recente esposizione a una malattia infettiva.
• Prematurità o basso peso alla nascita per la data
di gestazione.
• Malattia infettiva acuta lieve, con poca febbre o
diarrea di lieve entità, in un bambino peraltro assolutamente sano.
• L’anestesia generale non controindica le vaccinazioni.
BARTOLOZZI_09.indd 171
Vaccinazioni
in ambiente protetto
La vaccinazione in ambiente protetto rappresenta una
modalità di esecuzione dell’immunizzazione, caratteristica della Sanità italiana, che non trova riscontro in
altri Paesi. Ovviamente il ricorso a un centro specializzato dove esista la possibilità di trattare prontamente
possibili eventi avversi, eventualmente con la collaborazione del rianimatore pediatra, va per quanto possibile limitato ai casi che ne abbiano effettivamente un
assoluto bisogno.
Allargare l’indicazione oltre questi limiti significa
solo caricare di lavoro e di responsabilità servizi impegnati in altri e altrettanto importanti compiti.
In Italia sono state pubblicate due messe a punto
complete sull’argomento (Azzari C et al, 2003; Timitilli A et al, 2005).
La prima decisione da prendere di fronte a un bambino che presenti un evento avverso, è se esso possa
essere rivaccinato in una struttura periferica (Servizio
vaccinale, ambulatorio pediatrico e altro) o se debba
essere inviato in ambiente protetto, per il proseguimento della vaccinazione.
Sulla base dell’esperienza accumulata con gli anni, i
casi da inviare per la prosecuzione della vaccinazione
in ambiente protetto non sono moltissimi, perché si
limitano agli eventi avversi gravi, che comportino pericolo di vita, in altre parole una pregressa anafilassi da
vaccino.
Probabilmente non è invece opportuno, come viene
da alcuni consigliato, inviare in ambiente protetto qualunque bambino che abbia presentato un episodio di
anafilassi dovuto ad agenti diversi dal vaccino che stiamo per somministrare, come se l’anafilassi non fosse
tipicamente antigene-specifica: tuttavia conviene decidere caso per caso.
È invece assolutamente superfluo inviare al centro
(quasi sempre d’Immunologia e Allergologia) bambini
che abbiano avuto altri tipi di eventi avversi, manifestatisi poco dopo la vaccinazione e dopo molte ore,
come episodi d’ipotonia-iporesponsività, pianto prolungato, febbre ≥40,5 °C, convulsioni febbrili, piastrinopenia, sindrome di Guillain-Barré o altro.
Anche perché il presidio ospedaliero o la clinica non
possono tenere in osservazione il paziente se non per
poche ore dopo la vaccinazione, e perché, secondo l’esperienza, molte di queste condizioni non si ripetono
dopo il primo episodio, in occasione delle vaccinazioni
successive.
Per i bambini che debbano essere vaccinati con MPR
e che abbiano presentato anafilassi all’uovo e forme
minori di allergia, ma siano portatori di un asma cronico attivo, che richieda un trattamento con corticosteroidi per inalazione, viene ugualmente consigliata la
vaccinazione in ambiente protetto (Khakoo GA e Lack
G, 2000).
14/05/12 09:51
172
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Fase negativa
postvaccinazione
Che le vaccinazioni possano avere un effetto negativo,
per quanto riguarda le malattie infettive in genere, nella fase immediatamente successiva alla somministrazione del vaccino (per circa 7-10 giorni), è un concetto
che sorge, scompare e risorge, a cicli, nella mente dei
medici vaccinatori.
Un tale timore si è confermato assolutamente infondato: non è stata di recente trovata alcuna relazione fra
la somministrazione delle vaccinazioni di routine e un
aumentato rischio di malattie batteriche o virali, omo-
loghe o eterologhe. Anzi in una pubblicazione è stato
riportato un effetto protettivo, statisticamente significativo, nei primi 3 mesi dopo aver ricevuto una qualsiasi
vaccinazione.
Rimane da esaminare in modo più approfondito che
cosa avvenga dopo la vaccinazione contro l’Haemophilus influenzae tipo b: alcuni ricercatori hanno dimostrato che dopo la vaccinazione con polisaccaridi capsulari, non coniugati, esisteva un possibile aumento del
rischio di acquisire una malattia invasiva, per un periodo di 3 settimane dall’inoculazione (Sood SK e Daum
RS, 1990; Black SB et al, 1991). Questo effetto negativo non è stato dimostrato dopo l’uso dei moderni
vaccini coniugati contro l’Hib.
bibliografia
Aaby P, Vessari H, Nielsen J et al. Sex differential effects of routine
immunizations and childhood survival in rural Malawi. Pediatr Infect Dis J 25: 721-7, 2006.
Aaby P, Jensen H, Walraven G. Age-specific changes in the femalemale mortality ratio related to the pattern of vaccinations: an observational study from rural Gambia. Vaccine 24: 4701-8, 2006.
AIFA. Reazioni. Bollettino di farmacovigilanza dell’AIFA 1: 8, 2007.
American Academy of Pediatrics. Red Book, 26a ed, Elk Grove
Village, IL, 2003, p. 427.
American Pediatric Society, Society for Pediatric Research.
Datalink Study. Abstract 514, New Orleans, 1-5 maggio 1998.
Ara G. Gianotti Crosti dopo vaccinazione. Pediatria on Line 11
settembre 2003.
Ara G. Reazioni locali come risposta al dolore. Comunicazione personale, 2009.
Arshi S, Sadeghi H, Majidpour A et al. A simple mistake responsible
for 153 cases of muscular cold abscesses. Vaccine 21: 4120-1, 2003.
Ascherio A, Zhang SM, Herman MA et al. Hepatitis B vaccination
and the risk of multiple sclerosis. N Engl J Med 344: 327-32, 2001.
Azzari C, Bernardini R, Vierucci A. Come e quando vaccinare in
ambiente protetto. Area Pediatr 4: 8-16, 2003.
Bakshi R, Graves MC. Guillain-Barré syndrome after combined tetanus-diphtheria toxoid vaccination. J Neurol Sci 147: 201-2, 1997.
Ballotti S, Galli L, De Martino M. Il falso problema del vaccino
per il morbillo e dell’allergia all’uovo. Giorn It Inf Pediatr 7: 8-13,
2005.
Bartolozzi G. False controindicazioni alle vaccinazioni. Medico e
Bambino 12: 255-56, 1993.
Bartolozzi G. Reattogenicità delle vaccinazioni in età pediatrica.
Metodi epidemiologici per la valutazione delle vaccinazioni, Istituto
Superiore di Sanità, Roma, 13-17 ottobre 1997.
Bartolozzi G. Reazioni avverse lievi e gravi (rare) ai vaccini: una
revisione. Medico e Bambino 16: 643-7, 1997a.
Bartolozzi G. La bombatura della fontanella dopo vaccinazione.
Area Pediatrica 9, novembre, 2006.
Beeler J, Varricchio F, Wise R. Thrombocytopenia after immunization
with measles vaccines: review of the Vaccine Adverse Events Reporting System (1990 to 1994). Pediatr Infect Dis J 15: 88-90, 1996.
Beigel J, Kohl KS, Khuri-Bulos N et al. Rash including mucosal
involvement: case definition and guidelines for collection, analysis,
and presentation of immunization safety data. Vaccine 25: 5697-706,
2007.
Bergfors E, Trollfors B, Inerot A. Unexpectedly high incidence of
persistent itching nodules and delayed hypersensitivity to aluminium
in children after the use of adsorbed vaccines from a single manufacturer. Vaccine 22: 64-9, 2003.
Bernardini R, Novembre E, Ingargiola A et al. Prevalence and risk
factors of latex sensibilization in an unselected pediatric population.
J Allergy Clin Immunol 101: 621-5, 1998.
Bernardini R, Vierucci A, Marchese PM et al. Allergia al lattice.
Inserti della Regione Toscana, n. 3, marzo 2004.
Berti I, Longo G. Vaccino morbillo-parotite-rosolia e allergia all’uo-
BARTOLOZZI_09.indd 172
vo. Finalmente una svolta epocale. Medico e Bambino 29: 36-41,
2010.
Bines JE, Kohl KS, Forster J et al. Acute intussusception in infants
and children as an adverse event following immunization: case
definition and guidelines for data collection, analysis and presentation. Vaccine 22: 569-74, 2004.
Black SB, Cherry JD, Shinefield HR et al. Apparent decreases risk
of invasive bacterial disease after heterologous childhood immunization. AJDC 145: 746-9, 1991.
Black SB, Shinefeld HR, Lampert D et al. Safety and immunogenicity of oligosaccharide conjugate Haemophilus influenzae type b
(HbOH) vaccine in infancy. The Northern California Kaiser Permanente Vaccine Study Center Pediatrics Group. Pediatr Infect Dis J
10: 92-6, 1991a.
Bodor M, Montalvo E. Vaccination-related shoulder dysfunction.
Vaccine 25: 585-7, 2007.
Bohlke K, Davis RL, Marcy SM et al. Risk of anaphylaxis after
vaccination of children and adolescents. Pediatrics 112: 815-20,
2003.
Bonhoeffer J, Kohl K, Chen R et al. The Brighton Collaboration:
addressing the need for standardized case definitions of adverse
events following immunization (AEFI). Vaccine 21: 298-302, 2002.
Bonhoeffer J, Heininger U, Kohl K et al. Standardized case definitions of adverse events following immunization (AEFI). Vaccine 22:
547-50, 2004.
Bonhoeffer J, Vermeer P, Halpering S et al. Persistent crying in
infants and children as an adverse event following immunization:
case definition and guidelines for data collection, analysis and
presentation. Vaccine 22: 586-91, 2004a.
Bonhoeffer J, Menkes J, Gold MS et al. Generalized convulsive
seizure as an adverse event following immunization: case definition
and guidelines for data collection, analysis and presentation. Vaccine 22: 557-62, 2004b.
Bonhoeffer J, Gold MS, Heijbel H et al. Hypotonic-hyporesponsive
episode (HHE) as an adverse event following immunization: case
definition and guidelines for data collection, analysis and presentation. Vaccine 22: 563-8, 2004c.
Bonhoeffer J, Bentsi-Enchill A, Chen RT et al. Guidelines for
collection, analysis and presentation of vaccine safety data in surveillance systems. Vaccine 27: 2282-8, 2009.
Bonhoeffer J, Bentsi-Enchill A, Chen RT et al. Guidelines for
collection, analysis and presentation of vaccine safety data in surveillance systems. Vaccine 27: 2289-97, 2009a.
Braun MM, Ellenberg SS. Descriptive epidemiology of adverse
events after immunization: Reports to the Vaccine Adverse Event
Reporting System (VAERS), 1991-1994. J Pediatr 131: 529-35, 1997.
Braun MM, Patriarca PA, Ellenberg SS. Syncope after vaccination.
Arch Pediatr Adolesc Med 151: 255-9, 1997a.
Braun MM, Terracciano G, Salive ME et al. Report of a US Public
Health Service Workshop on hypotonia-hyporesponsive epidose
(HHE) after pertussis immunization. Pediatrics 102, p.e. 52, novembre 1998.
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Bremmer SA, Carey IM, DeWilde S et al. Timing of routine immunizations and subsequent hay fever. Arch Dis Child 90: 567-3, 2005.
Brotherton JML, Hull BP, Hayden A et al. Probability of coincident
vaccination in the 24 or 48 hours preceding sudden infant death
syndrome death in Australia. Pediatrics 115: e643-6, 2005.
Brogan PA, Bose A, Burgner D et al. Kawasaki disease: an evidence based approach to diagnosis, treatment and proposal for future
research. Arch Dis Child 86: 286-90, 2002.
Buettcher M, Heininger U, Braun M et al. Hypotonia-hyporesponsive episode (HHE) as an adverse event following immunization in
early childhood: case definition and guidelines for data collection,
analysis, and presentation. Vaccine 25: 5875-81, 2007.
Buttery J, La Vincente S, Andrews R et al. Adverse events following immunization: desperately seeking surveillance. Lancet Infect
Dis 6: 680-1, 2006.
Buttery J. HPV school program AEFIs causing local media blip
Melbourne, Australia. Vaccine Safety Information Sharing, 21 maggio 2007.
Campion EW. Suspicion about the safety of vaccines. N Engl J Med
347: 1474-5, 2002.
CDC. Diphtheria, tetanus, and pertussis: guidelines for vaccine prophylaxis and other preventive measures – recommendations of the
Immunization Practices Advisory Committee (ACIP). MMWR 34:
405-14 e 419-26, 1985.
CDC. Pertussis immunization: family history of convulsions and use of
antipiretics. Supplementary ACIP statement: recommendations of
the Immunization Practices Advisory Committee (ACIP). MMWR
36: 281-2, 1987.
CDC. Update: vaccine side effects, adverse reactions, controindications, and precautions. Recommendations of the Advisory Committee
on Immunization Practices (ACIP). MMWR 45(RR-12): 1-35, 1996.
CDC. General recommendations on immunization. Recommendations
of the Advisory Committee on Immunization Practices (ACIP).
MMWR 51(RR-03): 1-31, 2002.
CDC. Prevention and control of influenza. Recommendations of the
Advisory Committee on Immunization Practices (ACIP) and American Academy of Family Physicians (AAFP). MMWR 51(RR-02):
1-36, 2002a.
CDC. General recommendations on immunization. Recommendations
of the Advisory Committee on Immunization Practices (ACIP).
MMWR 55(RR-15): 1-48, 2006.
CDC. Syncope after vaccination – United States, january 2005-july
2007. MMWR 57: 457-60, 2008.
CDC. Recommendations of the Advisory Commettee on Immunization
Practices (ACIP). 60 (RR02): 1-60, 2011.
Center KJ, Hansen JR, Lewis E et al. Lack of association of Kawasaki disease after immunization in a cohort of infants followed for
multiple autoimmune diagnoses in a large, phase-4 observational
database safety study of 7-valent pneumococcal conjugate vaccine.
Pediatr Infect Dis J 28: 438-40, 2009.
Charatan F. US court rejects vaccine connection to autism. BMJ 338:
b673, 2009.
Chen RT, Rastogi SC, Mullen JR et al. The Vaccine Adverse Event
Reporting System (VAERS). Vaccine 12: 542-50, 1994.
Chen RT, Glasser JW, Rhodes PH et al. Vaccine safety datalink
project: a new tool for improving vaccine safety monitoring in the
Unites States. Pediatrics 99: 765-73, 1997.
Chen RT, DeStefano R. Vaccine adverse events: casual or coincidental. Lancet 351: 611-2, 1998.
Chen RT. Vaccine risks: real, perceived and unknown. Vaccine 17:
S41-6, 1999.
Chen RT, DeStefano F, Pless R et al. Challenges and controversies
in immunization safety. Infect Dis Clin North Am 15: 21-39, 2001.
Cherin P, Gherardi RK. Macrophagic myofasciitis. Curr Rheumatol
Rep 2: 196-200, 2000.
Chiappini E, Bonsignori F, Braccasi G et al. Considerazioni epidemiologiche per la valutazione della sicurezza dei vaccini. Giorn It
Inf Pediatr 8: 135-46, 2006.
Classen DC, Classen JB. The timing of pediatric immunization and
the risk of insulin-dipendent diabetes mellitus. Infect Dis Clin Pract
6: 449-54, 1997.
Cohen NJ, Lauderdale DS, Shete PB et al. Physician knowledge of
catch-up regimens and controindications for childhood immunizations. Pediatrics 111: 925-32, 2003.
Cohn V. Vaccines and risks. The responsibility of the media, scientists,
and clinicians. JAMA 276: 1917-8, 1996.
BARTOLOZZI_09.indd 173
173
Comitato operative Studio Hera. Sorveglianza post-marketing delle
vaccinazioni nei primi due anni di vita. Rapporti Istisan 07/34, 2007.
Confavreux C, Suissa S, Saddier P et al. Vaccinations and the risk
of relapse in multiple sclerosis. Vaccine in Multiple Sclerosis Study
Group. N Engl J Med 344: 319-26, 2001.
Coop CA, Schaefer SM, England RW. Extensive keloid formation and
progression after each vaccination. Human Vaccines 3: 127-30, 2007.
Cooper PA, Madhi SA, Huebner RE et al. Apnea and its possible
relationship to immunization in ex-premature infants. Vaccine 26:
3410-3, 2008.
Crovari P, Gabutti G, Giammanco G et al. Reactogenicity and immunogenicity of a new combined measles-mumps-rubella vaccine:
results of a multicenter trial. Vaccine 18: 2796-803, 2000.
Dales L, Hammer SJ, Smith NJ. Time trends in autism and in MMR
immunization coverage in California. JAMA 285: 1183-5, 2001.
D’Argenio P, Citarella A, Intorcia M, Aversano G. Al outbreak
of vaccination panic. Vaccine 14: 1289-90, 1996.
Darwish A, Roth CE, Duclos P et al. Investigation into a cluster of
infant deaths following immunization: evidence for methanol intoxication. Vaccine 20: 3585-9, 2002.
da Silveira CM, Salisbury DM, de Quadros CA. Measles vaccination and Guillain-Barré syndrome. Lancet 349: 14-6, 1997.
Davis RL, Bohlke K. Measles vaccination and inflammatory bowel
disease: controversy laid to rest? Drig Saf 24: 939-46, 2001.
DeStefano F, Mullooly JP, Okoro CA et al. Childhood vaccinations,
vaccination timing and risk of type 1 diabetes mellitus. Pediatrics
108: e102, 2001.
DeStefano F, Gu D, Kramarz P et al. Childhood vaccinations and
risk of asthma. Pediatr Infect Dis J 21: 498-504, 2002.
DeStefano F, Verstraeten T, Jackson LA et al. Vaccinations and
risk of Central Nervous System demyelinating disease in adults.
Arch Neurol 60: 504-9, 2003.
Dibs SD, Baker MD. Anaphylaxis in children: a 5-year experience.
Pediatrics, p.e. 99, gennaio 1997.
Di Miceli L, Pool V, Kelso JM et al. Vaccination of yeast sensitive
individuals: review of safety data in the US vaccine adverse event
reporting system (VAERS). Vaccine 24: 703-7, 2005.
Duchet-Niedziolka P, Launay O, Coutsinos Z et al. Vaccinations in
adults with auto-immune disease and/or drug related immune deficiency: results of the GAVACCIM Delphi survey. Vaccine 27: 15239, 2009.
Duclos P. A global perspective on vaccine safety. Vaccine 22: 205963, 2004.
DuVernoy TS, Braun MM. Hypotonic-hyporesponsive episodes reported to Vaccine Adverse Event Reporting System (VAERS) 19961998. Pediatrics 106, p.e. 52, ottobre 2000.
Ekbom A, Daszak P, Kraaz W, Wakefield AJ. Crohn’s disease after
in utero measles virus exposure. Lancet 348: 515-7, 1996.
Esteghamati A, Gouya MM, Keshtkar AA, Mahoney F. Relationship between occurrence of Guillain-Barré syndrome and mass
campaign of measles and rubella immunization in Iranian 5-14
years old children. Vaccine 26: 5058-61, 2008.
Faldella G. Vaccinazioni: controindicazioni vere e false. Riv Ital
Pediatr 24: 652-4, 1998.
Faldella G, Galletti S, Corvaglia L et al. Sicurezza della vaccinazione esavalente DTPa-IPV-Hib-HBV nei prematuri. Giorn It Inf
Pediatr 9: 33-40, 2007.
Fischer MC. Vaccine Safety. Pediatr Infect Dis J 27: 827-30, 2008.
Fleming PJ, Blair PS, Platt MW et al. The UK accelerated immunization programme and sudden unexpected death in infancy: casecontrol study. BMJ 322: 822-5, 2001.
Fombonne E, Zakarian R, Bennett A et al. Pervasive developmental
disorders in Montreal, Quebec, Canada: prevalence and links with
immunization. Pediatrics 118: e139-150, 2006.
François G, Duclos P, Margolis H et al. Vaccine safety controversies
and the future of vaccination programs. Pediatr Infect Dis J 24:
953-61, 2005.
Freed GL, Katz SL, Clrk SJ. Safety of vaccinations; Miss America,
the media and public Health. JAMA 276: 1869-72, 1996.
Freedman SB, Reed J, Burwen DR et al. Transiet bulging fontanellle after vaccination: case report and review of the vaccine adverse
event reporting system. J Pediatr 147: 640-4, 2005.
Gidudu J, Kohl KS, Halpering S et al. A local reaction at or near
injection site: case definition and guidelines for collection, analysis,
and presentation of immunization safety data. Vaccine 26: 6800-13,
2008.
14/05/12 09:51
174
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Global Advisory Committee on Vaccine Safety. Weekly Epidemiol
Rec 77: 389-404, 2002.
Glück T, Müller-Ladner U. Vaccination in patients with chronic rheumatic or autoimmune diseases. Clin Infect Dis 46: 1459-65, 2008.
Gold M, Goodwin H, Botham S et al. Re-vaccination of 421 children
with past history of an adverse vaccine reaction in a special immunisation service. Arch Dis Child 83: 128-31, 2000.
Goodman M, Lamm SH, Engel A et al. Cortical tuber count: a biomarker indicating neurologic severe tuberous sclerosis complex. J
Child Neurol 12: 85-90, 1997.
Goodman M, Nordin J. Vaccine adverse event reporting system reporting source: a possible source of bias in longitudinal studies.
Pediatrics 117: 387-90, 2006.
Goodwin H, Nash M, Gold M et al. Vaccination of children following
a previous hypotonic-hyporesponsive episode. J Pediatr Child Health
35: 549-52, 1999.
Goriely S, Goldman M. From tolerance to autoimmunity: is there a
risk in early life vaccination? J Comp Path 137: S57-S61, 2007.
Greco D, Salmaso S, Mastrantonio P et al. A controlled trial of two
acellular vaccines and one whole-cell vaccine against pertussis. N
Engl J Med 334: 341-8, 1996.
Grotto I, Mandel Y, Ephros M et al. Major adverse reactions to yeastderived hepatitis B vaccine. A review. Vaccine 16: 329-34, 1998.
Grüber C, Nilsson L, Björkstén B. Do early childhood immunizations influence the development of atopy and do they cause allergic
reactions? Pediatr Allergy Immunol 12: 296-11, 2001.
Grüber C, Illi S, Lau S et al. Transiet suppression of atopy in early
childhood is associated with high vaccination coverage. Pediatrics
111: e282-8, 2003.
Halperin S, Kohl KS, Gidudu J et al. Cellulitis at injection site: case
definition and guidelines for collection, analysis and presentation of
immunization safety data. Vaccine 25: 5803-20, 2007.
Halsey NA, Hyman SL, Conference Writing Panel. Measles-mumps-rubella vaccine and autistic spectrum disorder: report from the
New Challenges in Childhood Immunization Conference convened
in Oak Brook, Illinois, June 12-13, 2000. Pediatrics 107: E84, 2001.
Heijbel H, Ciofi degli Atti M, Harzer E. Hypotonic-hyporesponsive
episodies in eight pertussis vaccine studies. Dev Biol Stand (Basel)
89: 101-3, 1997.
Hernández D, de Rojas F, Martinez Escribano C et al. Fatal dextran-induced allergic anaphylaxis. Allergy 57: 862, 2002.
Holt PG, Rowe J, Loh R, Sly PD. Developmental factors associated
with risk for atopic disease: implications for vaccine strategies in
early childhood. Vaccine 21: 3432-35, 2003.
Hornig M, Briose T, Bule T et al. Lack of association between measles virus vaccine and autism with enteropathy: a case-control study.
PLosONE, v 3, 9: e3140, September 2008.
Horton R. The lesson of MMR. Lancet 363: 747-50, 2004.
Hua W, Izurieta HS, Slade B et al. Kawasaki disease after vaccination. Reports to the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J 28: 943-7, 2009.
Hughes RA, Charlton J, Latinovic R, Gulliford MC. No association between immunization and Guillain-Barré syndrome in the
United Kingdom, 1992 to 2000. Arch Intern Med 166: 1301-4, 2006.
Huynh W, Cordato DJ, Kehdi E et al. Post-vaccination encephalomyelitis: literature review and illustrative case. J Clin Neurosc 15:
1315-22, 2008.
Hviid A, Stellfeld M, Wohlfahrt J, Melbye M. Childhood vaccination and type 1 diabetes. N Engl J Med 350: 1398-404, 2004.
Institute for Vaccine Safety Diabetes Workshop Panel. Childhood
immunizations and type 1 diabetes: summary of an Institute for
Vaccine Safety Workshop. Pediatr Infect Dis J 18: 217-22, 1999.
Ipp MM, Gold R, Greenberg S et al. Acetaminophen prophylaxis of
adverse reactions following vaccination of infants with diphtheriapertussis-tetanus toxoid-polio vaccine. Pediatr Infect Dis J 6: 7215, 1987.
Ipponi A, Bencivenni L. Sicurezza dei vaccini. XXIV Congresso Nazionale SIFO, Venezia, 28 settembre-1 ottobre 2003.
Istituto Superiore di Sanità. Guida alle controindicazioni alle vaccinazioni. Rapporto Istasan 09/13, 2009.
Jadavji T, Scheifele D, Halpering S et al. Thrombocytopenia after
immunization in Canadian children. Pediatr Infect Dis J 22: 119-23,
2003.
James JM, Burks AW, Roberson PK et al. Safe administration of the
measles vaccine to children allergic to eggs. N Engl J Med 332:
1262-6, 1995.
BARTOLOZZI_09.indd 174
James JM, Burks AW, Roberson PK, Sampson HA. Safe administration of the measles vaccine to children allergic to eggs. N Engl J
Med 332: 1262-6, 1998.
James JM, Zeiger RS, Lester MR et al. Safe administration of influenza vaccine to patients with egg allergy. J Pediatr 133: 624-8, 1998a.
Jick H, Kaye JA. Autism and DTP vaccination in the United Kingdom.
N Engl J Med 350: 2722-3, 2004.
Jones JF, Kohl KS, Ahmadipour N et al. Fatigue: case definition and
guidelines for collection, analysis, and presentation of immunization
safety data. Vaccine 25: 5685-96, 2007.
Jozwiak S, Goodman M, Lamm SH. Poor mental development in
patients with tuberous sclerosis complex: clinical risk factor. Arch
Neurol 55: 379-84, 1998.
Kalaboka S, Annesi-Maesano I. The complex link between immunization against childhood diseases and allergy. Expert Rev Vaccines
6: 635-2, 2007.
Karvonen M, Cepaitis Z, Tuomilehto J. Association between type 1
diabetes and Haemophilus influenzae type b vaccination: birth
cohort study. BMJ 318: 1169-72, 1999.
Kaye JA, del Mar Melero-Montes M, Jick H. Mumps, measles,
and rubella vaccine and the incidence of autism recorded by
general practitioners: a time trend analysis. BMJ 322: 460-3,
2001.
Kelso JM, Jones RT, Yuninger JW et al. Anaphylaxis to measles,
mumps and rubella vaccine mediated by IgE to gelatin. J Allergy
Clin Immunol 91: 867-72, 1993.
Kemmeren JM, Vermeer-de Bondt PE, van der Maas NAT. Discolored leg syndrome after vaccination – descriptive epidemiology.
Rev J Pediatr 168: 43-50, 2009.
Khakoo GA, Lack G. Recommendations for using MMR vaccine in
children allergic to eggs. BMJ 320: 929-32, 2000.
King GE, Markowitz LE, Heath J et al. Antibody response to measles-mumps-rubella vaccine of children with mild illness at the time
of vaccination. JAMA 275: 704-7, 1996.
Kohl KS, Marcy SM, Blum M et al. Fever after immunization:
current concepts and improved future scientific understanding. Clin
Infect Dis 39: 389-94, 2004.
Kohl KS, Ball L, Gidudu J et al. Abscess at injection site: case
definition and guidelines for collection, analysis and presentation of
immunization safety data. Vaccine 25: 5821-38, 2007.
Kohl KS, Gidudu J, Banhoeffer J et al. The development of standardized case definitions and guidelines for adverse events following
immunization. Vaccine 25: 5671-4, 2007a.
Kohl KS, Walop W, Gidudu J et al. Induration at or near injection
site: case definition and guidelines for collection, analysis and presentation of immunization safety data. Vaccine 25: 5839-57, 2007b.
Kohl KS, Walop W, Gidudu J et al. Swelling at or near injection
site: case definition and guidelines for collection, analysis and presentation of immunization safety data. Vaccine 25: 5858-74, 2007c.
Koppen S, de Groot R, Neijens HJ et al. No epidemiological evidence for infant vaccination to cause allergic disease. Vaccine 22:
3375-85, 2004.
Lasky T, Terracciano GJ, Magder L et al. The Guillain-Barré sindrome and the 1992-1993 and 1993-1994 influenza vaccines. N
Engl J Med 339: 1797-802, 1998.
Lear JT, English JS. Anaphylaxis after hepatitis B vaccination. Lancet 345: 1249, 1995.
Lee J, Robinson JL, Spady DW. Frequency of apnea, bradycardia, and
desaturations following first diphtheria-tetanus-pertussis-inactivated
polio-Haemophilus influenzae type b immunization in hospitalized
preterm infants. BMC Pediatrics 6: 20, 2006.
Le Saux N, Barrowman NJ, Moore DL et al. Decrease in hospital
admissions for febrile seizures and reports of hypotonic-hyporesponsive episodes presenting to hospital Emergency Departments since
switching to acellular pertussis vaccine in Canada: a report from
IMPACT. Pediatrics 112: p.e. 348-353, 2003.
Letourneau M, Wells G, Walop W, Duclos P. Improving global
monitoring of vaccine safety: a quantitive analysis of adverse event
reports in the WHO Adverse Reactions Database. Vaccine 26: 118594, 2008.
Lewis K, Cherry JD, Sachs MH et al. The effect of prophylactic
acetaminophen administration on reactions to DTP vaccination. Am
J Dis Child 142: 62-5, 1988.
Marshall HS, Gold MS, Gent R et al. Ultrasound examination of
extensive limb swelling reactions after diphtheria-tetanus-acellular
pertussis or reduced-antigen content diphtheria-tetanus-acellular
14/05/12 09:51
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
pertussis immunization in preschool-aged children. Pediatrics 118:
1501-9, 2006.
Marcy SM, Kohl KS, Dagan R et al. Fever as an adverse event
following immunization: case definition and guidelines of data collection, analysis and presentation. Vaccine 22: 551-56, 2004.
McLean-Tooke APC, Bethune CA, Fay AC, Spickett GP. Adrenaline in the treatment of anaphylaxis: what is the evidence? BMJ 327:
1332-5, 2003.
McClure DL, Glanz JM, Xu S et al. Comparison of epidemiologic
methods for active surveillance of vaccine safety. Vaccine 26: 33415, 2008.
Meldolesi A. Quando il conflitto d’interessi danneggia la salute dei
cittadini. Il Riformista, 10 marzo 2004.
Mert A, Bilir M, Ozaras R et al. Results of hepatitis B vaccination
in sarcoidosis. Respiration 67: 543-5, 2000.
Miceli Sopo S. Comunicazione personale, 2000.
Miller E, Goldacre M, Pugh S et al. Risk of aseptic meningitis after
measles, mumps and rubella vaccine in UK children. Lancet 341:
979-95, 1993.
Miller E, Waight P, Farrington CP et al. Idiopathic thrombocytopenic purpura and MMR vaccination. Arch Dis Child 84: 227-9,
2001.
Mitchell EA, Steward AW, Clements M et al. Immunization and the
sudden infant death syndrome. Arch Dis Child 73: 498-501, 1995.
Mitchell LA, Tingle AJ, MacWilliam L et al. HLA-DR class II associations with rubella vaccine-induced joint manifestations. J Infect
Dis 177: 5-12, 1998.
Murch SH, Anthony A, Casson DH et al. Retraction of an interpretation. Lancet 363: 750, 2004.
Netterlid E, Bruze M, Hindsén M et al. Persistent itching nodules
after the fourth dose of diphtheria-tetanus toxoid vaccines without
evidence of delayed hypersensitivity to aluminium. Vaccine 22: 698706, 2004.
Netterlid E, Edwinson Månsson M, Håkansson A. Surveillance of
vaccine safety: comparison of parental reports with routine surveillance and clinical trial. Vaccine 27: 2042-7, 2009.
Nøkleby H. Neurological adverse events of immunization: experience
with an aluminium adjuvanted meningococcal B outer membrane
vesicle vaccine. Expert Rev Vaccines 6: 863-9, 2007.
Offit PA, Coffin SE. Communicating science to the public: MMR
vaccine and autism. Vaccine 22: 1-6, 2002.
Offit PA, Hackett CJ. Addressing parent’s concerns: do vaccines
cause allergic or autoimmune diseases? Pediatrics 111: 653-9, 2003.
Orbach H, Shoenfeld Y. Vaccination infection and autoimmunity:
myth and reality. Autoimmune Rev 6: 261-6, 2007.
Ottaviani G, Lavezzi AM, Matturri I. Sudden infant death syndrome
(SIDS) shortly after hexavalent vaccination: another pathology in
suspected SIDS? Virchows Arch. 448: 100-4, 2006.
Patja A, Davidkin I, Kurki T et al. Serious adverse events after
measles-mumps-rubella vaccination during a fourteen-year prospective follow-up. Pediatr Infect Dis J 19: 1127-34, 2000.
Patja A, Mäkinen-Kiljunen S, Davidkin I et al. Allergic reactions
to measles-mumps-rubella vaccination. Pediatrics 107, p.e. 27,
febbraio 2001.
Patja A, Mäkinen-Kiljunen S, Davidkin I et al. Allergic reactions to
measles-mumps-rubella vaccination. Pediatrics 107: E27.
Patja A, Paunio M, Kinnunen E et al. Risk of Guillain-Barré syndrome after measles-mumps-rubella vaccination. J Pediatr 138:
250-4, 2001a.
Patrizi A, Di Lernia V, Ricci G et al. Papular and papulo-vesicular
acrolocated eruptions and viral infections. Pediatr Dermatol 7: 22-6,
1990.
Pichichero ME, Cernichiari E, Lopreiato J, Treanor J. Mercury
concentrations and metabolism in infants receiving vaccines containing thiomersal: a descriptive study. Lancet 360: 1737-41, 2002.
Pittman PR, Coonan KM, Gibbs PH et al. Long-term health effects
of repeated exposure to multiple vaccines. Vaccine 23: 325-36, 2004.
Poland GA, Ovsyannikova IG, Jacobson RM. Adversomics: the
emergent field of vaccine adverse event immunogenetics. Pediatr
Infect Dis J 28: 431-2, 2009.
Pool V, Braun MM, Kelso JM et al. Prevalence of anti-gelatin IgE
antibodies in people with anaphylaxis after measles-mumps-rubella
vaccine in the United States. Pediatrics 110: e71, 2002.
Pourcirous M, Korones SB, Arheart KL, Bada HS. Primary immunization of premature infants with gestational age <35 weeks:
cardiorespiratory complications and C-reactive protein responses
BARTOLOZZI_09.indd 175
175
associated with administration of single and multiple separate vaccine simultaneously. J Pediatr 151: 167-72, 2007.
Price D, Jefferson T, De Micheli V. Methodological issues arising
from systematix reviews of the evidence of safety of vaccines. Vaccine 22: 2080-4, 2004.
Prymula R, Siegrist CA, Chlibek R et al. Effect of prophylactic
paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. Lancet 374: 1339-50, 2009.
Rajantie J, Zeller B, Treutiger I et al. Vaccination associated thrombocytopenic purpura in children. Vaccine 25: 1838-40, 2007.
Rantala J, Cherry JD, Shields WD et al. Epidemiology of GuillainBarré syndrome in children: relationship of oral polio vaccine administration to occorrence. J Pediatr 124: 220-3, 1994.
Rath B, Linder T, Cornblath D et al. “All that palsies is not Bell’s”.
The need to define Bell’s palsy as an adverse event following immunization. Vaccine 26: 1-14, 2007.
Rath B, Magnus M, Heininger U. Evaluating the Brighton Collaboration case definitions, aseptic meningitis, encephalitis, myelitis, and
acute disseminated encephalomyelitis. Vaccine 28: 3488-95, 2010.
Red Book 2009. XXVIII Report of the Committee on Infectious Diseases. American Academy of Pediatrics, 28a ed, Elk Grove Village,
IL, 2009, pp. 48-9.
Robertson WC. Carbamazepine toxicity after influenza vaccination.
Pediatr Neurol 26: 61-3, 2002.
Rosenthal S, Chen R. The reporting sensitivities of two passive surveillance systems for vaccine adverse events. Am J Public Health
85: 1706-9, 1995.
Rothstein E, Kohl KS, Ball L et al. Nodule at injection site as an
adverse event following immunization: case definition and guidelines for data collection, analysis and presentation. Vaccine 22: 57585, 2004.
Rüggeberg JU, Gold MS, Bayas J-M et al. Anaphylaxis: case definition and guidelines for data collection, analysis, and presentation
of immunization safety data. Vaccine 25: 5675-84, 2007.
Russell M, Pool V, Kelso JM, Tomazic-Jezic VJ. Vaccination of
persons allergic to latex: a review of safety data in the Vaccine
Adverse Event Reporting System (VAERS). Vaccine 23: 664-7, 2004.
Sakaguschi M, Nakayama T, Inouye S. Cases of systemic immediatetype urticaria associated with acellular diphtheria-tetanus-pertussis
vaccination. Vaccine 16: 1138-40, 1998.
Salmaso S. Studi ad hoc sulla frequenza di reazioni avverse. Corso
Metodi epidemiologici per la valutazione delle vaccinazioni. Roma,
Istituto Superiore di Sanità, 5-9 ottobre 1998.
Sanchez PJ, Lapttok AR, Fisher L et al. Apnea after immunization
of preterm infants. J Pediatr 130: 746-51, 1997.
Schattner A. Consequence or coincidence? The occurrence, pathogenesis and significance of autoimmune manifestations after viral
vaccines. Vaccine 23: 3876-86, 2005.
Schessl J, Luther B, Kirschmer J et al. Infections and vaccinations
preceding childhood Guillain-Barré syndrome: a prospective study.
Eur J Pediatr 165: 605-12, 2006.
Schmitt H-J, Siegrist C-A, Salmaso S et al. Reply to letter af B
Zinka et al. Vaccine 24: 5781-2, 2006.
Schonberger LB, Bregman DJ, Sullivan-Bolyai JZ et al. GuillainBarré syndrome following vaccination in the National Influenza
Immunization Program, United States 1976-1977. Am J Epidemiol
110: 105-23, 1979.
Seagroat V. MMR vaccine and Crohn’s disease: ecological study of
hospital admission in England, 1991 to 2002. BMJ 330: 1120-1, 2005.
Seitz CS, Bröcker E-B, Trautmann A. Vaccination-associated
anaphylaxis in adults: diagnostic testing ruling out IgE-mediated
vaccine allergy. Vaccine 27: 3885-9, 2009.
Sejvar JJ, Kohl KS, Bilynsky R et al. Encephalitis, myelitis, and
acute disseminated encephalomyelitis (ADEM): case definition and
guidelines for collection, analysis, and presentation of immunization
safety data. Vaccine 25: 5771-92, 2007.
Shohat T, Green MS, Nakar O et al. Gender differences in the
reactogenicity of measles-mumps-rubella vaccine. Isr Med Assoc J
2: 192-5, 2000.
Shlomovitz E, Davies W, Cairns E et al. Severe necrotizing pancreatitis following combined hepatitis A and B vaccination. CMAJ 176:
339-42, 2007.
Short JA, Walt JH, Zoanetti DC. Immunization and anesthesia – an
international survey. Pediatr Anaesthesia 16: 514-22, 2006.
Sicherer SH, Simons FE, Section on Allergy and Immunology.
14/05/12 09:51
176
9 - Effetti collaterali lievi e gravi, precauzioni e controindicazioni
Self-injectable epinephrine for first-aid management of anaphylaxis.
Pediatrics 119: 638-46, 2007.
Siebert JN, Posfay-Barbed KM, Habre W, Siegrist CA. Influence
of anesthesia on immune responses and its effect on vaccination in
children: review of evidence. Pediatr Anaesthesia 17: 410-20, 2007.
Simon PA, Chen RT, Elliott JA, Schwartz B. Outbreak of pyogenic
abscesses after diphteria and tetanus toxoids and pertussis vaccination. Pediatr Infect Dis 12: 368-71, 1993.
Singer S, Johnson CE, Mohr R, Holoweeky C. Urticaria following
varicella vaccine associated with gelatin allergy. Vaccine 17: 327-9,
1999.
Smeeth L, Rodrigues LC, Hall AJ et al. Evaluation of adverse effects
of vaccines: the case-control approach. Vaccine 20: 2611-7, 2002.
Smeeth L, Thomas SL, Hall AJ. Risk of myocardial infarction and
stroke after acute infection or vaccination. N Engl J Med 351: 26118, 2004.
Società Italiana di Allergologia e Immunologia. Aspetti medicolegali in immunologia: Memorandum. Giorn It Allergol Immunol
Clin 1: 99-114, 1991.
Sood SK, Daum RS. Diseases caused by Haemophilus influenzae type
b in the immediate period after homologous immunization: immunologic investigation. Pediatrics 85: 698-704, 1990.
Souayah N, Nasar A, Suri MFK, Qureshi AI. Guillain-Barré syndrome after vaccination in United States. A report from the CDC/
FDA Vaccine Adverse Event Reporting System. Vaccine 25: 5253-5,
2007.
Spier RE. Ethical aspect of the methods used to evaluate the safety of
vaccines. Vaccine 22: 285-90, 2004.
Stratton KR, Howe CJ, Johnston RB. Adverse events associated
with childhood vaccines: evidence bearing on causality. Washington, DC, National Academic Press, 1994.
Tapiainen T, Heininger U. Fever following immunization. Expert Rev
Vaccines 4: 419-27, 2005.
Tappin DM, Ford RPK, Nelson KP et al. The febrile stress of routine vaccination does not increase central apnea in normal infant.
Acta Paediatr 86: 873-80, 1997.
Tay YK. Gianotti-Crosti syndrome following immunization. Pediatr
Dermatol 18: 262, 2001.
Timitilli A, Caruso M, Bertoluzzo L et al. La vaccinazione in
ambiente protetto. Gaslini 3: 91-6, 2005.
Tozzi AE. Field evaluation of vaccine safety. Vaccine 22: 2091-5,
2004.
Tozzi AE, Bislacchi P, Tarantino V et al. Neuropsychological performance 10 years after immunization in infancy with thimerosalcontaining vaccines. Pediatrics 123: 475-82, 2009.
Tozzi AE, Celentano LP. Vaccinazioni e autoimmunità. Riv Immunol
Allergol Pediatr 18: 17-21, 2004.
Traversa G, Spila Alegiani S, Bianchi C et al. SIDS e vaccinazioni:
lo studio Hera. Epidemiologia per la sorveglianza: dal disegno alla
comunicazione. Istisan Convegno 06/C2. Roma, 15-16 maggio 2006.
Tuttle J, Chen RT, Rantala H et al. The risk of Guillain-Barré
syndrome after tetanus-toxoid-contaning vaccines in adults and
children in the United States. Am J Public Health 87: 2045-8, 1997.
van der Klauw MM, Wilson JH, Stricker BH. Drud associated
anaphylaxis: 20 years of reporting in The Nederlands (1974-1994)
and review of literature.Clin Exp Allergy 26: 1355-63, 1996.
van der Maas NAT, Vermeer-de Bondt PE, Kemmerer JM. Collapse
(Hypotonic Hyporesponsive Episode; HHE) following the first infant
vaccination: a case control study on risk factors and sequelae. 27°
ESPID, Bruxelles, 9-13 giugno 2009.
Varricchio F. Medication errors reported to the vaccine adverse event
reporting system (VAERS). Vaccine 20: 3049-51, 2002.
Varricchio F, Iskander J, Destefano F et al. Understanding vaccine
safety information from the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J 23: 287-94, 2004.
Velangi SS, Tidman MJ. Gianotti-Crosti syndrome after measlesmumps and rubella vaccination. Br J Dermatol 139: 1122-3, 1998.
BARTOLOZZI_09.indd 176
Vennemann MMT, Butterfass-Bahloul T, Jorch G et al. Sudden
infant death syndrome: no increased risk after immunization. Vaccine, 25: 336-40, 2007.
Vennemann MMT, Höffgen M, Bajanowski T et al. Do immunisation
reduce the risk for SIDS? A meta-analysis. Vaccine 25: 4875-9,
2007.
Vermeer-de Bondt PE, Džaferagi A, David S, van der Maas NAT.
Performance of the Brighton Collaboration case definition for hypotonic-hyporesponsive epidose (HHE) on reported collapse reaction
following infant vaccinations in the Netherlands. Vaccine 24: 706670, 2006.
Vermeer-de Bondt PE, Labadie J, Rümke HC. Rate of recurrent
collapse after vaccination with whole cell pertussis vaccine: follow
up study. Br Med J 316: 902-3, 1998.
Vlaka V, Forma EN, Miron D, Peter G. Recurrent thrombocytopenic
purpura after repeated measles-mumps-rubella vaccination. Pediatrics 97: 738-9, 1997.
Wakefield AJ, Murch SH, Anthony A et al. Ileal-lymphoid-nodular
hyperplasia, non-specific colitis and pervasive developmental disorder in children. Lancet 351: 737-41, 1998.
Walker AM, Jick H, Perera DR et al. Diphteria-tetanus-pertussis
immunization and sudden infant death syndrome. Am J Publ Health
77: 945-51, 1987.
Weibel RE, Caserta V, Benor DE, Evans G. Acute encephalophaty
followed by permanent brain injury or death associated with further
attenuated measles vaccines: a review of claims submitted to the
National Vaccine Injury Compensation Program. Pediatrics 101:
383-7, 1998.
Waibel KH. Anaphylaxis. Pediatr Rev 29: 255-63, 2008.
WHO. Immunization safety surveillance. EPI 99/01.
WHO. Working to ensure global quality, safety and standards in immunization. WHO/IVB/07.03.
WHO. Global status of immunization safety: a report based on the
WHO/UNICEF Joint Reporting Form, 2003 update. WER 80: 1427, 2005.
WHO. Global Advisory Committee on Vaccine Safety. 6-7 giugno
2006. WER 81: 273-84, 2006.
Wise RP, Kiminyo KP, Salive ME. Hair loss after routine immunizations. JAMA 278: 1176-8, 1997.
Wise RP, Bonhoeffer J, Beeler J et al. Thrombocytopenia: case
definition and guidelines for collection, analysis and presentation of
immunization safety data. Vaccine 25: 5717-24, 2007.
Woo EJ, Burwen DR, Gatumu SNM et al. Extensive limb swelling
after immunization: reports to the Vaccine Adverse Event Reporting
System. Clin Infect Dis 37: 351-8, 2003.
Wraith DC, Goldman M, Lambert PH. Vaccination and autoimmune disease: what is the evidence? Lancet 362: 1659-66, 2003.
Zanoni G, Nguyen TMD, Valsecchi M et al. Prevention and monitoring of adverse events following immunization: the “Green Channel” of the Veneto region in Italy. Vaccine 22: 194-201, 2003.
Zanoni G, Ferro A, Valsecchi M, Tridente G. The “Green Channel” of the Veneto region as a model for vaccine safety monitoring
in Italy. Vaccine 23: 2354-8, 2005.
Zanoni G, Berra P, Lucchi I et al. Vaccine adverse event monitoring
system across the European Union countries: time for unifying efforts. Vaccine 27: 3376-84, 2009.
Zanoni G, Micheletti F, Lucchi I et al. Un canale dedicato alla
prevenzione e sorveglianza degli eventi avversi a vaccini. RIAP 23:
30-6, 2009a.
Zent O, Arras-Reiter C, Broeker M, Henning R. Immediate allergic reactions after vaccinations. A post-marketing surveillance review. Eur J Pediatr 161: 21-5, 2002.
Zepp F. Infanrix combination: a safety update. 23° ESPID, Valencia,
18-20 maggio 2005.
Zinderman CE, Landow L, Wise RP. Anaphylactoid reactions to
Dextran 40 and 70: report to the United States Food and Drug
Administration, 1969 to 2004. J Vasc Surg 43: 1004-9, 2006.
14/05/12 09:51