GENETICA BATTERICA
Differenze tra procarioti e eucarioti
Caratteristiche
Procarioti
Eucarioti
Dimensioni
Organizzazione genetica
Nucleo circondato da membrana
DNA complessato agli istoni
Numero di cromosomi
DNA extracromosomiale
Geni
Divisione per mitosi
Citoplasma
Reticolo endoplasmico
Apparato del Golgi
Mitocondri
Lisosomi
Ribosomi
Membrana citoplasmatica
Parete cellulare
0,3-2μm
> 5μm
Assente
Assente
Uno
Plasmidi
Contigui o riuniti in operoni
Assente
Presente
Presente
Più di uno
Mitocondriale
Discontinui
Presente
Assente
Assente
Assenti
Assenti
70 S
Assenza di steroli
Formata
da peptidoglicano
Presente
Presente
Presenti
Presenti
80 S
Presenza di steroli
Se presente,
formata da
polisaccaridi
Vantaggi dello studio dei batteri
nell’analisi genetica
• facile e rapida coltivazione poco
dispendioso e
possibilità
di
seguire parecchie generazioni
• genomi hanno dimensioni ridotte rispetto a organismi superiori, ma è
possibile trarre informazioni preziose, anche su organismi superiori
• molto più facile ottenere trasformanti, mutanti, inattivazione di funzioni,
trasformazioni stabili
• i batteri in particolare, essendo aploidi, permettono di correlare più
direttamente il genotipo con il fenotipo
FACILE E RAPIDA COLTIVAZIONE
Contenitori per la crescita di batteri in terreno liquido (beuta e provetta) e in
terreno solido (piastra Petri). Nel primo caso la crescita dei batteri si evidenzia
come un intorbidimento del terreno di crescita trasparente, nel secondo si
osservano colonie di batteri sulla superficie del terreno solido
CURVA DI CRESCITA BATTERICA
trasmittanza (T): rapporto tra l’intensità della
luce in uscita ed intensità della luce incidente
Assorbanza (A)
Una cellula batterica che si
divide ogni 30 minuti dopo 15
ore darà origine ad un miliardo
di batteri che formano una
colonia o clone Ogni colonia è
un clone di batteri che deriva da
una singola cellula.
• I batteri auxotrofi sono mutanti che
hanno perduto la capacità di sintetizzare
metaboliti (aminoacidi, basi azotate o
vitamine), che quindi richiedono nel
mezzo di coltura
• Sono anche chiamati mutanti nutrizionali
o biochimici
Selezione di mutanti nutrizionali
attraverso l’utilizzo di terreni
selettivi
“replica plating” ideato nel 1952 dai coniugi Lederberg
Il trasferimento dei cloni che crescono in
terreno massimo al terreno minimo
mantenendo la loro distribuzione uguale a
quella che essi hanno nella piastra madre,
mostra che un clone della piastra madre è
un mutante auxotrofo
Dal momento che il mutante cresce solo in presenza
di leucina, è auxotrofo per la sintesi di leucina (leu-)
CELLULA BATTERICA
Strutture fondamentali
Strutture accessorie
•Parete
•Pili
•Membrana
•Flagelli
•Capsula
Strutture esterne:
Dall’esterno verso l’interno si possono trovare:
Capsula
Strato di polisaccaridi protettivo spesso associato con
la patogenicità perché serve come una barriera contro
la fagocitosi da parte dei leucociti.
Membrana
esterna
Doppio strato lipidico presente solo nei Gram-
Parete
cellulare
Formata da peptidoglicano (polisaccaridi + peptidi),
mantiene complessivamente la forma
Membrana
plasmatica
Doppio strato lipidico con diverse proteine responsabili
del trasporto di ioni, nutrienti
PARETE BATTERICA
Organizzazione diversa della parete nei
• Gram positivi
• Gram negativi
Colorazione di Gram
• Colorazione più importante e usata in batteriologia.
• Prende il nome dal patologo danese che la mise a punto.
• Permette di distinguere i batteri in Gram+ e Gram-.
• Colorazione differenziale.
• Utilizzando differenti coloranti in tempi successivi,
individua differenze strutturali della cellula batterica.
• Le differenze strutturali riguardano la parete cellulare.
• I batteri Gram+ si colorano in viola.
• I batteri Gram- si colorano in rosso.
GRAM POSITIVI: provvisti di un
rivestimento polisaccaridico (parete
cellulare a più strati di peptidoglicano)
che permette al batterio durante la
colorazione di GRAM di assumere un
colore blu/violetto
GRAM NEGATIVI: sono batteri che
hanno una parete cellulare formata da
due strati (una membrana lipidica
esterna e uno strato peptidoglicano
interno) e durante la colorazione di
GRAM assumono un colore rosso
COMPOSIZIONE PARETE GRAM +
Quasi la totalità della parete (90-95%) è costituita da mureina
(o peptidoglicano) la quale è responsabile della rigidità della
parete e del trattenimento del colorante di Gram.
I componenti principali del peptidoglicano sono
1. Scheletro glicanico costituito da
Acido N-acetilmuramico NAM
Acido N-acetilglucosammina NAG
Catene laterali peptidiche
D- L- aminoacidi
Acido diaminopimelico
3. Legami crociati peptidici
Il monomero del Peptidoglicano
NAM= N-Acetil muramico
NAG= N-Acetil glucosoammina,
Sono degli AMMINOZUCCHERI
Alle catene glicaniche è legato il tetrapeptide, catena costituita da 4 aminoacidi.
Queste catene sono legate al gruppo COOH dell’acido muramico tramite legame
peptidico. Le catene tetrapeptidiche sono essenziali per la formazione dei
legami crociati: ogni catena glicanica è legata ad altre catene glicaniche parallele,
tramite legami che si formano tra i tetrapeptidi.
Struttura del peptidoglicano
Legami crociati nei Gram-
Nei batteri Gram- la quantità di legami crociati è
molto minore rispetto a quella dei Gram+
Legami crociati nei Gram+
Nei batteri Gram+ le catene peptidiche non
formano legami diretti fra loro, ma sono unite
tramite un ponte di pentaglicina
Transpeptidazione
L’enzima responsabile della formazione del legame crociato è la transpeptidasi.
Gli antibiotici -lattamici (come la penicillina) funzionano da inibitori irreversibili
delle transpeptidasi batteriche.
Azione di penicilline e
cefalosporine
Acetil-D-Ala-D-Ala-OH
penicilline
cefalosporine
L’azione degli antibiotici avviene per la somiglianza con il substrato.
• Il substrato specifico della transpeptidasi è il frammento D-Ala-D-Ala delle
catene peptidiche del peptidoglicano in crescita.
•Un inibitore della transpeptidasi deve somigliare al frammento D-Ala-D-Ala
Funzioni della parete batterica
SOLLECITAZIONI
MECCANICHE
1. PROTEZIONE
RIGONFIAMENTO
OSMOTICO
2. FORMA
3. PROCESSO DI DIVISIONE
Un’altra funzione della parete è quella
di dare la forma
La suddivisione dei batteri può essere fatta in base alla loro forma.
La forma dei batteri è una condizione
•Fissa
•Geneticamente determinata
COCCHI: con forma tondeggiante
Stafilococchi: a grappolo
Streptococchi: lineare
BACILLI :forma a bastoncino
SPIRILLI :forma a spirale o a virgola
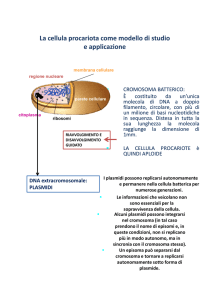
GENOMA BATTERICO
Il genoma batterico (o nucleoìde) consta di due componenti:
-Cromosoma (contiene i geni “housekeeping”, essenziali per la
sopravvivenza)
- Elementi extracromosomici “mobili” (MGEs)
(contiene geni non essenziali ma accessori, responsabili del
trasferimento genetico orizzontale o verticale)
• Il cromosoma dei batteri è
presente in singola copia ed è
unico
• Generalmente
super-spiralizzato
circolare,
• Mancano gli istoni
• Le dimensioni del cromosoma
sono variabili: 0.2-9 Mb
• Le dimensioni del cromosoma
sono proporzionali al livello di
interazione del microrganismo
con l ’ ambiente (intracellulari
obbligati 480 kbp; ambientali
6.3 Mbp)
• Frequente raggruppamento di
geni codificanti per funzioni
correlate organizzazione in
operoni
REPLICAZIONE BIDIREZIONALE DEL
CROMOSOMA BATTERICO
Il processo di duplicazione ha inizio da un punto di origine posto sulla
membrana citoplasmatica e termina dal lato opposto
Nei batteri l’informazione genetica, oltre a trovarsi
nel cromosoma, può essere presente su
“cromosomi” accessori, molecole di DNA circolare a
doppio filamento di dimensioni minori rispetto a
quelle del DNA genomico
ELEMENTI EXTRACROMOSOMICI NATURALI
PLASMIDI
EPISOMI
PLASMIDI
• Elementi genetici accessori: materiale genetico
extra-cromosomico
• DNA a doppia elica, forma circolare
• Dimensioni: da meno di 5 kb a centinaia di Kb
• Possono essere presenti in centinaia di copie
• Capaci di replicazione indipendente
FUNZIONI CONFERITE AI MICRORGANISMI
DAI PLASMIDI
Non sono indispensabili, ma conferiscono alla cellula batterica ospite
importanti vantaggi selettivi:
Produzione batteriocine
Utilizzazione fonti energetiche insolite
Antibiotico resistenza (fattore R)
Resistenza ai metalli pesanti
Induzione di tumori nelle piante
Agenti di virulenza: tossine o molecole responsabili della
virulenza
ELEMENTI TRASPONIBILI NEI
PROCARIOTI
SEQUENZE DI INSERZIONE (IS)
• Segmenti di DNA batterico che si possono muovere da una
posizione ad un ’ altra dello stesso cromosoma o di un altro
cromosoma
• Sono unità autonome e codificano solo per le proteine necessarie
alla propria trasposizione (trasposasi)
• Tutti gli elementi IS iniziano e finiscono con brevi sequenze a
ripetizione invertita (IR)
Struttura delle IS
Sequenza a ripetizione invertita
Sequenza a ripetizione invertita
Distribuzione degli elementi IS in un fattore F
• Essendo
regioni
con
sequenza
identica, gli IS sono potenziali siti di
crossing over (per esempio è alla base
dell ’ integrazione del fattore F nel
cromosoma a formare i ceppi Hfr)
Griffiths et al., GENETICA 6/E, Zanichelli Editore S.p.A. Copyright © 2006
I TRASPOSONI
Nei batteri esistono due tipi di trasposoni:
1.I trasposoni composti
Due elementi IS (con orientamento diverso) posti ai lati di un gene a
formare la sequenza a ripetizione invertita (IR).
La trasposasi codificata da uno dei due elementi IS è necessaria per
catalizzare il movimento dell’intero trasposone.
2. I trasposoni semplici
Affiancati da sequenze IR brevi (meno di 50 bp) che non codificano per
l’enzima trasposasi. I trasposoni semplici stessi codificano la loro
trasposasi, oltre a portare i geni batterici
I TRASPOSONI SONO PIÙ LUNGHI DEGLI ELEMENTI IS E
CONTENGONO ULTERIORI GENI CODIFICANTI PER PROTEINE
Sequenza d’inserzione
IR
IR
Trasposasi
Trasposoni composti
IR
IR
altri geni
IR
IR
Trasposasi
sequenza IS
sequenza IS
Trasposoni semplici
IR
altri geni
Trasposasi
IR
trasposone
lunghezza
(bp)
Tn3
Tn501
Tn951
Tn5
Tn9
Tn10
Tn1681
4957
8200
16500
5700
2500
9300
2061
modulo
terminale
IS50
IS1
IS10
IS1
marcatori genetici
Amp
Hg
Utilizzazione lattosio
Kc
Cm
Tet
Enterotossina stabile
al calore
I trasposoni furono inizialmente scoperti come elementi genetici
mobili che conferiscono resistenza ai farmaci
L’odissea evolutiva del gene ampC di Klebsiella
Sotto l’uso massiccio di antibiotici è stato selezionato il gene ampC che
aveva acquisito due sequenze IS con il risultato di essere maggiormente
trascritto conferendo un livello di resistenza clinicamente significativo
promotore
forte
ampC
IS
IS
Il risultante trasposone è stato capace di muovere ampC in un
plasmide coniugativo, oggi diffuso a molti ceppi di Klebsiella
Quello che un tempo era un gene di resistenza clinicamente irrilevante è
diventato il terrore degli ospedali – tutto grazie alle IS
Episomi
• Elementi genetici accessori: materiale genetico
extracromosomico
•
•
•
•
Capaci di replicazione indipendente
Dimensioni: circa 105 bp
Possono essere presenti in una o poche copie nel batterio
Non sono indispensabili, ma possono conferire alla cellula
batterica ospite importanti vantaggi selettivi
• Mentre i plasmidi sono solo elementi citoplasmatici gli
episomi possono trovarsi nel citoplasma oppure
integrati nel DNA
Caratteristiche di plasmidi ed episomi.
Minicromosoma
Dimensioni
(kb)
Numero
di geni
Numero
copie/cel
lula
Plasmide
3-5
<10
Fino
100
Episoma
~30
<30
1-2
Integrazione nel Geni specifici
DNA genomico
a No
Sì
Trasferimento geni!!!!!
Resistenza:
antibiotici,
metalli
pesanti;
Sintesi:
antibiotici, colicine,
enterotossine, ecc.
Integrazione,
trasferimento DNA,
coniugazione
Riproduzione dei batteri
I batteri si riproducono per “ schizogonia ”
o divisione
semplice: una cellula madre cioè si divide e forma due cellule
figlie perfettamente uguali tra loro, perché ciò possa avvenire
è necessario che il patrimonio genetico venga egualmente
ripartito, il DNA pertanto deve potersi duplicare. Questo
processo assicura la corretta ripartizione del corredo genetico
tra le cellule figlie.
Fasi della riproduzione batterica
Duplicazione del cromosoma batterico:
Il materiale cromosomico, ancorato alla membrana
citoplasmatica, si duplica generando due nuovi cromosomi
ancorati ciascuno separatamente alla membrana
Accrescimento delle membrane:
Si verifica l’accrescimento delle membrane batteriche ed il
conseguente allungamento della cellula, partendo dalla
zona di membrana che separa le due strutture
cromosomiche
Allontanamento delle strutture cromosomiche:
Continuando l’accrescimento della cellula, le due strutture
cromosomiche si distanziano sempre di più l’una dall’altra
Separazione delle cellule figlie:
La separazione è causata dalla formazione di un setto che
parte dalla membrana e si approfonda nel citoplasma in
direzione centripeta
Distacco delle cellule:
All’interno del setto di membrana si forma un setto di
parete permettendo il definitivo distacco delle cellule
Batteri: riproduzione asessuata mediante scissione binaria,
che è preceduta dalla duplicazione del DNA
la conseguenza più evidente di una riproduzione asessuata
consiste nell'uniformità della popolazione tutte le cellule
risultano uguali fra di loro e uguali alla cellula madre
in una popolazione batterica non dovremmo aspettarci nessuna
variazione genetica di generazione in generazione. In realtà
anche nei batteri esistono fenomeni di variabilità
genetica
La
variabilità
sopravvivenza
genetica
alla
consente
popolazione
una
maggiore
batterica.
Consiste in una modificazione del DNA e può avvenire per:
• Mutazione:
Variazione ereditabile della sequenza di basi dell ’ acido
nucleico che costituisce il genoma dell’organismo
• Ricombinazione genetica:
Processo attraverso il quale elementi genetici, presenti in due
genomi diversi, vengono a trovarsi in un ’ unica unità
genetica.
Esperimento di Lederberg & Tatum
(1946)
A. E. coli met- bio- thr+ leu+
x
B. E. coli met+ bio+ thr- leu-
10-7 met+ bio+ thr+ leu+
“exconiuganti” o “ricombinanti”
Dimostrazione di Lederberg
e Tatum della ricombinazione
genetica
tra
cellule
batteriche
A e B non sono in grado di
crescere su terreno minimo
(MM)
perché
contengono
mutazioni che determinano
l’incapacità di sintetizzare le
sostanze necessarie per la
crescita
• Questo risultato suggeriva che doveva essere avvenuta una
qualche forma di ricombinazione tra i genomi dei due diversi
ceppi
• Si poteva supporre che le cellule dei due ceppi non si scambiavano
geni ma diffondevano sostanze utilizzabili dalle altre cellule.
• Questa ipotesi fu scartata dagli studi di Davis col TUBO ad U
Il contatto fisico tra cellule è
necessario affinché avvenga la
ricombinazione.
Le cellule non possono passare
attraverso il filtro e quindi non
avviene la ricombinazione
Pierce, GENETICA, Zanichelli editore
S.p.A. Copyright © 2005
Trasferimento di materiale
genetico nei batteri
• Il trasferimento del materiale genetico è univoco: da
donatore a ricevente.
• I batteri riceventi possono acquisire informazioni genetiche
dal DNA donatore che gli permettono di ricevere nuovi
caratteri.
Tre meccanismi di
trasferimento di DNA batterico
• Trasformazione : Trasferimento di materiale genetico
mediante l’incorporazione di una molecola di DNA
extracellulare libero
• Coniugazione : due cellule batteriche entrano in contatto
tramite una struttura detta sex pilus che permette il
trasferimento di materiale genetico (plasmidi)
• Trasduzione (conversione fagica): il trasferimento genetico è
mediato da batteriofagi, virus capaci di infettare i batteri. Può
essere ristretta o generalizzata
CONIUGAZIONE
• Trasferimento di materiale genetico tra due cellule
batteriche mediante contatto diretto.
• Il trasferimento è mediato da una struttura cellulare
batterica chiamata pilo, la quale forma un ponte (o
tunnel) tra la cellula donatrice e la cellula ricevente
• In (a) il pilo tiene unite le due cellule batteriche
• In (b) tra le due cellule si forma un ponte-poro. Nella cellula donatrice
viene prodotta una copia a filamento singolo del DNA plasmidico che
passa nel ricevente dove funge da stampo per la costruzione di una
doppia elica
IL FATTORE F
La capacità da parte dei batteri di formare un pilo, e quindi di donare il
materiale genetico, è conferita dalla presenza nella cellula di un plasmide
definito fattore F (F indica fertilità).
Il fattore F porta i geni necessari alla sintesi del pilo (oltre ai geni necessari
per la sua replicazione durante la coniugazione).
Batteri provvisti del fattore F vengono definiti F+ e sono ceppi «donatori»
Batteri sprovvisti del fattore F vengono definiti F- e sono ceppi «riceventi»
Batteri F-, ricevendo durante la coniugazione il fattore F, diventano F+,
ossia diventano loro stessi in grado di «donare» il plasmide ricevuto
13 geni
- pilo F
Duplicazione «rolling circle» di DNA plasmidico
1. PLASMIDE CIRCOLARE
2. ROTTURA DI UNA
3. SPIAZZAMENTO DI CATENA
CATENA
4. SINTESI DI DNA
5. TERMINE REPLICAZIONE, LIGAZIONE
1. F+ (donatore) contenente un plasmide F+ codificante per il pilo sessuale. I pili si
legano alla cellula F- interagendo con una proteina di membrana presente sulla
superficie della cellula F- definita OmpA
2. Formazione “coppia coniugativa”. Nucleasi/elicasi causa rottura in oriT di una
catena del plasmide F+.
3. Retrazione del pilo sessuale e formazione di un ponte intercellulare. Una catena
del plasmide F+ entra in F-.
4. Sintesi della catena complementare di F+ in entrambi i batteri, adesso in
grado di produrre il pilo sessuale.
Nella coniugazione F+ x F- non si assiste a trasferimento di DNA cromosomico
Il fattore F è un EPISOMA
Può integrarsi nel cromosoma batterico tramite
ricombinazione (resa possibile da sequenze IS
nel DNA batterico e plasmidico).
Il DNA F integrato si replica con il cromosoma
batterico
La ricombinazione sitospecifica per crossing –over
tra un elemento IS del
fattore F e il cromosoma
batterico dà origine ad un
ceppo Hfr (high frequency
recombination).
LUCA CAVALLI SFORZA SCOPRÌ UN DERIVATO DI UN
CEPPO F+ CON 2 SINGOLARI PROPRIETÀ
1. Incrociando con ceppi F- questo ceppo produceva
ricombinanti pari a 1000 volte i ricombinanti prodotti da un
normale F+ e per questo lo chiamò Hfr
2. Negli incroci Hfr X F- nessuno dei genitori F- era convertito in
F+ o in Hfr
I
ceppi
Hfr
recombination)
(high
frequency
derivano
dall ’ integrazione del plasmide F nel
cromosoma.
Coniugazione: Hfr x F1. Formazione Hfr: inserzione di un plasmide F+ nel nucleoide del batterio donatore.
2. Formazione “coppia coniugativa”. Rottura monocatenaria del DNA a livello del
plasmide F+ integrato.
3. Retrazione pilo sex e formazione ponte intercellulare. Ingresso del DNA
monocatenario nel batterio accettore. Interruzione spontanea della coniugazione: solo
una parte del DNA donatore verrà trasferita all’accettore.
4. Il donatore sintetizza una copia complementare del DNA rimanendo Hfr. L’accettore
sintetizza una catena complementare del DNA trasferito.
Pierce, GENETICA, Zanichelli editore S.p.A.
Copyright © 2005
CONIUGAZIONE BATTERICA E RICOMBINAZIONE
• Negli Hfr in coniugazione il trasferimento del DNA a singolo filamento inizia da
un punto fisso del cromosoma detto origine (O) e prosegue in modo lineare
• Il punto O è il sito nel quale è inserito il plasmide F
• Quanto più è lontano un gene dall’origine, tanto più tardi sarà trasferito nella
cellula F• La rarità degli exconiuganti convertiti in Hfr suggerisce che il plasmide F
inserito sia trasferito al ricevente come ultimo elemento del
cromosoma lineare
CONIUGAZIONE INTERROTTA
• Vengono incrociati due ceppi batterici:
Hfr (lac+ e gal+ ma str-) x F- (lac- e gal- ma str+)
azir tonr lac+ gal+ strs x azis tons lac- gal- strr
Hfr
• Ad
intervalli
Fdi
tempi
diversi
viene
presa
un’aliquota della coltura batterica e posta in un
agitatore per indurre un ’ interruzione della
coniugazione.
• Dopo agitazione l ’ aliquota di batteri viene
piastrata su terreno contenente streptomicina e
su diversi terreni per saggiare la presenza di alleli
marcatori del donatore nell’exconiugante.
TONr (resistente al fago T1), AZIr (resistente alla sodio azide), STRs (sensibile
alla streptomicina)
Il fattore di fertilità F si inserisce in punti e con orientamenti variabili da
un ceppo Hfr di E.coli ad un altro. Tutti i ceppi hanno lo stesso ordine di
geni sul cromosoma. L’orientamento del fattore F determina quali geni
entrano per primi nella cellula ricevente. I geni più vicini alla parte
terminale entrano per ultimi.
La sovrapposizione delle mappe di coniugazione di diversi ceppi Hfr di un
tipo batterico ci permette di ricostruire le mappe geniche del tipo
batterico in esame. Inoltre, ha permesso di dedurre il cromosoma
batterico essere circolare
Ogni linea può essere considerata una mappa che mostra l’ordine degli
alleli sul cromosoma.
MAPPE DI ASSOCIAZIONE
La mappatura basata sul tempo di ingresso non si basa sulla frequenza di
ricombinazione e le unità di mappa sono minuti, non RF
Tuttavia,
anche
nei
batteri
è
possibile
usare
la
frequenza
di
ricombinazione per ottenere mappature di maggior dettaglio
La ricombinazione nei batteri non coinvolge due interi genomi ma
avviene tra un genoma completo proveniente da F-, l’endogenote, e da
uno incompleto derivante dal donatore Hfr detto esogenote
SCHEMA SINTETICO DELLA CONIUGAZIONE
Accade a volte che un fattore F fuoriesca dal
cromosoma tramite un crossing over tra le regioni
omologhe ai lati del plasmide
In alcuni casi, però, il plasmide porta via con sé una
parte del cromosoma batterico.
Un plasmide F che porta del DNA del genoma
batterico è detto plasmide F’ (F primo)
Ceppi di questo tipo, nell’esempio in figura, diventano F+ lac+ ed è chiamato F’
lac
Caratteristiche delle cellule di E. Coli
contenenti diversi tipi di fattore F
Tipo cellulare
Ruolo nella coniugazione
Fattore F
F+
Donatore
F-
Ricevente
Presente
(DNA circolare)
Assente
Hfr
Donatore ad alta
frequenza
Donatore
F’
Presente integrato
Presente
(DNA circolare con
geni batterici)
Risultati della coniugazione
Tipi cellulare
Dopo la coniugazione
F+ x F-
Due cellule F+
F- x Hfr
Una cellula Hfr ed una F-
F’ x F-
(se viene trasferito l’intero
cromosoma, evento molto raro, la
cellula F- diventa F+)
Due cellule F’
(la cellula F- diventa F’)
Il ceppo Hfr di E.coli mostrato qui sotto è stato usato come donatore
per la coniugazione con un triplo mutante (tri- pur- leu-). Se la
coniugazione viene interrotto dopo 30 minuti quale sarà il fenotipo
più frequente dell’ ex-coniugante?
20
10
tri
leu
20
20
pur
a. Prototrofo
b. Auxotrofico per tri, pur e leu
c. Auxotrofico per pur e tri
d. Auxotrofico solo per leu
e. Auxotrofico solo per pur
Primi esperimenti sulla trasformazione hanno riguardato il
trasferimento del carattere “ produzione della capsula ” da
ceppi di Streptococcus pneumoniae capsulati e quindi dotati
di virulenza a ceppi privi di capsula e perciò non patogeni.
GRIFFITH, 1928
Non può essere spiegato da
una mutazione
“Principio trasformante”
Che veniva trasferito alla
progenie
Avery, McCarty e McLeod (1944) identificarono
nel DNA la «sostanza trasformante»
TRASFORMAZIONE
Assunzione
di
frammenti
di
DNA
solubile
dall’ambiente
circostante da parte di cellule batteriche “competenti” (Bacillus,
Haemophilus, Neisseria, Pneumococcus).
Influenzato da:
• Dimensioni DNA
• Sensibilità DNA a nucleasi
• “Competenza” della cellula “accettrice”
naturale o indotta artificialmente
COMPETENZA
La cellula ricevente, per poter essere trasformata, deve trovarsi in una
particolare condizione che prende il nome di competenza
Il raggiungimento di un livello soglia nella densità cellulare attiva la sintesi
ed il rilascio di un “fattore di competenza” (Gram+) che, agendo a livello di
membrana, induce:
•modificazioni di parete cellulare (autolisina)
•sintesi/attivazione di proteine (DNA-binding, nucleasi, sistema RecA)
La competenza può essere:
• naturale (Bacillus, Streptococcus, Neisseria, Haemophilus)
• indotta artificialmente (P. aeruginosa, E. coli, S. typhimurium), mediante
trattamento “a freddo” con CaCl2 (bassa efficienza, utilizzato di routine nel
clonaggio di DNA in E. coli ) oppure elettroporazione.
FASI DEL PROCESSO DI TRASFORMAZIONE
Cellula batterica lisata rilascia frammenti
di DNA; il DNA conserva potenzialità di
guida a sintesi proteica
Frammenti
superficie
liberi
della
si
adsorbono
cellula
ricevente
attraversano la membrana cellulare
alla
e
ComEA, EC, FA e G sono proteine della competenza
I frammenti di DNA vengono incorporati nel cromosoma della cellula
ricevente; la proteina RecA promuove la ricombinazione omologa tra il
DNA ss donatore e quello recipiente
Mappe di associazione con la
Trasformazione
Pierce, GENETICA, Zanichelli editore
S.p.A. Copyright © 2005
TRASDUZIONE
• Trasferimento di materiale genetico tra due cellule batteriche
mediante batteriofagi (virus batterici)
Esistono due tipi di trasduzione
1.
Trasduzione
(teoricamente)
generalizzata:
qualsiasi
gene
può
essere trasferito
2.
Trasduzione specializzata: solo specifci
geni possono essere trasferiti
Griffiths et al., GENETICA 6/E, Zanichelli Editore S.p.A. Copyright
© 2006
Batteriofago T4 infetta E.coli
Batteriofagi litici (ciclo litico)
Batteriofagi temperati (ciclo lisogeno)
Trasduzione generalizzata
Il batteriofago riconosce e
Inocula
adsorbe alla cellula batterica
cellula batterica
il
genoma
nella
1. Il genoma batterico si frammenta e quello
del batteriofago si replica
2. Vengono assemblati nuovi batteriofagi
3. Frammenti del genoma batterico possono
essere assemblati nei nuovi batteriofagi
1. I batteriofagi neoformati vengono
2. I fagi con i frammenti del DNA del primo
liberati (lisi batterio)
batterio (donatore) adsorbono ad un altro
3. Il fago inocula il frammento di DNA del
4.
batterio donatore nel batterio ricevente
donatore si integra stabilmente nel genoma
batterio (ricevente)
Il
frammento
del batterio ricevente
di
DNA
del
batterio
Trasduzione generalizzata può essere usata per
ottenere informazioni sull’associazione genica
Geni
sufficientemente
vicini da essere
trasdotti in un
singolo frammenti
Pierce, GENETICA, Zanichelli editore
S.p.A. Copyright © 2005
Trasduzione ristretta (fagi temperati)
Il
batteriofago
inocula
il
Il genoma del batteriofago si integra nel
genoma nella cellula batterica
genoma della cellula batterica (profago)
Quando il genoma fagico si excide può
Il nuovo frammento fagico replica e si
incorporare
formano
batterico
un
frammento
del
DNA
batteriofagi
porzione di DNA batterico
veicolanti
la
Il batteriofago inocula il genoma veicolante
Il
la porzione di DNA batterico donatore in un
stabilmente nel genoma dell ’
altro batterio (ricevente)
veicola un tratto del genoma del batterio
genoma
donatore
del
fago,
integrandosi
ospite,
La trasduzione ristretta richiede una
ricombinazione sito-specifica
L’ integrasi di (Int) catalizza la
ricombinazione tra due siti specifici,
noti come siti di attacco, o att. Il
attP
sito attP si trova sul DNA fagico ed
il
sito
attB
sul
cromosoma
batterico
attB
attL
Griffiths et al., GENETICA 6/E, Zanichelli Editore S.p.A. Copyright © 2006
attR
Meccanismo
della
trasduzione
specializzata.
Un crossing
over nello
specifico sito di
attacco di λ
produce un
batterio
lisogenico
Il batterio
lisogenico può
produrre un
normale λ o
raramente un λ
dgal una
particella di
trasduzione
contenente il
gene gal
Fagi che portano i geni batterici localizzati sulla parte destra del profago,
mancheranno dei geni richiesti per le funzioni lisogene (es.. Il gene int) che sono
localizzati nella porzione sinistra del profago.
Fagi difettivi
Necessitano di
fago helper
BATTERIOFAGI POSSONO ESSERE USATI
NELL’ANALISI GENETICA
Si possono incrociare due
fenotipi fagici diversi per
misurare la ricombinazione
e quindi mappare il
genoma virale
Un singolo fago attraverso
infezioni
ripetute
e
produzione
di
progenie,
produce una placca (area
trasparente) su un tappeto
opaco di cellule batteriche
Morfologia della placca e specificità ospite sono alcuni utili
marcatori genetici
Fago T2 r-: provoca la lisi delle cellule rapidamente, producendo placche
grandi
Fago T2 r+: provoca lisi lenta, con placche piccole
Carattere r controlla la morfologia della placca
Fago T2 h-: può infettare 2 ceppi diversi di E.coli, ceppo 1 e 2 (placche
chiare)
Fago T2 h+: può infettare solo 1 (in una cultura mista placche torbide,
perche’ cellule del ceppo resistente continuano a crescere nella placca)
Carattere h controlla la specificità dell’ospite
Mappatura del cromosoma fagico mediante incroci
Incroci tra fagi. Infezione mista
Parentali h-r+ x h+rLa frequenza dei ricombinanti fra questi due caratteri indica la distanza di
mappa esistente tra i geni che conferiscono il carattere r ed h
Ricombinanti (h+r+)+ (h-r-) / numero totale delle placche
Doppia infezione
di una cellula di
E.Coli
Griffiths et al., GENETICA 6/E, Zanichelli
Editore S.p.A. Copyright © 2006
ESPERIMENTI DI BENZER PER LA MAPPATURA
INTRAGENICA
• I mutanti del locus rII del fago T4
sono in grado di crescere sul
ceppo B di E.coli (cosi come i wilde
type)
• I mutanti rII non crescono sul
ceppo K12 di E.coli
• Il fenotipo del mutante rII produce
placche grandi con margini definiti
mentre i wilde-type generano
placche piccole con margini
irregolari
• Benzer analizzò mutanti diversi del
locus rII
rII a-b+ x a+bgenomi virali ricombinanti
a+b+ a-bSelezionati con ceppi K
TEST CIS-TRANS E COMPLEMENTAZIONE
• Benzer effettuò la co-infezione di E.coli
K, in cui crescono solo fagi wilde type ,
con i due mutanti rII a- ed rII b• Se le due mutazioni appartengono a
geni diversi, si ha complementazione
• Se le due mutazioni sono localizzate
nello stesso gene, non c ’ è
complementazione e non si formano
placche di lisi