Allegato 2 – Distribuzione degli elementi sul territorio comunale
Alluminio
L'alluminio è un metallo leggero e argenteo, di peso atomico 26,9815; fonde a 660 °C, bolle a 2467
°C e ha densità relativa 2,7. Dal punto di vista chimico è estremamente reattivo, possiede elevata
elettropositività ed è quindi un forte agente riducente. A contatto con l'aria, si ricopre rapidamente
di un velo di ossido trasparente e molto resistente, che protegge la superficie dall'effetto di agenti
corrosivi e dalla formazione di ruggine. Riduce vari composti metallici allo stato fondamentale, e
questa proprietà è sfruttata in alcuni processi industriali tra i quali, ad esempio, il processo Thermit
per la saldatura del ferro: riscaldando la termite, una miscela di ossido di ferro e alluminio in
polvere, l'alluminio rimuove rapidamente l'ossigeno dal ferro e quest'ultimo fonde per effetto del
calore sviluppato dalla reazione.
L'alluminio è il più abbondante costituente metallico delle rocce terrestri; si ritrova generalmente
come silicato, sia solo sia mescolato con altri metalli come il sodio, il potassio, il ferro, il calcio e il
magnesio, ma mai allo stato libero. Il processo di estrazione dai silicati è tuttavia complesso ed
estremamente costoso, pertanto la bauxite, un ossido di alluminio idrato e impuro, rappresenta la
più importante fonte commerciale del metallo e dei suoi composti.
L'alluminio è un metallo particolarmente leggero, di costo modesto, duttile e malleabile, e con
buone caratteristiche di resistenza alla corrosione. Per questo motivo è utilizzato nell'industria
meccanica, aeronautica, e automobilistica, per la fabbricazione di parti di aerei, di vagoni ferroviari
e di veicoli a motore. Inoltre presenta notevole resistenza alla corrosione per effetto dell'acqua
salata e trova quindi impiego anche nell'industria navale, per la produzione di scafi per le barche e
altri mezzi acquatici. L'elevata conducibilità termica rende l'alluminio un materiale adatto alla
fabbricazione di utensili da cucina, e ne permette l'impiego nei motori a combustione interna.
Caratterizzato da buona conducibilità elettrica, esso viene spesso utilizzato in sostituzione del rame
nella trasmissione di elevati voltaggi a lunghe distanze. Conduttori in alluminio, estremamente
leggeri, sono oggi usati per trasmettere tensioni di oltre 700.000 volt.
L'alluminio sta diventando sempre più importante anche dal punto di vista architettonico, sia per
scopi industriali sia ornamentali. Intelaiature di alluminio, finestre e fogli sono eccellenti isolanti. Il
metallo viene utilizzato nei reattori nucleari a bassa temperatura perché, nonostante i limiti di
impiego dovuti al basso punto di fusione, presenta capacità di assorbire neutroni. Inoltre acquista
maggiore resistenza, pur mantenendo la medesima durezza in seguito a raffreddamento, e per
questo motivo è usato negli impianti criogenici. Fogli di alluminio spessi 0,018 cm, ormai diffusi
in tutte le case, vengono utilizzati per conservare cibo e altre sostanze. Grazie alla leggerezza, alla
facilità di plasmatura e alla compatibilità con cibi e bevande, l'alluminio viene largamente
impiegato nella fabbricazione di contenitori, imballaggi e lattine. Il riciclaggio di questi contenitori
è estremamente importante per la conservazione delle risorse.
Importante è pure l'uso di alluminio sotto forma di leghe che presentano migliori caratteristiche
meccaniche rispetto al metallo puro. Leghe particolari vengono usate per le corazze dei carri armati
e di altri mezzi di trasporto militari.
La produzione mondiale di alluminio per usi industriali è cresciuta sensibilmente nel corso degli
ultimi anni. Nel 1886 era inferiore a 45 kg; cent'anni dopo, nel 1989, raggiungeva 18 milioni di
tonnellate. Le ricerche mirate allo sviluppo di metodi di estrazione dai silicati potrebbero
comunque determinare una crescita ulteriore della produzione e un aumento dei possibili impieghi
commerciali e industriali del metallo.
80
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione dell’Alluminio
654 ppm
654 - 1724 ppm
1724 - 2246 ppm
2246 - 2816 ppm
2816 - 3975 ppm
81
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Arsenico
Elemento semimetallico estremamente velenoso, di simbolo As e numero atomico 33. Dal punto di
vista chimico, l'arsenico manifesta proprietà intermedie fra i metalli e i non metalli, e può essere
collocato nel mezzo della serie formata da azoto, fosforo, antimonio, e bismuto. Ha peso atomico
74,922, e se viene riscaldato alla temperatura di 613 °C sublima, cioè transisce direttamente dallo
stato solido a quello gassoso. Esiste in varie forme allotropiche, tra le quali una delle più comuni è
nota come arsenico grigio, una sostanza di aspetto metallico, con densità relativa 5,7. Una forma
non metallica, di colorazione gialla, ha invece densità relativa 2,0. In natura si ritrova allo stato
libero sotto forma di masse granulari grigio-biancastre, ed è un costituente di vari minerali, tra i
quali l'arsenopirite (FeAsS), da cui può essere prodotto per riscaldamento il realgar (As2S2),
l'orpimento (As2S3) e il triossido di arsenico (As2O3). Sostituisce spesso lo zolfo nei solfuri che
rappresentano le fonti principali dei metalli pesanti. Quando questi minerali vengono sottoposti ad
arrostimento, l'arsenico sublima e può essere raccolto nelle polveri dei fumi di vari prodotti
secondari.
L'arsenico è usato in grandi quantità nell'industria vetraria per eliminare il colore verde causato alla
presenza di impurezze di composti del ferro. Viene talvolta aggiunto al piombo per aumentare la
durezza di quest'ultimo, ed è usato nella preparazione dei gas tossici militari (come la lewisite e
l'adamsite). L'arsenato di piombo e l'arsenato di calcio trovano impiego come insetticidi. Alcuni
composti, come l'arseniuro di gallio (GaAs), sono invece usati nell'industria dei semiconduttori e
nella fabbricazione dei materiali per i laser. Il disolfuro di arsenico (As2S2), noto anche come
orpimento rosso o arsenico rubino, è usato come pigmento nella preparazione dei fuochi artificiali
e delle vernici.
L'arsenico è fortemente tossico e risulta letale se assunto in dosi maggiori di 200 mg.
L'avvelenamento può avvenire per ingestione o inalazione di polveri o gas che lo contengono. I test
per verificare la presenza di ridotte quantità di arsenico sono estremamente importanti, dal
momento che questo elemento è molto usato in vari settori dell'industria e può contaminare molte
sostanze. Il test di Marsh, introdotto dal chimico britannico James Marsh, fornisce un semplice
metodo per determinare tracce di arsenico così piccole che potrebbero sfuggire ad analisi comuni.
82
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione dell’Arsenico
0.23 - 0.27 ppm
0.27 - 0.3 ppm
0.3 - 0.4 ppm
0.4 - 0.48 ppm
0.48 - 0.68 ppm
83
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Bario
Elemento della tavola periodica di simbolo Ba e numero atomico 56, appartenente ai metalli
alcalino-terrosi. Fu isolato per la prima volta nel 1808 dallo scienziato britannico Humphry Davy.
Ha peso atomico 137,34; fonde a 714 °C, bolle a 1640 °C e ha densità relativa 3,75. Reagisce
vivacemente con l'acqua e si corrode rapidamente in aria umida. A causa della sua elevata
reattività, non si trova in natura allo stato puro ma solo in composti, in particolare nei minerali
baritina (solfato di bario) e witherite (carbonato di bario).
Il bario metallico ha poche applicazioni pratiche, sebbene sia talvolta usato per ricoprire i
conduttori elettrici in apparati elettronici e nei sistemi di accensione delle automobili. Il solfato di
bario (BaSO4) trova impiego nell'industria della gomma, delle vernici e del linoleum. Il nitrato di
bario è usato per i fuochi artificiali, mentre il carbonato come veleno per i topi. Il solfato di bario,
opaco ai raggi X, è utilizzato come mezzo di contrasto in radiologia.
84
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Bario
12.6 - 15.4 ppm
15.4 - 20.2 ppm
20.2 - 38.2 ppm
38.2 - 64 ppm
64 - 305 ppm
85
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Berillio
Elemento metallico, grigio, fragile, di simbolo Be e numero atomico 4. Fu scoperto nel 1798 dal
chimico francese Louis-Nicolas Vauquelin e isolato nel 1828 da Friedrich Wöhler, e
indipendentemente da Antonine-Alexandre-Brutus Bussy. Inizialmente chiamato glucino, con
allusione al suo sapore dolciastro, prese poi nome dal suo principale minerale, il berillo, un silicato
di alluminio e berillio. Il berillio, che appartiene ai metalli alcalino-terrosi, è piuttosto raro sulla
superficie terrestre. Ha peso atomico 9,012, fonde a circa 1277 °C, bolle a 2970 °C, e ha densità
relativa 1,85. Esposto all'aria, si ricopre di uno strato molto sottile di ossido che conferisce
all'elemento la caratteristica di graffiare i metalli. I suoi composti sono generalmente bianchi, ma
incolori in soluzione, e mostrano dal punto di vista chimico proprietà simili a quelle dei composti
dell'alluminio, elemento dal quale è quindi difficilmente separabile.Le leghe contenenti berillio
sono estremamente leggere, hanno buone proprietà termiche, meccaniche e di resistenza alla
corrosione: per questo motivo vengono impiegate nella tecnologia spaziale e nella fabbricazione di
parti di aerei supersonici; per alcuni usi sono invece sfruttate le proprietà elettriche del materiale.
Essendo trasparente ai raggi X, il berillio trova impiego nei tubi a raggi X; inoltre la naturale
tendenza a rallentare e catturare neutroni lo rende eccellente come moderatore nei reattori nucleari
per la produzione di energia nucleare. Sebbene i prodotti del berillio siano assolutamente innocui, i
vapori e le polveri rilasciati durante la produzione sono estremamente tossici ed è necessaria molta
attenzione per evitare di respirarne anche piccolissime quantità: le persone che lavorano a contatto
con gli ossidi di berillio usano infatti particolari dispositivi di protezione. Il berillio è utilizzato
nella fabbricazione di strumenti e apparecchi come computer, laser e televisori.
86
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Berillio
0.03 ppm
0.03 - 0.05 ppm
0.05 - 0.07 ppm
0.07 - 0.09 ppm
0.09 - 0.13 ppm
87
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Cadmio
Elemento metallico di colore bianco-argenteo, duttile e malleabile, di simbolo Cd e numero
atomico 48; è uno degli elementi di transizione e appartiene al gruppo IIB (o 12) della tavola
periodica. Il cadmio fu scoperto nel 1817 dal chimico tedesco Friedrich Stromeyer che lo individuò
nelle incrostazioni presenti all'interno di una fornace di zinco. Fonde a 321 °C, bolle a 765 °C, ha
densità relativa 8,64 e peso atomico 112,40. A temperatura ambiente si conserva inalterato per
lungo tempo, ma se riscaldato si incendia facilmente in presenza d'aria, generando una fiamma
brillante, e si trasforma rapidamente in ossido, CdO. In natura, il cadmio non si trova mai allo stato
nativo ed è presente in piccole quantità in alcuni minerali, come ad esempio la greenockite,
piuttosto rari e difficilmente sfruttabili industrialmente. Si ottiene prevalentemente come
sottoprodotto della raffinazione di minerali di zinco, dal quale viene separato mediante
distillazione frazionata o elettrolisi. Il cadmio viene usato soprattutto nella cadmiatura, un
trattamento metallurgico mediante il quale viene depositato su superfici metalliche, in modo
particolare di ferro o acciaio, per ottenere un sottile strato protettivo. In lega con piombo, stagno e
bismuto viene utilizzato per preparare metalli fusibili che trovano impiego nella produzione di
varie apparecchiature elettriche; inoltre, in lega con lo zinco, viene usato nella fabbricazione di
cuscinetti e nella saldatura. Il cadmio metallico, grazie all'elevato potere di assorbimento dei
neutroni, viene utilizzato nelle barre di controllo per i reattori nucleari. I sali di cadmio trovano
impiego in campo fotografico e nella fabbricazione di fuochi artificiali, gomme, vernici
fluorescenti, vetri e porcellane. Il solfuro (CdS), un composto giallo chiaro che si ottiene come
precipitato da soluzioni di sali di cadmio in cui si faccia gorgogliare solfuro di idrogeno, è usato
come pigmento e trova applicazione anche nella realizzazione di celle fotovoltaiche; le celle
elettrochimiche a nickel-cadmio inoltre sono ampiamente utilizzate in settori specialistici. Il solfato
di cadmio (3CdSO4·8H2O) è un efficace astringente. Il cadmio e tutti i suoi composti sono molti
tossici, e talvolta responsabili di avvelenamenti professionali.
88
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Cadmio
0.13 - 0.14 ppm
0.14 - 0.18 ppm
0.18 - 0.24 ppm
0.24 - 0.35 ppm
0.35 - 0.42 ppm
89
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Cobalto
Elemento metallico di colore bianco-argenteo, con spiccate proprietà magnetiche, di simbolo Co e
numero atomico 27; appartiene agli elementi di transizione della tavola periodica.
Fu scoperto nel 1735 dal chimico svedese George Brandt. A temperatura ambiente è un metallo
poco resistente e scarsamente duttile, ma la duttilità aumenta a temperature elevate. Fonde a circa
1495 °C, bolle a circa 2870 °C, ha densità relativa 8,9 e peso atomico 58,933.
Tra i numerosi isotopi conosciuti, il più importante è il cobalto 60, un isotopo radioattivo, che
decade con emissione di raggi gamma, e ha tempo di dimezzamento di circa 5,7 anni. Esso trova
applicazioni in vari settori dell'industria ed è usato nelle terapie mediche radioisotopiche, in
particolare per la cura dei tumori (cobaltoterapia). Il cobalto è piuttosto raro nella crosta terrestre;
si trova sotto forma di arseniuro, CoAs2, con il nome di smaltite; di solfoarseniuro (CoAsS), detto
cobalto grigio o cobaltite; di arseniato di cobalto idrato (Co(AsO4)2 · 8H2O), noto come eritrite o
fior di cobalto. Viene estratto principalmente da minerali di cobaltite o dai residui, chiamati
"speiss", ottenuti dalla fusione di arseniuri di nichel, rame e piombo. Il Canada e gli stati
centroafricani della Repubblica democratica del Congo e dello Zambia ne sono i tre maggiori
produttori.
La più importante applicazione del cobalto è nella fabbricazione di leghe particolarmente resistenti
al calore (chiamate superleghe), che vengono usate nel settore industriale e nella produzione di
motori per aerei. Una lega con l'acciaio, nota come acciaio al cobalto, è usata per realizzare
magneti permanenti. Il carboloy, una lega di cobalto e carburo di tungsteno, e la stellite, una lega
con il cromo, sono materiali caratterizzati da elevata durezza impiegati per tagliare e ridurre in
fogli sottili l'acciaio. Il cobalto è anche usato come pigmento per ceramica, come essiccativo per
vernici e come catalizzatore.
90
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Cobalto
0.28 - 0.38 ppm
0.38 - 0.53 ppm
0.53 - 0.74 ppm
0.74 - 0.94 ppm
0.94 - 1.9 ppm
91
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Cromo
Elemento di transizione della tavola periodica di simbolo Cr e numero atomico 24. Il cromo puro è
di colore grigio lucente, ha densità relativa 7,19 e peso atomico 51,996; fonde a 1875 °C e bolle a
2672 °C. È stato scoperto nel 1797 dal chimico francese Louis-Nicolas Vauquelin, che gli attribuì
il nome cromo (dal greco chroma, "colore") alludendo alla grande varietà di colori assunti dai suoi
composti. Il cromo può sostituire l'alluminio o il ferro in molti minerali, conferendo loro particolari
colorazioni, come si verifica nel caso di diverse gemme. È presente in natura nella crosta terrestre
e, in piccole quantità, in organismi vegetali e animali. Pochi minerali del cromo sono sfruttabili; tra
questi il più importante è la cromite, di formula FeCr2O4. Nei suoi composti il cromo manifesta
principalmente numeri di ossidazione +2, +3 e +6. L'ossido, di formula Cr2O3, è impiegato come
pigmento verde mentre il dicromato di potassio K2Cr2O7, è un solido rosso-arancio solubile in
acqua che, mescolato con la gelatina, permette di ottenere superfici fotosensibili usate nei processi
fotografici. I cromati sono solitamente gialli; il più noto è il cromato di piombo (PbCrO4), un
solido insolubile usato come pigmento sia puro (giallo cromo) che in miscela con il blu di Prussia
(verde cromo). In campo metallurgico il cromo viene usato come componente di molte leghe di
ferro, nichel o cobalto alle quali conferisce elevata durezza; negli acciai inossidabili, ad esempio, è
presente in concentrazione del 10%. Nell'industria automobilistica è impiegato nella produzione di
superfici cromate dure, resistenti alla corrosione ed estremamente lucide. L'alto punto di fusione, il
ridotto coefficiente di espansione termica e l'elevata stabilità strutturale consentono inoltre un largo
utilizzo della cromite come materiale refrattario. È pure importante l'uso dei composti del cromo in
conceria e in tintoria, in particolare nella produzione di pigmenti.
92
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Cromo
1.9 - 3.4 ppm
3.4 - 5 ppm
5 - 7.3 ppm
7.3 - 9.5 ppm
9.5 - 16.8 ppm
93
Allegato 2 – Distribuzione degli elementi sul territorio comunale
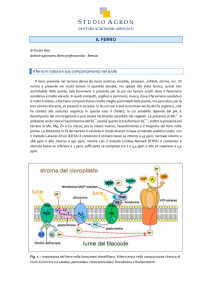
Ferro
Elemento di transizione della tavola periodica di simbolo Fe e numero atomico 26. Il ferro è il
quarto elemento, in ordine di abbondanza, sulla superficie terrestre, dopo ossigeno, silicio e
alluminio; i suoi composti sono molto diffusi e, in lega con il nichel, è il costituente principale di
alcuni meteoriti e del nucleo centrale della Terra. A causa della elevata reattività con l'ossigeno si
rinviene allo stato elementare o nativo solo in piccole quantità e in poche regioni, tra le quali la
Groenlandia e l'Irlanda. Solo alcuni minerali del ferro costituiscono giacimenti sfruttabili
industrialmente: l'ematite, la goethite, la magnetite, la siderite e la limonite. La pirite è utilizzata
prevalentemente nella produzione dell'acido solforico. Piccole quantità di composti di ferro sono
presenti nelle acque, nelle piante e in quasi tutti gli alimenti; esso è inoltre un componente
essenziale negli organismi animali perché presente nella molecola dell'emoglobina. Le
caratteristiche fisiche e chimiche del ferro possono essere sensibilmente migliorate mediante
aggiunta di atomi di carbonio e di altri elementi in lega; queste procedure, utili anche per eliminare
le impurità invariabilmente presenti nel ferro commerciale, sono impiegate nella produzione di
ghisa e acciaio, che costituiscono le principali applicazioni industriali di questo metallo. Allo stato
puro, preparato per elettrolisi di soluzioni di solfato ferroso, ha uso limitato alla produzione di
lamiera zincata e di elettromagneti. Composti di ferro sono contenuti in medicinali usati come
tonici e nel trattamento dell'anemia, quando la quantità di emoglobina o il numero di globuli rossi
nel sangue sono inferiori alla norma. Il ferro forma composti in cui presenta stato di ossidazione +2
(composti ferrosi) e +3 (composti ferrici). Il più importante composto del ferro bivalente è il
solfato FeSO4, detto anche vetriolo verde, un sale verde chiaro che cristallizza con sette molecole
di acqua di idratazione. Si ottiene in grandi quantità come sottoprodotto del decapaggio del ferro e
viene usato come mordente in tintoria, come tonico in medicina e nell'industria degli inchiostri e
dei pigmenti.L'ossido di ferro (III), una polvere amorfa rosso-bruna, si ottiene dal trattamento dei
sali di ferro (III) con una base o dall'ossidazione della pirite. Viene usato quale pigmento (rosso
ferro o rosso veneziano), come polvere abrasiva lucidante e come mezzo magnetizzabile nei nastri
e nei dischi magnetici. Il cloruro di ferro (III), un composto cristallino verde scuro che si ottiene
per riscaldamento del ferro con il cloro, viene usato in medicina in soluzione alcolica con il nome
di tintura di ferro. Gli ioni ferro (II) e ferro (III) formano con lo ione cianuro dei complessi molto
stabili. L'esacianoferrato (II) di ferro (III) (ferrocianuro ferrico) Fe4[Fe(CN)6]3, un solido amorfo
blu scuro formato dalla reazione dell'esacianoferrato (II) di potassio con un sale di ferro (III), è
noto con il nome di blu di Prussia e viene usato come pigmento e come azzurrante per correggere
l'ingiallimento dei tessuti dovuto alle tracce di sali ferrosi presenti nell'acqua. L'esacianoferrato
(III) di potassio (ferricianuro di potassio o prussiato rosso) K3[Fe(CN)6] viene usato nella
produzione della carta per cianografia mentre l'esacianoferrato (III) di potasssio e ferro (II)
KFe[Fe(CN)6] è un pigmento noto con il nome di azzurro di Turnbull. Le reazioni fisico-chimiche
tra il ferro e il carbonio sono alla base del processo di formazione delle ghise e degli acciai.
94
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Ferro
1004 - 1405 ppm
1405 - 1821 ppm
1821 - 2279 ppm
2279 - 3154 ppm
3154 - 4438 ppm
95
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Mercurio
Mercurio Elemento metallico, di simbolo Hg e numero atomico 80; è uno degli elementi di
transizione della tavola periodica. Un tempo noto come "argento liquido" e molto usato dagli
alchimisti, fu distinto come elemento dal chimico francese Antoine-Laurent Lavoisier, nel corso
delle sue analisi sulla composizione dell'aria. A temperatura ambiente è un liquido splendente, di
colore argenteo, leggermente volatile. Solidifica se sottoposto a pressione di 7640 atmosfere,
valore usato come standard nella misura di altissime pressioni; in condizioni standard di pressione
invece solidifica a -39 °C, bolle a 357 °C; ha densità relativa 13,5 e peso atomico 200,59. Si
scioglie nell'acido nitrico o solforico concentrato ma è resistente agli alcali. Elemento piuttosto raro
in natura, si trova sia in forma pura sia combinato con argento, ma soprattutto sotto forma di
solfuro nel minerale cinabro da cui si estrae per arrostimento in corrente d'aria e successiva
condensazione del gas prodotto. Poiché ha coefficiente di dilatazione termica praticamente
costante, cioè subisce perlopiù la stessa variazione di volume per ogni grado di temperatura, il
mercurio viene usato nella costruzione dei termometri. È anche utilizzato in altri apparecchi
scientifici, come le pompe a vuoto, i barometri e gli interruttori. Le lampade a vapori di mercurio
trovano impiego come fonte di raggi ultravioletti per uso domestico e per sterilizzare l'acqua; i
vapori di mercurio sono inoltre usati nei bollitori di alcuni motori a reazione. Il mercurio si
combina con tutti i metalli più comuni, a eccezione di ferro e platino, per formare leghe dette
amalgama. Un metodo di estrazione dell'oro e dell'argento si basa sulla loro combinazione con
mercurio, che viene poi rimosso mediante distillazione. Il mercurio forma composti monovalenti e
bivalenti, tra i quali importanti sono il solfuro di mercurio (II), noto antisettico; il cloruro di
mercurio (I), o calomelano, usato negli elettrodi; il cloruro di mercurio (II), estremamente
corrosivo; alcuni medicinali, come ad esempio il mercurocromo. Il mercurio è altamente tossico,
sia in forma di vapore sia come sale solubile. L'avvelenamento cronico da mercurio, che insorge
quando piccole quantità dei suoi sali liposolubili, in particolare il metilmercurio, vengono ingerite
per lunghi periodi, causa danni irreversibili al cervello, al fegato e ai reni. Attualmente è posta
molta attenzione allo scarico non controllato del metallo nell'ambiente poiché, a causa dell'aumento
dell'inquinamento delle acque, sono state ritrovate quantità significative di mercurio in alcune
specie di pesci.
96
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Mercurio
0.025 ppm
0.025 - 0.05 ppm
0.05 - 0.06 ppm
0.06 - 0.08 ppm
0.08 - 0.1 ppm
97
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Litio
Litio Elemento metallico bianco argenteo di simbolo Li e numero atomico 3. Appartiene al gruppo
IA (o 1) della tavola periodica ed è pertanto un metallo alcalino. Fonde a 180 °C, bolle a 1340 °C,
ha densità relativa 0,53 e peso atomico 6,94. A causa della sua elevata reattività non si trova in
natura allo stato elementare ma è presente, spesso associato a sodio e potassio, in composti molto
diffusi. In laboratorio si ottiene per elettrolisi di una miscela di cloruri di litio e di potassio fusi; si
ossida istantaneamente per esposizione all'aria perciò deve essere conservato immerso in un liquido
come il petrolio. Viene usato come disossidante e degassificante in metallurgia, infatti la presenza
di suoi vapori evita che il diossido di carbonio e l'ossigeno formino scorie nelle fornaci di
lavorazione dell'acciaio. Tra i composti di litio più importanti si ricordano l'idrossido LiOH, usato
per catturare il diossido di carbonio nei sistemi di ventilazione delle navicelle spaziali e dei
sottomarini; l'idruro LiH, adatto per gonfiare le scialuppe di salvataggio, e il suo equivalente
deuterato LiD, sfruttato nella preparazione della bomba a idrogeno. Il carbonato di litio viene
impiegato nel trattamento delle sindromi maniaco-depressive.
98
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Litio
>2 ppm
2 - 4.7 ppm
99
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Magnesio
Magnesio Elemento metallico bianco-argenteo, poco reattivo, di simbolo Mg e numero atomico 12;
appartiene al gruppo IIA (o 2) della tavola periodica, ed è quindi tra i metalli alcalino-terrosi. Il
metallo, isolato per la prima volta dal chimico britannico Humphry Davy nel 1808, è ottenuto
principalmente dall'elettrolisi del cloruro fuso. È malleabile e duttile se viene scaldato; a
temperatura ambiente non viene attaccato dall'ossigeno, dall'acqua o dagli alcali, ma reagisce
facilmente con gli acidi. Se scaldato a 800 °C, reagisce con l'ossigeno ed emette una luce brillante.
Fonde a 650 °C, bolle a circa 1107 °C, ha densità relativa 1,74 e peso atomico 24,312.
Relativamente abbondante sulla crosta terrestre, si trova in natura combinato ad altri elementi, in
particolare nei minerali carnallite, dolomite e magnesite; in molti silicati nelle rocce; come sale, ad
esempio cloruro di magnesio, negli oceani e nei laghi salati. È uno dei principali costituenti dei
tessuti delle piante e degli animali. Il magnesio forma composti bivalenti, fra i quali il carbonato di
magnesio (MgCO3), che si produce per reazione fra un sale di magnesio e il carbonato di sodio e
viene usato come materiale refrattario e isolante; il cloruro di magnesio (MgCl2·6H2O), preparato
facendo reagire carbonato o ossido di magnesio con acido cloridrico e impiegato nei tessuti di lana
e cotone, nell'industria della carta, nella produzione di cemento e ceramiche; il citrato di magnesio
(Mg3(C6H5O7)2·4H2O), ottenuto per reazione fra carbonato di magnesio e acido citrico e
utilizzato nella produzione di medicinali o bevande effervescenti; l'idrossido di magnesio
(Mg(OH)2), formato dalla reazione fra sali di magnesio e idrossido di sodio, usato in medicina
come lassativo ("latte di magnesia") e nella raffinazione dello zucchero; il solfato di magnesio
(MgSO4·7H2O), meglio conosciuto come sale di Epsom; l'ossido di magnesio (MgO), detto
magnesia, preparato bruciando il magnesio in corrente di ossigeno o riscaldando il carbonato di
magnesio, usato come materiale refrattario e isolante, nell'industria dei cosmetici e della carta e
come lassativo debole e antiacido. Le leghe di magnesio e rame, o alluminio, estremamente leggere
ma caratterizzate da elevata resistenza a trazione, sono utilizzate per fabbricare parti di aeroplani,
arti artificiali, strumenti ottici e sci. Il metallo puro è usato nelle polveri per i flash fotografici, nelle
bombe incendiarie, nei razzi di segnalazione e come deossidante nella fusione dei metalli.
100
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Magnesio
1170 - 1420 ppm
1420 - 1886 ppm
1886 - 2134 ppm
2134 - 3284 ppm
3284 - 4537 ppm
101
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Manganese
Manganese Elemento di transizione della tavola periodica di simbolo Mn e numero atomico 25. È
un metallo di colore bianco argenteo usato principalmente nella produzione di leghe. Il manganese
fu scoperto nel 1774 dal chimico svedese Karl Wilhelm Scheele e isolato nello stesso anno da
Johan Gottlieb Gahn. Se esposto all'aria si ossida in superficie, in aria umida arrugginisce, e viene
facilmente sciolto dagli acidi diluiti. Fonde a 1245 °C, bolle a circa 2150 °C, ha densità relativa 7,2
e peso atomico 54,94. Il manganese puro si ottiene per combustione della pirolusite (diossido di
manganese) con polvere di alluminio o per elettrolisi del solfato. Non si rinviene allo stato
elementare, tranne che nelle meteoriti, ma è contenuto in diversi minerali, come la pirolusite che
rappresenta la principale fonte di questo metallo, la rodocrosite (carbonato di manganese), la
manganite e la franklinite. Il manganese trova impiego come componente di leghe ferrose, ottenute
trattando la pirolusite in altoforno con minerali di ferro e carbone. Aggiunto in piccole quantità
all'acciaio serve come disossidante; in maggiori quantità conferisce a questo materiale durezza,
resistenza all'usura e al calore. Le casseforti ad esempio sono costruite con acciaio contenente circa
il 12% di manganese (acciaio Hadfield). Tra le leghe non ferrose sono importanti il bronzo di
manganese (composto da manganese, rame, stagno e zinco), che resiste alla corrosione dell'acqua
marina e viene usato nelle eliche delle imbarcazioni, e la manganina (contenente manganese, rame
e nichel), impiegata nella costruzione di strumenti di misura molto accurati poiché la sua
conduttività elettrica non varia apprezzabilmente con la temperatura. Il manganese forma composti
in cui presenta numero d'ossidazione +2, +3, +4, +6 e +7. Il diossido di manganese MnO2,
sintetizzato per decomposizione termica del nitrato Mn(NO3)2, è sfruttato come depolarizzante
nelle pile a secco, come colorante per vetro e ceramica, e come ossidante nella preparazione del
cloro e dello iodio. Il solfato di manganese (II) MnSO4, un solido cristallino rosa ottenuto per
trattamento del diossido con acido solforico, trova impiego nella tintura del cotone. Il
permanganato di potassio KMnO4, usato come ossidante e disinfettante, è un composto cristallino
di colore viola intenso preparato per ossidazione chimica o elettrochimica di composti del
manganese.
102
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Manganese
25.7 - 35.6 ppm
35.6 - 47 ppm
47 - 53.6 ppm
53.6 - 120.6 ppm
120.6 - 559.2 ppm
103
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Nichel
Nichel Elemento metallico bianco-argenteo di simbolo Ni e numero atomico 28, appartenente agli
elementi di transizione della tavola periodica. Il nichel venne usato a lungo per produrre le leghe
rame-nichel usate nel conio delle monete, ma non fu riconosciuto come sostanza elementare fino al
1751, quando il chimico svedese Axel Frederic Cronstedt lo isolò dal minerale niccolite. Il nichel è
un metallo duro, duttile, malleabile e lucidabile; fonde a 1455 °C, bolle a 2950 °C, ha densità
relativa 8,9 e peso atomico 58,71. A temperature inferiori ai 345 °C presenta spiccate
caratteristiche magnetiche. Esiste in cinque forme isotopiche stabili. Il nichel metallico non è molto
attivo dal punto di vista chimico; è solubile in acido nitrico diluito e si passiva (cioè diventa non
reattivo) in acido nitrico concentrato; non reagisce con gli alcali. Il nichel si ritrova in forma
elementare soltanto nelle meteoriti ma, combinato con altri elementi, è piuttosto diffuso sulla
crosta terrestre in minerali come la garnierite, la millerite, la niccolite, la pentlandite e la pirrotite. I
minerali di nichel contengono generalmente delle impurità, in modo particolare di rame. I minerali
solfurici, come la pentlandite e la pirrotite nichelifera, vengono generalmente fusi in un altoforno e
trasportati in forma di lingotti di solfuro di rame e nichel alle raffinerie, dove il nichel viene
estratto per mezzo di vari metodi. Nei processi di raffinazione elettrochimica, il nichel si ottiene in
forma metallica con un elevato grado di purezza, per deposizione del rame impiegando un
voltaggio diverso e una soluzione elettrolitica adeguata. Nel processo Mond, il rame viene separato
per dissoluzione in acido solforico diluito, mentre il residuo di nichel viene ridotto a nichel
metallico impuro. Facendo passare monossido di carbonio sul nichel impuro, si forma il nichel
carbonile (Ni(CO)4), un gas volatile che si decompone se scaldato alla temperatura di 200 °C,
depositando nichel metallico puro. Il nichel viene utilizzato per formare rivestimenti protettivi e
ornamentali per i metalli, in particolare per ferro e acciaio, che sono particolarmente sensibili alla
corrosione. Lo strato di nichel è depositato sulla superficie degli oggetti per elettrolisi. Viene usato
anche come catalizzatore in vari processi, tra cui il più importante è l'idrogenazione degli oli.
L'impiego più importante, tuttavia, si ha sotto forma di leghe. L'acciaio al nichel, che contiene dal
2 al 4% del metallo, è usato per fabbricare parti di automobili come i semiassi, l'albero motore, il
cambio, le valvole, macchinari di vario tipo e anche corazze. Alcune delle leghe più importanti
contenenti nichel sono l'argento tedesco, l'Invar, il metallo Monel, il nichel-cromo e il Permalloy.
Le monete usate abitualmente sono di solito realizzate con una lega composta dal 25% di nichel e
dal 75% di rame. Il nichel è inoltre uno dei componenti principali delle batterie al nichel-cadmio.
La maggior parte del nichel viene estratto in Canada, in particolare nella regione del Québec dove
nel 1957 fu scoperto un ricchissimo deposito. Cuba, i paesi dell'ex Unione Sovietica, la Cina e
l'Australia restano comunque importanti produttori. Il nichel forma principalmente composti
bivalenti, sebbene esistano esempi di composti con grado di ossidazione da -1 a +4. La maggior
parte dei sali di nichel, come il cloruro (NiCl2), il solfato (NiSO4) e il nitrato (Ni(NO3)2), sono di
colore verde e blu, e si trovano in forma idrata. Il solfato di nichel ammonio (NiSO4 · (NH4)2SO4
· 6H2O) è usato nelle soluzioni elettrolitiche. I composti di nichel si identificano aggiungendo un
reagente organico, la dimetilglossima, che forma un precipitato a fiocchi rossi.
104
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Nichel
0.37 - 0.47 ppm
0.47 - 0.56 ppm
0.56 - 1.4 ppm
1.4 - 2.3 ppm
2.3 - 3.2 ppm
105
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Piombo
Elemento metallico denso, con colore grigio-bluastro, di simbolo Pb e numero atomico 82;
appartiene al gruppo IVB (o 14) della tavola periodica. Esistono otto isotopi naturali del piombo,
quattro dei quali sono stabili. Il piombo 206, il piombo 207 e il piombo 208 sono rispettivamente i
prodotti finali del decadimento di uranio, attinio e torio; il piombo 204, anch'esso stabile, non ha
precursori radioattivi naturali. Il piombo è abbondantemente diffuso in tutto il mondo sotto forma
di solfuro, nel minerale chiamato galena e in minerali di secondaria importanza come la cerussite e
l'anglesite. Viene estratto mediante un processo di arrostimento e riduzione, che consiste nella
conversione del piombo a ossido e successiva riduzione con carbone coke in fornace. Un altro
metodo prevede l'arrostimento in fornace a riverbero, con conversione di parte del solfuro a ossido
o solfato; rimuovendo l'aria e innalzando la temperatura, il solfuro di piombo iniziale si combina
con il solfato e con l'ossido, producendo piombo metallico e biossido di zolfo. Il piombo è usato in
enormi quantità nelle batterie e come rivestimento di cavi elettrici, tubi, serbatoi e negli apparecchi
per i raggi X. Per la sua elevata densità e la grande sezione di cattura, il piombo trova impiego
come sostanza schermante per i materiali radioattivi. Numerose leghe contenenti un'alta
percentuale di piombo sono utilizzate nella saldatura, per i caratteri da stampa, per gli ingranaggi.
Una quantità considerevole di composti di piombo è inoltre consumata nelle vernici e nei pigmenti.
Il piombo è tossico se viene ingerito. I sintomi dell'avvelenamento, che si manifestano solo dopo
l'accumulo di una determinata quantità di piombo nel corpo, sono anemia, debolezza, stitichezza,
coliche, e spesso paralisi dei polsi e delle anche. Colori e giocattoli contenenti piombo sono
considerati un serio pericolo per i bambini. Il piombo può provocare riduzioni nell'intelligenza,
perdita della memoria, ritardare lo sviluppo motorio e causare problemi all'udito e all'equilibrio.
Negli adulti, un segno dell'avvelenamento da piombo è l'aumento della pressione. Attualmente, il
trattamento dell'avvelenamento da piombo include la somministrazione di calcio disodio
etilendiamminotetracetato (EDTA): il piombo crea un complesso stabile con EDTA, che viene poi
espulso nelle urine.
106
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Piombo
2.4 - 2.9 ppm
2.9 - 4 ppm
4 - 5.1 ppm
5.1 - 9.2 ppm
9.2 - 12.4 ppm
107
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Rame
Elemento metallico marrone-rosso, di simbolo Cu e numero atomico 29; appartiene agli elementi
di transizione della tavola periodica. Conosciuto fin dalla preistoria, il rame è stato probabilmente
il primo metallo utilizzato per costruire armi, utensili e attrezzi rudimentali. Oggetti di rame sono
stati trovati tra i resti di molte civiltà antiche, ad esempio in Egitto, in Asia, in Europa e in Grecia; i
romani, che lo chiamarono cyprum, lo utilizzavano anche per la realizzazione di strumenti adibiti
alle pratiche religiose. Il rame fonde a circa 1083 °C, bolle a circa 2595 °C, ha densità relativa 8,9
e peso atomico 63,546. È caratterizzato da elevata conducibilità termica ed elettrica, buona
resistenza alla corrosione, malleabilità, duttilità, ma anche bellezza, e trova quindi moltissime
applicazioni. Viene utilizzato prevalentemente per condutture elettriche. Sottili fili conduttori
estremamente resistenti sono impiegati sia come cavi esterni sia per gli impianti elettrici domestici,
in lampade e dispositivi come generatori, relè, elettromagneti e strumenti per telecomunicazioni. È
sempre stato usato per fabbricare monete ma anche utensili da cucina, contenitori e oggetti
ornamentali, e un tempo era utilizzato per rivestire il fondo delle navi di legno per prevenire le
falle. Può essere facilmente galvanizzato, sia da solo sia come base per altri metalli. Il trattamento
metallurgico prevede diverse fasi. I solfuri, tra i più importanti minerali che contengono rame,
vengono frantumati e concentrati tramite flottazione, quindi fusi in un forno a riverbero, dove si
produce rame metallico grezzo, con grado di purezza del 98% circa. Questo materiale viene
ulteriormente purificato per elettrolisi, fino a ottenere un prodotto puro al 99,9%. Il rame puro è
molto morbido e per essere lavorato deve essere indurito; al contrario le leghe di rame, sono dure e
resistenti, hanno elevata resistenza elettrica e di conseguenza non possono essere utilizzate come
materiale conduttore. Le più importanti leghe sono l'ottone, una lega di zinco, e il bronzo, una lega
di stagno; comunque il rame viene anche utilizzato in lega con oro, argento e nichel, ed è un
importante costituente di leghe come il metallo Monel, il metallo per proiettili e l'argento tedesco.
Il rame forma due serie di composti chimici: i composti rameosi nei quali presenta stato di
ossidazione +1, e quelli rameici in cui ha stato di ossidazione +2. I primi vengono ossidati
facilmente a rameici, anche per semplice esposizione all'aria, e hanno poca importanza dal punto di
vista industriale; i composti rameici invece sono stabili. Alcune soluzioni di rame sciolgono la
cellulosa e per questo motivo vengono utilizzate nei processi di produzione del rayon. Il rame è
inoltre un costituente di diversi pigmenti, insetticidi e fungicidi, anche se spesso viene sostituito da
composti organici. Relativamente diffuso in natura anche allo stato elementare, il rame si trova
spesso combinato ad altri metalli, come oro, argento, bismuto e piombo; è presente in piccole
quantità in diversi tipi di rocce, in particolare nelle lave basaltiche. Le fonti principali di rame sono
la calcopirite e la bornite, solfati misti di rame e ferro. Importanti sono pure la calcosina e la
covellite, solfati di rame, diffusi in diverse regioni di Stati Uniti e Inghilterra. L'azzurite, un
carbonato basico, si trova in Francia e Australia mentre la malachite, anch'esso un carbonato, è
diffusa nella regione degli Urali. La tetraedrite, un solfoantimonuro di rame e altri metalli, e la
crisocolla, un silicato, sono pure molto diffusi. Elevate quantità di cuprite, un ossido, si trovano a
Cuba mentre l'atacamite, un cloruro basico, è presente soprattutto in Perù. I giacimenti più
importanti dal punto di vista industriale sono in Cile.
108
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Rame
5.5 - 6.8 ppm
6.8 - 8.8 ppm
8.8 - 15.6 ppm
15.6 - 23 ppm
23 - 37 ppm
109
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Sodio
Sodio Elemento metallico di colore argenteo, estremamente reattivo, di simbolo Na e numero
atomico 11; appartiene al gruppo IA (o 1) della tavola periodica, ed è quindi tra i metalli alcalini.
Fu scoperto nel 1807 dal chimico britannico Humphry Davy. Il sodio metallico è estremamente
morbido e può essere facilmente tagliato con un semplice coltello. Si ossida immediatamente per
esposizione all'aria e reagisce violentemente con l'acqua, formando idrossido di sodio e liberando
idrogeno. Fonde a circa 98 °C, bolle a 892 °C, ha densità relativa 0,97 e peso atomico 22,9898. Il
sodio non esiste in natura allo stato elementare ma si trova nelle acque salate sotto forma di cloruro
di sodio, NaCl o, meno spesso, di carbonato, Na2CO3, e di solfato, Na2SO4. Viene preparato
industrialmente tramite decomposizione elettrolitica di cloruro di sodio fuso. È uno dei costituenti
principali dei tessuti delle piante e degli animali. Il sodio si utilizza nella produzione del piombo
tetraetile e come refrigerante nei reattori nucleari. Tra i composti più importanti troviamo il cloruro
di sodio, comunemente noto come sale, il carbonato di sodio, e il sodio bicarbonato, detto
comunemente bicarbonato. L'idrossido di sodio, noto come soda caustica, trova impiego nella
produzione di sapone, rayon, carta, nella raffinazione degli oli e nelle industrie tessili e della
gomma. Il tetraborato di sodio è comunemente detto borace. Il fluoruro di sodio, NaF, è usato
come antisettico, come veleno per topi e scarafaggi, e nelle ceramiche; il nitrato di sodio, noto
come salnitro, è usato come fertilizzante; il perossido, Na2O2, è un agente sbiancante e ossidante;
il tiosolfato di sodio, Na2S2O3 · 5H 2O, è usato in fotografia come fissante.
110
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Sodio
175.4 - 207 ppm
207 - 267.6 ppm
267.6 - 355.6 ppm
355.6 - 465 ppm
465 - 654 ppm
111
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Stronzio
Stronzio Elemento metallico duttile, malleabile e reattivo, di simbolo Sr e numero atomico 38;
appartiene al gruppo IIA (o 2) della tavola periodica ed è pertanto un metallo alcalino-terroso. Lo
stronzio metallico fu isolato dal chimico britannico Humphry Davy nel 1808, ma era già stato
individuato intorno al 1790 nel minerale stronzianite. Il metallo appena tagliato presenta lucentezza
argentea ma si ossida rapidamente se esposto all'aria. Reagisce anche con l'acqua, formando
idrossido di stronzio e idrogeno gassoso secondo la reazione Sr + 2H2O ± Sr(OH)2 + H2. Come
altri metalli alcalino-terrosi viene preparato per trasformazione del solfato o del carbonato in
cloruro che, per elettrolisi, fornisce il metallo. Fonde a 769 °C, bolle a 1366 °C, ha densità relativa
2,6 e peso atomico 87,62. In natura non esiste allo stato elementare ma sotto forma di carbonato
nella stronzianite (SrCO3) e di solfato nella celestina (SrSO4); viene estratto soprattutto in
Messico, Inghilterra e Scozia. I composti di stronzio, se bruciati, danno luogo a una fiamma di
colore rosso brillante e vengono usati nella produzione di fuochi artificiali e razzi. L'isotopo
radioattivo stronzio 85 viene impiegato nella diagnosi dei tumori ossei; lo stronzio 90 è uno dei più
pericolosi componenti del fallout radioattivo che segue alla detonazione di alcune bombe nucleari.
112
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione dello Stronzio
8.1 - 18.2 ppm
18.2 - 31.2 ppm
31.2 - 38.6 ppm
38.6 - 57.4 ppm
57.4 - 74 ppm
113
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Selenio
Selenio (Dal greco selene, "luna"), elemento semimetallico, di simbolo Se e numero atomico 34,
appartenente al gruppo VIB (o 16) della tavola periodica. Venne scoperto nel 1817 dal chimico
svedese Jöns Jakob Berzelius nei residui dell'acido solforico e fu così chiamato perché era spesso
associato al tellurio (dal latino tellus,"terra"). Dal punto di vista chimico, il selenio è simile allo
zolfo e come questo esiste in varie forme allotropiche: si trova sotto forma di polvere rosso
mattone; di massa amorfa e vetrosa marrone scuro detta in genere selenio vetroso; di cristalli rossi
o grigi e lucidi, noti come selenio grigio. Reagisce con idrogeno e ossigeno formando l'acido
selenioso (H2SeO3) e l'acido selenico (H2SeO4), i cui sali sono detti rispettivamente seleniti e
selenati. Il selenio fonde a 217 °C, bolle a 685 °C, ha densità relativa 4,81 e peso atomico 78,96.
L'elemento è presente in vari minerali, il più comune dei quali è la claustalite, o selenite di piombo,
ed è associato a vari minerali di zolfo. Si ottiene generalmente come sottoprodotto della
raffinazione dei minerali di rame, anche se la quantità ottenuta in questo modo è insufficiente a
soddisfare l'aumentata richiesta di tale elemento. Il selenio grigio è un buon conduttore di
elettricità, e la sua conducibilità è direttamente proporzionale all'intensità luminosa, ossia
l'elemento conduce meglio alla luce che all'oscurità, e per questo motivo è molto usato in numerosi
apparecchi fotoelettrici. Sotto forma di selenio rosso o di selenuro di sodio viene usato per tingere
di rosso vetri e smalti, e talvolta per decolorare i vetri poiché ha la proprietà di neutralizzare il
colore verdastro prodotto dai composti ferrosi. Piccole quantità di selenio vengono aggiunte alla
gomma vulcanizzata per accrescerne la resistenza all'abrasione. Il selenato di sodio è un potente
insetticida. Il solfuro di selenio è utilizzato per il trattamento della forfora, dell'acne, degli eczemi,
di alcune dermatiti e di altri disturbi della pelle.
114
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Selenio
0.16 ppm
0.16 - 0.22 ppm
0.22 - 0.25 ppm
0.25 - 0.28 ppm
0.28 - 0.32 ppm
115
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Titanio
Elemento di transizione della tavola periodica di simbolo Ti e numero atomico 22; è un metallo di
colore argenteo, usato principalmente nella produzione di leghe leggere e resistenti. Fu individuato
come costituente del rutilo dal chimico tedesco Martin Heinrich Klaproth nel 1795, ma venne
isolato soltanto cinque anni dopo. È molto resistente alla corrosione e non viene intaccato né
dall'acqua né dall'acido nitrico; è tuttavia solubile nell'acido solforico e nell'acido cloridrico
concentrati ma soprattutto nell'acido fluoridrico che rappresenta il suo migliore solvente. La
presenza di impurezze, anche in piccola quantità, rende il metallo fragile e non lavorabile; al
contrario, il titanio puro è invece molto resistente, duttile e malleabile. Fonde a circa 1660 °C, bolle
a 3260 °C, ha densità relativa 4,51 e peso atomico 47,90. Il titanio presenta numero d'ossidazione
+2, +3 e +4, come ad esempio nei tre cloruri TiCl2, Ti2Cl3 e TiCl4. È relativamente abbondante
nella crosta terrestre; tuttavia non viene rinvenuto allo stato elementare ma sotto forma ossidata nei
minerali ilmenite (FeO · TiO2), rutilo (TiO2) e titanite (CaO · TiO2 · SiO2). Il diossido di titanio,
TiO2, si ottiene dal trattamento del minerale ridotto in polvere con carbonato di potassio e acido
fluoridrico acquoso, in modo da formare l'esafluorotitanato (IV) di potassio K2[TiF6], un sale che
può essere facilmente separato dalle scorie perché solubile in acqua in opportune condizioni di
temperatura. L'aggiunta di ammoniaca alla soluzione determina la precipitazione di un ossido
ammoniacale che, per calcinazione in un crogiuolo di platino, rigenera il diossido. Il metallo puro
si ottiene dal tetracloruro di titanio, un liquido volatile e facilmente purificabile ricavato dal
diossido per reazione con il cloro; il cloruro viene ridotto con magnesio, in atmosfera d'argon, a
metallo spugnoso, che viene fuso e conservato in lingotti. Il complicato metodo di preparazione del
titanio puro lo rende molto costoso, benché i suoi minerali siano piuttosto diffusi. Il titanio è molto
usato come componente delle leghe metalliche; ad esempio la lega di titanio, alluminio e vanadio
trova applicazioni nell'industria aerospaziale, nella produzione di pareti tagliafiamma, rivestimenti
esterni, componenti dei carrelli d'atterraggio, tubazioni idrauliche e supporti dei motori. Il titanio
viene anche usato nella costruzione dei missili e delle capsule spaziali. Importanti materiali sono
poi la lega madre ferro-carbonio-titanio, ottenuta dalla riduzione dell'ilmenite con il coke in una
fornace elettrica, e il cuprotitanio e il manganotitanio, prodotti per riduzione del rutilo in presenza
rispettivamente di rame o di manganese. La relativa inerzia del titanio lo rende adatto a sostituire
ossa e cartilagini; inoltre viene anche usato per gli scambiatori di calore degli impianti di
desalinizzazione. In metallurgia le leghe di titanio vengono impiegate come disossidanti e
denitrificanti, data l'affinità di questo elemento per l'ossigeno e l'azoto. L'ossido di titanio è un
pigmento bianco (bianco di titanio) usato nella produzione di vernici, materie plastiche, tessuti,
carta e gomma.
116
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Titanio
3 - 5.1 ppm
5.1 - 11 ppm
11 - 20 ppm
20 - 26.1 ppm
26.1 - 32.8 ppm
117
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Vanadio
Vanadio Elemento di transizione della tavola periodica, di simbolo V e numero atomico 23.
Scoperto intorno al 1800, fu inizialmente scambiato per una forma particolare di cromo e solo in
un secondo tempo classificato come nuovo elemento. È un metallo grigio-argenteo, duro ma
duttile; se lucidato, diventa molto brillante. Fonde a 1890 °C, bolle a circa 3000 °C, ha densità
relativa 6,07 e peso atomico 50,94. È solubile in acido nitrico e solforico, ma non in acido
cloridrico e in soluzioni diluite di idrossido di sodio o di alcol. Tra i suoi composti, sono importanti
il pentossido di vanadio, V2O5, un ossido di colore rosso ruggine; il pentasolfuro di vanadio,
V2S5; il dicloruro e il tricloruro di vanadio, VCI2 e VCI3, e l'acido metavanadico, HVO3. In
natura non si trova allo stato puro, ma è diffuso in minerali come la vanadinite, la carnotite e la
patronite, in cui è combinato con diversi metalli. I principali produttori di vanadio sono Stati Uniti,
Russia e Sud Africa. La durezza e l'elevata resistenza a trazione che caratterizzano questo elemento
lo rendono utilizzabile in numerose leghe, come la lega ferro-vanadio, usata come additivo nella
produzione di acciai con elevata resistenza all'usura, e le leghe nickel-vanadio e cromo-vanadio.
Gli acciai al cromo-vanadio sono utilizzati per produrre molle a elica cilindrica, meccanismi di
trasmissione e altri componenti dei motori. Le leghe titanio-vanadio sono usate nelle coperture dei
missili, negli alloggiamenti dei motori a propulsione e in componenti dei reattori nucleari. Come
catalizzatore, sostituisce il platino nella produzione di acido solforico; viene inoltre utilizzato nelle
soluzioni per lo sviluppo di pellicole fotografiche, come agente riducente e come essiccante per
vari tipi di vernici.
118
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione del Vanadio
2.5 - 3.3 ppm
3.3 - 5.9 ppm
5.9 - 6.7 ppm
6.7 - 8.8 ppm
8.8 - 11 ppm
119
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Zinco
Zinco Elemento metallico di colore bianco-bluastro, di simbolo Zn e numero atomico 30; è uno
degli elementi di transizione della tavola periodica. Lo zinco puro è un metallo cristallino,
insolubile in acqua e solubile in alcol, in acidi e in sostanze alcaline. È inerte all'aria secca, ma
all'aria umida si ossida e si ricopre di uno strato di carbonato che lo protegge dalla corrosione.
Fonde a 420 °C, bolle a circa 907 °C, ha densità relativa 7,14 e peso atomico 65,38. nIn natura non
si trova mai allo stato puro, ma sotto forma di ossido, ZnO; di silicato, Zn4[(OH)2Si2O7]·H2O
(calamina o emimorfite); di carbonato, ZnCO3 (smithsonite); di ossido misto di ferro e zinco,
ZnFe2O4 (franklinite) e di solfuro, ZnS (blenda o sfalerite). I minerali usati più comunemente per
l'estrazione dello zinco sono la smithsonite e la sfalerite. Il primo passaggio del processo
metallurgico di estrazione consiste nella trasformazione dei minerali in ossido di zinco tramite
calcinazione. Gli ossidi ottenuti vengono poi ridotti dal carbone in una fornace elettrica; lo zinco
viene raccolto liquido, scaldato fino all'ebollizione e distillato in storte di refrattario. Lo zinco
ottenuto per distillazione contiene impurezze di ferro, arsenico, cadmio e piombo e viene definito
zinco termico. In alternativa, i minerali calcinati vengono trattati con acido solforico. Si ottiene una
soluzione di solfato di zinco che, purificata da tutti gli altri metalli, viene elettrolizzata. Lo zinco
elettrolitico è puro al 99,99% e presenta proprietà molto ricercate. Lo zinco metallico è usato come
rivestimento protettivo (galvanizzazione) per ferro e acciaio, è un costituente di molte leghe, ad
esempio dell'ottone (rame-zinco), e viene usato come piastra per le celle elettrochimiche. L'ossido
di zinco, noto come zinco bianco, trova impiego come pigmento e nell'industria dei cosmetici. Il
cloruro è utilizzato per proteggere il legno e come fondente; il solfuro è usato in dispositivi che
sfruttano fenomeni di elettroluminescenza, di fotoconduttività e di semiconduttività, come i
rivestimenti fluorescenti e i tubi catodici collegati allo schermo televisivo.
120
Allegato 2 – Distribuzione degli elementi sul territorio comunale
Distribuzione dello Zinco
19.6 - 22.7 ppm
22.7 - 28.1 ppm
28.1 - 47.8 ppm
47.8 - 76 ppm
76 - 118.5 ppm
121