SENSORI E BIOSENSORI
6.1 INTRODUZIONE
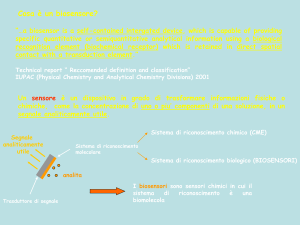
Un sensore chimico è un dispositivo integrato capace di fornire una informazione quantitativa o
semiquantitativa sulla presenza di un determinato composto chimico (substrato o analita) in un
certo ambiente. Questa capacità deriva dall’abilità di trasformare una qualche informazione legata
alla concentrazione del substrato, risultato di una qualche interazione chimica o di una reazione, in
un segnale (generalmente un segnale elettrico, ma può essere anche di altra natura, ad esempio
colorimetrico). Ciò richiede, normalmente, la presenza di un “riconoscitore” chimico (recettore),
che subisce una qualche modificazione chimica da parte del substrato o provoca una qualche
reazione chimica che coinvolge il substrato, ed un trasduttore chimico-fisico, che trasforma la
modificazione chimica del recettore in un segnale elettrico. Un sensore elettrochimico è un
sensore che utilizza un elettrodo come trasduttore, per cui il segnale è un segnale elettrochimico
(a seconda della tecnica impiegata può essere un potenziale o una corrente o un’impedenza). I
sensori elettrochimici sono molto interessanti, grazie alla elevata sensibilità, alla semplicità d’uso e
al basso costo. I sensori elettrochimici
utilizzano elettrodi chimicamente
modificati, cioè elettrodi la cui
SUBSTRATO
superficie
viene
trasformata
chimicamente, in generale mediante
reazione del substrato
adsorbimento chimico di una qualche
RECETTORE
specie capace di interagire con
modificazione del recettore
l’analita desiderato. Naturalmente la
TRASDUTTORE
specie adsorbita deve rispondere al
requisito di selettività del sensore, per
segnale output
cui lo sforzo è sempre orientato
all’individuazione di un opportuno
recettore, dopo di che si dovrà risolvere il problema di depositare il recettore sulla superficie di un
elettrodo e garantire la “comunicazione” tra recettore ed elettrodo.
Un biosensore è un sensore (chimico o elettrochimico) nel quale il recettore utilizza un
meccanismo biochimico. Una delle proprietà fondamentali di un sensore è la selettività, cioè la
capacità di riconoscere e, quindi, rispondere ad una specifica sostanza chimica. I processi di
riconoscimento biochimico sono caratterizzati da alta selettività, per cui lo sviluppo di biosensori è
oggetto di forte interesse.
Il trasduttore serve a trasferire il segnale dall’uscita del dominio del recettore (cioè la
modificazione di una qualche proprietà chimico-fisica del recettore) quasi sempre al dominio
elettrico (cioè in un segnale elettrico). Spesso viene chiamato detector, oppure sensore o
elettrodo, anche se il termine trasduttore è più appropriato.
Un biosensore elettrochimico è un sensore che utilizza come elemento riconoscitore un
composto biologico (recettore biochimico), che è in diretto contatto fisico con un trasduttore
elettrochimico, cioè un dispositivo in grado di trasformare la ricognizione in una modifica di un
qualche segnale elettrochimico. Per tale motivo il reagente biospecifico viene immobilizzato su un
opportuno elettrodo, capace di dare un responso elettrochimico correlato all’azione del recettore
biochimico. Si tratta quindi di realizzare degli elettrodi chimicamente modificati, in grado di
“ospitare” adeguatamente il recettore biochimico; ciò significa poter depositare sulla superficie
elettrodica una qualche sostanza in grado di garantire la comunicazione elettrica e di fissare il
recettore, garantendone l’attività naturale.
La tendenza è quella di realizzare biosensori facili da usare e possibilmente poco costosi, perché
possano essere realizzati anche nella forma monouso.
La realizzazione di biosensori segue due linee di sviluppo:
95
a) riconoscimento biocatalitico
è basato su una reazione chimica catalizzata da una macromolecola biologica; il substrato
(analita) viene consumato continuamente dal biocatalizzatore incorporato nel sensore,
potendosi avere sia responsi transienti che in stato stazionario, che vengono monitorati da un
detector integrato; i più frequenti biocatalizzatori sono enzimi (mono- o multi-enzimi); cellule
integrali (batteri, funghi, cellule eucariote, lieviti); tessuti (animali o vegetali);
generalmente il substrato (S) reagisce con qualche altra sostanza chimica (S’) per azione del
biocatalizzatore, producendo uno o più prodotti; il trasduttore può essere sensibile al consumo
del co-substrato S’, oppure al prodotto P o anche al possibile trasferimento elettronico tra il sito
attivo di un enzima redox e l’elettrodo;
b) riconoscimento per biocomplessamento o bioaffinità
in questo caso si ha una interazione diretta tra il substrato e la macromolecola biologica per cui
si raggiunge la condizione di equilibrio e non si ha un consumo del substrato; le interazioni
possono essere del tipo anticorpo-antigene oppure recettore-antagonista-agonista.
Tabella 6.1
Principali recettori e relative misure elettrochimiche dei più diffusi sensori (in corsivo sono
indicati i costituenti di biosensori).
Analytes
Receptor/chemical recognition system
1. Ions
Mixed valence metal oxides;
permselective, ion-conductive
inorganic crystals;
trapped mobile synthetic or
Measurement technique/
transduction mode
Potentiometric, voltammetric
biological ionophores;
ion exchange glasses;
enzyme(s)
2. Dissolved gases,
vapours, odours
3. Substrates
4. Antibody/antigen
Bilayer lipid or hydrophobic membrane;
inert metal electrode;
enzyme(s);
antibody, receptor
Enzyme(s);
whole cells;
membrane receptors;
plant or animal tissue
Antigen/antibody;
oligonucleotide duplex, aptamer;
enzyme labelled;
In series with 1;
amperometric;
amperometric or potentiometric;
amperometric, potentiometric or
impedance, piezoelectric, optical
Amperometric or potentiometric;
in series with 1 or 2 or metal or
carbon electrode, conductometric,
piezoelectric, optical, calorimetric;
as above;
as above;
as above;
Amperometric, potentiometric or
impedimetric, piezoelectric, optical,
surface plasmon resonance;
in series with 3;
optical
chemiluminescent or fuorescent labelled;
5. Various proteins
and low molecular
weight substrates, ions
Specifc ligands
protein receptors and channels;
enzyme labelled;
As 4
fuorescent labelled
La classificazione dei sensori elettrochimici può essere fatta in diversi modi, a seconda dell’aspetto
che viene considerato: il tipo di analita (come nella Tab. 6.1), il tipo di misura elettrochimica o, più
in generale, chimico-fisica, il tipo di recettore. Per quanto riguarda il tipo di misura elettrochimica,
esistono sostanzialmente quattro metodologie di funzionamento (Tab. 6.2), a seconda dei possibili
trasduttori. Generalmente le diverse metodologie sono scelte in modo preferenziale a seconda
dell’analita oggetto di indagine.
96
Tabella 6.2
Tipologie di misure elettrochimiche nei trasduttori di alcuni sensori
Tipo di misura
1. Potentiometric
2. Amperometric
3. Conductometric,
impedimetric
4. Ion charge or field
effect
Trasduttore
Ion-selective electrode (ISE);
glass electrode;
gas electrode;
metal electrode
Metal or carbon electrode;
chemically modifed electrodes (CME)
Interdigitated electrodes;
metal electrode
Ion-sensitive field-effect transistor (ISFET);
enzyme FET (ENFET)
Analita
K+ , Cl , Ca2+ , F
H+, Na+ . . . ;
CO2, NH3;
redox species
O2, sugars, alcohols . . . ;
sugars, alcohols, phenols,
oligonucleotides . . .
Urea, charged species,
oligonucleotides . . .
H+, K+ . . .
6.2 BIOSENSORI A RICONOSCIMENTO BIOCATALITICO
L’uso di enzimi come recettori è legato alla consapevolezza che nel corpo umano ci sono alcune
migliaia di enzimi che servono a catalizzare specifiche bioreazioni con una elevata selettività, per
cui possono essere eccellenti componenti di biosensori. Quando si utilizzano enzimi come recettori
si devono considerare due questioni particolarmente importanti: l’adsorbimento dell’enzima sulla
superficie elettrodica ed il trasferimento elettronico tra elettrodo ed il cuore redox dell’enzima (ad
esempio l’eme delle proteine con Fe).
L’adsorbimento dell’enzima sulla
superficie
elettrodica
è
detto
immobilizzazione. Spesso questa
comporta qualche problema: dopo
essere stato adsorbito l’enzima
espelle alcune parti vitali per cui
viene denaturato; in pochi minuti si
autodistrugge. Per evitare questa
denaturazione
è
necessario
costituire una sorta di cuscinetto tra
la superficie metallica e l’enzima il
che può essere fatto attraverso la
cosiddetta
“modificazione”
superficiale, cioè ricoprendo la
superficie elettrodica con uno strato
di molecole organiche (ad esempio
uno strato di 4,4’-bipiridile o di
acetato di cellulosa). In questo
modo la grossa proteina (enzima)
non sente l’ambiente estraneo della
Figura 6.2.1. Realizzazione di un biosensore elettrochimico
superficie metallica per cui non
subisce la decomposizione.
In Fig. 6.2.1 è raffigurata in modo schematico la realizzazione di un biosensore elettrochimico con
immobilizzazione di enzima. L’enzima viene depositato sullo strato di acetato di cellulosa e poi
racchiuso con una membrana di collagene che lo tiene immobilizzato.
6.2.1 Biosensori per glucosio
La determinazione del glucosio nel sangue è una analisi di enorme importanza per la diagnosi e la
terapia del diabete. Per tale determinazione è stato realizzato il primo biosensore a base di
enzima: si utilizza il glucosio ossidasi (GOx), che ossida il glucosio ad acido gluconico e, in
97
presenza di O2, produce acqua ossigenata:
glucosio + O2
GOx
acido gluconico + H2O2
(6.1)
in questo caso viene monitorata amperometricamente l’acqua ossigenata che viene ossidata su un
elettrodo di Pt, per cui si misura la corrente di ossidazione:
H2O2
O2 + 2H+ + 2e
(6.2)
Questo modo di funzionamento è tipico dei biosensori elettrochimici della prima generazione
(A), che funzionano, appunto, in modo
indiretto, ossia l’enzima reagisce con il substrato
S (in questo caso glucosio), producendo una
specie chimica secondaria P2 (H2O2) che è in
grado di interagire con l’elettrodo. L’elettrodo
quindi interagisce con questo prodotto
secondario (ossidandolo o riducendolo, a
seconda dei casi), misurando la corrente, che è
correlata alla concentrazione del composto P2 e,
quindi, alla concentrazione di S. Questo sistema
ha però due limiti: da una parte l’efficienza della
produzione di P2 potrebbe non essere sempre
ottimale, per cui la sensibilità di questa
metodologia non è la migliore; dall’altra,
generalmente più limitante, il fatto che il
processo elettrodico (specialmente se di tipo
amperometrico, cioè se misura la corrente che
accompagna la riduzione o ossidazione di P2)
non è molto selettivo, perché potrebbero esserci
anche altre specie chimiche in grado di
interagire contempora-neamente a P2 e
l’elettrodo non è in grado di discriminare dato
che non è specifico per la specie P2, ma è un
generico conduttore elettronico. In questo modo
si finisce quindi per sprecare la selettività del
recettore. Ad esempio, nel caso dei biosensori
per glucosio, nei liquidi biologici nei quali si
effettua l’analisi, c’è molto spesso presenza di
acido ascorbico o acido urico, che possono
essere ossidati.
Per tale motivo si è pensato di sviluppare
biosensori della seconda generazione (B),
Fig. 6.2.2 Diverse generazioni di biosensori:
(A) prima generazione; (B) seconda generazione; che
prevedono una diversa interazione
(C) terza generazione.
dell’elettrodo con il sistema recettore. E’ chiaro
che, per sfruttare la elevata selettività del biorecettore, bisognerebbe che l’elettrodo potesse
interagire direttamente con lo stesso biorecettore, avvertendo il suo cambiamento chimico (che
avviene in seguito alla reazione con il substrato S), cioè fosse in grado di avvertire il cambiamento
di stato di ossidazione del recettore. Però, nell’uso degli enzimi del tipo ossi-ridutasi è difficile
avere il trasferimento elettronico tra il centro redox dell’enzima (generalmente all’interno del
grosso involucro di amminoacidi) e la superficie elettrodica. Tale trasferimento avviene per
tunneling, dato che la proteina non è in grado di condurre elettroni lungo i legami. E’ stato
dimostrato che il tunneling può produrre salti per una distanza massima di 2 nm. Ora, uno tra i più
piccoli enzimi, come il Citocromo c (peso molecolare 12400) ha un raggio di ca. 5 nm, per cui non
è possibile avere tunneling tra il centro redox dell’enzima e la superficie elettrodica. In questo caso
98
si rende “conduttore” l’enzima introducendo dei mediatori, gruppi redox (Ox/Red) capaci di
diffondere all’interno dell’involucro enzimatico, in modo da ridurre il salto elettronico tra un centro
e l’altro, fino al cuore dell’enzima.
Come mediatori si utilizzano diversi composti
redox organici o organometallici: ad esempio
metilferrocene
(a),
tetratiafulvalene
(b),
tetracianochinondimetano (c), mostrati nello
schema a fianco.
In Fig. 6.2.2 (B) è riportato lo schema di un
biosensore di questo tipo, dove si evita anche
l’impiego dell’ossigeno per cui l’ossidazione del
glucosio viene effettuata da parte dell’enzima
Eox (cioè GOx), che viene quindi ridotto dal
glucosio a Ered. La forma ridotta dell’enzima,
anziché venire ossidata da O2, questa volta
viene ossidata dal catalizzatore Ox (ad esempio
dopamina) che, una volta ridotto in fase
omogenea a Red, viene riossidato all’elettrodo.
glucosio + GOx(ox)
GOx(red) + 2Ox
2Red
acido gluconico + GOx(red)
GOx(ox) + 2H+ + 2Red
2Ox + 2e
(6.3)
(6.4)
(6.5)
In questa situazione si ha quindi un trasferimento elettronico (TE) tra l’enzima (che è stato ridotto
dal substrato) ed il mediatore (Ox), dopo di che la forma ridotta del mediatore (Red) viene
ossidata all’elettrodo. Poiché la forma ridotta Red può essere prodotta solo da GOx(red), cioè dalla
forma ridotta dell’enzima (ERed), che, a sua volta, può essere prodotta solo dall’ossidazione del
nostro substrato S, è chiaro che la corrente di ossidazione di Red corrisponde direttamente
all’ossidazione di S.
Nel caso del glucosio ossidasi il processo diventa la sequenza 6.3-6.5, che consente, ad esempio,
di realizzare un sensore a penna o come strip dove basta una goccia di sangue per rilevare il
contenuto di glucosio, con un tempo
di risposta di ca. 30 s. In Fig. 6.2.3 è
riportato lo schema di un sensore a
striscia:
l’elettrodo
lavorante
contiene il GOx opportunamente
immobilizzato, per cui il suo
potenziale dipende dalla quantità di
glucosio. La differenza di potenziale
tra il lavorante ed il riferimento è
quindi il segnale elettrico (misura
potenziometrica) che viene misurato
inserendo la striscia (attraverso i due
contatti) in un voltmetro digitale.
Figura 6.2.3. Sensore a strip
Un’altra possibilità è quella di modificare l’enzima introducendo un comunicatore che consenta la
ricostituzione dell’enzima (Fig. 6.2.4). Ad esempio, nel caso di GOx viene rimosso il centro attivo
(flavina-adenina dinucleotide, FAD) e viene inserito un gruppo FAD modificato, al quale è stato
attaccato un gruppo ferrocenile.
In questo caso è il gruppo ferrocenile che è in grado di comunicare con l’elettrodo, per cui si può
99
misurare sia il potenziale della
coppia
ferricinio/ferrocene
(trasduttore potenziometrico) che
la corrente erogata (trasduttore
amperometrico).
Naturalmente l’ideale sarebbe che
l’elettrodo
potesse
interagire
direttamente con l’enzima, come
avviene nei biosensori della terza
generazione (C). In questo caso
l’interazione diretta tra elettrodo e
centro redox dell’enzima è resa
possibile dalla particolare struttura
del materiale elettrodico che riduce
la distanza e rende possibile il
tunneling elettronico tra enzima ed
elettrodo.
Fig. 6.2.4. Schema di modificazione del GOx.
6.2.2 Biosensori per etanolo
Un altro esempio di biosensori elettrochimici di largo impiego riguarda la determinazione
dell’etanolo. In questo caso si utilizza il nicotinammide-adenina dinucleotide (NAD+) in presenza di
alcol deidrogenasi (ADH):
C2H5OH + NAD+
ADH
CH3CHO + NADH
(6.6)
L’alcol etilico viene ossidato ad aldeide ed il NAD+ viene ridotto a NADH. Il NADH viene poi
riossidato elettrochimicamente a NAD+ (reazione 6.7) per cui si rileva la corrente di ossidazione
NADH
NAD+ + H+ + 2e
(6.7)
Il sensore si realizza immobilizzando in prossimità di un elettrodo di carbone o Pt una miscela di
NAD+ e ADH, per cui, introducendo tale elettrodo nella soluzione alcolica si ottiene l’ossidazione
dell’etanolo e, conseguentemente, la corrente anodica. L’ossidazione di NADH richiede peraltro una
elevata sovratensione; per ovviare a questa difficoltà si può ricorrere ad un mediatore di
trasferimento elettronico, cioè un’altra sostanza capace di ossidarsi ad un potenziale più basso
(meno positivo) sulla superficie elettrodica e ossidare poi, per via chimica, il reagente (NADH),
realizzando quindi il processo elettrochimico per via catalitica (catalisi redox omogenea).
6.2.3 Biosensori a tessuto o a batteri
I sensori ad enzimi soffrono l’instabilità che spesso manifestano gli enzimi isolati; inoltre sono
abbastanza costosi. Una valida alternativa, almeno in taluni casi, è rappresentata dall’utilizzo di
materiali cellulari: tessuti vegetali o cellule di batteri, ecc.. Ad esempio i tessuti di banana, che
contengono polifenolo ossidasi, possono venire impastati con carbone realizzando così un sensore
sensibile alla dopamina, che di fatto funziona come un elettrodo ad enzima, solo che non si usa un
enzima isolato, ma il molto meno costoso tessuto.
6.3 BIOSENSORI AD AFFINITA’
I sensori ad affinità sfruttano la capacità selettiva di alcune molecole di legare determinate specie
chimiche. Ad esempio molecole come anticorpi o polinucleotidi sono in grado di legare
specificamente determinate molecole, con un processo di associazione altamente selettivo.
100
Una possibilità è quella di sfruttare la reazione tra un anticorpo (Ac) ed un antigene (Agene) per
formare il complesso anticorpo/antigene (Ac/Agene):
Ac + Agene
Ac/Agene
(6.8)
Un anticorpo è una proteina
globulare
prodotta
da
un
organismo
per
legare
una
molecola estranea (come appunto
un antigene) e marcarla perché
venga eliminata dall’organismo.
I biosensori ad affinità, detti anche
immunosensori, utilizzano degli
anticorpi o degli antigeni, marcati
con un enzima in grado di reagire
con
il
substrato
(S)
per
trasformarlo
in
un
qualche
prodotto (P). Esistono due diverse
versioni:
gli
immunosensori:
sandwich e diretti (Fig. 6.3.1). Gli
Fig. 6.3.1 Biosensori ad affinità.
immunosensori sandwich hanno gli
anticorpi attaccati alla superficie
elettrodica ricoperta da una opportuna membrana; tali anticorpi legano gli antigeni i quali, a loro
volta, legano degli altri anticorpi marcati con gli opportuni enzimi. A questo punto gli elettrodi
vengono introdotti nell’ambiente contenente il substrato e la reazione enzimatica, che trasforma il
substrato in prodotto, viene monitorata elettrochimicamente.
In quelli diretti invece vengono marcati gli antigeni con l’enzima e monitorata sempre l’attività
enzimatica di trasformazione del substrato in prodotto.
6.4 SENSORI AD ARGILLA
Un modo largamente diffuso di modificare la superficie elettrodica per poter adsorbire diversi tipi di
recettori è quello di depositare sulla superficie di un elettrodo una argilla (clay-modified
electrode, CLME). Le argille sono solidi plastici costituiti da particelle molto piccole, in grado di
assorbire acqua fino a costituire una sospensione colloidale. Sono di due tipi: cationiche e
anioniche; le prime rappresentano le argille naturali, largamente diffuse sulla crosta terrestre (ne
sono il principale costituente); sono costituite da strati di alluminosilicati (specie anioniche), per cui
possono incorporare cationi. Le seconde sono artificiali, costituite da strati di idrossidi caricati
positivamente, per cui possono incorporare anioni.
Le argille possono servire come matrici per incorporare ioni elettroattivi, essendo in grado di
incorporare ioni mediante processi di scambio ionico, in modo analogo agli ionomeri polimerici.
Inoltre l’adsorbimento di proteine sulla superficie di un’argilla consente la realizzazione di
biosensori. In questo caso si realizza un film di argilla-proteina, depositando una certa
concentrazione di proteina su un CLME. La modificazione elettrodica con argille favorisce il
processo di trasferimento elettronico eterogeneo tra la proteina e la superficie elettrodica (che,
come abbiamo visto, è uno dei problemi più rilevanti di molti biosensori). Le argille cationiche
riescono a mantenere le proteine con una orientazione favorevole per rendere veloce il
trasferimento elettronico con la superficie elettrodica (per cui consentono di realizzare biosensori
della terza generazione). D’altra parte la proteina non viene modificata dalle interazioni con
l’argilla, per cui conserva la propria struttura nativa (mentre subisce spesso degradazione quando
viene adsorbita direttamente sulla superficie di un elettrodo).
Le argille anioniche sono dette anche Layered double hydroxides (LDH) e sono costituite da
miscele di idrossidi e sali, che possono incorporare anioni per scambio anionico con gli OH . Il loro
101
comportamento è molto simile e speculare a quello delle cationiche e appaiono molto promettenti
per l’analisi degli anioni.
Per favorire il trasporto di
carica all’interno dello strato di
argilla è opportuno renderla
amorfa e non cristallina, in
modo che i pori siano più
facilmente accessibili. Questo
richiede ad esempio che si
usino argille con particelle più
piccole (ad esempio laponite al
posto
di
montmorillonite),
oppure si può impastare
l’argilla con un tensioattivo o un polimero in grado di favorire l’espansione porosa delle stesse.
Un’alternativa è la possibilità di incorporare nell’argilla dei centri redox che facciano da
trasmettitori: per le argille cationiche si utilizza Fe, Co, Cu, mentre per quelle anioniche si
utilizzano Ni, Co, Mn. Ulteriore possibilità è quella di impastare l’argilla con un polimero conduttore
(ad esempio polipirrolo) o un composito conduttore (V2O5).
La preparazione di elettrodi modificati con argilla (CLME) è un processo abbastanza semplice. Si
deposita la sospensione di argilla sulla superficie elettrodica (generalmente a spruzzo) e si lascia
evaporare lentamente. Alternativamente si possono realizzare delle paste di argilla e carbone da
depositare su una qualche superficie elettrodica.
6.4.1 Sensori a preconcentrazione
Esistono molti sensori elettrochimici ad argille, per la determinazione di ioni metallici pesanti (Fe3+,
Ag+, Cu2+, Hg2+, Cd2+, Ca2+), ma anche per la determinazione di sostanze organiche (anilina,
fenolo, nitrobenzene, nitrofenolo, dopamina, acido urico, xantina, ecc.). Un’importante proprietà
del film di argilla è quella di provocare la cosiddetta “preconcentrazione” del substrato, grazie
all’assorbimento dello stesso nei pori dell’argilla, per cui si realizza una concentrazione maggiore in
prossimità della superficie elettrodica e, quindi, un maggiore segnale elettrochimico.
Per consentire una efficace
preconcentrazione è necessario un
adeguato tempo di accumulo.
L’elettrodo deve essere lasciato a
contatto con la soluzione del
substrato per un tempo sufficiente
perché il substrato possa venire
assorbito dallo strato di argilla,
dopo di che si effettua la misura
elettrochimica (naturalmente si ha
un protocollo che fissa in modo
preciso tempi di accumulo e di
misura.
Con questa metodologia si possono determinare anche solo tracce di ioni (fino a 10 10 M), per cui
la tecnica della preconcentrazione viene ampiamente utilizzata per l’analisi dei metalli pesanti, che
hanno elevata tossicità.
La stessa metodologia è utilizzata anche per l’analisi di sostanze organiche neutre, come pesticidi o
farmaci. In questo caso si può preanodizzare l’elettrodo modificato, realizzando così una sensibile
presenza di Fe (costituente dell’argilla) ad alto stato di ossidazione, capace di attirare il substrato
organico nell’argilla.
102
6.4.2 Sensori elettrocatalitici
Una metodologia abbastanza diffusa con i
CLME è la realizzazione di sensori
elettrocatalitici. Si tratta di dispositivi nei
quali il trasferimento elettronico (TE) tra la
superficie elettrodica ed il substrato viene
mediato da un catalizzatore immobilizzato
sulla superficie elettrodica. In altri termini, in
prossimità della superficie elettrodica è
presente un “catalizzatore” che può subire
un trasferimento elettronico reversibile (quindi
molto veloce) da parte dell’elettrodo. Tale
catalizzatore scambia poi gli elettroni con il
substrato, il quale, al potenziale di lavoro, non
1
1
Figura 6.4.1. Catalisi redox omogenea.
è in grado di dare TE diretto con l’elettrodo a causa della elevata sovratensione dovuta alla
lentezza del suo TE. Questo meccanismo, detto catalisi redox omogenea, consente di ridurre la
sovratensione per il processo di TE al substrato e aumenta la corrente elettrodica (e quindi la
sensibilità del sensore).
Se consideriamo lo schema di Fig. 6.4.1, la coppia redox Ox/Red è il catalizzatore che interagisce
con l’elettrodo ad un potenziale al quale il substrato (S) non è in grado di interagire, a causa della
elevata sovratensione del suo TE. Normalmente si ha quindi la riduzione di Ox
Ox + e
Red
(6.9)
dopo di che Red è in grado di ridurre direttamente il substrato S in fase omogenea (cioè alla
superficie di contatto tra la membrana di argilla e la soluzione elettrolitica)
Red + S
Ox + P
(6.10)
dando luogo al processo di trasformazione elettrochimica del substrato. In queste condizioni si ha
la riduzione del substrato al potenziale di riduzione del catalizzatore Ox. D’altra parte l’ossidazione
di Red da parte di S riforma Ox, che è in vicinanza dell’elettrodo e quindi può essere nuovamente
ridotto: la coppia Ox/Red subisce quindi un numero elevato di cicli di TE, per cui la corrente che
passa all’elettrodo risulta molto più alta di quella che avremmo in assenza di S, per la sola
monoriduzione di Ox.
Nello schema di Fig. 6.4.1 è riportata anche una seconda coppia redox Ox1/Red1, che non è
strettamente necessaria per la catalisi redox omogenea (infatti basta la prima coppia redox), ma in
taluni casi si possono avere meccanismi multipli come quello indicato in questo caso. La specie Red
non è in grado di reagire con il substrato, ma può ridurre un’altra specie Ox1 (che potrebbe non
essere in grado di raggiungere l’elettrodo e quindi non può ridursi direttamente all’elettrodo), che è
invece in grado di ridurre il substrato (magari per una maggiore affinità chimica che facilita il TE
tra Red1 ed S). Un caso del genere si realizza ad esempio in sensori per H2O2, nei quali si usa il
metilviologeno (MV2+) come coppia Ox/Red, capace di ridursi all’elettrodo
MV2+ + e
MV+
(6.11)
2+
MV
per ridurre poi la coppia Ox1/Red1, cioè il Fe3+ dell’argilla (nontronite), che è immobilizzato nella
struttura della stessa
MV+ + Fe3+
MV2+ + Fe2+
il Fe2+ è in grado di ridurre l’acqua ossigenata (reazione di Fenton)
103
(6.12)
2Fe2+ + H2O2 + 2H+
2Fe3+ + 2H2O
(6.13)
6.4.3 Biosensori amperometrici
Come abbiamo detto al capitolo 6.2, l’immobilizzazione di un enzima rappresenta un passaggio
cruciale per la realizzazione di un biosensore, dato che è possibile avere la denaturazione dello
stesso enzima. Le argille si presentano come particolarmente adatte a questa attività di
immobilizzazione, grazie alle loro caratteristiche di idrofilicità e porosità e alla capacità di
rigonfiamento. L’intrappolamento di un enzima nella matrice argillosa è un procedimento semplice
e poco costoso: si tratta di far adsorbire una soluzione colloidale di argilla ed enzima sulla
superficie elettrodica. Purtroppo, il tempo di vita di un tale elettrodo modificato risulta abbastanza
limitato, dato che l’enzima viene lentamente rilasciato in soluzione. Per ovviare a questo
inconveniente si introduce nell’argilla una qualche sostanza capace di legare l’enzima.
Come abbiamo già detto, l’utilizzazione di argille nella realizzazione di biosensori per la
determinazione del glucosio, consente di realizzare biosensori della terza generazione, che
sfruttano quindi pienamente l’elevata selettività dell’enzima.
6.5 NANOPARTICELLE
Una delle frontiere più promettenti della sensoristica elettrochimica, ma non solo, è l’utilizzazione
di nanoparticelle. Lo sviluppo di nanoparticelle ha avuto un grande impulso grazie alle proprietà
dell’oro di formare con facilità nanoparticelle, di notevole stabilità (anche all’aria, per cui possono
essere facilmente manipolate). In realtà l’utilizzo di nanoparticelle d’oro risale ai tempi antichi
(probabilmente V-IV Sec. AC, in Egitto e in Cina, dove si utilizzava il cosiddetto “oro solubile” sia
per attività decorative che come medicinale). In effetti l’oro solubile era una dispersione colloidale
di nanoparticelle di oro metallico, che costituiva una soluzione rosa utilizzata frequentemente
durante il medioevo per curare diverse malattie. Nel 1618 fu pubblicato il primo libro sull’oro
“potabile”.
Nel 1857 Faraday riportò la formazione di soluzioni rosso intenso di oro colloidale, per riduzione
di cloroaurato (AuCl4 ) con fosforo in solfuro di carbonio. Il termine colloidale in realtà fu coniato
pochi anni dopo (dal francese colle). Faraday riuscì a depositare uno strato di questo colloide
facendo evaporare la soluzione e poté constatare che si aveva un cambiamento reversibile di
colore mediante compressione meccanica.
Le proprietà fisiche e chimiche di nanoparticelle metalliche con un diametro tra 1÷10 nm sono
notevolmente diverse da quelle del metallo massivo, ma anche da quelle del singolo atomo,
fortemente dipendenti dalle dimensioni delle nanoparticelle (oltre che dalla distanza interparticelle)
e dalla natura del guscio di protezione (che è necessario per stabilizzare le nanoparticelle ed
impedire la loro coagulazione).
Nelle nanoparticelle di dimensioni inferiori a 20 nm si ha un gap tra la banda di valenza e quella di
conduzione (a differenza dei metalli), per cui si ha una transizione metallo-isolante quando le
dimensioni scendono al di sotto di tale valore. Peraltro si è verificato che questi nanoclusters sono
in grado di manifestare fino a 15 stati di ossidazione (in realtà parrebbe che il numero fosse
limitato dalla finestra di potenziale esplorabile, più che dalle proprietà redox del nanocluster).
La struttura dei nanoclusters è assimilabile a quella che si ottiene considerando gli atomi di Au
come sfere, per cui ciascun atomo è circondato da 12 atomi-sfere. Ciò comporta che ogni guscio è
costituito da 10n2 + 2 particelle, quindi i clusters più frequenti sono (n = 3÷8) Au55 (1+12+42),
Au147 (1+12+42+92), Au309, Au561, Au923, Au1415, Au2057 (1+12+42+92+162+252+362+492+642).
La preparazione di nanoparticelle di oro (AuNPs) è stata realizzata, più di cinquant’anni fa, per
semplice riduzione dell’acido cloroaurico HAuCl4 con citrato di sodio in acqua.
Per stabilizzare le nanoparticelle è però necessario aggiungere anche un tiolo detto pure
mercaptano: CH3-(CH2)n-SH.
104
In Fig. 6.5.1 si usa un tensioattivo (2) ed il
mercaptopropionato
di
sodio
(1)
HS-CH2-CH2-CO2Na. I tioli hanno la
capacità di attaccarsi sulla superficie di Au
metallico, formando un guscio di molecole
che ricopre totalmente la superficie con un
monostrato
molto
compatto
(self
assembled monolayer: SAM), che
rende stabili le nanoparticelle e impedisce
la loro coalescenza.
Il legame tra il tiolo e Au non è ben
definito: in effetti non si tratta di un vero
solfuro (la reazione tra Au metallico e RSH non sembra sviluppare H2, d’altra parte
la formazione avviene anche utilizzando un
disolfuro R-S-S-R). Lo stato di ossidazione
di Au nelle AuNPs appare essere Au0, per
Figura 6.5.1. Preparazione nanoparticelle di Au.
cui il legame Au-S non avrebbe le
caratteristiche di un solfuro. D’altra parte,
nel legame tra Au e il tiolo non appare essere presente l’H (la decomposizione termica produce
infatti disolfuro e non il tiolo), per cui la questione è ancora aperta. Il legame risulta essere Au-S,
ma con caratteristiche diverse del solfuro di Au. L’ossidazione con iodio di nanoclusters SAM porta
alla formazione di ioduro di oro e disolfuro, il che consente di sciogliere le AuNP, ad esempio dopo
averci costruito un guscio di molecole attorno (un caso tipico è quello di costruire un guscio di
polimero) per cui rimane il guscio vuoto, che può essere utilizzato per diverse applicazioni.
Il metodo più largamente utilizzato oggi è quello di
Brust-Schiffrin (Fig. 6.5.2), che prevede una riduzione
in un sistema bifasico e la stabilizzazione delle
nanoparticelle con alcantioli: l’anione cloroaurato
AuCl4 viene trasferito dalla soluzione acquosa al
toluene
grazie
alla
presenza
di
cationi
tetraottilammonio (C8H17)4N+, avendo sciolto in
toluene bromuro di tetraottilammonio (C8H17)4NBr, che
si dissocia abbastanza facilemente grazie alle grandi
Figura 6.5.2. Sintesi di Brust-Schiffrin.
dimensioni del catione (per cui le interazioni
coulombiane sono meno forti). In toluene l’anione
cloroaurato viene poi ridotto con NaBH4, in presenza di dodecantiolo C12H25SH, formando
nanoparticelle di dimensioni che dipendono dal rapporto tiolo/Au, ma con una relativamente bassa
dispersione.
AuCl4
(aq)
m AuCl4
+ (C8H17)4N+(toluene)
(toluene)
(C8H17)4N+AuCl4
+ n C12H25SH(toluene) + 3m e
La sintesi di Brust-Schiffrin
consente di preparare AuNPs
con vari gruppi funzionali
grazie alla possibilità di reazioni
di scambio degli alcantioli, per
cui si possono attaccare alla
AuNP dei tioli con opportuni
gruppi funzionali (Fig. 6.5.3)
che possono svolgere diverse
funzioni (catalisi, recettori,
building blocks, ecc.).
(toluene)
(6.14)
4m Cl + [Aum(C12H25SH)n](toluene) (6.15)
Figura 6.5.3. Funzionalizzazione di AuNP per scambio di alcantioli.
105
Questa metodologia di scambio, consente di sfruttare tutte le abilità della sintesi organica per
funzionalizzare le AuNPs in relazione ai diversi impieghi che se ne possono fare. In particolare è
possibile introdurre dei gruppi funzionali terminali che consentano di ancorare le AuNPs su
specifiche superfici (elettrodiche), per tutte le applicazioni di tipo eterogeneo (catalisi chimica ed
elettrochimica, elettrodi chimicamente modificati, ecc.). D’altra parte è possibile introdurre gruppi
funzionali in grado di svolgere particolari azioni (ad esempio recettori per sensori e biosensori).
Oltre agli alcantioli, che rimangono comunque i principali composti impiegati per stabilizzare le
AuNPs, possono venire utilizzate anche altre sostanze. Ad esempio fosfine (come la trifenilfosfina
PPh3 o la tri-n-ottilfosfinaossido, TOPO) che consentono di ottenere anche degli arrays
bidimesionali e tridimensionali di AuNPs.
Un’altra possibilità è quella di utilizzare dei polimeri come stabilizzanti delle AuNPs. Naturalmente il
ruolo del polimero è quello di impedire la coagulazione delle nanoparticelle. Si è realizzata la
formazione di AuNPs per riduzione di HAuCl4 (mediante riflusso in metanolo) in presenza di PVP
(polivinilpiridina) oppure per riduzione con NaBH4 in presenza di poliacrilammide.
Un aspetto di particolare rilevanza, per la grande potenzialità applicativa, è la possibilità di
realizzare dei dendrimeri. Si tratta cioè di attaccare alla nanoparticella (fig. 6.5.4), sempre
mediante un gruppo SH, dei dendrimeri che consentono di svolgere diverse funzioni (in particolare
nel campo della sensoristica). Si sono realizzate, ad esempio, nanoparticelle con attaccati fino a
180 gruppi ferrocenile.
Figura 6.5.4. Sintesi di dendrimeri per reazione di scambio di tioli.
6.5.1 Riconoscimento molecolare
AuNPs funzionalizzate con gruppi ammidoferrocenile possono essere utilizzate come sensori
elettrochimici per gli ioni H2PO4 e HSO4 . In presenza di ioni tetrabutilammonio (n-Bu4N+) si ha
una interazione tra gli anioni in questione e il gruppo ammidoferrocenile. Ad esempio, con H2PO4
si forma un legame a idrogeno tra l’idrogeno del gruppo ammidico e l’ossigeno negativo del
fosfato; ciò consente all’anione fosfato di interagire con il Fe, in particolare di stabilizzare il Fe3+ del
ferricinio, facilitando quindi l’ossidazione del ferrocene a ferricinio. Questa stabilizzazione si traduce
in uno spostamento del potenziale della coppia Fe3+/Fe2+ a valori meno positivi, con un
106
E° = E°libero E°legato = 220 mV, che consente di riconoscere facilmente la presenza dell’anione
fosfato. Questa elevata variazione di potenziale è sensibilmente maggiore di quella che si ottiene
per un ammidoferrocene libero che interagisca con un anione H2PO4 (circa 45 mV), grazie al fatto
che il guscio di tioli attorno alla AuNP comprime l’anione fosfato vicino al gruppo
ammidoferrocenile, dato che i canali di penetrazione sono molto sottili
Questa capacità viene sfruttata ad esempio per la
NH2
determinazione dell’ATP (adenosintrifosfato, schema a
N
N
fianco), che è un importante agente del ciclo biologico, per
N
il trasferimento di fosfati (in particolare al glucosio) e di
O
N
O
O
O
P
O P O P OH energia. I fosfati presenti nell’ATP sono in grado di
O
H
H
interagire con il gruppo ammidoferrocenile, provocando lo
OH
OH
OH
H
H
shift catodico del suo potenziale redox.
OH OH
Mediante voltammetria ciclica (Fig. 6.5.5) si rileva il rapporto tra i gruppi ferrocenile liberi e quelli
legati, dal rapporto tra i rispettivi picchi di riduzione del Fe3+. Nella scansione anodica (cioè quando
il potenziale del microelettrodo di Pt, che si usa come lavorante per rilevare il processo
elettrochimico, si muove verso valori più positivi) si ha l’ossidazione del ferrocene (Fe2+) a ferricinio
(Fe3+), che non risente della presenza del fosfato (ATP). Nella scansione catodica di ritorno, si ha
la riduzione del Fe3+: al potenziale più positivo quello del ferrocenile libero e meno positivo quello
del ferrocenile legato, che è stabilizzato dal fosfato. La quantità di Fe3+ legato dipende dalla
quantità di ATP, per cui si può effettuare una vera e propria titolazione dell’ATP (fig. 6.5.6).
Figura 6.5.6. Titolazione di ATP2
Bu4N)2ATP
Figura 6.5.5. Voltammetria ciclica di AuNP
a) solo AuNP
b) AuNP + ATP2
c) con un eccesso di (n-
Nel caso del bisolfato HSO4 le interazioni sono più deboli, per cui non si ha un analogo
spostamento del potenziale redox. Ciò significa che non si ha lo sdoppiamento dei picchi
voltammetrici, ma uno spostamento a valori meno positivi del picco di riduzione. Comunque lo
spostamento è funzione della quantità di gruppi ferrocenile legati, per cui si può determinare la
quantità di HSO4 presente.
6.5.2 Elettrocatalisi
Recentemente è stata riportata l’attività elettrocatalitica di AuNPs nell’ossidazione elettrochimica di
CO e di CH3OH:
107
CO + H2O
CO2 + 2H+ + 2e
(6.16)
CO + 4OH
CO32 + 2H2O + 2e
(6.16’)
CO2 + 6H+ + 6e
(6.17)
CH3OH + H2O
CH3OH + 8OH
CO32 + 6H2O + 6e
(6.17’)
rispettivamente in ambiente acido e in ambiente alcalino.
Precipitando delle AuNPs stabilizzate con alcantioli su un elettrodo di Glassy Carbon (GC), si può
rilevare il picco di ossidazione del CO o del CH3OH, a seconda del substrato presente, cosa che non
si ha sul solo GC. La corrente di picco aumenta all’aumentare della concentrazione del substrato,
anche se per avere l’effetto elettrocatalitico è necessaria una pre-ossidazione dell’elettrodo
chimicamente modificato ad un potenziale abbastanza positivo.
Depositando per riduzione elettrochimica diretta di una soluzione di NaAuCl4, delle AuNPs su un
elettrodo di oro, si ottiene un elettrodo che catalizza la riduzione elettrochimica di O2:
O2 + 2H+ + 2e
H2O2
(6.18)
H2O2 + 2H+ + 2e
2H2O
(6.19)
Analogamente si sono ottenuti elettrodi capaci di svolgere un’azione elettrocatalitica nella riduzione
di O2, depositando AuNPs su un elettrodo di diamante drogato con boro (Boro-Dopped
Diamond, BDD), ottenendo un’efficienza 20 volte superiore di quella dei depositi su oro.
Naturalmente si capisce la rilevanza di questi risultati per le possibili applicazioni nella tecnologia
delle celle a combustibile.
6.5.3 Interazioni con DNA
Un aspetto di notevole importanza è legato alla possibilità di legare alle AuNPs delle sequenze di
DNA (oligonucleotidi), funzionalizzate con un gruppo SH terminale.
Queste AuNPs modificate possono venire
utilizzate per due diverse finalità: da una
parte la capacità degli oligonucleotidi di
ibridizzare con il DNA complementare,
consente di accoppiare le AuNPs con una
sequenza complementare di DNA realizzando
così un nanocristallo (Fig. 6.5.6), cioè una
distribuzione di nanoparticelle d’oro in modo
perfettamente ordinato secondo la struttura
del DNA o degli oligonucleotidi utilizzati come
telaio.
Dall’altra
parte
le
AuNPs
possono
riconoscere, sempre grazie al meccanismo di
ibridizzazione
con
la
sequenza
complementare, una specifica sequenza del
DNA, il che le rende dei potenti biosensori
per l’analisi del DNA. Questa potenzialità è
alla base dello sviluppo di biosensori per la
diagnosi
di
malattie
che
inducono
modificazioni del DNA, come ad esempio i
Figura 6.5.6. Ibridizzazione di AuNPs con oligonucleotidi. tumori.
108
La Fig. 6.5.7 mostra il meccanismo di
riconoscimento di un oligonucleotide da
parte delle AuNPs funzionalizzate con
oligonucleotidi complementari.
L’ibridizzazione consente di intercettare lo
specifico oligonucleotide, la cui presenza,
dopo la deibridizzazione, potrà essere
riconosciuta con un qualche metodo
analitico.
Figura 6.5.7. Meccanismo di riconoscimento di
oligonucleotidi.
6.6 NANOTUBI DI CARBONIO
Un’altra realtà che, come la precedente, sta irrompendo nella ricerca scientifica di questi ultimi
anni, coinvolgendo molteplici aspetti e grandi potenzialità è quella dei nanotubi di carbonio
(carbon nano tube, CNT)
L’interesse per i CNTs, così come quello
per le AuNPs, riguarda molte proprietà
chimico-fisiche e svariate applicazioni, per
cui il loro aggancio con la sensoristica è
solo una piccola parte di tale interesse.
Un nanotubo di carbonio è un piano di
grafite (Fig. 6.6.1) che si avvolge a cilindro
saldando le due estremità lungo le quali gli
atomi di C sono reattivi, avendo un
elettrone spaiato.
Figura 6.6.1. Piano di grafite (
= C).
Esistono modi diversi di arrotolomaneto del piano di
grafite per cui la struttura dei nanotubi risulta
diversa e, conseguentemente, diverse risultano le
proprietà chimico-fisiche. Come si può osservare in
Fig. 6.6.2, l’asse di rotazione nei tre nanotubi è
diverso per cui si ottengono non soltanto una
diversa configurazione della distribuzione degli
atomi di C rispetto all’asse del tubo, ma anche una
diversa capacità di curvatura della superficie
laterale. La stessa figura mostra che i nanotubi sono
chiusi alle estremità. Poiché gli atomi terminali che
si hanno in un nanotubo aperto, hanno proprietà
chimiche molto interessanti, si provvede a tagliare i
nanotubi in modo da realizzare dei tubi aperti
per le svariate
Figura 6.6.2. Diverse tipologie di CNTs.
109
applicazioni nelle quali vengono impiegati. Peraltro, a
seconda del tipo di arrotolamento la configurazione dei C
terminali è sensibilmente diversa.
Esistono nanotubi costituiti da una singola superficie,
cioè formati da un unico piano di grafite (Single Walled
Nano Tube, SWNT) e nanotubi costituiti da più tubi
concentrici, cioè da più piani grafitici arrotolati (Multi
Walled Nano Tube, MWNT) (Fig. 6.6.3).
Il diametro di un nanotubo varia da 0.4 nm a 3 nm per
un SWNT, mentre può variare da 1.4 nm a 100 nm per
un MWNT; la lunghezza può essere anche di diverse
centinaia di nm.
Figura 6.6.3. SWNT e MWNT
Si tratta di materiali con caratteristiche estremamente versatili e importanti, quali ad esempio:
ottima conducibilità termica,
buona conducibilità elettrica con possibilità di comportarsi da conduttori metallici o da
semiconduttori (a seconda del diametro e di altri parametri),
superconduttività a temperature relativamente alte,
elevata resistenza e buona elasticità.
Si sono realizzati elettrodi chimicamente modificati con CNTs, ad esempio utilizzando il Nafion per
solubilizzare i CNTs e confinarli sulla superficie elettrodica. In questo modo sono stati preparati, tra
gli altri, elettrodi con una rilevante attività elettrocatalitica nei confronti di H2O2 e di NADH, dovuta
proprio ai CNTs. Questa attività elettrocatalitica è stata sfruttata per realizzare dei biosensori con
l’immobilizzazione di enzimi ossidasi (come GOx) o con l’immobilizzazione di enzimi deidrogenasi,
con elevata stabilità e ottima riproducibilità.
In alternativa al Nafion, si possono utilizzare polimeri conduttori, come il polipirrolo (PPy) o la
polianilina (PAn) per preparare elettrodi a nanocompositi CNT/PPy o CNT/PAn con elevata stabilità
e conduttività e facili da preparare.
Un’altra possibilità è quella di preparare elettrodi a pasta, impastando CNTs con olio e
depositando la pasta in una cavità nella quale sia presente il contatto elettrico. Per avere buoni
responsi elettrodici è necessario avere elevate percentuali di CNTs nella pasta.
Una tecnica molto diffusa per la
preparazione di elettrodi a base di CNTs è
Fe(CN)63
Fe(CN)64
la tecnica sol-gel, una tecnica che ha
trovato notevoli applicazioni anche in
elettrochimica per la preparazione
di
particella
elettrodi
a
carbonio
ceramici
(Ceramic
di silicato
Carbon Electrode, CCE), ottenuti facendo
CNT
indurire della polvere di carbone o grafite
in una matrice di gel di silice.
Analogamente si possono preparare dei
Ceramic-Carbon Nanotube Nanocomposite
Electrodes (CCNNEs), facendo indurire i
Figura 6.6.4. Nanocompositi CNT/sol-gel.
CNTs in matrici di gel di silice. La preparazione di gel di silicati utilizza composti
come il metiltrietossisilano, come precursore che viene idrolizzato a metilsilano, il quale polimerizza
per policondensazione. L’idrolisi dei gruppi etossilici viene promossa da HCl, con formazione dei
corrispondenti silanoli (Si-OH), che polimerizzano per policondensazione formando i silossani. Si
ottiene così una sospensione colloidale di particelle (sol) le quali possono aggregarsi per ulteriore
110
condensazione per formare una struttura rigida e porosa (gel).
CH3
C2H5O Si OC2H5
OC2H5
CH3
HO Si OH
OH
n
CH3
Si O
+
+ 3H2O
CH3
HO Si OH
OH
3C2H5OH
CH3
HO Si O
OH
CH3
HO Si OH
OH
CH3
Si O
CH3
Si
+
CH3
Si OH +
OH
H2O
CH3
Si
n
Alcuni silossani hanno caratteristiche idrofobiche per cui sono in grado di interagire con i CNTs
attraverso interazioni idrofobiche. La formazione del sol in presenza di CNTs provoca la
separazione di questi ultimi in singoli CNT per arrivare anche alla frammentazione degli stessi in
tratti indipendenti (Fig. 6.6.4). In questo modo i frammenti esterni dei CNTs sono
elettrochimicamente attivi nei confronti di specie elettroattive.
Gli elettrodi a nanocompositi CNT/sol-gel possono essere utilizzati per lo sviluppo di biosensori,
mediante intrappolamento di enzimi o altre proteine nei nanocompositi, grazie all’eccellente
biocompatibilità della matrice sol-gel e le ottime proprietà elettrochimiche dei CNTs. Ad esempio si
è realizzato l’intrappolamento dell’enzima amminoacido-ossidasi per un biosensore per la
determinazione degli amminoacidi.
6.6.1 Elettrocatalisi
Esistono diverse tipologie di elettrodi a base di carbonio (GC, grafite, BDD, fullerene), con
caratteristiche diverse a causa delle differenti proprietà strutturali ed elettroniche che
caratterizzano i vari materiali. I CNTs hanno un comportamento elettrochimico sensibilmente
diverso dagli altri carbo-elettrodi. Essi sono caratterizzati da due distinti tipi di atomi di C: quelli
sulla superficie laterale e quelli terminali. Mentre i primi si comportano come gli atomi di C planari
della grafite (ad esempio di una HOPG, High Orientated Pyrolytic Graphite), i secondi si
comportano come gli atomi terminali di una HOPG: la loro insaturazione li rende più reattivi. Pur
avendo una configurazione simile alla HOPG i CNTs esercitano un rilevante ruolo elettrocatalitico;
sono in grado cioè di facilitare i processi di TE verso diversi substrati. Questa accelerazione del TE
viene imputata a due fattori: (i) un migliore contatto (bagnabilità) con il substrato grazie alla
porosità del materiale elettrodico; (ii) la struttura elettronica superficiale sensibilmente diversa,
infatti la superficie non è planare, ma cilindrica per cui si hanno delle distorsioni dei legami, oltre a
possibili difetti topologici. Alcuni dati sperimentali tenderebbero però ad attribuire un ruolo
preminente agli atomi di C terminali e, probabilmente, anche alla loro capacità di trasformazione
chimica (ad esempio con formazione di gruppi carbossilici).
L’attività elettrocatalitica può essere comunque sfruttata per l’analisi di diverse sostanze, come
mostra la seguente Tabella:
Substrato
Elettrodo
Substrato
Elettrodo
Catecolo
Dopamina
Cisteina
Glutatione
Omocisteina
NADH
H2O2
MWNT
SW/MWNT
CNTPE
MWNT
MWNT
MWNT
MWNT
Acido Urico
Ossigeno
Glucosio
Adenina
Guanina
Insulina
SWNT
MWNT
MWNT
CNTPE
CNTPE
MWNT
111
6.6.2 CNTs funzionalizzati
Una metodologia di funzionalizzazione dei CNTs consiste nel formare dei nanocompositi di
opportuni metalli (o ossidi metallici) e CNTs, i quali si prestano particolarmente bene come
supporti per catalizzatori metallici, grazie alle specifiche proprietà, in particolare all’elevata area
superficiale. Ad esempio elettrodi a nanocompositi ottenuti con nanoparticelle di Pt e CNTs
possono essere utilizzati come sensori elettrochimici. L’elevata area superficiale favorisce il
trasporto di massa per cui il responso amperometrico è esaltato aumentando così la sensibilità nei
confronti dei substrati. Su Pt ad esempio può venire ossidata l’H2O2, il che consente di realizzare
un biosensore elettrochimico per il glucosio: intrappolando GOx, che ossida il glucosio, in presenza
di O2, ad acido gluconico e H2O2, si è ottenuto un biosensore molto più sensibile delle versioni
GOx/GC, GOx/Pt/GC e GOx/CNT/GC.
Lo stesso tipo di nanocompositi può trovare impiego come sensori per ossigeno, ma anche come
catodi per Fuel Cells a metanolo.
Un’altro tipo di funzionalizzazione riguarda i composti organici. I composti aromatici danno forti
interazioni con la struttura planare della grafite, di tipo - , formando prodotti di adsorbimento
molto stabili. Rispetto agli altri composti di carbonio, i CNTs possiedono una significativa curvatura
della superficie laterale che conferisce loro una maggiore capacità -coniugativa ed un carattere
fortemente idrofobico. Per tali caratteristiche le interazioni tra composti aromatici e CNTs sono
sensibilmente più forti di quelle con grafite. Alcune tra le diverse sostanze aromatiche utilizzate per
questo tipo di funzionalizzazione sono riportate nella seguente Tabella:
Substrato
Ni complessato
Cu complessato
Tionina
Arildiazonio
Pirene
9,10-Fenantrachinone
1,2-Naftochinone
4-Nitrobenzilammina
Porfirina
Antracene
Tensioattivi
Polianilina
Elettrodo
SWNT
SWNT
SWNT
SWNT
SWNT
MWNT
MWNT
MWNT
SWNT
SWNT
SWNT
SWNT
Sui CNTs è possibile integrare anche biomateriali come proteine, enzimi, antigeni, anticorpi o DNA.
Si realizzano così dei sistemi ibridi che sfruttano le proprietà conduttrici o semiconduttrici dei CNTs
accoppiate con le proprietà catalizzatrici o riconoscitrici dei biomateriali. In particolare, la cavità
interna o la superficie esterna dei CNTs costituiscono una opportuna piattaforma per ospitare le
biomolecole e realizzare così dei nanodispositivi bioelettronici.
Un aspetto particolarmente interessante dell’interazione tra CNTs e biomolecole è la capacità di
facilitare il TE da parte di enzimi (come il GOx), eme-proteine, tra cui Citocromo c, HRP
(Horseradish perossidasi), emoglobina, mioglobina, ecc.. La capacità dei CNTs di favorire il TE,
assieme alla specificità delle interazioni enzima-substrato, consentono di realizzare dei sistemi
nanoibridi per lo sviluppo di nanodispositivi bioelettronici. Tuttavia rimangono ancora alcuni
problemi da risolvere: (i) i CNTs tendono ad aggregarsi, per cui non sono facilmente manipolabili;
(ii) la comunicazione elettronica tra proteina e CNTs è relativamente lenta; (iii) le forti interazioni
tra le proteine e i CNTs portano a distorsioni delle proteine con rischio di perdita delle loro attività
biocatalitiche nei confronti dei substrati. Per evitare questi limiti è necessaria una opportuna
funzionalizzazione dei CNTs per aumentare la loro biocompatibilità.
In ogni caso si possono realizzare biosensori elettrochimici che, come i biosensori elettrochimici
convenzionali, sono classificati in tre categorie: (i) prima generazione, quelli che rilevano H2O2 o O2
coinvolti nelle reazioni enzimatiche; (ii) seconda generazione, quelli che utilizzano un mediatore di
TE; (iii) terza generazione, quelli che sono basati sul TE diretto da parte degli enzimi. Gli elettrodi a
112
CNT hanno dimostrato di possedere un’attività elettrocatalitica nei confronti dell’ossidazione di
H2O2 e della riduzione di O2, oltre alla capacità di facilitare il TE delle proteine. Queste due
proprietà rendono i CNTs particolarmente interessanti per la realizzazione di biosensori della prima
e della terza generazione. In aggiunta però, si possono immobilizzare diversi elettrocatalizzatori
organici, cioè mediatori di TE per catalisi redox omogenea (come antracene ed altri composti
aromatici polinucleari) grazie alle particolari interazioni - che si possono instaurare. Ciò consente
sia di accelerare il TE a substrati come H2O2, che fungere da navetta per il TE tra CNT e la
proteina. Queste proprietà, assieme alla buona conducibilità elettrica dei CNTs consentono di
realizzare biosensori elettrochimici della prima e della seconda generazione. Ad esempio,
funzionalizzando un MWNT con Fe-ftalocianina, in grado di funzionare da catalizzatore redox per
l’ossidazione di H2O2, e co-immobilizzando GOx su tali MWNTs funzionalizzati, si sono realizzati dei
biosensori di elevate prestazioni (elevata sensibilità e selettività) per la rilevazione del glucosio.
Le notevoli potenzialità dei CNTs sono correlate alla convergenza di alcune importanti proprietà: (i)
i CNTs hanno una spiccata attività elettrocatalitica; (ii) le proprietà strutturali li rendono
particolarmente interessanti per ospitare sostanze con specifica funzionalità elettrochimica o
biologica, compresi mediatori di TE; (iii) i CNTs favoriscono il TE in diverse proteine; (iv) gli
elettrodi a CNTs manifestano le caratteristiche proprietà degli elettrodi tridimensionali, se vengono
adeguatamente depositati sull’elettrodo di supporto.
113