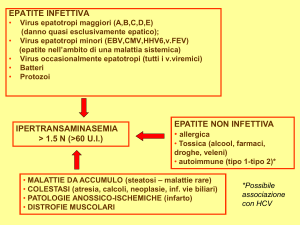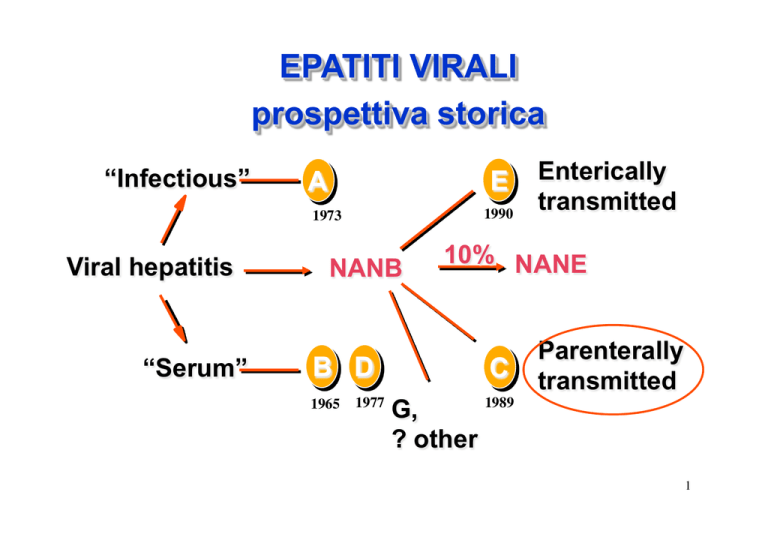
EPATITI VIRALI
prospettiva storica
“Infectious”
E
A
1990
1973
Viral hepatitis
“Serum”
NANB
B D
1965
1977
Enterically
transmitted
10% NANE
C
1989
G,
? other
Parenterally
transmitted
1
GROUP VI RNA viruses
GROUP VII DNA viruses
Hepadnaviridae
3
Il virione
Virioni e particelle subvirali
42 nm
Scoperto nel 1965 (Blumberg et al.)
20 nm
200 nm
Source: Center for Disease Control and Prevention
Il genoma
3213
• Primasi TP
• Spacer
• Trascrittasi inversa
• RNasi H
HBsAg
proteine
envelope :
• large 39kDa
• Medium 31kDa
• Small 24kDa
S
prom
2458
PS1
prom
EcoRI
3221, 1
(-)strand
3,200nt
(+)
(-)
Pre-C
prom
DR1
ENII
X
prom
834
proteina preC 24kDa
ê
HBeAg 16kDa
preS2
polymerase
Terminal protein
HBcAg 21kDa
(nucleocapside)
rcDNA: forma circolare rilasciata
parziale doppio filamento
Oligo RNA con cap
DR2
1622
1816
X
• proteina X
17kDa
5
Il ciclo replicativo
pre-S1
pre-S2
16 ore
recycling
RNA subgenomici
Lamivudina
Adefovir
RNA subgenomici
IFNa
24 ore
RNA pregenomico
Proteine virali
• Gli antigeni s (HBsAg nelle 3 forme) costituenti dell’involucro
esterno (envelope) prodotti del gene s (trascritti subgenomici 3 AUG)
• L’antigene c (HBcAg) il costituente del capside (core) prodotto del
gene precore/core (trascritto pre-genomico AUG interno)
• L’antigene e (HBeAg) prodotto del gene precore/core (trascritto
pregenomico AUG iniziale) è processato differentemente dalla cellula,
viene secreto dall’epatocita si può trovare nel siero. Attraversa la
placenta ed induce immunotolleranza nel neonato (modello murino)
Indica replicazione attiva e infettività, ma non è essenziale per la
replicazione (varianti e-minus). Il suo ruolo biologico è poco compreso.
• La polimerasi associata al virione è un prodotto del gene P, ha
attività di primasi, trascrittasi inversa (DNA polimerasi RNA e DNA
dipendente), RNasi H, (trascritto pre-genomico AUG interno non in frame)
• L’antigene X (HBxAg) localizzazione cellulare, debole
transattivatore della trascrizione di fattori cellulari è necessario per
la replicazione (trascritto subgenomico)
HBV: vie di trasmissione
• Parenterale percutanea
• Tossicodipendenti
• Trasfusi /Trapiantati
• Medici
• Paramedici
• Sessuale
• Perinatale
• Madri HBeAg+ (70-90%)
• Madri HBeAg- (20-30%)
9
Concentrazione di HBV nei
fluidi corporei
alta
sangue
siero
essudato ferite
moderata
bassa
sperma
fluido vaginale
saliva
urine
feci
sudore
lacrime
latte
Infezione acuta da HBV: i sintomi
• Periodo di incubazione: 60-90 gg (range 45-180)
• Circa il 50%-60% degli adulti non mostrano segni o sintomi
d’infezione.
• Le infezioni sintomatiche possono essere caratterizzate da:
Ø Astenia
Ø Dolori articolari
Ø Dolori addominali
Ø Perdita di appetito
Ø Nausea, vomito
Ø Ittero
Esito dell’infezione da HBV
Probabilita’ di sviluppare lo
stato di infezione cron i c a
80
70-90%
25-50%
5%
20-30%
80
Chronic Infection
40
Neonati
Bambini
Adulti
Anziani
60
40
100
20
60
20
Symptomatic Infection
0
Birth
1-6 months
7-12 months
Age at Infection
1-4 years
0
Older Children
and Adults
Symptomatic Infection (%)
Chronic Infection (%)
100
STORIA NATURALE DELL’INFEZIONE
DA HBV
90-95% (adulti)
Asintomatica Guarigione
Stabilizzata
70-90%
Infezione
Acuta
Epatite
Cronica
Cirrosi
compensata
In 5 aa
Cirrosi
30%
In 5 aa
Cancro
MORTE
10%
5–10% dei trapianti
Epatite
Scompenso epatico
Portatore cronico
Attiva
10-30%
>70% neonati 60% dei casi 20-23% in 5 aa
da madre HBeAg
30 - 50 anni
Epatite fulminante in 0,5-1%
(necrosi estensiva, pz osped.)
MORTE
> 0.5–1 mil. per anno
13
Patogenesi
Perché esistono esiti così differenti?
fattori del virus
persistenza
fattori dell’ospite
clearance
L’esito dipende da una varietà di fattori virali e dell’ospite e sebbene la risposta immune giochi un ruolo
determinante per l’evoluzione, la stessa biologia del virus, e una varietà di meccansmi di adattamento,
riferibili a mutazioni in regioni critiche del genoma del virus possono influire sull’andamento dell’infezione
14
Immunopatogenesi dell’infezione da
HBV
L’ospite sano interviene
con una vigorosa
risposta immune
antivirale diretta contro
il virus e contro il
fegato che nella
maggior parte dei casi è
in grado di controllare
l’infezione
TH2
TH1
TNFα;
IFNγ
Sembrano ridurre l’accumulo di mRNA e in alcuni casi destabilizzare i componenti del capside
Determinanti della clearence virale
Risposta immune
infezione primaria
risolta
non risolta
vigorosa
CTL
policlonale
contro tutti gli Ag
CD4
vigorosa vs cAg eAg
TNF
citochine
IFN
debole
non determinabile
debole
Dati derivati dalla comparazione di pazienti infettati con HBV, dai risultati
ottenuti con scimmie inoculate con HBV per studiare l’infezione primaria, dai
risultati ottenuti con topi transgenici per l’espressione di antigeni o per la
replicazione virale
Patogenesi : il virus
Virus formation by
budding into ER
Terminal redundancy
10-50 copie / nucleo
circolarizzazione
reservoir epatico dell’acido nucleico
genomi lineari a DOPPIO
FILAMENTO che potrebbero
essere integrati
Assembly
of cores
RNA DR1 + cap
10% dei casi
- DNA strand
1° traslocazione
+ DNA strand
2° trasloc.
RNA DR1 + cap
Patogenesi : il virus
France USA
South & Central
America USA
West -South
Africa
H
Cronicità e HCC
South Europe
North Africa
Migliore prognosi
South East Asia
North West Europe
North America
L’esito sembra indipendente dal genotipo virale
Varianti virali di HBV
• Il virus ha un elevato tasso di mutazione (10-4 10-5 per
base per ciclo)
• Tuttavia la maggiorparte delle mutazioni che avvengono
durante la replicazione sono dannose o letali e non sono
mantenute nella popolazione virale che è piuttosto
omogenea
• Ciononostante possono emergere degli escape mutants
selezionati dalla risposta immune o dalla terapia
• O comunque mutanti che sopravvivono perché hanno
qualche vantaggio selettivo rispetto alla popolazione preesistente
Varianti virali di HBV
Mutazioni a livello
del gene “s”
Mutazioni a livello del
gene “pol”
Mutazioni a livello
della regione pre-core
22
EMERGENZA E SELEZIONE DELLE VARIANTI
HBeAg -MINUS DELL’HBV
HBeAg
Wild 100%
Mutante
0%
Anti - HBe
-
75%
25%
25%
0%
75%
100%
l stop-codon nella regione preC (G1896A o G1899A);
ldoppie mutazioni (A1762T e T1764A) a monte del promotore core.
Le mutazioni determinano proteina troncata o dotata di maggiore idrofobicità che non viene traslocata
attraverso il reticolo endoplasmico e pertanto non viene secreta e rilasciata in forma solubile
In quali circostanze sono stati trovati i
mutanti dell’HBsAg?
•
Erano i responsabili di almeno tre situazioni:
1) insuccesso della vaccinazione in neonati da madri
HBsAg-positive
2) fallimento della immunoprofilassi in pazienti sottoposti
a trapianto ortotopico di fegato (OLT)
3) diagnosi di infezione attiva da HBV in soggetti negativi
per HBsAg
Riferimento: Locarnini, S. A. 1998. Hepatitis B Virus Surface Antigen and Polymerase Gene Variants: Potential
Virological and Clinical Significance. Hepatology 27: 294 - 297.
24
121
s-s- 124
Loop 1 of ‘a’ determinant
Vaccine Escape Mutants:
126
T126S
M133L
D144E
158 Y
F
si ottengono in realtà degli
escape mutants non solo per i
vaccini ma anche per la
possibilità di identificazione da
parte di saggi diagnostici che
costruiscono i loro reagenti su
164
E
D
questa regione
131
99
133
137
--s--s-
107 -s-s- 138 139
141
149
s-s- 147
144 G
D
145
Loop 2 of ‘a’ determinant
epitopi conformazionali altamente immunogeni
W. Carman, J Viral Hepatitis 1997; 4: 11-20
T131N
K141E
G145R
195
R
I
W
E
M
210
198
I
25
M
S
196
Diagnosi
La diagnosi è tipicamente sierologica con definizione
dell’assetto dei marcatori virali ottenuto mediante utilizzo di
tecniche immunoenzimatiche per la determinazione di antigeni
o anticorpi
HBsAg
l’utilizzo coordinato di tecniche sierologiche e molecolari ci permette di
definire alcune fasi nella storia naturale dell’infezione
Infezione acuta da HBV con “guarigione”
ccc DNA
in liver
Infezione persistente
Symptoms
HBV DNA
ALT AST
Mahomey et al CMR 1999
Interpretazione dei marcatori d’infezione
Marker
Acute
HBV
HBsAg
P
Acute HBV
Recovery
(< 6mesi)
Anti-HBs
P
Anti-HBc
IgM
(+/-)
P
Anti-HBc
P
HBeAg
P
ALT
P
HBeAg
Positive
HBeAg
Negative
Inactive
HBeAg Negative
Carrier State
P
P
P
(+/-)
(+/-)
Possono essere
presenti in tracce
P
Possono essere
presenti in tracce
P
P
P
P
P
(+/-)
Anti-HBe
HBV DNA
Possono perdurare
dopo la sieroconversione HBsAg
Chronic HBV Disease
(scomparsa lenta)
P
non rilevato
>105cpI/ml
>104 cp/ml
<1000 cp/ml
elevate
normali
elevate
elevate
normali
Keeffe EB, et al. Clin Gastroenterol Hepatol. 2006;4:936-962.
Lok AS, et al. Hepatology. 2007;45:507-539.
N.B.: 1UI = 5 copie di genoma 29
Epatite cronica o portatore inattivo?
Marker
Acute
HBV
HBsAg
P
Acute HBV
Recovery
P
Anti-HBc
IgM
(+/-)
P
Anti-HBc
P
HBeAg
P
HBeAg
Negative
P
P
P
(+/-)
(+/-)
Possono perdurare
dopo la sieroconversione HBsAg
Possono essere
presenti in tracce
P
P
Possono essere
presenti in tracce
P
P
P
P
P
(+/-)
Anti-HBe
ALT
HBeAg
Positive
Inactive
HBeAg Negative
Carrier State
(< 6mesi)
Anti-HBs
HBV DNA
Chronic HBV Disease
(scomparsa lenta)
P
non rilevato
>105cp/ml
>104 cp/ml
<1000 cp/ml
elevate
normali
elevate
elevate
normali
Keeffe EB, et al. Clin Gastroenterol Hepatol. 2006;4:936-962.
Lok AS, et al. Hepatology. 2007;45:507-539.
30
HBV: marcatori sierologici
• HBsAg
– Definisce l’infezione in atto: la persistenza per più di 6 mesi consente di
stabilire la presenza di una infezione cronica.
• HBeAg
– Indica invariabilmente replicazione / infettività
• Anti-HBe
– La sieroconversione da HBeAg a anti-HBe indica classicamente la
risoluzione, ma la positività degli anti-HBe Ab nel cronico non esclude
replica/infettività
• Anti-HBs
– Indica immunità (naturale o in seguito a immunoprofilassi)
• Anti-HBc IgM
– Differenzia l’infezione acuta dall’infezione cronica. Può perdurare per
breve tempo nell’infezione risolta.
– Positivo a bassi livelli nelle fasi di esacerbazione dell’infezione cronica
• Anti-HBc IgTot
– Presente in tutte le fasi dell’infezione: può essere l’unico marcatore nelle
31
infezioni occulte
HBV: marcatori molecolari
– HBV-DNA
•
Determinazione quantitativa mediante Real Time PCR
(Range dinamico: 10 – 109 IU/ml)
q Attività della replicazione a bassi titoli
o
o
Per identificare il portatore inattivo
Per valutare la carica virale HBV nelle coinfezioni con HCV HDV
q Infezione occulta in particolari categorie di soggetti
la persistenza a lungo termine di genomi virali all’interno del tessuto
epatico (e in alcuni casi nel siero) di individui immunosoppressi negativi per
l’antigene di superficie dell’HBV
q Risposta alla terapia
32
Terapia
Raccomandata in pazienti con :
✔ ALT persistentemente elevata
✔ Attiva replicazione virale
✔ Danno epatico da moderato a
severo
✔ Fibrosi.
Riduzione della
replicazione
End points :
✔ Sieroconvesione eAg/anti-e
✔ scomparsa di HBV-DNA
sierico (test PCR),
✔ normalizzazione ALT
✔ Prevenire cirrosi, HCC, morte.
Trattamento
• Interferone - per pazienti HBeAg + con epatite cronica
attiva. Risposta in ~ 30%.
• Lamivudina-Adefovir (Entecavir, Telbivudina Tenofovir) Analoghi nucleos(t)idici inibitori della trascrittasi inversa.
– Possibile l’emergenza di resistenze dopo trattamento
prolungato.
– Possibile il rebound dopo interruzione
1992
IFN alfa
1998
LAM
“The New Era”
Oral therapy
2002
2005
2006
ADV
ETV
LdT
PegIFN alfa-2a
2008 e
oltre…
TDF
Clevudine*
Combination Rx?
HBV Pol Resistance Mutations
Terminal Protein
Spacer
Reverse Transcriptase
RNase H
LAM e Telb-associated
F G
A
B
I169T
T184G/L
S202I
M250V
ETV-associated
C
D
E
A194T TDF-assoc.
A181V
N236T
ADV-associated: Lam sensibili
Patients (%)
Percentuale di comparsa di mutanti resistenti in relazione alla durata del trattamento
80
71
60
40
20
0
55
46
23
65
30
25
5
0 0 0
1
<1
2
3
19
11
0
x <1
3
0
x 1.2
4
?
x 1.2
5
LAM
Telbivudine
Entec. naive pt
ADV
TDF
?
Year
39
Infezione da HBV nel mondo: WHO
350 milioni di portatori del virus nel mondo
50 milioni di nuove infezioni ogni anno
1 milione di decessi all’anno per infezione da HBV
Italia: prevalenza
HBsAg: 0.5-5%
Complessivamente 1/3 della
popolazione mondiale è stata
infettata con HBV
Portatori di HBsAg:
prevalenza
>8% - alta
2-7% - Intermedia
< 2% - bassa
Fonte: CDC 2008
40
Prevenzione
• Vaccinazione - E’ disponibile un vaccino
estremamente efficace costituito da antigene S
(HBsAg) ricombinante.
• Immunoglobuline iperimmuni - Possono essere
usate per prevenire l’infezione. Devono essere
somministrate entro 24-(72) ore dall’esposizione.
Vengono somministrate ai neonati da madri HBsAg+
assieme al vaccino.
Casi di epatite riportati in USA
(1975-1997)
HBsAg purificato da
sangue di portatori
Si stima che il vaccino salvi 1 milione di vite per
anno
La speranza è l’eradicazione del virus
HBsAg
ricombinante
HDV
• 1977: scoperta di un nuovo antigene
nucleare (δ Ag) in pazienti infettati
con HBV
• 1980: trasmissione dell’infezione allo
scimpanzè
• 1986: genoma RNA (-) ~1700 nt,
associato all’antigene δ e protetto
da un envelope contenente
HBsAg
• HDV è un patogeno trasmissibile
difettivo che dipende da HBV per
l’infezione con alcune proprietà dei
virus satelliti ed altre dei viroidi
delle piante
• Poco meno del 10% di HBV
positivi sono coinfettati
G. Antonelli, M. Clementi, G. Pozzi, G.M. Rossolini Ambrosiana
Principi di Microbiologia medica, II ed. Copyright 2011 C.E.A. Casa Editrice
Flaviviridae
Gruppo IV: virus a RNA senso (+)
Specie
infettate
Malattia nell’uomo
Flavivirus
Japanese encephalitis
West Nile virus encephalitis
St Louis encephalitis
Virus Dengue
Virus della Febbre gialla
Zoonosi
(Artropodivertebrati)
Encefaliti
Febbri emorragiche
Pestivirus
Virus della diarrea bovina
Virus della febbre suina
classica
vertebrati
Genere
Hepacivirus
Non
assegnati
Virus
Virus dell’epatite C
GB virus (HGV)
Uomo
Scimpanzè
EA, EC, Cirrosi, HCC
Uomo
Epatite (?) non
associato a patologia
Flaviviridae: Relazioni filogenetiche
Classificazione di HCV
Categories
Sequence identity (%)
ü Type
ü Subtype
ü Quasispecies
66-69
77-80
>98
7 Types and major subtypes
1a, 1b, 1c
2a, 2b, 2c, 2d
3a, 3b, 3c, 3d, 3e, 3f, 3g
4a, 4b, 4c, 4d, 4e, 4f, 4g
5a
6a, 6b
7
Distribuzione geografica di HCV clade
Europe
Thailand
Hong Kong
6a Macao
Vietnam
US
Northern Europe
3a
Australia
South Asia
3b
4a Egypt
Ultimamante é in Italia
4c Central Africa
2b
1c Egypt
Western Europe
Southern Europe
2c
2a
Japan
China
5a
South Africa
1b
1a North America
Europe
Taiwan
Thailand
China
Japan
Argentina
South Africa
South America
Australia
Europe
Thailand
Japan
49
Il virus dell’epatite C (HCV)
• Flaviviridae
Hepacivirus
Envelope
• genoma 9.6 kb (+)
Core
• identificato nel 1989
• 6 genotipi maggiori
(clade)
• >50 sottotipi
• Quasispecie nell’ospite
Envelope
glycoproteins
Viral RNA (9600 nucleotidi)
55-65 nm
Organizzazione del genoma
Inizio traduzione e
replicazione
Co: Clivaggio co-traslazionale
Post: Clivaggio post-traslazionale
replicazione
IRES
Host’s signal peptidase
co
co
post
co
Ion chanel
Cysteine
autoprotease
co post post
post
?
Inibisce PKR
Complesso di replicazione
Adsorbimento ed penetrazione di HCV
scavenger receptor class B type1
gligosaminoglicani
Circulating HCV particles can be
associated with low- and very-lowdensity lipoproteins (LP).
Virus binding to the cell surface and
entry may involve the low density
lipoprotein receptor (LDLR),
glycosaminoglycans (GAG),
scavenger receptor class B type I
(SR-BI), the tetraspanin protein
CD81 and claudin-1 (CLDN1). CLDN1
functions at a late stage of cell entry,
possibly at tight junctions of
polarized hepatocytes.
Internalization depends on clathrinmediated endocytosis.
Acidification of the endosome
induces HCV glycoprotein
membrane fusion. Little is known
about the uncoating process, which
results in genome release into the
cytosol.
Il ciclo replicativo
Core p22
Core
• Encapsidazione del genoma
• Sopprime la trascrizione di alcuni geni immunoregolatori
dell’ospite (promuove la persistenza)
• Nei sistemi artificiali interferisce con la morte cellulare
programmata (promuove la persistenza e la
proliferazione cellulare attraverso l’attivazione di ras,
l’interazione con p53 –ruolo oncogenetico–)
• Interferisce con l’espressione dei genomi di virus
coinfettanti (HBV ê carica virale)
54
Glicoproteine E1 e E2
gp35 e gp60
Envelope
glycoproteins
• E1 ed E2 : coinvolte nel legame al recettore e nel
processo di penetrazione
• E2 contiene le due porzioni HVR1 e HVR2 più variabili del
genoma.
5’ NC
• Anticorpi contro HVR1 neutralizzano il legame di E2, ma Core
E1
solo alcuni cloni anticorpali appaiono proteggenti
E2
• La variabilità di E2 si origina per mutazioni random e
selezione di mutanti che probabilmente funzionano come NS2
NS3
“falsi bersagli” per il sistema immune inducendo una
NS4
risposta non neutralizzante. (promuove la persistenza)
NS5
• E2 contiene una sequenza identica per la fosforilazione 3’ NC
da parte della protein-chinasi (PKR), quindi interferisce
con i meccanismi di induzione dello stato antivirale
(competendo con eIF2 per la fosforilazione da parte di
PKR attivata dall’IFN ) (promuove la persistenza)
STRAIN H77
Nt changes
AA changes
ND
ND
1
2
3
4
5
6Mutation rate (Changes/Site/Year x 10-3)
NS5a & NS5b
• NS5a interagisce direttamente con PKR attivata da IFN,
interferendo con lo stato di resistenza antivirale indotto da IFN
(promuove la persistenza)
• NS5b rappresenta la RNA-dependent RNA polymerase (RdRp)
• Come tutte le RNA polimerasi non possiede un processo di
correzione dell’errore e questo è alla base della variabilità virale,
la creazione di nuovi epitopi confonde il sistema immune e
permette l’evasione dal controllo cellulare e umorale (promuove la
persistenza)
NS3
• È responsabile del processo proteolitico dell’intera
poliproteina a valle (attività di serine proteasi)
• Srotola l’RNA per permettere la traduzione e la
replicazione (attività di RNA elicasi)
• È un target attraente per la terapia antivirale
• Contro questa proteina sono stati sviluppati i primi
farmaci noti come DAA (direct-acting antiviral agents)
57
Infezione da HCV
• Trasmissione parenterale
• Incubazione: 50 giorni (15-160
gg)
Infezione da HCV
• Sintomi : 15-20%
Epatite acuta
• Fulminante 0,2%
• Infezione persistente: >70%
(Ep.Cronica: non attiva 35%,
lieve/moderata 40%, severa
25%)
80-85% asintomatica
10-30
70-80%
anni
• L’infezione risolta non fornisce
protezione da una successiva
reinfezione virale
• L’immunità non è duratura
Epatite cronica
Cirrosi
20-30%
HCC
1-4%/anno
Fattori che possono influenzare l’esito
dell’infezione da HCV
Host
Virus
Viral variability
HCV genotype
Quasispecies complexity
Environment
Alcohol or drugs
HBV coinfection
HIV coinfection
Steatosis
Iron
NASH
Alberti A, et al. J Hepatol. 1999;31(suppl 1):17-24.
Sex
Age
Race
Genetics
Immune response
Duration of Infection
La variabilità genetica di HCV
HCV GT1: 698-nt region spanning
the E1–E2 junction
• DIVERSITA’ INTER-OSPITE
Varianti virali dello
stesso genotipo
HCV evolution from
a common source
• DIVERSITA’ INTRA-OSPITE
Quasispecie virali
Elevata dinamica di replicazione del virus
Alto tasso di errore della polimerasi
Pressione selettiva operata dall’ospite
Ray S C et al. J Exp Med 2005;201:1753-1759
Y
Y
Y
Dinamica dell’infezione da HCV
Y
Y
Y
Y
Y
degradation
- antigen-specific
- unspecific
cell death
Neumann et al., Science 1998
T: infectable cells
I: infected cells
V: viral load
s: production rate of infectable cells
d: decay rate of infectable cells
β: de novo infection rate
δ: decay rate of infected cells
p: production rate (virions/cell/day)
c: clearance rate (virions/day)
(1 - h): reduction of de novo infection rate
(1 - e): reduction of virus production
dT/dt
dI/dt
dV/dt
= s - dT - (1 - η) βVT
= (1 - η) βVT - δI
= (1 - ε) pI - cV
Produzione (giorno) 1010-1013
Ricambio (%)
97-99
Vita media (ore)
2-5
I determinanti dell’evoluzione intra-ospite
MUTAZIONI DOVUTE
AGLI ERRORI DELLA
POLIMERASI
pressione
selettiva
dell’ospite
HCV DIVERSITA’
INTRA-OSPITE
ELEVATA DINAMICA DI
REPLICAZIONE
RICOMBINAZIONE TRA
LE VARIANTI VIRALI
EVOLUZIONE
DI HCV
Fitness delle singole
varianti mutate
Risposta immune
• Il momento decisivo per la
cronicizzazione dipende da comparsa e
qualità della risposta immune
• Risposta NK e T (Th1) più vigorosa nei
pazienti che guariscono
World J Gastroenterol. 2014 Apr 7;20(13):3418-30. doi: 10.3748/
wjg.v20.i13.3418.
Adaptive immune response during hepatitis C virus infection.
Larrubia JR, Moreno-Cubero E, Lokhande MU, García-Garzón S, Lázaro
A, Miquel J, Perna C, Sanz-de-Villalobos E.
Persistenza dell’infezione e meccanismi
64
che portano al danno epatico
Determinanti della clearence virale
Bassa pressione
selettiva di Ab
Forte
controllo virale
La risposta
immune iniziale
(CTL, CD4 TH1)
clearance virale
Alta pressione
selettiva di Ab
Debole
controllo virale
persistenza virale
Vengono prodotti epitopi fuorvianti il sistema immune
-
-
Perdita di attività CTL
CTL
Non vengono generate
CTL efficaci
Perdita di attività
T help
CD4
Non vengono generati
nuovi Ab neutralizzanti
Infezione da HCV: lo scenario globale nel 2013
Italia
1.9 milioni
3.2 %
Europa
17.5 milioni
(2.3 %)
Asia
83 milioni
(2.1%)
America
14 milioni
(1.5%)
Medio Oriente
16 million
(4.7 %)
Africa
28 milioni
(3.2%)
Australia - Oceania
0.4 milioni
(1.2 %)
Tasso di Prevalenza medio del 2.35% pari a circa 185 milioni di persone infette,
350.000 morti/anno
D. Lavanchy. Clinical Microbiology and Infection, Volume 17 Number 2, February 2011
Hanafiah Mk, Hepatology 2013
Infezione da HCV: lo scenario Italiano
La più alta prevalenza in Europa
(1.5 – 1.9 milioni di infetti)
Variabilità regionale
Frequenza residua (nuovi casi) non
azzerata e disgraziatamente
difficilmente valutabile
In Italia, l’HCV è la prima causa di:
• epatopatia (53% epatiti croniche, 52% cirrosi, 64% epatocarcinoma)
• trapianto epatico
• morte tra le infezioni trasmissibili (>20,000 decessi/anno per epatopatia)
“Le epatiti virali: urgenze, gestione e ottimizzazione delle risorse in Italia” Senato della Repubblica 19.06.2012
… ritornando alla storia naturale….
1
Esposizione
>2 sett.
Infezione
da HCV
~16%
Nessuna
infezione
~84%
Infezione
acuta
sintomatica
Infezione
acuta
asintomatica
10-30 anni
15% – 30%
Risoluzione
spontanea
<30%
?
1. Orland, et Hepatology, 2001
2. www.medscape.com/viewarticle/416562_3
Infezione
persistente
>70%
Cirrosi
epatica2
2-4% per anno
in cirrosi
HCC
Dinamica dei marcatori virologici
ALT
HCV RNA
Positivo
Negativo
Anti-HCV
0 2 4 6
Settimane
Negativo
1
2
3
4
10
20
Anni dopo l’esposizione
30
Positivo
A: Infezione cronica con viremia persistentemente elevata
B: Guarigione spontanea dopo l’infezione acuta. Gli anti-HCV ê con gli anni
C: Infezione cronica con viremia oscillante
Scott J.D., et al Molecular Diagnostic of HCV Infection. JAMA vol.297 , Feb 2007
69
Panoramica dei metodi diagnostici
disponibili
Diagnosi eziologica
Test di screening immunoenz.
Test di conferma RIBA
(immunoblot) o screening
alternativo
Tool diagnostici
Stadiazione - Monitoraggio
HCV-core Ag (HS)
HCV-RNA quantitativo
HCV-RNA genotipo
Diagnosi di laboratorio
• Anticorpi anti-HCV: dimostrano un avvenuta infezione
ma non danno informazioni sulla persistenza. Spesso
negativi nella fase acuta.
• HCV-RNA - indica una infezione attiva. E’ positivo
nell’infezione persistente e nella fase acuta. Viene
utilizzato per il monitoraggio della terapia.
• Ricerca HCV core Ag - indica infezione attiva utile per
identificare l’infezione acuta, in molte occasioni può
sostituire il test molecolare.
• Genotipizzazione – permette di valutare la probabilità
di risposta e la durata della terapia con IFN
pegilato più ribavirina
Lo standard nel trattamento di HCV
PEG-IFNs + Ribavirin
“Easy-to-treat”
(HCV-2, HCV-3)
“Difficult-to-treat”
(HCV-1, HCV-4?)
800 mg ribavirin
1,000-1,200 mg ribavirin
24 weeks
48 weeks
NIH Consensus Development Conference on Management of hepatitis C: 2002
Bersagli dei nuovi antivirali ad azione
diretta (DAA) per HCV
HCV Polyprotein
C
E1
E2
p7
NS2
NS3
NS4A
NS4B
NS5A
NS5B
Daclatasvir
Sofosbuvir
Telaprevir
Boceprevir
NS3 Protease
domain
NS3 Helicase
domain
NS3 Bifunctional
protease / helicase
NS5B RNA-dependent
RNA polymerase
Trattamento e profilassi
ü Interferone pegilato (peg-IFN) e ribavirina (RBV) in
associazione.
ü Il successo (eradicazione virale) dipende dal genotipo,
si ha nell’80% dei casi con HCV GT2 – HCV GT3, nel
40-45% dei casi con HCV GT1
ü Boceprevir e Telaprevir inibitori della proteasi virale
(NS3) usati in terapia combinata con peg-IFN+RBV
riducono gli insuccessi terapeutici con una risposta
virologica sostenuta (SVR) nel 70-80% dei relapsernaïve HCV GT1
ü Sofosbuvir inibitore della polimerasi virale (NS5b) è il
primo DAA approvato anche per HCV-GT2 e GT3 in
combinazione con solo RBV (IFN-free!) e per GT1 e GT4
in combinazione con peg-IFN+RBV
76
ü Non esiste a tutt’oggi un vaccino efficace
Vie di trasmissione e fattori di rischio
• Parenterale: Percutanea e Permucosale
d) Piercing, tatuaggio, manicure/pedicure, rasatura dal barbiere
ESPOSIZIONE NOSOCOMIALE e USO DI DROGHE PER VIA INIETTIVA :
39.6% e 30.5% dei casi di epatite acuta C
TRATTAMENTI COSMETICI CON ESPOSIZIONE PERCUTANEA: 11% dei casi
SEIEVA: Sistema epidemiologico integrato dell'epatite virale acuta. Dati relativi al periodo 2003-2010
Prevenzione dell’epatite C
• Screening dei materiali a rischio
• Modifica dei comportamenti a rischio
• Adozione dei dispositivi di protezione
individuali
% of Recipients Infected
Decremento delle epatiti C
post-trasfusionali
Donatori volontari
HBsAg
30
le frecce indicano i principali interventi nello
screening e nella selezione del sangue
donato che sono stati efficaci nell’abbassare
il rischio d’infezione
0,1-2,3/1.000.000 donazioni
25
20
Screening per fattori di
rischio per HIV
15
Anti-HIV
ALT/Anti-HBc
10
Anti-HCV
5
0
1965
1970
1975
1980
1985
Year
Adapted from HJ Alter and Tobler and Busch, Clin Chem 1997
1990
Migliori test
HCV
1995
2000
HBV/HCV e PLC
530.000 casi/anno di Carcinoma Primitivo del Fegato (PLC)
82% di questi casi è associato ad una infezione virale:
316.000 (60%) all’infezione da HBV
118.000 (40%) all’infezione da HCV
82
Storia naturale del carcinoma
epatocellulare
Studi epidemiologici suggeriscono l’esistenza di una stretta correlazione
tra infezione da HBV e HCV ed insorgenza dell’epatocarcinoma primitivo
del fegato.
E’ verosimile che l’effetto sia indiretto e forse multifattoriale:
1. L’infezione persistente con questi virus provoca un danno cronico
(continua erosione immunologica) al fegato con conseguente iperplasia
rigenerativa;
2. Aumenta di conseguenza il numero di cellule a rischio di subire
successive alterazioni genetiche;
3. Una di queste cellule trasformate può essere l’origine di un clone HCC;
4. HBV esprime proteine che possiedono attività transattivante (HBxAg,
mutanti preS2) e potrebbero giocare un ruolo iniziale nella perdita di
controllo, la proteina C di HCV interagisce coi sistemi di controllo della
83
proliferazione cellulare e dell’apoptosi
In conclusione
HBV e HCV presentano un notevole potenziale
patogeno che include
la patologia epatica acuta,
la patologia epatica cronica
e si associa ad una grave neoplasia epatica
84