Il RUOLO DELLA DIETA E DELLE INTOLLERANZE ALIMENTARI NELLE
UTILIZZATRICI DI CONTRACCEZIONE ORMONALE
Tassone Paola1, Rizzo Carmelo2, Angela Lauletta2.
1. Biologa Nutrizionista, Via Gallonio, Roma
2. Accademia Internazionale Nutrizione Clinica (AINUC), Via Tacito, Roma
Abstract
I Contraccettivi Orali (OC) sono in uso ormai da diversi decenni e rappresentano il più diffuso sistema
anticoncezionale. Ad oggi si stima che circa 150-200 milioni di donne nel mondo utilizzano la “pillola”.
A parte la loro ben nota efficacia ginecologica, gli ormoni hanno dimostrato influenzare un certo numero di
processi metabolici e nutrizionali, presentando effetti sia vantaggiosi che svantaggiosi.
L’assunzione prolungata di OC è noto produrre cambiamenti nel metabolismo dei carboidrati, lipidi, proteine,
vitamine e minerali. Tali alterazioni sembrano essere mediate dagli estrogeni, progestinici (o gestageni) e dai
loro derivati.
Una corretta alimentazione è ormai accertato che diviene fondamentale per il benessere di qualsiasi
persona. Questa particolare attenzione al tipo di alimentazione deve essere impiegata per tutti i pazienti che
usano farmaci, e nello specifico anche nei confronti delle utilizzatrici di OC.
In questo lavoro siamo andati a valutare gli alimenti che non venivano tollerati dalle donne che
consumavano quotidianamente OC. Inoltre abbiamo studiato gli effetti prodotti dopo esclusione di questi cibi
dalla dieta, eseguendo una completa astinenza dell’intera famiglia biologica attraverso una dieta a rotazione.
I risultati, se pur preliminari, hanno evidenziato che le pazienti hanno tratto beneficio del regime dietetico
privo degli alimenti a cui sono risultate intolleranti e di aver avuto una notevole diminuzione della
sintomatologia riportata all’inizio nell’anamnesi. Infine il regime alimentare a rotazione programmato ha
procurato un maggior stato di benessere, indicato anche dalla rapida perdita di peso.
1. CENNI STORICI
Agli inizi del XX secolo, diversi scienziati europei, tra cui Beard, Prenant e Loeb, svilupparono il concetto che
le secrezioni del corpo luteo aboliva l’ovulazione durante la gravidanza. Tramite queste evidenze, e
l’estensione delle conoscenze di base della fisiologia della riproduzione, svilupparono l’idea che gli ormoni
potessero essere utilizzati per la sterilizzazione.
Solo dopo gli anni ’20 si riuscì ad isolare il progesterone dal corpo luteo. Successivamente altri ricercatori
osservarono che l’assunzione dell’ormone puro bloccava l’ovulazione nei conigli (1). Da qui inizia lo
straordinario interesse verso le prime sperimentazioni che portano lo sviluppo negli anni ‘50 di 19norprogestinici che riuscivano a prevenire l’ovulazione nella donna.
Lo scenario si amplia ed inizia l’era degli studi clinici sui contraccettivi ormonali. Solo verso la fine del 1959
fu approvata dalla FDA (Food and Drug Administration) la prima “pillola”, (noretinodrel+mestranolo),
presentata con lo scopo di aiutare i disturbi legati al ciclo mestruale e infertilità, e nel 1960 lo stesso farmaco
fu approvato come contraccettivo negli Stati Uniti. Nel 1966 giungono sul mercato approssimativamente una
dozzina di preparazioni di “prima generazione” che utilizzavano sia il mestranolo che l’etinilestradiolo in
combinazione con uno dei diversi 19-norprogestinici.
Questi nuovi farmaci oltre a segnare un punto importante nella storia dell’embriologia, ha rivoluzionato anche
i metodi di controllo delle nascite, cambiando anche la percezione della sessualità.
Solo negli anni ’70 emergono i primi dati sugli effetti indesiderati, stabilendo che gli effetti collaterali erano
per lo più dose-dipendente. Da quel momento lo studio si concentra nello sviluppo dei cosiddetti
contraccettivi a basso dosaggio di steroidi. Solo nel 1990 le preparazioni di OC definite di “terza
generazione” iniziano a contenere progestinici con ridotta attività androginica (2).
2. GLI ORMONI
La regolazione della contraccezione ormonale ha subito un notevole sviluppo negli ultimi decenni, grazie
all’introduzione di molecole in grado di modulare in maniera sempre più precisa l’attività riproduttiva con la
possibilità di utilizzare dosaggi ormonali progressivamente decrescenti (2).
1
Con il termine “ormone”, nel 1905, si indica, per la prima volta, un principio attivo (la secretina), rilasciato
dalla mucosa del duodeno, per stimolare la secrezione pancreatica.
Solo successivamente la scoperta di altri composti con proprietà analoghe portò a coniare una nuova
definizione generale, delineando che “l’Ormone è un principio attivo endogeno, prodotto dalle ghiandole
endocrine, e trasportato dal sistema circolatorio fino alle cellule di organi effettori, dotate dei recettori
specifici, per regolarne l’attività”. Pertanto questa definizione, dopo diversi studi, venne ampliata andando a
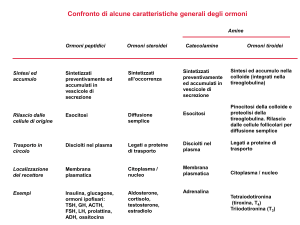
diversificare il tipo di ormone in base all’origine di produzione ed al tipo di trasporto (figura 1).
Figura 1. Schematizzazione della classificazione degli ormoni
Gli ormoni steroidei sono ormoni di natura lipidica e derivano da un precursore comune il colesterolo. I
corticosteroidi si formano dalla rimozione della catena laterale dell'anello D del colesterolo attraverso
l’aggiunta di atomi di ossigeno nella molecola per formare gruppi chetonici e ossidrilici. I corticosteroidi sono
noti essere implicati in molti meccanismi fisiologici, che rientrano nella regolazione dei processi infiammatori,
al sistema immunitario, al metabolismo dei carboidrati, delle proteine, fino alla regolazione dei livelli di
elettroliti circolanti nel sangue.
Gli ormoni steroidei si possono suddividere in due classi:
Glucocorticoidi
Mineralcorticoidi
(esempio il cortisolo), che regolano il metabolismo dei carboidrati
(esempio l’aldosterone), che regolano la concentrazione degli
elettroliti nel sangue.
Gli ormoni steroidei formano un gruppo di ormoni lipofili che agiscono su diversi livelli, controllando il
metabolismo, la crescita e ovviamente la riproduzione. Essi viaggiano nel flusso circolatorio, trasportati da
particolari proteine che prendono il nome di carrier SBP (Steroid Binding Protein). Queste proteine di legame
consentono all'ormone di raggiungere le rispettive cellule bersaglio. Ma soprattutto essendo di natura
lipidica, riescono ad entrare la cellula legarsi ai propri recettori sia a livello citoplasmatico che a livello
nucleare. In particolare il legame tra ormone e SBP attiva, come per gli ormoni protidici, l'adenilato ciclasi.
Infine alcuni di questi ormoni hanno anche il proprio recettore posto sulla membrana cellulare ed il loro
legame determina l’attivazione di una specifica proteina G formata da tre subunità (alfa, beta e gamma). La
subunità alfa dopo l'attacco si fosforila e si dissocia andando in circolo nel citoplasma dove, spostandosi
liberamente, va ad attivare l'adenilatociclasi (meccanismo identico agli ormoni progestinici).
Tra gli ormoni steroidei abbiamo:
Androgeni
Tra i più noti ricordiamo il testosterone, a 19 atomi di carbonio, prodotto in maggior parte dal testicolo e dalle
ghiandole surrenali nell'uomo. Nella donna è prodotto in piccole quantità dalle cellule della teca e dalle
ghiandole surrenali. Per esempio l'androsterone è prodotto dall'ovaio. Entrambi sono importanti per la
determinazione dei caratteri sessuali e del comportamento che ne deriva.
Estrogeni
Ormoni a 18 atomi di carbonio. Tra i più importanti ricordiamo l'estradiolo, prodotto dalle ovaie, importante
per l'accumulo di acidi grassi e per il processo di vitellogenesi (crescita dell’ovocita).
Progestinici
Ormoni a 21 atomi di carbonio. Tra i più importanti c'è il progesterone prodotto dalle ovaie e dalla placenta.
Gli ormoni estrogenici e progestinici favoriscono la ritenzione idrica?
Il corpo umano nasce come una macchina perfetta, molto complessa basti pensare che esso riesce a
produrre da solo più di 100 diversi ormoni. Per questa ragione se alcuni di questi ormoni non sono più in
2
equilibrio fisiologico si verificano molte complicazioni che vanno dall’invecchiamento precoce all’aumento di
peso. Se invece gli ormoni si mantengono in equilibrio stabile la persona il più delle volte è in grado di
mantenere un peso sano facilmente. Molti ormoni hanno un ruolo nel mantenere il peso corretto di una
persona come ad esempio: l’insulina, il glucagone, la leptina, gli ormoni tiroidei, l’ormone della crescita, gli
ormoni sessuali (estrogeni, progesterone e testosterone), il cortisolo, e il DHEA (deidroepiandrosterone).
Tuttavia è noto anche che tra le cause che giocano un ruolo importante nei disturbi del circolo periferico
venoso linfatico rientrano gli ormoni estrogenici e progestinici (gli anticoncezionali). Questi ormoni infatti
favoriscono la ritenzione di liquidi. Il problema della ritenzione idrica può essere aggravata dagli stili di vita
sbagliati, da dieta sbilanciata, e peggiorata dall’assenza o scarsa attività fisica, ulteriormente acutizzata
dall’uso di indumenti troppo stretti.
La ritenzione idrica potrebbe essere un fenomeno temporaneo, legato per esempio ad un momentaneo
rallentamento della circolazione sanguigna oppure diventare cronico e dare origine a cellulite e a disturbi
della circolazione. La ritenzione idrica è un accumulo di liquidi nei tessuti (edema) che ostacola il normale
funzionamento delle cellule. Come sappiano il nostro corpo è costituito maggiormente da acqua distribuita in
parte all'interno e all'esterno della cellula. Tra i due comparti, in situazioni normali, esiste un perfetto
equilibrio dinamico, mantenuto in larga parte dalla presenza di particolari sali. Il sodio è l'elemento principale
nel comparto extra cellulare, se il suo livello nella dieta e quindi nel sangue è eccessivo, l'acqua passa
all'esterno della cellula, ristagnando nei tessuti. Ne consegue un rallentamento della circolazione sanguigna.
L'accumulo di liquidi nel derma va a influire inevitabilmente anche sulle condizioni del tessuto adiposo. Le
cellule adipose con il tempo vanno incontro ad una lenta degenerazione che evolve in cellulite, creando un
circolo vizioso. Per questi motivi si consiglia una dieta depurativa a base di frutta e verdura che regolano un
importante apporto di vitamine e potassio con poco sodio, ideali per contrastare la pelle a buccia d’arancio e
la ritenzione idrica restituendo energia. Tra gli alimenti vanno privilegiati tutti quelli noti esser diuretici come
ad esempio: broccoli, cavoli, cavolfiori e cavoletti di Bruxelles (aiutano il fegato nella detossicazione delle
scorie), cipolle (ricche di zolfo), aglio (coadiuva l’eliminazione delle scorie), cetrioli, sedano, asparagi,
pomodori, carciofi, prezzemolo, mirtilli rossi, anguria (alimenti molto diuretici). Per bilanciare i livelli dei fluidi
inoltre, occorre mangiare cibi ricchi di potassio come banane, albicocche secche, spinaci, patate dolci e
melone.
3. MECCANISMI DI AZIONE DEI CO:
L’ASSE IPOTALAMO-IPOFISI-OVAIO
Per spiegare i meccanismi di azione dei OC occorre annoverare le strutture implicate nel controllo
ormonale, che sono: 1) l’ipotalamo, 2) l’ipofisi e 3) le ovaie, come rappresentato in figura 2. Tuttavia la
periodicità mestruale è garantita dalla complessa funzione dell’asse ipotalamo-ipofisi e ovaio. Questo
articolato asse è noto anche ad esser adibito al controllo della riproduzione, grazie alla modulazione di
sostanze prodotte sia dal sistema nervoso centrale (neurotrasmettitori) e sia dagli organi periferici (steroidi
sessuali, ormoni tiroidei, ormoni surrenalici). In cima a questo complicato asse si trovano i nuclei ipotalamici
(sovraottico e paraventricolare) che rilasciano in modo pulsatile il GnRH (Gonadotropin-Releasing
Hormone). Questo agisce sull’ipofisi inducendo la produzione ed il rilascio, sempre in modo pulsatile, delle
gonadotropine: FSH, (Follicle-Stimulating Hormone ed LH (Luteinizing Hormone), le quali vanno poi a
stimolare la funzione delle ovaie (figura.2).
È opportuno ricordare che grazie alle sue caratteristiche neuroendocrine l’ipotalamo integra molte afferenze
provenienti dalla corteccia cerebrale, dal sistema limbico, dall’epifisi, andando infine a controllare afferenze
periferiche di tipo ormonale. Perciò il ciclo riproduttivo ha la centrale operativa all’altezza dell’ipotalamo, da
cui dipartono segnali molto precisi che vengono regolati e controllati sia a livello del sistema nervoso
centrale e dagli ormoni prodotti in periferia.
Il controllo del sistema nervoso centrale (SNC) sulla funzione riproduttiva si esplica attraverso l’azione di una
miriade di neuromodulatori e neurotrasmettitori, non tutti noti, tra i quali vanno menzionati il Neuropeptide Y
(NPY), gli oppiodi endogeni, la ßendorfina (ßEP), altri neurotrasmettitori la dopamina, la serotonina e la
noradrenalina (3, 4).
La dimostrazione di questo sta il fatto che, ogni qualvolta il SNC è iper attivato o costretto ad attivare
meccanismi particolari di difesa, si determinano disfunzioni anche dell’asse riproduttivo. Infatti, gli stress fisici
(eccessivo allenamento delle atlete), metabolici (diete ipocaloriche, dimagrimenti troppo veloci, diabete) e
psicologici (lutti, divorzi, fallimenti scolastici e/o lavorativi), determinano un aumento del rilascio degli oppioidi
endogeni e del CRF (Corticotropin Releasing Factor) che, stimolando la produzione di ACTH (Adreno
Cortico Tropic Hormone), determinando una modulazione negativa della funzione ipotalamo-ipofisaria che
portano all’ alterazione della normale funzione ovarica e quindi alterata ciclicità mestruale.
3
In condizioni fisiologiche, nella fase follicolare, LH ed FSH hanno una sincronicità di secrezione pulsatile che
dimostra la piena dipendenza del loro rilascio dal GnRH, ma questo sincronismo viene perso nella fase
luteale. Infatti, mentre nella fase follicolare il loro rilascio è sincrono, dopo l’avvenuta ovulazione, fin
dall’inizio della fase luteale, la frequenza dei picchi secretori dell’LH si modifica mentre quella dell’FSH
rimane pressoché invariata. Il sincronismo viene quindi perduto (5). Il progesterone che viene liberato nella
fase luteale del ciclo mestruale può spiegare solo in parte tale fenomeno attraverso la sua azione sui
neurotrasmettitori e neuropeptidi che modulano la funzione ipotalamo-ipofisaria; sembra però che siano gli
effetti del sistema activina-inibina e follistatina ad agire in modo determinante sulla regolazione della
secrezione di FSH (5, 6).
Il controllo della funzione ovarica è quindi dipendente dall’azione delle gonadotropine e determina
l’appropriata attività steroidogenetica dell’ovaio, con la produzione di estrogeni ed androgeni nella fase
follicolare e di estrogeni, androgeni e progesterone dopo l’ovulazione e la formazione del corpo luteo. Non
deve stupire che si parli di androgeni come sostanze prodotte dall’ovaio. La gonadotropina LH stimola le
cellule della teca interna del follicolo ovarico a produrre sostanzialmente androgeni, che passano nelle
cellule della granulosa dove vengono convertiti in estradiolo dall’aromatasi. E’ questa un’ azione
fondamentale ed è la chiave per la corretta funzione steroidogenetica dell’ovaio.
Dopo l’ovulazione, l’LH determina la lutenizzazione delle cellule della granulosa e della teca interna,
favorendo la formazione del corpo luteo, la produzione di progesterone e portando ad una ridotta quantità di
estradiolo. La presenza di steroidi ovarici (androgeni, estradiolo e progesterone) nel corso delle due fasi del
ciclo ovarico fa sì che si venga ad esercitare un feed-back sull’ipotalamo e sull’ipofisi che modula in modo
specifico e progressivo la sintesi ed il rilascio di GnRH e a sua volta di FSH e di LH.
Da quanto detto sopra si intuisce che nel contesto del ciclo ovarico l’ovaio assolve sostanzialmente a due
funzioni: una follicolo genetica e una steroidogenetica (7).
Tenuto conto della fisiologia del ciclo mestruale, l’efficacia degli estro-progestinici è legata alla capacità di
interferire a più livelli sulla funzione. La somministrazione di estro-progestinici garantisce il controllo delle
nascite agendo principalmente attraverso l’inibizione dell’ovulazione: bloccano la secrezione di LH,
prevenendo quindi il picco di LH (8). L’azione dell’estrogeno infatti inibisce per un fenomeno di feedback
negativo il rilascio del GnRH ipotalamico e di conseguenza anche delle gonadotropine ipofisarie.
Ovviamente le concentrazioni dell’estrogeno sono l’elemento chiave per avere l’effetto di blocco ma, per le
caratteristiche con cui oggi i contraccettivi sono “progettati”, si tende ad usare sempre dosi di etinilestradiolo
basse, fino a 15 μg, per cui pur ottenendo un blocco del rilascio del GnRH e delle gonadotropine, questo
però non consiste in un blocco totale. Infatti studi specifici hanno osservato che il rilascio delle
gonadotropine in corso di uso di contraccettivi a basso dosaggio fa si che l’ipofisi rilasci comunque quote
dosabili di LH ed FSH anche se non sufficienti ad innescare la maturazione follicolare. Per questo motivo
l’accidentale dimenticanza di assumere una pillola può molto facilmente determinare una rapida ripresa
funzionale ipofisaria e quindi ovarica, spiegando sia la perdita dell’effetto contraccettivo sia la perdita simil
mestruale. Anche la presenza del progestinico nella preparazione contraccettiva serve a mantenere l’effetto
di inibizione sulla liberazione dell’LH ma anche a indurre specifici effetti del tutto legati al progesterone quali
quello sul muco cervicale, sulla mucosa endometriale e sulle salpingi di cui ne riduce la motilità. Infatti l’uso
dei contraccettivi con solo progestinico, come il levonorgestrel o il noretisterone , determinano un effetto
contraccettivo minimo attraverso l’inibizione dell’ovulazione, ma essenzialmente agendo attraverso
meccanismi periferici quale, appunto, l’effetto sul muco. Il muco cervicale, sotto l’azione dei progestinici
(come del progesterone naturale), diviene spesso impenetrabile al passaggio degli spermatozoi e
l’endometrio è reso non adatto all’impianto embrionale. Pertanto, nel contraccettivo estroprogestinico oltre
ad avere un effetto di controllo sulla crescita follicolare (e sull’ ovulazione) indotto dall’estrogeno ha anche
l’effetto del progestinico, agisce a livello periferico creando delle condizioni ambientali di muco ed anche
endometriali sfavorevoli per l’impianto embrionale.
In generale gli estrogeni, comunque somministrati, vengono rapidamente assorbiti attraverso la cute o le
mucose (sia del canale alimentare come della regione vaginale) e subiscono una metabolizzazione del tutto
simile a quella degli ormoni steroidei endogeni. Infatti vengono inattivati a livello epatico e convertiti in
prodotti meno attivi. Una piccola percentuale di estrogeni viene escreta nella bile e riassorbita a livello
intestinale rientrando di nuovo nel circuito metabolico. La limitazione dell’efficacia degli estrogeni
somministrati per via orale è legata al loro eventuale anomalo assorbimento intestinale ed al loro ridotto
metabolismo epatico, soprattutto in presenza di patologie del tratto gastro-enterico, epatico oppure a seguito
di assunzione di terapie antibiotiche o lassative che interferiscono molto sulle funzioni di assorbimento
intestinale dei preparati estro-progestinici.
4
Figura 2. Gli effetti dei contraccettivi sono sostanzialmente mirati a sostituirsi alla produzione endogena
ovarica di steroidi sessuali determinando così un controllo per inibizione negativa della funzione ipotalamoipofisaria. A seguito del tono progestinico indotto dal contraccettivo si hanno poi specifiche influenze
sull’ambiente della regione cervico-vaginale.
TABELLA 1. Vari tipi di contraccezione ormonale
PILLOLE
Etinilestradiolo + Gestodene
Etinilestradiolo + Desogestrel
Desogestrel
Etinilestradiolo + Levonorgestrel
Etinilestradiolo + Drospirenone
Etinilestradiolo + Ciproterone Acetato
Etinilestradiolo + Clormardinone
Estradiolo valerato + Dienogest
CEROTTI TRANSDERMICI
ANELLI VAGINALI E SPIRALE
SOTTOCUTANEI
5
4. TIPI DI CONTRACCETTIVI ORMONALI E INTOLLERANZA ALIMENTARE
I OC sono tra i farmaci più usati al mondo. Da quando divennero disponibili, nel 1960, hanno influenzato la
vita di milioni di individui ed hanno avuto un impatto rivoluzionario sull’intera società.
L'ovaio nella donna ha funzioni importanti, ha il grande compito di realizzare la gametogenesi ed avere
fondamentali attività ormonali. Quindi quando parliamo delle gonadi femminili parliamo delle ovaie che sono
quiescenti fino al periodo della pubertà. Quando arriva lo stimolo delle gonadotropine ipotalamiche, stimolate
a loro volta da parte dell'ipofisi, si ha la maturazione delle gonadi, con il risultato evidente del ciclo mestruale.
Questa sequenza di fasi comparirà ciclicamente per circa 30-40 anni. Quando questo stimolo viene a
mancare, finisce il periodo ciclico delle mestruazioni e la donna entra in menopausa. Gli ormoni rilasciati
dalle gonadi femminili sono il follicolostimolante (FSH) e il luteinizzante (LH); in risposta al follicolostimolante
vengono prodotti estrogeni, che causano dapprima la crescita del seno e, dopo i primi anni, si osservano le
perdite emorragiche tipiche del ciclo. All'inizio di ogni ciclo un numero più o meno variabile di follicoli, che
contengono ognuno un ovocita, maturano su stimolo dell'ormone follicolostimolante. Dopo 5 o 6 giorni uno
dei follicoli, il follicolo dominante, termina la maturazione prima degli altri e comincia a produrre estrogeni su
stimolo dell'ormone luteinizzante. Gli estrogeni prodotti inibiscono il rilascio di FSH con regressione dei
follicoli non maturi. Poco prima dell'ovulazione si ha il picco nella produzione di estrogeni (come estradiolo,
estrone ed estriolo) e il follicolo inizia a produrre progestinici. Questo comporta un incremento di FSH e LH
che causa lo scoppio della cavità follicolare e la proliferazione delle cellule della cavità follicolare in corpo
luteo, che al termine del ciclo va incontro a regressione in caso di mancata fecondazione (figura. 3). Infine
per avere un chiaro meccanismo è importante ricordare che i recettori degli estrogeni e dei progestinici si
trovano nel nucleo cellulare, e il legame con il target attiva fattori di trascrizione con successivo aumento
trascrizionale per alcuni geni specifici, che codificano per proteine e recettori che comportano particolari
effetti fisiologici.
Figura 3. Schema del ciclo mestruale
6
Estradiolo
Quinestrolo
Progesterone
Dietilstilbestrolo
Figura 4. Struttura degli ormoni sessuali
Tra i vari effetti che gli estrogeni possono esercitare sulla fisiologia ricordiamo alcuni, quali: la capacità di
inibire il riassorbimento osseo,
potrebbero esercitare un’alternazione ematica, aumentandone la
coagulabilità, la maturazione dei caratteri primari e secondari femminili infine esercitare vari effetti sulla
sintesi epatica di altri ormoni e proteine.
Anche i progestinici forniscono particolari effetti fisiologici e sarebbero in grado di provocare un aumento dei
depositi di grasso e dei livelli di insulina; alcuni lavori riportano che i progestinici eserciterebbero una
inibizione del riassorbimento di sodio (e quindi di acqua) per competizione con l'aldosterone.
I componenti dei contraccettivi ormonali orali esercitano importanti effetti sul metabolismo delle lipoproteine
plasmatiche. È noto che gli estrogeni possono aumentare la produzione di trigliceridi plasmatici, con
conseguente aumento dei livelli di lipoproteine a bassa densità, ma possono anche ridurre i livelli di
colesterolo e lipoproteine a bassa densità potenzialmente aterogenica. Pertanto, gli estrogeni aumentano i
livelli di lipoproteine ad alta densità (HDL), in particolare l’HDL2, questo si pensa essere legato alla riduzione
dei tassi di mortalità per le malattie cardiovascolari nelle donne in post-menopausa, che assumono una
terapia ormonale sostitutiva. Tutte le combinazioni di contraccettivi, utilizzate negli Stati Uniti, tendono ad
aumentare i livelli plasmatici di trigliceridi, lipoproteina a bassa densità, e HDL3. Al contrario, variazioni di
HDL e HDL2 riflettono gli effetti combinati della dose di estrogeno e androgeni, relativa alla componente
progestinica. Anche se in generale, molti lavori riportano che il cambiamento maggiore inteso come aumento
del contenuto di lipoproteine, si ha quando siamo in presenza di un contenuto/dose di ormoni elevato nei
preparati contraccettivi, mentre si osserva una significativa diminuzione di lipoproteine nei preparati con dosi
inferiori di ormoni. Gli OC possono anche influenzare il metabolismo dei carboidrati, principalmente
attraverso l'attività dei progestinici. Molti studi hanno dimostrato una insulino-resistenza, causata dall’insulina
plasmatica, con una relativa intolleranza al glucosio. Ma questi effetti sono molto meno pronunciati dopo la
somministrazione di preparazioni di contraccettivi a base progestinica a bassa dose. (9).
Contraccettivi orali in associazione
I OC più utilizzati sono quelli che vengono preparati in combinazione sia con un estrogeno che un
progestinico. Questi possiedono un’efficienza teorica del 99%. I due estrogeni più utilizzati sono
l’etinilestradiolo e il mestranolo. I progestinici più utilizzati sono della serie dell’estrano e del gonano. Ognuno
di essi ha vari gradi di attività androgenica, estrogenica ed antiestrogenica che può essere responsabile di
alcuni dei ben noti effetti collaterali. I composti come il desogestrel e il norgestimate sono i composti
sviluppati più recentemente e hanno attività androgeniche inferiori rispetto ad altri composti 19-nor.
7
I OC in associazione sono disponibili come preparazione monofasiche, bifaseche o trifasiche. Generalmente
si tratta di confezioni che contengono 21 compresse. I monofasici sono caratterizzati da quantità fisse di
estrogeno e progestinico in ogni pillola, la quale è presa quotidianamente per 21 giorni, seguita da un
periodo di 7 giorni senza farmaco. Le preparazioni bifasiche e trifasiche forniscono due o tre pillole diverse
che contengono differenti quantità di composti attivi. Il contenuto di estrogeni varia tra 20 e i 50 mcg, le
preparazioni che contengono 35 mcg o meno, sono solitamente definite “a basso dosaggio” o “moderne”.
Attualmente vengono preparate utilizzando in associazione estrogeno con drospirenone.
Recentemente, dopo il parere positivo dell'Agenzia Europea dei Medicinali (EMA), arriva un ulteriore nuova
pillola anticoncezionale in associazione che si differenzia da tutte le altre pillole in quanto è l'unico
contraccettivo orale combinato, monofasico che utilizza un estrogeno naturale, cioè strutturalmente identico
a quello prodotto dall'organismo femminile durante il ciclo. La confezione contiene 28 compresse in due
diverse colori, 24 compresse bianche (attive) e 4 gialle (prive dei principi attivi), semplici placebo. L’utilizzo
dell’estrogeno naturale consente di ridurre l’impatto metabolico, epatico e vascolare rispetto a quello delle
pillole di precedente formulazione.
Contraccettivi ormonale per via alternativa
Oltre alla pillola tradizionale contenente una combinazione di estrogeni e progesterone, tra i vari metodi
anticoncezionali, , esistono delle vie alternative che vanno dal Cerotto trans-dermico all’anello vaginale fino
al dispositivo intrauterino (IUD) vedi tabella 1. Il primo dispositivo è un cerotto, costituito normalmente da una
protezione esterna che serve da supporto ad una preparazione contenente il principio attivo, che viene
applicato sulla cute, rilasciando giornalmente un’associazione di estro-progestinici. Un cerotto viene
utilizzato per 7 giorni e dopo l’uso di 3 segue una pausa di sospensione di una settimana, in cui compare
un’emorragia simil-mestruale. Il secondo dispositivo è uno strumento a forma di anello ad uso vaginale, in
materiale biocompatibile, flessibile e trasparente, contenente un’associazione di ormoni estro-progestinici.
L’anello vaginale deve essere introdotto manualmente in vagina e lasciato in sede per 21 giorni; nella
settimana successiva alla rimozione, compare il sanguinamento simil-mestruale. Ed infine si ha anche la
possibilità di utilizzare IUD, è un sistema intrauterino a forma di T, che viene inserito dal ginecologo, che
rilascia lentamente e costantemente un ormone progestinico. Quest’ormone determina una modificazione
del muco cervicale e della mucosa uterina, tale da interferire con il passaggio degli spermatozoi ed impedire
l’eventuale impianto dell’uovo fecondato. Si distinguono in due tipi di IUD: inerti, realizzati in materiale
plastico con l'aggiunta di radio di bario che li rende così radiopachi e quelli medicati ovvero potenziati nella
loro azione contraccettiva per la presenza di una sostanza quale rame, progesterone o progestinici
(levonorgestrel 20 mcg). Con una efficacia contraccettiva molto elevata, in media cinque anni.
Contraccettivi di soli progestinici
Svariati farmaci sono disponibili per la contraccezione con soli progestinici, ma sono considerati leggermente
meno efficaci dei OC in associazione. Queste particolari preparazioni comprendono la “minipillola” o
preparazioni orali a basse dosi di progestinico, ad esempio 350 mcg di noretindone o 75 mcg di norgestrel
che vengono assunti quotidianamente senza interruzione. Abitualmente le donne che desiderano utilizzare
un metodo di contraccezione orale senza assumere estrogeni, possono indirizzarsi verso la pillola
contraccettiva a base di solo progestinico,indicata per le donne che allattano, che fumano, che sono entrate
in premenopausa o che soffrono di malattie autoimmuni e tromboemboliche. Il desogestrel, infatti, è un
progestinico caratterizzato da una minore androgenicità. L’utilizzo di questo OC ha meno effetti indesiderati
rispetto ad altri prodotti come la nausea, cefalea, tensione mammaria, acne e impatto metabolico
Contraccezione postcoitale e di emergenza
In alcuni specifici casi viene utilizza l’assunzione di alte dosi di dietilstilbestrolo e di altri estrogeni come
contraccezione postcoito, definita anche come la “pillola del giorno dopo”. Occore ricordare che tale metodo
contraccettivo è efficace se messo in atto entro le 72 ore dal rapporto; qualora il trattamento ormonale venga
iniziato entro 12 ore dal rapporto le percentuali di gravidanza sono inferiori allo 0,5% mentre arrivano al 4,1%
qualora il trattamento sia iniziato tra le 61 e le 72 ore del rapporto.
Intolleranze Alimentari
Oggi la scelta del cibo è sempre più determinata dalla necessità di procurarsi piacere. Frequentemente le
scelte alimentari sono dettate dallo stress, dalla mancanza di tempo, dalla noia, dall’insoddisfazione, più che
dal “desiderio di salute”. Il cibo può rappresentare un’irrinunciabile “gratificazione” ma le conoscenze attuali
dimostrano che l’eliminazione di un alimento risultato tossico diventa un utile “strumento terapeutico
8
integrativo” che ottimizza le terapie e migliora lo stato di benessere clinico e metabolico. Le intolleranze
alimentari si differenziano dalle allergie alimentari vere e proprie, perché non producono shock anafilattico e
di solito non rispondono ai tradizionali test allergici cutanei. Non provocano quasi mai delle reazioni violente
ed immediate nell'organismo e quindi, spesso, non sono direttamente collegabili all’assunzione del cibo che
le determina. L'esperienza clinica dimostra che le reazioni avverse agli alimenti possono essere causate da
bevande, medicinali o altre sostanze che ingeriamo normalmente.
L'intolleranza alimentare è una reazione anomala dell'organismo verso particolari cibi. Non si può parlare
quindi di allergia dal momento che l'intolleranza non coinvolge il sistema immunitario (non è IgE-mediata)
quanto, piuttosto, quello metabolico. In altre parole le persone che presentano una specifica intolleranza
verso un alimento non sono in grado di assimilarlo in maniera corretta, ma ciò non comporta reazioni da
parte del sistema immunitario. Ciò non significa tuttavia che l'intolleranza alimentare sia da sottovalutare; al
contrario l'impossibilità per il nostro organismo di assorbire un cibo può causare sintomi significativi tra i
quali: prurito, emicrania, palpitazioni, gastrite etc..
Le intolleranze alimentari possono essere di vari tipi:
- Intolleranze farmacologiche: possono derivare da sostanze presenti in alcuni farmaci ed alimenti, come
ad esempio le xantine che si trovano nel caffè e nel tè e possono causare sintomi tra i quali tachicardia ed
acidità digestiva.
- Intolleranze metaboliche: nascono da carenza, o assenza, di enzimi impiegati nel metabolizzare alcuni
aminoacidi. Ad esempio è molto diffusa l'intolleranza al lattosio, zucchero contenuto nel latte, la quale deriva
da una carenza dell'enzima lattasi. In questo caso insorgono problemi nella digestione del lattosio i quali
possono causare disturbi gastrointestinali, tra cui gonfiore, dolori addominali e diarrea. Molto importante, in
ragione del crescente numero di persone interessate, è l'intolleranza al glutine, proteina presente in tanti
cerali (frumento, segale, orzo etc...)
.- Intolleranze agli additivi chimici che di frequente sono presenti nei cibi che ingeriamo quotidianamente.
Conservanti, dolcificanti, esaltatori di sapidità possono infatti produrre sintomi come nausea, mal di testa,
dolori addominali o asma. Naturalmente ciò non significa che sia necessario evitare alimenti con conservanti
o dolcificanti, ma rispettare il proprio livello soglia al sintomo.
Inoltre occorre ricordare che nella sezione di speciali avvertenze e precauzioni per l’uso di alcuni
contraccettivi viene riportato dalla csa farmaceutica stessa la seguente dicitura : “ogni compressa rosa
chiaro contiene 46 mg di lattosio, ogni compressa bianca contiene 50 mg di lattosio. Le pazienti con rari
problemi ereditari di intolleranza al galattosio, carenza di lattasi o malassorbimento di glucosio-galattosio che
seguono una dieta senza lattosio devono tenere conto dell’aliquota derivante dall’assunzione della
compressa”.
Dalle intolleranze alimentari si può “guarire” seguendo una dieta impostata secondo un programma
alimentare personalizzato (che prevede la sospensione per un certo periodo dell'alimento non tollerato).
Realizzare la disintossicazione dell'organismo da quell’ alimento tossico è essenziale, poiché l’esclusione
permette il ripristino della funzionalità della mucosa e dell’integrità intestinale compromessa.
5. EFFETTI AVVERSI
Molti degli effetti collaterali descritti per i OC risultano essere dose-dipendente, ciò ha portato allo sviluppo di
preparazioni a basse dosi. Gli OC possono interferire con la farmacocinetica e farmocodinamica (10). Inoltre
è importante ricordare che i recettori sessuali ormonali si comportano come fattori di trascrizione (11) (figura
5), alterando l’espressione di alcuni geni e come conseguenza possono cambiare il normale stato interno,
procurando un’alterazione dell’attività dell’asse ipofisi-ovaio (12-13) e l’asse ipotalamo-ipofisi-surrene figura
2. Nei primi studi sugli effetti degli OC è stato osservato diversi affetti avversi: a livello cardiovascolare,
ipertensione, infarto miocardico, ictus emorragico, ischemico o trombosi venose (14-15). Inoltre sono stati
osservati cancri alla mammella, molti effetti endocrini e metabolici. In particolare è noto che i contraccettivi
orali possono indurre anomalie nel metabolismo dei carboidrati (16-17) ed alterazione del metabolismo dei
lipidi (18).
Nel 2004 è stato osservato un aumento della proteina C-reattiva in donne utilizzatrici di OC (19). Infine i OC
causano una diminuzione di metilarginina simmetrica e dimetilarginina asimmetrica (20) sostanza nota con
l’acronimo ADMA, essendo quest'ultima un inibitore di ossido nitrico, questo indicato essere un buon indice
di disfunzione endoteliale (21).
L'equilibrio tra i benefici ed i rischi è ancora molto dibattuto. Ad esempio l'estrogeno sintetico Etinil-Estradiolo
(EE) esercita un effetto più forte che del naturale estradiolo (E2) sul metabolismo epatico tra i marcatori
estrogeno-dipendenti come le proteine del fegato. Pertanto l'impatto più forte a livello epatico di EE è stato
legata al gruppo 17α-etinilestradiolo, che impedisce l'inattivazione della molecola, la quale si traduce in un
9
effetto più pronunciato a livello epatico di EE rispetto all’estradiolo. Al fine di ingannare le modificazioni
metaboliche indotte da EE, sono stati introdotti dei nuovi prodotti che utilizzano composti più naturali come il
valerato estradiolo (E2V) e l’estradiolo (E2). I progestinici sintetici, utilizzati per la contraccezione, sono
invece strutturalmente legati sia al testosterone (T) (estranes e gonanes) sia al progesterone (pregnanes e
19-norpregnanes).
I rischi e benefici dei nuovi progestinici usati nella contraccezione dipendono dalla struttura molecolare, dalla
dose di estrogeno associata. Tuttavia la combinazione e la via di somministrazione sembrerebbe avere una
notevole rilevanza per tenere sotto controllo gli effetti ed avere buoni risultati come contraccettivi (22).
TABELLA 2. Elenco delle reazioni avverse secondo la classificazione per sistemi ed
organi MedDRA (MedDRA SOC).
Classificazione per
Comuni ( ≥ 1/100
sistemi e organi
fino a <1/10)
Infezioni e infestazioni
Patologie del sistema
emolinfopoietico
Disturbi del sistema
immunitario
Patologie endocrine
Disturbi del
metabolismo e della
nutrizione
Non comuni ( ≥ 1/1000 fino a
<1/100)
Rari ( ≥ 1/10000 fino a <1/1000)
candida
anemia, trombocitopenia
reazioni allergiche
disturbo endocrino
aumento dell’appetito, anoressia,
iperkaliemia, iponatriemia
Disturbi psichiatrici
labilità emotiva
depressione, diminuzione della
libido, nervosismo,
sonnolenza,
anorgasmia, insonnia
Patologie del sistema
nervoso
mal di testa
capogiro, parestesia
vertigine, tremore
congiuntivite, secchezza oculare, disturbo
oculare
tachicardia
Patologie dell'occhio
Patologie cardiache
emicrania, vene varicose,
ipertensione
Patologie vascolari
Patologie
gastrointestinali
nausea,
Patologie epatobiliari
Patologie della cute e
del tessuto
sottocutaneo
Patologie del sistema
muscoloscheletrico e
del tessuto connettivo
Patologie dell'apparato
riproduttivo e della
mammella
Patologie sistemiche e
condizioni relative alla
sede di
somministrazione
Esami diagnostici
flebite, disturbo vascolare, epistassi, sincope
addome ingrossato, disturbo
dolore addominale, vomito,
gastrointestinale, pienezza gastrointestinale,
dispepsia, flatulenza, gastrite,
ernia iatale, candidiasi orale, costipazione,
diarrea
secchezza delle fauci
dolore biliare, colecistite
cloasma, eczema, alopecia, dermatite
acneiforme, secchezza della pelle, eritema
acne, prurito, rash,
nodoso, ipertricosi, patologia della cute,
pelle striata, dermatite da contatto,
dermatite fotosensitiva, noduli cutanei
dolore alla schiena, dolore alle
estremità, crampi muscolari
dolore al seno,
metrorragia*,
amenorrea
candidiasi vaginale, dolore
pelvico, ingrossamento del
dispareunia, vulvovaginite, sanguinamento
seno, seno fibrocistico,
post-coitale, mancanza di sanguinamento,
sanguinamento
cisti mammaria, iperplasia del seno,
uterino/vaginale*, deflusso
genitale, vampate di calore, neoplasma del seno, polipo cervicale, atrofia
vaginite, patologia mestruale, endometriale, cisti ovariche, ingrossamento
dell’utero
dismenorrea, ipomenorrea,
menorragia, secchezza
vaginale, PAP test sospetto
astenia, aumento della
sudorazione, edema
malessere
(generalizzato, periferico,
facciale)
aumento di peso
diminuzione di peso
*i sanguinamenti irregolari di solito diminuiscono durante il trattamento continuato.
10
NB:Le frequenze si riferiscono a dati derivanti dagli studi clinici. Si è utilizzato il termine più appropriato MedDRA per descrivere una specifica
reazione, i suoi sinonimi e le condizioni collegate.
Figura 5. Schematizzazione grafica di come i recettori sessuali ormonali si possono comportare come fattori
di trascrizione ed alterare l’espressione di alcune geni target.
6. Anamnesi e sintomatologia delle utilizzatrici di OC .
Questo studio inizia con un’accurata anamnesi eseguita su 30 donne, con età media di circa 32 anni,
utilizzatrici di Contraccettivi Ormonali (OC). Prima di iniziare il programma dietetico personalizzato siamo
andati a valutare la sintomatologia presente in ogni paziente. Innanzitutto, occorre precisare che le donne
intervistate, per questa ricerca, riferiscono un aumento di peso dopo l’inizio della terapia ormonale.
La figura 6, rappresenta il grafico delle sintomatologia delle pazienti esaminate. Si osserva che i sintomi più
frequenti sono chiaramente il meteorismo per il 60% delle pazienti, seguito dalla cefalea 50% e candidosi
per il 40%. Mentre circa il 30% delle pazienti riferiscono dermatite, stipsi, dolori addominali; il 15-20%
presenta colon irritabile, cistite, ansia, crampi notturni e bocca amara; mentre un numero più basso di
pazienti (10%) riferisce: aerofagia, brufoli, alitosi, insonnia, difficoltà digestiva, nausea e astenia. Le infezioni
genitali valutate dalla presenza di candidosi vaginale è riportata dal 40% delle pazienti di questo studio.
Dall’anamnesi inoltre, figura 6, emerge che il 63% delle donne che fanno uso di CO hanno un ciclo regolare,
mentre solo il 10% hanno un ciclo mestruale assente, questa amenorrea è legata a forti stress subiti dalle
pazienti, che successivamente iniziano una terapia ormonale (figura 7).
11
100
90
SINTOMATOLOGIA
80
Pazienti (%)
70
60
50
40
30
20
10
st
en
ia
rn
i
A
pi
N
ot
tu
au
se
a
N
ra
m
D
C
e
In
so
nn
ia
D
ig
es
C
tiv
ol
e
on
Irr
ita
bi
le
at
it
iff
ic
ol
ta
D
er
m
lit
os
i
A
am
ar
a
si
St
ip
oc
ca
B
ol
i
ru
f
B
id
os
i
i
an
d
is
tit
C
C
ef
al
ee
M
et
eo
ris
m
o
A
e
D
r
of
ol
ag
or
iA
ia
dd
om
in
al
i
C
A
ns
ia
0
Figura 6 Rappresentazione grafica delle percentuali dei sintomi presenti nelle pazienti utilizzatrici di
contraccettivi ormonali. Mancano barre di errore
CICLO
assente
regolare
regolare doloroso
assente
10%
regolare doloroso
27%
regolare
63%
Figura 7. Rappresentazione grafica delle percentuali del tipo di ciclo mestruale nelle pazienti utilizzatrici di
contraccettivi ormonali.
12
7. Intolleranze alimentari nelle utilizzatrici di OC
E’ noto orami da tempo che le intolleranze alimentari sono reazioni anomale dell’organismo verso particolari
cibi. L’esperienza clinica dimostra che le reazioni avverse agli alimenti possono essere causate da bevande,
medicinali o altre sostanze che ingeriamo normalmente. Nella figura 8 sono riportati gli alimenti, a cui le
pazienti utilizzatrici di OC sono risultate essere intolleranti, attraverso la positività manifestata dopo
l’esecuzione del cytotest, che consente di identificare, osservando direttamente al microscopio ottico le
alterazioni leucocitarie quando queste cellule vengono al contatto con estratti alimentari. Il 55% delle donne
ripartavo, dopo l’esecuzione del cytotest intolleranza al latte, mentre il 46% al pomodoro, solo il 26% al caffè,
segue oliva e uova.
Una percentuale più bassa di donne in esame, presenta una intolleranza alle solanacee (7%). Mentre circa il
12% risulta, invece, intollerante al lievito.
Le donne sottoposte a tale studio hanno così eseguito per un mese una dieta metabolica a rotazione, sono
stati eliminati tutti gli alimenti (e le famiglie biologiche) a cui sono risultate intolleranti, ed in media le donne
hanno perso un peso di circa 1,7 kg rispetto al peso iniziale, in alcune pazienti è stato addirittura osservata
una perdita di peso di circa 4 kg rispetto al peso iniziale
100
Intolleranze Alimentari
90
80
Pazienti (%)
70
60
50
40
30
20
10
0
latte
caffe'
pomodoro
oliva
lievito
uova
grano
patate
Alimenti
Figura 8. Tipologia e percentuale di alimenti a cui le pazienti OC sono risultati intolleranti
8. CONCLUSIONI
Una corretta alimentazione è fondamentale per il benessere di qualsiasi persona e ancora di più le
utilizzatrici di contraccettivi orali, che devono seguire un regime dietetico particolare e preciso per non
stimolare troppo il sistema immunitario e limiti la produzione di estrogeno. Il nostro corpo è una macchina
perfetta ma con un instabile equilibrio fisiologico, e come tale il suo equilibrio può essere alterato facilmente.
nella sua complessità produce più di 100 diversi ormoni. Questi ormoni hanno un equilibrio ben prestabilito,
e se la persona non riesce a mantenere un bilanciamento perfetto dei vari ormoni, non riesce nemmeno a
mantenere un peso sano, motivo, per il quale, è consigliato eseguire il test delle intolleranze alimentare, in
quanto quest’ultime sono in grado di generare uno stato di “intossicazione” che sfociano in differenti sintomi
fastidiosi per ogni paziente.
Le pazienti che sono state esaminate in questo studio hanno avvalorato l’ipotesi che seguire un regime
dietetico privo degli alimenti a cui sono risultate intolleranti porta innanzitutto ad un benessere generale della
persona, questo si rispecchia nel miglioramento della sintomatologia pre-dieta e non solo perdita di peso.
Siamo riusciti inoltre a catalogare le intolleranze più frequenti riscontrate nelle utilizzatrici OC. Il 55% delle
13
utilizzatrici, mostravano inaspettatamente intolleranza al latte, il 46% al pomodoro, solo il 26% al caffè, alcuni
presentavano intolleranze oliva e uova. Una percentuale più bassa di donne in esame, presentava una
intolleranza alle solanacee (7%), mentre circa il 12% risultava, invece, intollerante al lievito e al grano.
Il programma dietetico da noi consigliato alle utilizzatrici prevedeva un elevato consumo di pesce, frutta,
verdura ed acqua. Tuttavia e’ noto che le utilizzatrici di OC presentano una maggiore capacità di trattenere
acqua nei propri tessuti,. Quindi essendo il sodio l’elemento principe per questo fenomeno, il suo livello nella
dieta è stato ridotto o eliminato totalmente dalla dieta. Per tale motivo alle pazienti si è consigliato una dieta
ricca di verdure che regolasse, di conseguenza, l’apporto di vitamine e potassio con poco sodio. Inoltre in
base alle positività al citotest, che evidenzia gli alimenti con un alta tossicità, sono state consigliati a
privilegiare tutti gli alimenti noti per essere diuretici come ad esempio: broccoli, cavoli, cavolfiori e cavoletti di
Bruxelles (che aiutano il fegato nella detossificazione delle scorie), cipolle (ricche di zolfo), aglio (che
coadiuva l’eliminazione delle scorie), cetrioli, sedano, asparagi, pomodori, carciofi, prezzemolo, mirtilli rossi,
anguria (alimenti molto diuretici). Per bilanciare i livelli dei fluidi sono stati assunti cibi ricchi di potassio come:
banane, albicocche secche, spinaci, patate dolci, melone. Degno di nota è il ruolo svolto dall’assunzione di
pesce, nella terapia dietetica di queste pazienti poiché fonte di acidi grassi omega 3, importanti per la
produzione di molecole anti-infiammatorie. Occorre ricordare che la frutta e la verdura, non solo sono note
per essere ricche di vitamine e di antiossidanti, ma sono in grado di rinforzare le difese immunitarie,
riequilibrando l’intestino. Tuttavia, una recentissima pubblicazione (23) chiarisce come il tratto
gastrointestinale umano ospita centinaia di microrganismi, normali commensali, chiamati collettivamente
microbiota e di come la flora batterica intestinale è influenzata da differenti fattori che comprendono sia il
proprio genotipo, la dieta, gli antibiotici assunti e le possibili infezioni. Quando si verifica l’alterazione del
microbiota, si viene ad instaurare una disbiosi nota anche con il termine dismicrobismo. In particolare
possiamo ipotizzare, che a causa del dismicrobismo intestinale è possibile che gli stessi principi attivi
ormonali possono non essere completamente assorbiti, per cui si potrebbe osservare un eventuale
fallimento della contraccezione ormonale con possibili gravidanze indesiderate. Pertanto non solo le
interferenze farmacologiche, possono compromettere l’assorbimento dei contraccettivi orali, ma anche il
dismicrobismo, prodotte anche dalle intolleranze alimentari, andando ad avviare non solo stati infiammatori
ma anche autoimmuni, compromettendo le terapie ormonali contraccettive orali. A tal fine, lo stesso uso
protratto nel tempo della contraccezione ormonale con pillole contenente ad esempio lattosio, potrebbe
determinare intolleranza allo stesso e vanificarne l’assorbimento. Quindi la contraccezione ormonale del
futuro dovrebbe sempre più essere indirizzata verso vie alternative alla somministrazione orale del farmaco.
Per tale motivo si dovrebbe tendere verso un uso privilegiato delle vie alternative di contraccezione come
quelle trans-vaginale, sottocutanea, intrauterina. Il regime alimentare somministrato alle nostre pazienti, che
metteva in luce le intolleranze, e l’eliminazione dello stesse dalla dieta, ha permesso infine, non solo di
perdere peso, ma di migliorare la sintomatologia inizialmente riferita.
Questi dati, seppure preliminari, evidenziano l’importanza dell’alimentazione e dell’esclusione degli alimenti
non tollerati dall’organismo nelle utilizzatrici di contraccezione ormonale per via orale. Eliminare alimenti non
tollerati può migliorare l'assorbimento al fine di raggiungere un maggior stato di benessere, con la riduzione
soprattutto dei fastidi come meteorismo, aerofagia e infezioni genitali.
BIBLIOGRAFIA
1.
Makepeace AW, Weistein GL, and Friedman MH. The effect of progestin and progesterone on
ovulation in the rabbit. Am. J. Physiol., 1937, 119:512-526.
2.
Gooldman e Gilman. Le basi farmacologiche della terapia. 10° edizione, Ed. McGraw-Hill 2003 58:
1541-1552
3.
Yen SC, Jaffe R, Barbieri RL, Endocrinologia della Riproduzione, IV° Ed.Verduci Editore , Roma
2000.
4.
Genazzani AD, Nappi L. The transition from puberal development to postmenopause discloses a
gonadotropin releasing-hormonemechanism regulating follicle-stimulating hormone release. Gynecol
Endocrinol 1998; 12:135-44.
5.
Genazzani AD, Petraglia F, Volpogni C, et al. FSH secretory pattern and degree of concordance with
LH in amenorrheic, fertile and postmenopausal women. Am J Physiol 1993; 264:E776-E781.
6.
Genazzani AD, Massolo F, Ferrari E, et al. Long- term GnRH agonist administration revealed a
GnRH-indipendent mechanism stimulating FSH discharge in humans. European Journal of Endocrinology
1996; 134:77-83.
7.
Pescetto, De Cecco, Pecorari, Ragni: Manuale di Ginecologia ed Ostetricia vol. 1, Società editrice
Universo , Roma 1997.
8.
Swerdloff RS, Odell WD. Serum luteinizing follicle stimulating hormone levels during sequential and
non-sequential contraceptive treatment of eugonadal women. J Clin Endocrinol 1969; 29:157-63.
14
9.
Krauss RM, Burkman RT Jr. The metabolic impact of oral contraceptives. Source Am J Obstet
Gynecol. 1992 Oct;167(4 Pt 2):1177-84.
10.
Franconi F, Brunelleschi S, Steardo L, Cuomo V: Gender differences in drug responses. Pharmacol
Res 2007, 55:81-95.
11.
Ascenzi P, Bocedi A, Marino M: Structure-function relationship of estrogen receptor alpha and beta:
impact on human health. Mol Aspects Med 2006, 27:299-402.
12.
Ascenzi P, Bocedi A, Marino M: Structure-function relationship of estrogen receptor alpha and beta:
impact on human health. Mol Aspects Med 2006, 27:299-402.
13.
Kirschbaum C, Kudielka BM, Gaab J, Schommer NC, Hellhammer DH: Impact of gender, menstrual
cycle phase, and oral contraceptives on the activity of the hypothalamus-pituitary-adrenal axis. Psychosom
Med 1999, 61:154-162.
14.
Vessey M, Mant D, Smith A, Yeates D: Oral contraceptives and venous thromboembolism: findings
in a large prospective study. Br Med J (Clin Res Ed) 1986, 292:526.
15.
Spitzer WO, Lewis MA, Heinemann LA, Thorogood M, MacRae KD: Third generation oral
contraceptives and risk of venous thromboembolic disorders: an international case-control study.
Transnational Research Group on Oral Contraceptives and the Health of Young Women. BMJ 1996, 312:8388.
16.
Skouby SO, Andersen O, Saurbrey N, Kuhl C: Oral contraception and insulin sensitivity: in vivo
assessment in normal women and women with previous gestational diabetes. J Clin Endocrinol Metab 1987,
64:519-523.
17.
Petersen KR, Christiansen E, Madsbad S, Skouby SO, Andersen LF, Jespersen J: Metabolic and
fibrinolytic response to changed insulin sensitivity in users of oral contraceptives. Contraception 1999,
60:337-344.
18
Wiegratz I, Kuhl H: Progestogen therapies: differences in clinical effects? Trends Endocrinol Metab
2004, 15:277-285.
19.
Haarala A, Eklund C, Pessi T, Lehtimaki T, Huupponen R, Jula A, Viikari J, Raitakari O, Hurme M:
Use of combined oral contraceptives alters metabolic determinants and genetic regulation of C-reactive
protein. The Cardiovascular Risk in Young Finns Study. Scand J Clin Lab Invest 2009, 69:168-174.
20.
Valtonen P, Punnonen K, Saarelainen H, Heiskanen N, Raitakari OT, Juonala M, Viikari JS, Alfthan
G, Kahonen M, Laaksonen R, Lyyra-Laitinen T, Laitinen T, Heinonen S: ADMA concentration changes
across the menstrual cycle and during oral contraceptive use: the Cardiovascular Risk in Young Finns Study.
Eur J Endocrinol 2010, 162:259-265.
21
Campesi I, Sanna M, Zinellu A, Carru C, Rubattu L, Bulzomi P, Seghieri G, Tonolo G, Palermo M,
Rosano G, Marino M, Franconi F. Oral contraceptives modify DNA methylation and monocyte-derived
macrophage function. Biol Sex Differ. 2012 Jan 27;3:4.
22.
Sitruk-Ware R, Nath A. Metabolic effects of contraceptive steroids. Rev Endocr Metab Disord. 2011
1
Jun;12(2):63-75. 23.
Karczewski J , Poniedziałek B, Adamski Z, Rzymski P The effects of the microbiota
on the host immune system. Autoimmunity. 2014 Jul 14:1-11.
WOMN-1116272-0000-NUV-W-07/2016
MSD Italia S.r.l.
www.msd-italia.it www.contattamsd.it [email protected] www.univadis.it
Ogni prodotto menzionato deve essere usato in accordo con il relativo riassunto delle caratteristiche del
prodotto fornito dalla ditta produttrice.
Servizio scientifico offerto alla Classe Medica da MSD Italia S.r.l.
Questa pubblicazione riflette i punti di vista e le esperienze degli autori e non necessariamente quelli della
MSD S.r.l.
15