Retrovirus e HIV
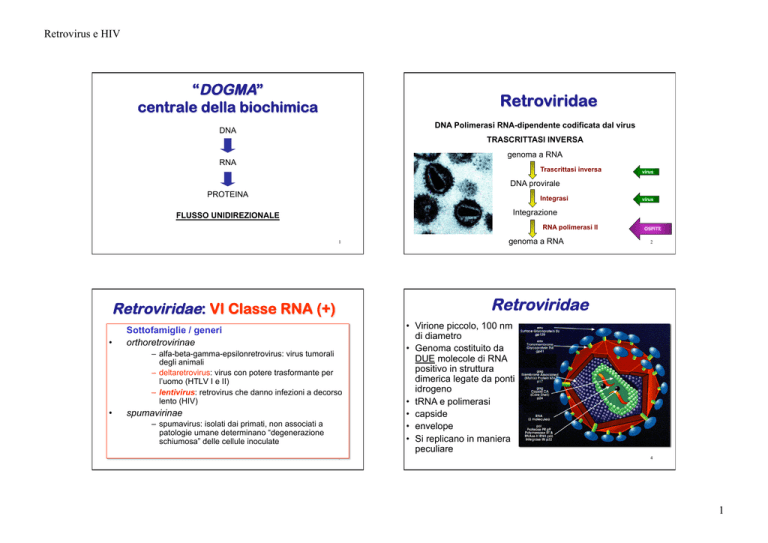
“DOGMA”
centrale della biochimica
Retroviridae
DNA Polimerasi RNA-dipendente codificata dal virus
DNA
TRASCRITTASI INVERSA
genoma a RNA
RNA
Trascrittasi inversa
virus
DNA provirale
PROTEINA
Integrasi
FLUSSO UNIDIREZIONALE
RNA polimerasi II
1
Sottofamiglie / generi
orthoretrovirinae
– alfa-beta-gamma-epsilonretrovirus: virus tumorali
degli animali
– deltaretrovirus: virus con potere trasformante per
l’uomo (HTLV I e II)
– lentivirus: retrovirus che danno infezioni a decorso
lento (HIV)
•
genoma a RNA
OSPITE
2
Retroviridae
Retroviridae: VI Classe RNA (+)
•
virus
Integrazione
spumavirinae
– spumavirus: isolati dai primati, non associati a
patologie umane determinano “degenerazione
schiumosa” delle cellule inoculate
3
• Virione piccolo, 100 nm
di diametro
• Genoma costituito da
DUE molecole di RNA
positivo in struttura
dimerica legate da ponti
idrogeno
• tRNA e polimerasi
• capside
• envelope
• Si replicano in maniera
peculiare
4
1
Retrovirus e HIV
Genoma dei retrovirus
Retroviridae
(RNA positivo)
l’RNA virale è diploide:
• dotato di cap al 5’, poliadenilato al 3’
R
U5
GAG
POL
ENV
U3
R
• orientamento positivo (come mRNA)
un retrovirus ha tipicamente tre geni
L’RNA virale non può essere tradotto direttamente
perché è associato a proteine
GAG : proteine interne
Nuovo mRNA deve essere sintetizzato
ENV: glicoproteine dell’envelope
Per far questo il virus deve passare attraverso un
intermedio replicativo a DNA
POL: enzimi, Trascrittasi inversa, Integrasi, Proteasi
5
Il ciclo
replicativo
I problemi della replicazione
RETROTRSCRIZIONE
INTEGRAZIONE
TRASCRIZIONE di
mRNA e vRNA
(POL II cellulare)
SINTESI
PRECURSORI PROTEICI
Per questo motivo la trascrittasi inversa è all’interno del
virione
6
Quando RNA Pol II trascrive un gene
cellulare non copia l’intero gene
Infatti, nella sintesi di RNA messaggero non
vengono copiati gli elementi genetici che
regolano la trascrizione ma non sono
necessari per la traduzione
ASSEMBLAGGIO
sulla plasmamembrana
MATURAZIONE
attività della PROTEASI
8
2
Retrovirus e HIV
In pratica
Retroviridae
RNA
genomico
virale
RT
primer
RNA polymerase II non può copiare
Le sequenze a monte del sito di inizio della trascrizione
Reverse
transcriptase
dsDNA
• Promotori / Enhancers
Una parte delle sequenze a valle del sito di termine della trascrizione
RNA synthesis
initiation site
• Poly A site / termination site
?
promotor
il provirus dovrebbe integrare a valle di un promotore cellulare
e a monte di un sito di termine
RNA pol II
RNA synthesis termination
site
OPPURE
Trovare il modo per avere le sue proprie sequenze
di controllo che però
IL RISULTATO
DELLA
TRASCRIZIONE
È UN
RNA
SENZA
IL RISULTATO
DELLA
TRASCRIZIONE
È UN
RNA
PIU’ SEQUENZE
CORTO!!
10
DI REGOLAZIONE CHE NON SERVONO PER LA TRADUZIONE
NON vengono copiate!
Retroviridae
Repeat
region
R
U5
Viral RNA
Repeat
region
soluzione: DNA e RNA sono diversi
11
U3
R
Reverse
transcriptase
RNA genomico
R
U5
RNA termination site
GAG
POL
ENV
U3
R
Proviral DNA
RNA initiation site
DNA provirale
U3
R
U5
U3
R
U5
vengono formati gli LTR (long terminal repeats)
U3
R
U5
GAG
POL
ENV
U3
R
U5
promotor
POLII
LTR
POLII
LTR
il DNA provirale è riorganizzato in modo da avere le sequenze regolatorie nella
giusta posizione per essere trasmesse al messaggero genomico
RNA initiation site
12
RNA termination site
13
3
Retrovirus e HIV
**
Formazione
degli LTR
LTR: sequenze regolatrici
RNasiH
1° salto
**
RNasiH
DNA-
RNasiH
**
RNA
**
5’LTR
2° salto
3’LTR
RNA
DNA+
DNA+
** : primer
• Regioni di controllo (tipiche degli eucarioti)
che legano i fattori di trascrizione e regolano
l’inizio e la fine della trascrizione, enhancer e
promoters (U3), terminator (U5)
• CAT box e TATA box (sito di legame dei TFII
per la RNA pol II) si trovano nel contesto del
promoter (U3) al 5’ del genoma provirale
• Il sito di poliadenilazione e di termine della
trascrizione (U5) al 3’ del genoma provirale
14
Retrovirus difettivi
Alcuni retrovirus hanno un gene
extra che conferisce loro
capacità trasformanti
hanno un oncogene al posto del gene regolare
Avian Myeloblastosis Virus
“retrovirus tipico ”
R
U5
GAG
POL
ENV
16
R
U3
U5
R
GAG
POL
MYB
U3
R
Feline Sarcoma Virus (FSV)
R
Rous Sarcoma Virus
U5
dGAG
FMS
dENV
U3
R
Avian Myelocytoma Virus (MC29)
R
U5
GAG
POL
ENV
SRC
U3
R
17
R
U5
dGAG
MYC
dENV
U3
R
18
4
Retrovirus e HIV
Retrovirus difettivi
hanno un oncogene al posto del gene regolare
Non possono produrre le loro proprie
proteine strutturali e così hanno
bisogno di un virus “helper” per
produrre infezione e replicare.
Da dove viene il gene?
• Il gene è stato acquisito dalle cellule eucariote in
seguito a continui passaggi infettivi
• Il processo d’integrazione del DNA provirale
rappresenta uno strumento eccezionale per lo
scambio orizzontale di geni tra individui.
È dunque probabile che i retrovirus siano stati
fondamentali nel corso del processo evolutivo
proprio favorendo questo mescolamento.
• Si ritiene che circa l’8% del genoma umano sia
costituito da sequenze retrovirali (retrovirus
endogeni “HERV”) il cui ruolo biologico è a
tutt’oggi oscuro
19
20
Virus oncogeni a RNA
Virus tumorali a RNA
L’oncogene virale è
Un gene simile al proto-oncogene cellulare MA
è capace di indurre trasformazione perché nel
retrovirus è overespresso
oncogene virale
V-onc
Un oncogene cellulare induce tumore per
Cellular Proto-oncogene
• mutazione
C-onc
• altri cambiamenti nel genoma cellulare
21
22
5
Retrovirus e HIV
Retrovirus
cronicamente trasformanti
Retrovirus acutamente trasformanti
(ATV)
oncovirus difettivi transattivanti
• Non sono in grado di replicarsi (ecc. RSV)
• Possiedono un gene sostituito (v-onc) e se
integrano causano il tumore in modo molto rapido
• Possono agire direttamente o transattivando fattori
cellulari (trans-attivanti)
• Non hanno bisogno di inserirsi in un sito
particolare
23
Retrovirus
cronicamente trasformanti
Causano il tumore in modo inefficiente e dopo
molto tempo
Avian Leukosis Virus (causa leucemia)
R
U5
GAG
POL
ENV
U3
R
Non c’è oncogene! – come causa il
tumore?
24
Retrovirus
cronicamente trasformanti
ALV può integrare in MOLTI punti del genoma
della cellula ospite
Ma nel tumore si trova sempre nello STESSO sito
?
Il tumore nasce da una cellula
• Qualche cosa che riguarda il sito di integrazione
deve essere importante per la trasformazione
• l’evento è cruciale ma è raro
25
L’integrazione che produce trasformazione nella
leucemia aviaria avviene in prossimità di un
oncogene cellulare
C-myc!
Oncogenesi per inserzione di un
promotore
26
6
Retrovirus e HIV
Oncogenesi
Retroviridae
oncovirus non-difettivi cis-attivanti
POL II
POL II
Host DNA
U3
R
U5
Promotore
Gag
Pol
Env
U3
R
U5
Host DNA
Promotore
c-myc
overespresso
INSERZIONE DI UN PROMOTORE
ü il virus si integra a caso e solo quando si integra in
siti particolari induce il tumore
ü gli enhancer/promoter virali sono molto forti
ü se il gene cellulare a valle di un promoter virale è
un oncogene il virus può trasformare la cellula
ü oncogenesi è conseguente alla disregolazione
(attivazione della trascrizione) di un c-onc
27
28
Virus tumorali a RNA
Deltaretrovirus
La scoperta di retrovirus contenenti oncogeni
spiega come i tumori possono avere eziologia
virale
Questi virus causano tumori negli animali da
laboratorio
Non c’è evidenza che lo causino nell’uomo
ü A questo genere appartengono i primi
retrovirus umani isolati, HTLV-1 e HTLV-2
ü Questi virus causano il cancro dopo una
latenza di almeno 30 anni
ü Oltre ai geni virali contengono due o più geni
regolatori non correlati con oncogeni cellulari
- tax
- rex
29
30
7
Retrovirus e HIV
Genoma HTLV-1
rex
ü È un regolatore dell’espressione a livello
post-trascrizionale agendo sugli mRNA virali,
prevenendo ulteriore splicing e promuovendo
il trasporto al citoplasma dei messaggeri
lunghi.
Tat e rex derivano da un processo di doppio splicing: regolano la replicazione virale
interferendo sul livello di trascrizione: regolano l’espressione di geni eterologhi.
L’azione di entrambi è capace di produrre uno stimolo autocrino per la proliferazione
31
delle celluleT -> moltiplicazione incontrollata -> trasformazione
32
Oncogenesi
tax
(oncovirus non-difettivi transattivanti)
ü È un trans-attivatore trascrizionale, attiva la
trascrizione dell’mRNA virale (e quindi del
genoma e delle proteine virali) legandosi al
promotore sull’LTR dell’estremità 5’
ü Attiva anche i promotori di geni eterologhi,
tra i quali IL-2, IL-2r, IL-3, il fattore stimolante
le colonie di granulociti/macrofagi (GM-CSF),
che promuovono la crescita cellulare
33
Quindi promuovono la trasformazione cellulare in
un modo indiretto rispetto agli altri oncovirus
Attraverso
ü Transattivazione dei geni che controllano la
crescita
Non è necessaria
ü Integrazione vicino a geni che controllano la
crescita
34
8
Retrovirus e HIV
HTLV-1: trasmissione
HTLV-1
• È l’agente eziologico della leucemia
a cellule T dell’adulto: forma rara e
molto aggressiva di leucemia che
coinvolge anche la cute (Africa,
Giappone, Caraibi)
• Tutti i malati sono positivi per
anticorpi anti HTLV-1
• Nelle cellule tumorali viene messo in
evidenza il genoma virale integrato.
• Poche cellule inizialmente infette,
l’espansione è usualmente
oligoclonale e clonale
Lesioni cutanee in paziente
con ATL acuta
ü Attraverso lo scambio di fluidi biologici per contatto
cellula-cellula e non attraverso virus libero
à Rapporto sessuale (linfociti presenti nelle secrezioni
genitali)
à Trasfusione (prima del 1989 sangue non controllato per
la presenza di anticorpi)
à Condivisione di aghi contaminati da sangue
(tossicodipendenti)
à Perinatale (linfociti durante l’allattamento)
35
HTLV-1: patogenesi
ü L’infezione è usualmente asintomatica
ü Il tropismo è selettivo per i linfociti T CD4+ attivati
ü Può rimanere latente o replicare lentamente per
anni, ma può indurre la crescita clonale di cellule T
CD4+ -> aberrazioni cromosomiche -> leucemia in
1- 5% dei casi dopo 30-50 anni
ü La maggioranza dei soggetti infettati NON sviluppa
la patologia leucemica
ü Dimostrato un legame tra questo virus e una rara
malattia del SNC (paraparesi spastica tropicale).37
36
HTLV-2
ü E’ stato isolato da una forma particolare di
leucemia detta “a cellule capellute” (hairy
cells leukemia)
ü non sono chiari i legami di questo virus con le
patologie umane
ü È spesso presente in tossicodipendenti (IDU)
infettati da HIV
ü La maggior parte dei sieropositivi rimane
asintomatica per tutta la vita
38
9
Retrovirus e HIV
Virus dell’immunodeficienza umana
Il virione
ü Famiglia: Retroviridae
Sottofamiglia: Orthoretrovirinae
Genere: Lentivirus
Proteina di
matrice p17
RNA genomico 2
molecole
ü HIV-1: Isolato nel 1983
ü Genoma esiste sotto due forme
fisiche: RNA 9.2 kb nel virione
libero, DNA ds 10.000 bp nella
cellula infettata
gp41 env
ü 2 distinti tipi: HIV-1 e HIV-2
ü HIV 1: 4 gruppi (M, N, O, P)
Core virale
p24
ü 11 sottotipi nel gruppo M (da A a
K); 5 sotto-sottotipi (A1-4, F1-2);
(forme ricombinanti
43 CRF; n URF circolanti e uniche)
80-120 nm
ü Quasispecie nell’ospite
infettato
39
È L’AGENTE EZIOLOGICO DELL’AIDS
HIV-1: ORGANIZZAZIONE DEL GENOMA e DEL VIRIONE
vpr
R
U5
pol
gag
vif
rev
vpr
• È anche indispensabile
l’interazione con un corecettore
vif
Capside, p24
Nucleocapside, p7
Glicoproteina di
transmembrana (gp41)
rev-
-vpu
tat
-nef
env
rev
tat-
La replicazione di HIV
– linfociti T, monociti, macrofagi, cellule
dendritiche e della microglia
Matrice, p17
Trascrittasi
An An
inversa p51, p66
Vif, Vpr, Nef
Glicoproteina
di superficie (gp120)
gag
U3 R
Lipid Bilayer
RNA genomico
U3 R
tat-
40
• Avviene in cellule che esprimono la
molecola CD4 che è il recettore per
la gp120 dell’envelope
-nef
env
Proteasi p11
pol
rev-
-vpu
tat
Integrasi p32
U5
gp120 env
U5
41
– CCR5 (macrofagi e linfociti, lega βchemochine e RANTES)
• Ceppi macrofagotropici, NSI, R5tropici
– CXCR4 (linfociti, lega α-chemochine,
SDF-1)
• Ceppi linfotropici, SI, X4-tropici
42
U3 R
10
Retrovirus e HIV
replicazione di HIV: ingresso
Il ciclo replicativo
• l’interazione di gp120 con i recettori provoca
una modifica della conformazione di gp41 che
media la fusione tra cellula ed envelope virale
• Il virus entra quindi per FUSIONE
gp120
CD4
Conformational
Changes
gp120
gp120
CD4
Bind CCR5
Binding
Conformational
changes
gp41
Membrane
penetration
Membrane
fusion
43
RNA EXPRESSION PATTERN OF HIV-1
OPEN READING FRAMES
tev2
44
REGOLAZIONE DELLA TRASCRIZIONE
tat2/tev3
rev1/tev1
pol
vpr
gag
vif
6044
6724
4962
5463
SD5
transcription
9602
AAA
SA7
SD1
TAR
splicing
EXONS CONSTITUTING SPLICED mRNA
E1
E2
E3
E4/5
AAA
RRE
E7
CYTOPLASM
EARLY
Multiply spliced mRNAs
UNSPLICED mRNA (full-length HIV transcripts -> genome , gag, gag-pol)
SINGLY SPLICED mRNA 4.0 Kb class
RRE
Rev-dependent transport
Rev-independent transport
8369
5777
5954
4913
5390
455
SA4
SD2 SD3
rev2
SD4
SA5
SA2
CAP
SA3
743
Integrated provirus
nef
vpu
SPLICE JUNCTIONS
NUCLEUS
env
tat 1
VpuEnv 80%
Vif 100%
Vpr 100%
translation
Tat 48%
Rev 40%
4549%
Nef
Unspliced + singly spliced mRNA
RRE
RRE
translation
Tat
MULTIPLY SPLICED mRNA 1.8 Kb class
LATE
Rev
Nef
“Early” proteins
Gag, Pol, Env,
Vpr, Vpu, Vif
“Late” proteins
46
11
Retrovirus e HIV
TAT
proteine regolatorie
Transcriptional activator (p14)
• tat, rev
• sono codificate da geni organizzati in esoni
e derivano quindi da messaggeri processati
dalla cellula ospite mediante “splicing”
ü Rientra nel nucleo dove transattiva il genoma virale
ü Non si lega al DNA ma esplica la sua azione legandosi a
TAR (transactivator active region) all’inizio del trascritto virale
ü In presenza di fattori dell’ospite aumenta la capacità di
trascrizione della RNA Pol II sullo stampo del DNA virale
(trascritti lunghi)
ü Agisce anche in cellule non infettate provocando
l’innesco di segnali di membrana per l’attivazione
48
49
NEF
REV
regolatore dell’espressione virale (p19)
ü Protegge dallo splicing gli mRNA di maggiori
dimensioni
ü L’attività si estrinseca attraverso il legame di
rev con sequenze RRE
ü Promuove l’esporto di trascritti lunghi o non
completamente processati
50
negative effector (p27kD)
ü Riduce la presenza di CD4 mediante
endocitosi e l’espressione di MHC I
ü Blocca l’apoptosi
ü Altera lo stato di attivazione cellulare
ü Eleva l’infettività
ü La sua delezione correla con una lenta
progressione
51
12
Retrovirus e HIV
proteine gag e pol
altre proteine regolatorie
Favoriscono in modo diverso l’infettività virale
Favoriscono in modo diverso l’infettività virale
ü Vpr viral
protein R (p15kD)
ü Promuove l’arresto del ciclo cellulare in G2
ü Vpr
viral protein
R (p15)
incorporata
nel virione
ü Facilita
l’importo
nucleare
del PIC
ü Promuove l’arresto del ciclo cellulare in G2
ü Facilita
nucleare
del PIC (p23kD)
ü Vif
virall’importo
infectivity
factor
ü Vif
viral infectivity
factordi(p23)
ü Contrasta
l’effetto
APOBECG3 (citidina deaminasi
ü cellulare)
Contrasta l’effetto
di APOBECG3 (citidina
deaminasi cellulare)
che
che produrrebbe
ipermutazione
del genoma
produrrebbe
del genoma
provirale
infezione abortiva nel
provirale eipermutazione
infezione abortiva
nel
ciclo esuccessivo
ciclo successivo
ü Vpu
(virul
protein
U, 16kD)
ü Vpu (virul
protein
U, 16kD)
• Sintetizzate come precursori poliproteici
(55 e 170 Kd) da un messaggero virale
unspliced (genoma o gag-pol)
– p55 precursore delle proteine di gag
– p170 (poliproteina di fusione)
precursore anche delle proteine
enzimatiche codificate da pol
• Entrambi i precursori sono miristilati
• Entrambi digeriti dalla proteasi VIRALE :
Gag Precursor (pr 55) Assemblin
–
nella
degradazione
di CD4 a
del
– Interviene
Interviene nella
degradazione
di CD4 all’interno
dellivello
proteasoma
– proteasoma
Facilita il rilascio delle particelle virali dalla membrana
– Facilita il rilascio delle particelle virali dalla membrana
LTR
gag orf
pol orf
translation with -1 frameshift
Gag-Pol Precursor (pr 170)
Assemblin domain
52
proteine env
• precursore gp160 matura nel RE
• le proteasi CELLULARI lo scindono in due
glicoproteine
– gp41 che attraversa l’involucro lipidico
– gp120, ancorata a gp41, che è esposta sulla
superficie del virione
viral envelope
gp 120 SU
gp 41 TM
cellular protease digestion
Env Precursor (gp 160)
env orf
protease digestion
p17
p24
p7, p6
53
Assemblaggio, gemmazione e
maturazione
• Gli antigeni di env (gp120 e gp41), dopo la
maturazione avvenuta nel golgi, compaiono
sulla superficie cellulare
• I precursori gag e gag-pol (p55 e p170), l’RNA
genomico, vpr e vif si assemblano al di sotto
della membrana dove inizia il processamento
delle proteine del core virale che continua dopo
la gemmazione
• La gemmazione può danneggiare le cellule
56
57
LTR
13
Retrovirus e HIV
Meccanismi che mediano la citopatogenicità virale
diretta e indiretta
Patogenesi
fattori dell’ospite
fattori del virus
L’ospite oppone una fortissima risposta antivirale contro il virus ma il virus infetta
ed integra proprio nel genoma delle cellule deputate a contenere l’infezione.
Si apre una gara impari, la persistenza dell’infezione è sicura.
59
Modello di infezione acuta vaginale nella scimmia Rhesus.
60
RISPOSTA IMMUNITARIA
Linfocita B memoria
Eventi precoci nella infezione transmucosale
di HIV-1
La proteina dell’envelope virale si lega alla
molecola CD4 delle cellule dendritiche di
Langerhans nella lamina propria. L’ingresso
nella cellula richiede la presenza di un
corecettore sulla membrana.
Le cellule dendritiche esprimono CD4 e CCR5
sono selettivamente infettate da ceppi virali
R5 (macrofago-tropici).
Dopo 2 giorni dall’esposizione il virus è
presente nei linfonodi.
Dopo altri 3 giorni può essere coltivato dal
plasma. (viremia primaria)
Si calcola che nell’uomo il tempo tra
l’infezione della mucosa e la viremia
iniziale sia compreso tra 4-11 giorni
Linfocita T
CD4+
Linfocita B
TH2
Macrofago che
presenta l’antigene
Linfocita B
attivato
Molecole di
segnalazione
TH1 stimolatorie
Linfocita T
CD8 +
Cellula infettata da HIV
Linfocita T CD8
predisposto
Cellula infettata
uccisa
Macrofago infettato
Linfocita T CD8 memoria
N.Engl.J.Med., Kahn & Walker, 2 July ‘98, Vol.339
61
62
14
Retrovirus e HIV
Ostacoli che il sistema immune deve affrontare
DYNAMICS OF HIV-1 INFECTION IN VIVO
Productively infected
CD4+ lymphocytes
Tutti questi ostacoli
alla eliminazione e/o
controllo
dell’infezione da
parte delle difese
dell’ospite sono già
stabiliti
nell’infezione acuta.
Latently infected
CD4+ lymphocytes
t1/2 8.5d
<1%
t1/2 1.1d
1.2 days
per
generation
93-99%
HIV-1
t1/2 6h
Uninfected
CD4+ lymphocytes
1-7%
?%
Lymphoid tissue
follicular dendritic cells
Trapping
Uninfected activated
CD4+ lymphocytes
PHASE 1
63
Variabilità di HIV
~1010 new genomes per day
~140 replication cycles per year
CD4+ lymphocytes
infected with
defective provirus
t1/2 145d
PHASE 2
Long-lived
cell populations
64
The scale of HIV variation
tutto concorre alla
generazione di una
quasispecie, per dirla con
Eigen, una distribuzione
di varianti ottenute da un
processo combinato di
mutazione e selezione.
On the nature of virus quasispecies. Trends Microbiol
1996; 4: 216–218
Bagnarelli et al J Virol 1999
65
La divergenza di HIV in una singola persona è simile a quella del
virus dell’influenza A nell’epidemia globale del 96
66
15
Retrovirus e HIV
HIV variability
Le cause della diversità di HIV
Dinamica di replicazione virale
Tendenza all’errore della RT
Caratteristiche genetiche dell’ospite
La risposta immune
La compartimentalizzazione
L’attivazione casuale di cellule infettate
latentemente
La fitness delle varianti virali
Diversità ed
evoluzione della
quasispecie virale
Le conseguenze
Hemelaar, AIDS 2006
L’enorme flessibilità
genetica
Il tropismo cellulare (NSI vs SI; R5 vs X4)
Evasione dalla risposta immune
Resistenza ai farmaci
Fallimento della vaccinazione
Distribuzione regionale dei vari subtipi e delle principali CRF. Il 50% delle infezioni è globalmente sostenuto
da virus di sottotipo C (che ha un primato assoluto in Africa subsaariana ed in India dove è responsabile di
> dell’80% delle iinfezioni, seguono il sottotipo A (12%) e quindi il B (10%), che prevale in Occidente
67
HIV-1
HIV-1 mortality
mortality
HIV-1
INFECTION
Long term non-progressors
Elite Controllers
<1%
Length
Length of
of infection
infection
69
8 - 15 years70
Persone infettate con HIV da più di
sette anni che mantengono nel tempo
un numero di linfociti CD4 stabilmente
al di sopra di 600 per ul, sono
asintomatici e non sono mai stati
trattati
71
16
Retrovirus e HIV
Fattori legati all’ospite infetto e
all’ospite esposto non infetto
Fattori legati al virus
ü Controllo mediato da una risposta immune cellulare
efficace che persiste nel tempo senza esaurirsi
ü Mutazioni del corecettore o dei ligandi naturali
ü Autoimmunità funzionale che abolisce il CCR5 dalla
membrana
ü Aplotipi MHC (HLA) classe I e II contro epitopi molto
conservati (prostitute di nairobi)
ü Immunità contro cellule umane (prostitute di nairobi)
• Forte pressione selettiva verso varianti
di env con inferiore capacità replicativa
• Alterazioni nei geni regolatori:
soprattutto delezioni nel gene nef
(coorte australiana)
72
Trasmissione di HIV
Storia naturale dell’infezione da HIV
Infezione
primaria
• Sessuale
• Parenterale
73
Latenza clinica
SIEROCONVERSIONE
Risposta immune
X
MORTE
Sindrome
costituzionale
AIDS
Infezioni
opportunistiche
tumori
N° cellule CD4+
• Verticale
Plasma viremia
Cellule infettive
i contatti interpersonali
non trasmettono il virus
3-12 weeks
76
sintomi
1-3 anni
Fino a 12 anni
sintomi
77
17
Retrovirus e HIV
Storia naturale dell’infezione da HIV
Infezione
primaria
Latenza clinica
SIEROCONVERSIONE
Risposta immune
MORTE
Sindrome
costituzionale
AIDS
Infezioni
opportunistiche
tumori
N° cellule CD4+
Ulcerazioni
Mughetto
Ulcerazioni
Plasma viremia
Cellule infettive
3-12 weeks
78
Relazione tra il set-point della viremia dopo
l’infezione acuta e la probabilità di progressione
nella malattia
sintomi
1-3 anni
Fino a 12 anni
sintomi
79
Relazione tra il numero dei CD4 dopo l’infezione
acuta e la probabilità di progressione nella
malattia
HIV 1-RNA nel plasma
( copie / ml )
106
105
62%
104
49%
26%
% pazienti con AIDS
5 anni dopo l’infezione
8%
103
Il numero assoluto di
cellule CD4 non è un
buon predittore di
progressione
Soglia di sensibilità
0
0.5
1.0
1.5
2.0
Adattato da Mellors JW Science 1996;Ho DD Science 199680
81
18
Retrovirus e HIV
Storia naturale dell’infezione da HIV
Infezione
primaria
Latenza clinica
SIEROCONVERSIONE
Risposta immune
MORTE
Sindrome
costituzionale
AIDS
Infezioni
opportunistiche
tumori
N° cellule CD4+
Plasma viremia
Cellule infettive
3-12 weeks
1-3 anni
Fino a 12 anni
sintomi
sintomi
82
83
Storia naturale dell’infezione da HIV
Infezione
primaria
Latenza clinica
SIEROCONVERSIONE
Risposta immune
MORTE
Sindrome
costituzionale
AIDS
• Sierologia. Include un test di screening ed
un test di conferma. La positività indica
contatto con il virus, infezione.
• Screening: viene utilizzato un test ELISA
combinato per la ricerca degli anticorpi e
dell’antigene p24. È molto precoce e risulta
positivo anche nell’infezione acuta.
Infezioni
opportunistiche
tumori
N° cellule CD4+
Plasma viremia
Cellule infettive
3-12 weeks
sintomi
1-3 anni
Fino a 12 anni e più
sintomi
HIV: diagnosi
84
• Conferma - Viene utilizzato un Western Blot.
85
19
Retrovirus e HIV
Terapia antiretrovirale
Individuazione dei target nel ciclo di replicazione.
Altri test
• Isolamento virale (non usato)
• Ricerca RNA e DNA virale mediante PCR
– Standardizzate, rapide e molto affidabili
indispensabili per la diagnosi nei bambini nati
da madre sieropositiva
• Ricerca quantitativa RNA genomico (viremia)
– Indispensabile per il controllo dell’andamento
dell’infezione e della terapia
• Sequenziamento
– Permette la valutazione di resistenze a farmaci
88
HAART
La terapia antiretrovirale (HAART)
1.
2.
3.
4.
5.
89
Modulatori dell’espressione del recettore cellulare CD4
Inibitori della fase di attacco del virus (attivi su gp120)
Antagonisti dei recettori delle chemochine (Maraviroc)
Inibitori della fusione cellulare (Fuzeon)
Inibitori della trascrittasi inversa
- Inibitori nucleosidici della trascrittasi inversa (NRTIs)
(AZT, d4T, 3TC…)
- Inibitori nucleotidici della trascrittasi inversa (NtRTIs)
(Tenofovir TDF)
- Inibitori non nucleosidici della trascrittasi inversa (NNRTIs)
(Nevirapina…)
6.
7.
8.
9.
Inibitori dell’integrasi (Raltegravir, Eviltegravir, Dolutegravir)
Inibitori della trascrizione
Inibitori della protesi (PIs) (Indinavir, Ritonavir, Saquinavir…)
Inibitori della ribonucleasi H
90
Non esiste a tutt’oggi un
vaccino efficace
92
20
Retrovirus e HIV
PROBLEMI INERENTI LO SVILUPPO DEL
VACCINO
Persone HIV positive in vita alla fine 2008
® Il virus replica nonostante la vigorosa risposta immune (sia umorale che cellulare)
® La comparsa di anticorpi neutralizzanti è debole e tardiva rispetto al contenimento
della replicazione subito dopo l’infezione primaria ⇒ non sono critici nel limitare
la replicazione
L’iniziale contenimento della replicazione coincide con l’emergenza di una
risposta CTL virus specifica ⇒ un vaccino efficace dovrebbe stimolare questa
risposta
® Il virus muta molto rapidamente ⇒ mutanti non riconosciuti dal sistema immune
Tuttavia sono stati generati alcuni monoclonali umani dotati di potente attività
neutralizzante contro isolati primari differenti
® Il virus persiste come DNA provirale latente ⇒ può replicare in tempi successivi
® La via di trasmissione più frequente è attraverso le mucose ⇒ immunità
mucosale
Western Europe
North America
1.3 million
[600 000 – 1.1 million]
[480 000 – 1.9 million]
Caribbean
230 000
Eastern Europe
& Central Asia
760 000
1.6 million
[ 1.2 – 2.1 million]
[210 000 – 370 000]
800 000
[270 000 – 500 000]
Latin America
Sub-Saharan Africa
[1.4 – 1.9 million]
[20.9 – 24.3 million]
1.6 million
East Asia
North Africa & Middle East South [620 000 – 960 000]
380 000
& South-East Asia
22.5 million
4.0 million
[3.3 – 5.1 million]
Oceania
75 000
[53 000 – 120 000]
Totale: 33.2 (30.6 – 36.1) milioni
93
Sieropositività riscontrata negli
ambulatori per le gravide
94
La prevenzione……
Hiv prevalence (%) among pregnant women attending
antenatal clinics in Sub-Saharan Africa, 1997-2007
95
96
Source: WHO, HIV/AIDS Epidemiological Surveillance Update for the WHO African Region, 2002
21
Retrovirus e HIV
La migliore strategia è combinare prevenzione
e trattamento
Il trattamento….
men and women aged 25–44 years
3.7 million new HIV
infections
Population = 640
milioni
-6% yearly
-50% yearly
Population = 273
milioni
29 milioni di nuove infezioni e 10 milioni di morti sarebbero risparmiate tra il 2004 e il 2020
-74% yearly
L’epidemia in Africa sub-Saariana
Dove 3/4 delle morti sono causate dall’AIDS
97
98
Nuove diagnosi di infezione da HIV per modalità di
trasmissione e anno di diagnosi
100%
80%
Altro
Incidenza media nel 2014 = 6,1
4,7 / 100000 italiani
19,3 / 100000 stranieri
60%
Eterosess
40%
Omo/bisess
20%
TD
06
04
03
02
01
00
99
98
97
96
95
94
93
92
91
90
89
88
87
86
05
20
20
20
20
20
20
20
19
19
19
19
19
19
19
19
19
19
19
19
19
19
19
85
0%
1511
1593
951
Parallelo incremento di
HIV sottotipi non B nel
tempo
99
2649
100
Notiziario dell’Istituto Superiore di Sanità, www.iss.it
22
Retrovirus e HIV
Numero stimato di soggetti HIV+ viventi
in Italia nel 2009:
~150.000
Quanti sanno di essere HIV+?
101
102
Dati COA
Persone che scoprono la loro HIV-positività alla diagnosi
di AIDS: 1996-2009
Numero stimato di soggetti HIV+ viventi
in Italia nel 2009:
At AIDS diagnosis
Before AIDS diagnosis
100%
90%
~150.000
80%
70%
60%
50%
Quanti non sanno di essere HIV+?
1/4 dei soggetti HIV+ in Italia non sa
di essere infetto
Suligoi B, COA
103
40%
30%
20%
10%
25.8 33.0 41.3 46.3 48.1 48.0 51.3 51.0 50.8 52.2 54.0 55.3 59.0 60.2
0%
1996
1997
1998
1999
2000
2001
2002
2003
2004
2005
2006
2007
2008
Molti pazienti non sanno di essere infetti
2009*
104
National AIDS Center, Italy; data at November 2009
23
Retrovirus e HIV
Numero dei casi di AIDS e incidenza
1996
HAART
Incidenza delle nuove diagnosi di HIV e AIDS
HIV
AIDS
Incidenza: 7-3,9
Incidenza: 3-1
938 nel
2014
105
Dati italiani update dic 2014
106
2015
• Stabile il numero delle nuove diagnosi di HIV.
• Più frequenti le diagnosi in MSM (maschi che fanno sesso con maschi) tra
gli italiani e in eterosessuali femmine tra gli stranieri.
• Aumenta l’età nelle nuove diagnosi di HIV (39 anni maschi, 36 anni
femmine).
• Più della metà delle nuove diagnosi di HIV avviene in fase avanzata (bassi
CD4 o presenza di sintomi).
• Stabile il numero dei casi di AIDS.
• Diminuiscono i decessi in persone con AIDS.
• La maggior parte delle persone diagnosticate con AIDS non ha effettuato
terapia antiretrovirale.
107
Centro Operativo AIDS (COA)
www.iss.it/ccoa/
108
24
Retrovirus e HIV
Alcune considerazioni…
Ø I casi di AIDS in Italia sono in diminuzione
Ø Le nuove terapie ARV consentono una migliore qualità di vita e una maggiore
sopravvivenza
Ø I test di laboratorio permettono una diagnosi sempre più accurata e precoce
dell’infezione
Ø L’epidemia da HIV in Italia non è in declino
tuttavia...
• Non si può abbassare la guardia.
• Informazione/pubblicità e ricerca per nuovi farmaci efficaci
sono necessari per superare il problema della diffusione del
109
virus
25












