PATHOLOGICA 2005;97:73-77
ARTICOLO
DI AGGIORNAMENTO
Cellule staminali tumorali: la malattia neoplastica
da un altro punto di vista
Cancer stem cells: the neoplastic disease from a different view point
P.G. NUCIFORO, F. FRAGGETTA1
Molecular Pathology Unit IFOM, Istituto FIRC di Oncologia Molecolare, Milano;
1
Anatomia Patologica, Ospedale Cannizzaro, Catania
Parole chiave
Cellula staminale • Cellula staminale tumorale
Introduzione
Gran parte del dibattito sulle cellule staminali (CS) si
concentra sugli aspetti più o meno etici dell’origine
embrionale di tali elementi e sulle possibilità di manipolazione degli stessi per la riparazione di tessuti danneggiati. Tuttavia, di recente, particolare attenzione è
stata dedicata all’applicazione dei principi biologici di
staminalità in campo oncologico 1-6.
Ad oggi uno dei principali obiettivi del mondo scientifico è rappresentato dall’identificazione del tipo cellulare responsabile delle malattie neoplastiche, della loro
crescita nel tempo, della progressione e metastatizzazione. Le CS, in virtù della loro illimitata capacità replicativa e della loro “lunga” vita, potrebbero rappresentare il candidato ideale come cellula di origine delle neoplasie e, di conseguenza, il bersaglio terapeutico
per l’eradicazione del tumore.
In questa breve review verranno rapidamente trattate
le caratteristiche biologiche delle CS, verrà discussa
l’esistenza di una CS tumorale, la “cancer stem cell
theory” e l’eventuale ruolo del patologo in questo
nuovo scenario.
La cellula staminale: definizione e
caratteristiche biologiche
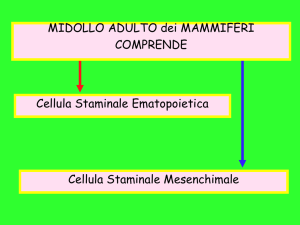
Le CS, come classicamente definite, sono cellule dotate di due caratteristiche principali: sono capaci di autogenerarsi (caratteristica nota come “self-renew”) e di
generare cellule figlie, o cellule progenitrici (CP o cellule transit), destinate a differenziarsi verso svariati tipi cellulari e quindi a dar vita a tessuti e organi, come i
muscoli, il cuore, il fegato, le ossa ecc. 7 8. Tale capacità
Key words
Stem cell • Cancer stem cell
differenziativa può essere totipotente (cellule staminali
embrionali), quando un’unica cellula è in grado di dare
origine a tutti i tipi di tessuto; multipotente (per es. le
cellule progenitrici della linea ematopoietica), quando
da origine ad alcuni tipi cellulari, ed unipotente, quando da una cellula origina un solo tipo cellulare.
Il mantenimento del comparto staminale e della sua
progenie è possibile grazie all’abilità di ogni CS di andare incontro a due tipi di divisione cellulare, definiti
asimmetrica e simmetrica 5-9. Nella prima modalità una
cellula staminale genera una cellula identica a se stessa
ed un’altra più differenziata (CP). Quell’identica provvede all’automantenimento del comparto staminale;
quella diversa, attraverso svariati passaggi differenziativi e divisioni cellulari, dà luogo infine ad una popolazione cellulare matura. Nella divisione simmetrica, invece, la cellula staminale genera due cellule figlie identiche, una delle quali mantiene la caratteristica di CS e
l’altra può successivamente acquisire la capacità di CP.
Ne scaturisce che le CS possono ampliare il loro comparto utilizzando la divisione simmetrica e non indirizzando nessuna delle cellule figlie verso le CP.
Le CS possono essere divise in due classi funzionali: la
prima rappresentata da cellule adibite al rinnovo tissutale, la seconda rappresentata da CS che sono attivate solo
in condizioni particolari. Nel primo caso – ad esempio
nel midollo osseo, cute ed intestino – le cellule staminali hanno il ruolo di sostituire le cellule terminalmente
differenziate, una volta che queste maturano e muoiono
o sono eliminate (vedi ad esempio attraverso la superficie cutanea). Ne risulta che tali CS sono sempre attive
sebbene a bassa attività. Nel secondo caso, come avviene ad esempio nella riparazione tissutale, esse sono attivate solo a seguito di stimoli e sono capaci di rimpiazzare il tessuto danneggiato o andato perduto.
Corrispondenza
Dr. Paolo Giovanni Nuciforo, Unità di Patologia Molecolare,
IFOM, Istituto FIRC di Oncologia Molecolare, Via Adamello 16,
20139 Milano, Italy - Tel. +39 02 574303603 - Fax +39 02
574303231.
P. NUCIFORO, F. FRAGGETTA
74
La capacità di una CS o di una CP di produrre cellule figlie che esprimono diversi fenotipi maturi è detta plasticità. La plasticità consente ad esempio ad una CS impiantata in tessuti già differenziati, di dar luogo a tipi cellulari non presenti nel tessuto di origine della CS stessa.
Così, ad esempio, una CS del midollo osseo può dare origine ad una cellula epatica, cardiaca o nervosa. Questa
capacità (detta transdifferenziazione) è strettamente dipendente dalle influenze del microambiente in cui la CS
si trova a crescere. La produzione di fattori di crescita e
di differenziazione da parte delle cellule del nuovo microambiente (per lo più cellule della matrice extracellulare) sembra determinante per il destino della CS 10 11. Tuttavia, alcuni ricercatori sostengono che tale processo derivi piuttosto dalla fusione di una cellula staminale o della sua progenie con una cellula di un altro organo 5 12-14.
ziare il processo di differenziazione sono stati individuati geni quali Oct-4,Wnt/b-catenina, Notch, BMP,
chinasi della famiglia Janus ecc. La perdita, le mutazioni, attivazioni, alterati funzionamenti di tali sistemi,
necessari per una normale organogenesi, sono stati riportati strettamente correlati a sviluppo e progressione
di molti tumori, come ad esempio quello del colon, della mammella, delle leucemie 22-27.
In conclusione, l’esistenza di similitudini tra i meccanismi molecolari che controllano la proliferazione e la
differenziazione delle CS e dei tumori, di per sé rappresenta solo una prova indiretta, seppur prova, di una
relazione tra CS e cancro. Se davvero esiste una CS tumorale e se i tumori insorgono da essa è oggetto di dibattito, anche se recenti pubblicazioni sembrano supportare tale scenario.
Cellule staminali e ciclo cellulare
La cellula staminale tumorale (CST)
La comprensione dei fattori che controllano la crescita
delle CS e la loro capacità differenziativa potrà sicuramente far luce su quelli che sono i meccanismi di un’eventuale trasformazione neoplastica delle stesse e quindi suggerire nuovi approcci terapeutici.
La capacità espansiva delle CS è sotto il controllo di
costrizioni genetiche necessarie ad impedire un’espansione illimitata di questo compartimento 15-17. L’espansione illimitata, associata all’abilità delle cellule staminali di entrare in circolo (in poche parole, di “metastatizzare”) 12, si tradurrebbe, infatti, nella creazione di un
fenotipo cellulare con caratteristiche biologiche sovrapponibili a quelle di una cellula neoplastica, eccezion fatta della capacità di invasione dei tessuti. In genere, la percentuale di CS in vivo proliferanti è nettamente inferiore a quella delle CP. Nel sistema emopoietico un incremento della divisione cellulare delle
cellule staminali si verifica in particolari condizioni come ad esempio dopo trapianto o deplezione delle cellule in ciclo cellulare. Tuttavia la relativa quiescenza delle cellule staminali emopoietiche sembra essere essenziale per prevenirne una prematura scomparsa in corso
di stress fisiologici 18.
Tuttavia non sono ancora del tutto noti quali siano i segnali, extra- ed intracellulari che stabiliscono quale CS
debba rimanere quiescente, quale e quando debba entrare in ciclo cellulare, quale rimanga CS o venga indirizzata verso una linea differenziativa. Ancor di più, esistono teorie che non prevedono necessariamente l’esistenza
di una CS in tutti gli organi: tali teorie suggeriscono che
esistono cellule con capacità simil-staminale, verosimilmente attivata dal microambiente che le circonda 10.
Le attuali conoscenze della biologia delle cellule staminali si devono principalmente agli studi di ematologia ed
oncoematologia sia per la facilità di accesso al sangue
periferico e al midollo sia per tutti gli studi che sono stati condotti nei trapianti in ambito ematologico 19-21.
Tra i geni che controllano i segnali necessari per stabilire quale cellula debba rimanere una CS e quale ini-
Il termine CST definisce una cellula neoplastica capace di autorigenerarsi, cioè di dare origine ad un’altra
cellula uguale a se stessa come anche generare una popolazione cellulare neoplastica più differenziata con
capacità non-tumorigenica. Il concetto di cellula staminale tumorale nasce dall’osservazione che il processo
di tumorigenesi ha molte similitudini con quello di organogenesi, dove una singola popolazione cellulare è
in grado di orchestrare l’accrescimento e la differenziazione di un tessuto neoformato. La differenza sta nel
fatto che nel tumore il normale programma organogenetico è alterato con la conseguente generazione di un
“organo abnorme” contenente una popolazione di cellule tumorigeniche (o CST) responsabili della crescita
tumorale, del mantenimento del compartimento staminale neoplastico e della sua progenie non-tumorigenica, che costituisce la massa del tumore, ma è priva di
quelle caratteristiche proprie delle CST 28-30.
Diverse osservazioni cliniche suggeriscono che il modello staminale, con il contributo dell’instabilità genetica e
dei fattori ambientali, sarebbe il principale responsabile
della estrema eterogeneità osservata nei tumori 31.
Esistono davvero le CST?
La scoperta che solo una piccola parte delle cellule tumorali nel contesto di una neoplasia ha capacità “clonogeniche” quando messe in coltura o iniettate in topi immunodeficienti ha portato il mondo scientifico a considerare la possibilità dell’esistenza delle CST 27-29 32.
Pionieristici in questo ambito sono stati gli studi sulle
leucemie ed in particolare sulle leucemie mieloidi acute (LMA). È stato possibile identificare e purificare dal
midollo osseo di diversi pazienti una sottopopolazione
di cellule leucemiche con capacità tumorigenica 33 34.
Più recentemente Matsui et al. 35 hanno dimostrato la
presenza di una sottopopolazione staminale mielomatosa anche nell’ambito dei mielomi multipli. Gli Auto-
CELLULE STAMINALI TUMORALI
ri hanno isolato, in un mieloma CD138+ (antigene di
differenziazione plasmacellulare maturo), una piccola
popolazione di cellule CD138- con la peculiare capacità di attecchire una volta impiantata in topi immunodeficienti e di generare una popolazione di cellule
CD138+ con la stessa restrizione di catene leggere osservata nel tumore primitivo da cui erano state isolate.
L’isolamento di cellule neoplastiche con capacità tumorigenica e di cellule non-tumorigeniche dal carcinoma della mammella ha rappresentato la prima evidenza
dell’esistenza delle CST anche nell’ambito dei tumori
solidi 1 2. Da uno studio di Al-Hajj et al. 1 su un modello “xenograft” è infatti emerso che solo un sottogruppo
di cellule di carcinoma della mammella caratterizzate
da un fenotipo CD44+CD24-/low (pari allo 0,1-1%
dell’intera popolazione tumorale) aveva la capacità di
formare un nuovo tumore quando iniettate nei topi. In
seguito a passaggi seriali, questo sottogruppo di cellule era in grado di rigenerare nuovi tumori contenenti
una quota addizionale di cellule tumorigeniche con lo
stesso fenotipo CD44+CD24-/low mista ad una popolazione fenotipicamente eterogena, suggerendo che tali
cellule possiedono quindi le caratteristiche biologiche
di staminalità.
Ancora più recentemente, due gruppi di ricerca hanno
dimostrato che anche i tumori pediatrici di origine neuronale contengono una piccola popolazione di cellule
clonogeniche in vitro 6 36. Il numero di cellule clonogeniche capaci di formare sfere variava dall’1 al 25% delle cellule tumorali. Cellule individuali separate dalle
neurosfere erano capaci di formare nuove neurosfere in
seguito a passaggi seriali in colture cellulari, dimostrando la capacità di autorigenerarsi tipica delle cellule staminali. Quando tali cellule venivano isolate in base all’espressione del CD133, un marker delle cellule
staminali neurali normali, solo le cellule CD133+ erano capaci di riformare sfere. Questi studi suggeriscono
che i tumori del SNC di origine neurale contengono
una popolazione di cellule neoplastiche con caratteristiche staminali.
Implicazioni del modello staminale
in campo oncologico
Se la stessa popolazione di cellule che è tumorigenica
in vitro o sui modelli animali dovesse risultare tumorigenica anche nell’uomo, le implicazioni sull’attuale
metodo di studio, diagnosi e trattamento delle neoplasie sarebbero notevoli.
Le attuali strategie terapeutiche considerano il tumore
come costituito da una popolazione cellulare omogenea, non tenendo conto quindi delle potenziali differenze in termini di sensibilità e/o di espressione del target
di riferimento tra le CST e la restante popolazione tumorale. L’inabilità dei chemioterapici correntemente
utilizzati nell’eradicare le neoplasie potrebbe essere
spiegata dalle differenze esistenti nelle popolazioni cellulari all’interno di uno stesso tumore.
75
Uno dei parametri clinici di risposta alla terapia è rappresentato dalla riduzione della massa tumorale. Tuttavia, dato che in molti tumori le CST rappresentano la
minoranza della popolazione neoplastica e che gli
agenti terapeutici ad oggi usati agiscono sulla maggioranza delle cellule tumorali, il rischio che il chemioterapico possa risparmiare un significativo numero di
CST è elevato parimenti al conseguente rischio di riformare il tumore localmente e/o a distanza. A favore di
questa ipotesi, recenti studi hanno dimostrato una ridotta sensibilità alla danorubicina e citarabina delle
cellule leucemiche con fenotipo CD34+CD38- rispetto
all’intera popolazione blastica 37 38. Inoltre, la terapia
potrebbe avere un effetto indirettamente promotore sulla crescita delle CST. È ipotizzabile che dato la stretto
scambio di messaggi tra CST e restanti cellule tumorali, la distruzione di quest’ultima popolazione da parte
del chemioterapico possa indurre una modificazione
nei meccanismi di controllo e di crescita del compartimento staminale tali da favorirne l’espansione.
Il modello staminale ha potenzialità per l’identificazione di futuri target terapeutici. I profili di espressione
delle cellule staminali normali e quelli della loro progenie più differenziata possono essere estremamente
differenti 39. Gli studi dei profili di espressione genica
tramite i microarrays si sono fino ad oggi focalizzati
sull’analisi dell’intera popolazione neoplastica rendendo improbabile l’identificazione di geni caratteristici
della sottopopolazione di CST che rappresenta meno
dell’1% dell’intera massa. L’identificazione di nuovi
marker diagnostici e target terapeutici dovrebbe quindi
passare attraverso lo studio dei profili di espressione
delle CST.
Il ruolo del patologo
La dimostrazione dell’esistenza delle CST avrà come
effetto immediato quello di cambiare l’attuale approccio alla malattia neoplastica sia in termini di diagnosi e
prognosi, sia per il trattamento. Le figure professionali
coinvolte nella gestione del paziente neoplastico dovranno modificare il loro punto di vista ed il modo di
approcciarsi al tumore. La rivoluzione genomica ha già
modificato il ruolo del patologo. Nella nostra pratica
quotidiana, la formulazione di una corretta diagnosi
non è più sufficiente a garantire al paziente tutte le
informazioni necessarie per la prognosi ed il trattamento da seguire. La valutazione dell’espressione di
markers molecolari quali l’erbB2 per il carcinoma della mammella e il c-Kit per i tumori stromali gastrointestinali rappresentano oggi un elemento chiave per il
corretto management del paziente. Tuttavia, l’analisi
immunoistochimica e/o molecolare di tali markers viene eseguita secondo un modello stocastico di neoplasia,
cioè considerando il tumore come costituito da una popolazione omogenea di cellule. Se invece all’interno
del tumore esiste realmente una gerarchia, dove le pur
poche CST rappresentano la componente base dello
P. NUCIFORO, F. FRAGGETTA
76
sviluppo e del mantenimento della neoplasia, stiamo
forse concentrando i nostri sforzi verso bersagli non del
tutto corretti 40. L’estrema eterogenità morfologica di
un tumore (aspetto ben noto all’anatomopatologo) associata alla eterogeneità molecolare evidenziabile dalla
variabilità di espressione di markers proliferativi, differenziativi ed oncogenici, rende a tutt’oggi estremamente difficile, se non impossibile, una corretta identificazione della cellula tumorale con fenotipo staminale.
Conclusioni
La presenza di CST all’interno delle neoplasie è una
questione aperta, nonostante i recenti risultati ottenuti
in vitro ed in vivo. Rimane ancora da chiarire se la capacità tumorigenica sia realmente una peculiarità di un
ristretto gruppo di cellule neoplastiche o è posseduta da
tutte le cellule all’interno di un tumore ma, in presenza
di particolari circostanze in cui le cellule tumorali si
vengono a trovare in vitro e/o in vivo (in agar, in xenograft), solo alcune di esse la manifestano 41.
Qualora nuove definitive prove della loro esistenza venissero fornite dai sistemi sperimentali, ulteriori domande richiederanno una risposta 2. Le CST originano
da una cellula staminale o da una cellula progenitrice
normali? La progressione neoplastica è determinata da
un’espansione del compartimento staminale neoplastico? La quantità di CST in un tumore ha un significato
prognostico? Le mutazioni oncogeniche interessano le
CST, la loro progenie non-tumorigenica, o entrambe?
Sarà possibile sviluppare farmaci efficaci contro le
CST senza allo stesso tempo arrecare danno alla popolazione staminale adulta normale?
L’approfondimento dei pathways molecolari che regolano l’autorigenerarsi delle cellule staminali normali
probabilmente ci consentiranno anche la comprensione
della complessità dei meccanismi regolativi delle staminali tumorali fornendoci la risposta a queste stimolanti domande.
Bibliografia
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke
MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003;100:3983-8.
Al-Hajj M, Clarke MF. Self-renewal and solid tumor stem cells.
Oncogene 2004;23:7274-82.
Galli R, Gritti A, Bonfanti L, Vescovi AL. Neural stem cells: an
overview. Circ Res 2003;92:598-608.
Galli R, Binda E, Orfanelli U, Cipelletti B, Gritti A, De Vitis S, et
al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res
2004;64:7011-21.
Sell S. Stem cell origin of cancer and differentiation therapy. Crit
Rev Oncol Hematol 2004;51:1-28.
Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire
J, et al. Identification of a cancer stem cell in human brain tumors. Cancer Res 2003;63:5821-8.
Smalley M, Ashworth A. Stem cells and breast cancer: A field in
transit. Nat Rev Cancer 2003;3:832-44.
Potten CS, Loeffler M. Stem cells: attributes, cycles, spirals, pitfalls and uncertainties. Lessons for and from the crypt. Development 1990;110:1001-20.
Seaberg RM, Van Der Kooy D. Stem and progenitor cells: the
premature desertion of rigorous definitions. Trends Neurosci
2003;26:125-31.
Spradling A, Drummond-Barbosa D, Kai T. Stem cell and their
niche. Nature 2001; 414:98-104.
Ohlstein B, Kai T, Decotto E, Spradling A. The stem cell niche:
theme and variations. Curr Opin Cell Biol 2004;16:693-9.
Wagers AJ, Christensen JL, Weissman IL. Cell fate determination
from stem cells. Gene Ther 2002;9:606-12.
Vassilopoulos G, Russell DW. Cell fusion: an alternative to stem
cell plasticity and its therapeutic implications. Curr Opin Genet
Dev 2003;13:480-5.
Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, et al. Cell fusion is the principal source of bone-marrowderived hepatocytes. Nature 2003;422:897-901.
Phillips RL, Reinhart AJ, Van Zant G. Genetic control of murine
16
17
18
19
20
21
22
23
24
25
26
27
28
29
hematopoietic stem cell pool sizes and cycling kinetics. Proc Natl Acad Sci USA 1992;89:11607-11.
Phillips RL. Investigating the genetic control of stem cell behavior. Curr Top Microbiol Immunol 2000;251:13-9.
Morrison SJ, Qian D, Jerabek L, Thiel BA, Park IK, Ford PS, et
al. A genetic determinant that specifically regulates the frequency
of hematopoietic stem cells. J Immunol 2002;168:635-42.
Cheng T, Rodrigues N, Dombkowski D, Stier S, Scadden DT.
Stem cell repopulation efficiency but not pool size is governed by
p27(kip1). Nat Med 2000;6:1235-40.
Hedrick SM. T cell development: bottoms-up. Immunity
2002;16:619-22.
Ohneda K, Yamamoto M. Roles of hematopoietic transcription
factors GATA-1 and GATA-2 in the development of red blood cell
lineage. Acta Hematol 2002;108:237-45.
Brehm A, Ohbo K, Zwerschke W, Botquin V, Jansen-Durr P,
Scholer HR. Synergism with germ line transcription factor Oct-4:
viral oncoproteins share the ability to mimic a stem cell-specific
activity. Mol Cell Biol 1999;19:2635-43.
Taipale J, Beachy PA. The Hedgehog and Wnt signaling
pathways in cancer. Nature 2001;411:349-54.
Pan GJ, Chang ZY, Scholer HR, Pei D. Stem cell pluripotency
and transcription factor Oct4. Cell Res 2002;12:321-9.
Kojika S, Griffin JD. Notch receptors and hematopoiesis. Exp
Hematol 2001;29:1041-52.
Artavanis-Tsakonas S, Rand MD, Lake RJ. Notch Signaling: Cell
Fate Control and Signal Integration in Development. Science
1999;284:770-6.
Hitoshi S, Alexson T, Tropepe V, Donoviel D, Elia AJ, Nye JS, et
al. Notch pathway molecules are essential for the maintenance,
but no the generation, of mammalian neural stem cells. Genes
Dev 2002;16:846-58.
Henrique D, Hirsinger E, Adam J, Le Roux I, Pourquie O, IshHorowicz D, et al. Maintenance of neuroepithelial progenitor
cells by Delta-Notch signalling in the embryonic chick retina.
Curr Biol 1997;7:661-70.
Heppner GH. Tumor heterogeneity. Cancer Res 1984;44:2259-65.
Bergsagel DE, Valeriote FA. Growth characteristics of a mouse
plasma cell tumor. Cancer Res 1968;28:2187-96.
CELLULE STAMINALI TUMORALI
30
Ozols RF, Willson JK, Weltz MD, Grotzinger KR, Myers CE,
Young RC. Inhibition of human ovarian cancer colony formation
by adriamycin and its major metabolites. Cancer Res
1980;40:4109-12.
31
Aubele M, Werner M. Heterogeneity in breast cancer and the
problem of relevance of findings. Anal Cell Pathol 1999;19:53-8.
32
Park CH, Bergsagel DE, McCulloch EA. Mouse myeloma tumor
stem cells: a primary cell culture assay. J Natl Cancer Inst
1971;46:411-22.
77
37
38
33
Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, CaceresCortes J, et al. A cell initiating human acute myeloid leukaemia
after transplantation into SCID mice. Nature 1994;17:645-8.
34
Bonnet D, Dick JE. Human acute myeloid leukemia is organized
as a hierarchy that originates from a primitive hematopoietic cell.
Nat Med 1997;3:730-7.
35
Matsui W, Huff CA, Wang Q, Malehorn MT, Barber J, Tanhehco
Y, et al. Characterization of clonogenic multiple myeloma cells.
Blood 2004;103:2332-6.
40
36
Hemmati HD, Nakano I, Lazareff JA, Masterman-Smith M, Geschwind DH, Bronner-Fraser M, et al. Cancerous stem cells can
41
39
arise from pediatric brain tumors. Proc Natl Acad Sci USA
2003;100:15178-83.
Costello RT, Mallet F, Gaugler B, Sainty D, Arnoulet C, Gastaut
JA, et al. Human acute myeloid leukemia CD34+/CD38- progenitor cells have decreased sensitivity to chemotherapy and Fasinduced apoptosis, reduced immunogenicity, and impaired dendritic cell transformation capacities. Cancer Res 2000;60:440311.
Guzman ML, Swiderski CF, Howard DS, Grimes BA, Rossi RM,
Szilvassy SJ, et al. Preferential induction of apoptosis for primary human leukemic stem cells. Proc Natl Acad Sci USA
2002;99:16220-5.
Akashi K, He X, Chen J, Iwasaki H, Niu C, Steenhard B, et al.
Transcriptional accessibility for genes of multiple tissues and hematopoietic lineages is hierarchically controlled during early hematopoiesis. Blood 2003;101:383-9.
Nuciforo P, Fraggetta F. Cancer stem cell theory: pathologists’
considerations and ruminations about wasting time and wrong
evaluations. J Clin Pathol 2004;57:782.
Weisenthal L, Lippman ME. Clonogenic and nonclonogenic in
vitro chemosensitivity assays. Cancer Treat Rep 1985;69:615-32.