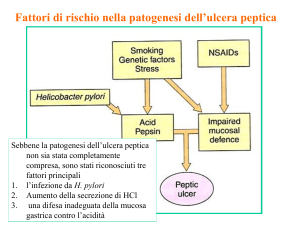
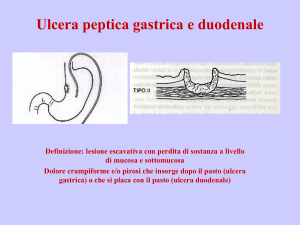
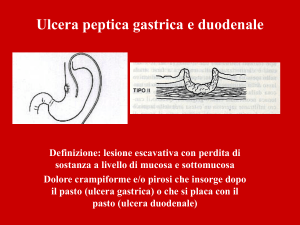
LA MALATTIA ULCEROSA PEPTICA
http://www.gastronet.it/approfondimento/ulcerapeptica
CAP.6 COMPLICANZE
Carcinoma
Emorragia
Perforazione e Penetrazione
Stenosi Pilorica
CARCINOMA
Gastrite, ulcera peptica ed adenocarcinoma dello stomaco sono legati da fattori eziologici, patogenetici e
morfogenetici.
Il carcinoma gastrico é una delle neoplasie più frequenti e rappresenta un’importante causa di mortalità
per cancro nel mondo. In Europa, negli ultimi decenni si è osservato un decremento dei tassi di mortalità,
ma ciò è avvenuto disomogeneamente, con una diminuzione di oltre il 60% nei paesi del nord Europa, in
Francia e in Svizzera, del 50% in Italia e Spagna e del 16% nel Portogallo.
In Italia sono maggiormente interessate le regioni centrali.
La sopravvivenza dei pazienti colpiti da tale neoplasia, dipende dallo stadio nel quale la diagnosi é
effettuata, arrivando a 86% a 10 anni, quando essa è posta in fase precoce (Barchielli et al. 2001).
La maggioranza dei carcinomi gastrici sono di tipo "intestinale" e sono preceduti da un lungo stadio di
precancerosi, con un modello che parte dalla gastrite cronica atrofica e attraversa la metaplasia
intestinale (MI) e la displasia. La metaplasia intestinale esordirebbe con caratteristiche morfologiche
dell’epitelio
del
piccolo
intestino,
evolvendo
in
fenotipi
meno
differenziati,
con
caratteristiche
mucosecernenti ed antigeniche sempre più simili all’epitelio colonico. Delle tre varianti, una sembra
essere più strettamente correlata con il rischio di sviluppare un adenocarcinoma dello stomaco: si tratta
della MI incompleta di tipo colonico, definita di "tipo III", identificabile dalla produzione e secrezione di
solfomucine (Wu et al 1998).
Nel 1994 l’International Agency for Research on Cancer ha definito l’H.pylori come agente carcinogeno
di tipo I, ma è chiaro che la patogenesi del cancro gastrico, come per gli altri tumori in generale, é
multifattoriale e legata ad una serie di agenti iniziatori e ad altri continuatori. L’infezione batterica
avrebbe un ruolo fino ad un certo punto della trasformazione cellulare, oltre il quale la malattia
progredirebbe indipendentemente da questa.
Ciò spiegherebbe per esempio le discrepanze tra gli studi nell’evidenziare un nesso di causalità.
Uno studio prospettico giapponese della durata di 9 anni, su 2602 individui, ha dimostrato che
l’infezione da H.pylori si associa negli uomini ad un rischio relativo di 2.59 (IC 95% 1.03-6.50) di
sviluppare la neoplasia gastrica mentre non sembra avere un ruolo nelle donne (Yamagata et al 2000).
Un altro studio giapponese con un follow-up di 7.8 anni, condotto su 1526 soggetti, ha dimostrato che
il 2.9% degli infetti versus 0% dei non infetti sviluppava cancro (Uemura et al 2001). In Italia, tra
pazienti affetti da neoplasia gastrica di età inferiore a 40 anni, l’infezione da H.pylori rappresenta un
fattore di rischio con una odds ratio (OR) di 2.79 (IC95% 1.52-5.11) e il ceppo citotossico di 2.94
(IC95% 1.56-5.52) (Rugge et al 1999).
D’altra parte non si deve dimenticare che esiste un minoritario sottogruppo (18%) di pazienti che
sviluppa carcinoma in assenza del batterio (Wu et al 1998).
Per giustificare la plausibilità biologica di un ruolo del microrganismo nell’induzione del tumore allo
stomaco, vi sono dati che dimostrano sia la riduzione della concentrazione di acido ascorbico nel succo
gastrico (presente in particolare nel caso di infezione da ceppi patogeni) sia l’incremento dei
nitrosocomposti (Zhang et al 1998). Inoltre, lo stimolo alla flogosi, indotto dal batterio, sembrerebbe
determinare lo sviluppo di danno ossidativo del DNA selettivo per alcuni geni come p53 che
cotribuirebbe alla carcinogenesi (Choi et al 2002). E’ dimostrato che l’eradicazione batterica
comporterebbe un beneficio sull’instabilità genomica da questo indotta (Nardone et al. 1999).
E’ ancora oggetto di controversie se e quando l’eradicazione dell’H.pylori, in pazienti con MI o displasia,
possa condurre alla loro regressione: secondo alcuni studi la totale scomparsa della metaplasia intestinale
si osserverebbe nel 30% dei casi dopo un anno e nel 61% dopo due anni dall’eradicazione (Ciok et al
1997), i metodi di conduzione degli studi (per esempio il numero dei prelievi bioptici) potrebbero tuttavia
rappresentare un bias (El-Zimaity et al. 1999), altri studi infatti hanno dimostrato che mentre l’atrofia si
conferma un importante predittore di rischio di cancro, la metaplasia può evolvere in tutte le direzioni
indipendentemente dallo status H.pylori (El-Zimaity et al 2001).
EMORRAGIA
L’emorragia rappresenta la complicanza più frequente della malattia ulcerosa e si verifica nel 5-15% dei
pazienti con ulcera gastrica o duodenale, inoltre tale complicanza costituisce la principale causa di
emorragia del tratto digestivo superiore (Figura 7).
A parte l’assunzione di FANS e l’infezione da H. pylori, gli altri fattori di rischio identificati per la malattia
ulcerosa non complicata (per esempio il fumo di sigaretta) non sembrano avere alcun tipo di correlazione
con l’evento emorragico. Uno studio multicentrico tedesco, ha dimostrato, dopo analisi multivariata, che
l’assunzione di FANS e ASA, il mancato pretrattamento con antisecretori e le malattie del polmone,
risultavano fattori di rischio per sanguinamento (Imhof et al 1997).
Mentre i segni clinici più eclatanti dell’emorragia digestiva sono l’ematemesi e la melena, va ricordata la
possibilità di uno stillicidio cronico che si manifesta con anemizzazione o sideropenia ed il fatto che
l’asintomaticità é più frequente negli anziani ed in quei pazienti che assumono terapia continuativa con
FANS.
Il sanguinamento dall’ulcera peptica, è causato dall’erosione prodotta dal cratere ulceroso su un vaso
sanguigno (Figura 8), solitamente arterioso, posto alla base della lesione stessa.
L’approccio endoscopico è di primo impiego per arrestare l’emorragia mentre trova sempre maggiori
conferme l’indicazione all’eradicazione dell’H.pylori, in pazienti con emorragia, in assenza di assunzione di
FANS, al fine di prevenirne le recidive. La reale utilità degli antisecretori nella prevenzione di tale
complicanza seppur controversa è l’unica opzione praticabile qualora il rischio di recidiva possa
compromettere la vita del paziente.
PERFORAZIONE e PENETRAZIONE
Una delle complicanze più temibili, per l’elevato rischio di mortalità che comporta, è rappresentata dalla
perforazione libera dell’ulcera peptica in cavità peritonale. Tale evento è stimato occorrere in circa il 2-5%
dei casi, con una prevalenza aumentata nel sesso maschile ed in pazienti che assumono cronicamente
FANS. Oltre che perforarsi in cavità addominale, le ulcere possono penetrare in pancreas, omento, vie
biliari, fegato e colon.
Nel 5-10% dei casi tali complicazioni esordiscono in pazienti che non presentano una pregressa storia
clinico-sintomatologica suggestiva per ulcera peptica.
Complessivamente, il rischio di perforazione risulta maggiore per le ulcere gastriche localizzate lungo la
piccola curvatura dello stomaco e, in circa il 10% dei casi, le lesioni perforate sono complicate da un
sanguinamento. Quest’ultima evenienza aumenta in maniera considerevole il tasso di mortalità, che
normalmente si aggira intorno al 10-15% ed è più elevato per le lesioni localizzate in prossimità della
regione cardiale. Anche il rischio operatorio in questi soggetti risulta elevato, e la loro precisa
stratificazione per classi di rischio, é un problema di primaria importanza nella gestione non chirurgica
della lesione perforata. In quest’ottica, sono stati proposti degli score per la misurazione del grado di
severità della patologia, nonché per predirne l’andamento clinico.
Sui fattori di rischio per perforazione, un importante ruolo é assegnato al fumo: in uno studio
norvegese,condotto su 168 pazienti, è stato documentato un rischio aumentato di oltre 10 volte nei
fumatori; gli autori, tuttavia, non hanno analizzato in questo gruppo, la prevalenza di infezione da H.
pylori (Svanes et al 1997). In uno studio belga, é stato dimostrato che la popolazione di soggetti con
perforazione è eterogenea e la ricorrenza di ulcera dopo perforazione avviene prevalentemente in coloro
che sono infettati da H. pylori (Debongnie et al 1995). In uno studio indiano, non é stato osservato
nessun caso di ulcera perforata associata ad H.pylori ma la casistica era limitata (Chowdhary et al. 1998).
STENOSI PILORICA
La localizzazione dell’ulcera peptica a livello della regione pilorica, può provocare una stenosi locale.
Il processo infiammatorio periulceroso è dimostrato essere causa oltre che di disturbi funzionali, quale il
rallentato svuotamento, anche di deformazioni inclusi i pseudo-diverticoli irreversibili e la retroversione
dell’angolo pilorico.
Mentre sporadiche segnalazioni indicano che l’eradicazione dell’H.pylori può essere di beneficio
nella
regressione della stenosi, verosimilmente mediata dalla cura dell’infiammazione e dell’edema, la
dilatazione endoscopica è l’approccio di secondo livello e il ricorso all’opzione chirurgica é riservato al
caso di fallimento delle altre metodiche.