Genetica batterica
Giovanni Di Bonaventura, PhD
CI «Microbiologia e Microbiologia Clinica»
CdS Medicina e Chirurgia
AA 2015-2016
Genoma batterico
Il genoma batterico (o nucleoìde) consta di due componenti:
- Cromosoma (contiene i geni “housekeeping”, essenziali per la sopravvivenza)
- Elementi extracromosomici “mobili” (contengono geni non essenziali ma accessori: determinanti
di virulenza, geni responsabili del trasferimento genetico orizzontale o verticale):
plasmidi
elementi trasponibili
o sequenze di inserzione
o trasposoni
o elementi invertibili
Cromosoma batterico
Singolo (microrganismi aploidi)
DNA bicatenario e circolare (lineare in Streptomyces coelicolor e Borrelia burgdorferi)
Privo di istoni
«Mosaico» in natura: contiene geni di diversa provenienza, a seguito di fenomeni di trasferimento
genetico orizzontale (trasferimento genico tra cellule diverse)
Dimensioni variabili (0.2-9.0 Mb; 1100-1400 µm), proporzionali al livello di interazione del
microrganismo con l’ambiente
intracellulari obbligati - Mycoplasma genitalium: 480 kbp;
ambientali - Pseudomonas spp: 6.3 Mbp)
Per poter essere contenuto nella cellula batterica, il cromosma è superavvolto.
Replicazione bidirezionale, da una singola origine. Richiede despiralizzazione (DNA-girasi).
Cromosoma batterico
Replicazione del DNA batterico
Escherichia coli: cromosoma rilasciato a
seguito di lisi batterica
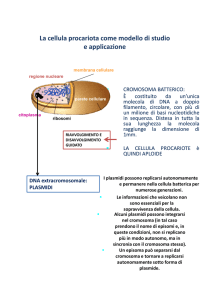
Plasmidi
Elementi genetici extracromosomici di piccole dimensioni (1-150 kpb), in grado di replicarsi autonomamente
DNA bicatenario e circolare (lineare in Streptomyces spp)
Possono trovarsi liberi nel citoplasma oppure «integrati» nel cromosoma batterico (episoma)
Non confinati nel singolo ospite: possono essere trasferiti e replicati in diversi ospiti +/- strettamente correlati.
Numerosità e tipologia di plasmidi in funzione della specie batterica:
gruppi di compatibilità: dimensioni = 1/k n copie
Qualità dell’informazione genetica
scarsa omologia con il cromosoma e raramente indispensabili per la sopravvivenza/moltiplicazione batterica in
condizioni “ottimali”
codificano per fattori di virulenza batterica:
produzione di pili, tossine (enterotossine, emolisine), adesine, siderofori, batteriocine
fattori R: determinanti dell’antibiotico-resistenza
Plasmidi: F (sessuali o coniugativi), F’ (Hfr): integrati nel cromosoma
plasmidi “criptici”: funzionalità non nota
Un batterio può perdere (“curarsi”) un plasmide, in assenza di una pressione selettiva (es. batterio con plasmide
antibiotico-R cresciuto per varie generazioni in assenza di antibiotico)
Plasmidi
Elementi trasponibili
Tipologia:
sequenze di inserzione
trasposoni
elementi invertibili
Caratteristica traslocazione tra “elementi” diversi (cromosoma, plasmidi) del genoma batterico
Generalmente, la traslocazione avviene all’interno della STESSA cellula (a differenza dei meccanismi
di trasferimento di materiale genetico)
eccezione: trasposoni coniugativi (coniugazione)
Due meccanismi di trasposizione:
conservativa – nessuna duplicazione di elemento
replicativa – duplicazione di elemento
La trasposizione induce un effetto “mutageno”:
mutazione letale
mutazione non letale
Elementi trasponibili
Sequenze di Inserzione (IS) – piccole dimensioni (8002.000 bp), integrazione sito-specifica mediante sequenze
invertite e ripetute, “core” codificante solo per
trasposizione (solo effetto mutageno).
Trasposoni – rilevanti dimensioni (> 2.000 bp),
integrazione sito-specifica mediante IS, “core” contenente
uno o più geni (es. geni per farmaco-resistenza).
Trasposoni coniugativi (possono essere trasferiti da una
cellula all’altra). Possibile fusione di diversi trasposoni
Elementi trasponibili
Elementi invertibili – oltre a geni codificatori per la trasposizione, presenza di “DNA-invertasi”
capace di invertire l’elemento di 180° (rispetto ad un asse centrale virtuale) nella sua locazione
cromosomica (“variazione di fase flagellare” H1/H2 in Salmonella, fase fimbriale in E. coli)
Isole genomiche – integrate nel cromosoma mediante fago,
veicolano geni per la patogenicità (pathogenicity island) e per
la vita simbiontica. Caratterizzano la patogenicità (invasività,
adesività, sopravvivenza intracellulare, iron-uptake, etc.) di
batteri di una stessa specie differenziandoli da batteri non
patogeni.
Meccanismi di variabilità genetica
La variabilità genetica consente al batterio una maggiore fitness, ossia la capacità di potersi adattare a
differenti ambienti.
I cambiamenti a carico del genoma avvengono mediante:
Mutazione genica
Trasferimento genico orizzontale:
Coniugazione
Trasformazione
Trasduzione
Ricombinazione genetica
Conversione lisogenica
Fusione del protoplasto
Mutazioni
Mutazione = modificazione, più o meno estesa, della sequenza nucleotidica (genotipo), con
possibili effetti sulle caratteristiche macroscopiche (fenotipo).
Considerato il tempo di generazione medio di una cellula batterica, l’effetto di una mutazione sul
fenotipo si esprime in tempi brevissimi (20-30 min).
Ceppo mutante vs ceppo selvaggio (wild-type, wt).
Una mutazione viene selezionata se conferisce un vantaggio selettivo (es. antibiotico-R).
Possono essere, talvolta, letali per la cellula.
Mutazioni spontanee (10-7- 10-11 bp / generazione) insorte durante la duplicazione/riparazione del
DNA, a seguito di integrazione/perdita di elementi mobili, per azione fagica.
Mutazioni indotte da agenti mutageni chimici (ag. alchilanti, ac. nitrico, 5-bromouracile), fisici (raggi
X, U.V.) o biologici (virus). Elevata frequenza.
Reversione della mutazione: può avvenire nel sito mutato originario od in un sito differente. Annulla
la mutazione ristabilendo il fenotipo originario (ceppo revertante).
Mutazioni microlesionali: effetti sul fenotipo
Puntiformi, interessano 1 sola base:
Inserzione – aggiunta di una base (frameshift)
Delezione – perdita di una base (frameshift)
Sostituzione
Transizione - sostituzione tra basi puriniche/pirimidiniche.
Transversione - sostituzione base pur/pirim con base pirim/pur.
Effetti sul fenotipo:
sequenza aa invariata per degenerazione del codice genetico - proteina
funzionale (mutazioni SILENTI).
sequenza aa mutata – proteina incompleta, probabilmente non funzionale
(mutazioni MISSENSE).
produzione di un codone di STOP: arresto sintesi proteina, non funzionale
(mutazioni NONSENSE).
Mutazioni macrolesionali: effetti sul fenotipo
Interessano più basi (sequenze):
Delezione - comporta l’eliminazione completa di un segmento di DNA.
Inserzione - introduzione di un nuovo segmento di DNA all’interno di una sequenza preesistente.
Duplicazione - ripetizione in tandem di un segmento di DNA.
Inversione - rotazione di 180° di un segmento di DNA.
Traslocazione - inserimento di un segmento di DNA in un’altra posizione del genoma.
Effetti sul fenotipo:
inattivazione del gene interessato
Meccanismi di trasferimento genico orizzontale
I meccanismi di trasferimento genico consentono la mobilizzazione di
sequenze di DNA (plasmidi, parte del cromosoma, trasposoni
coniugativi) tra cellule differenti, appartenenti alla stessa specie od a
specie differenti:
Coniugazione
Trasformazione
Trasduzione
La sequenza di DNA trasferita potrà integrarsi nel cromosoma della
cellula accettrice a seguito di ricombinazione genetica.
Meccanismi di trasferimento genico orizzontale
Coniugazione
Coniugazione = trasferimento genico unidirezionale mediato da plasmide che richiede un
contatto “fisico” tra due cellule batteriche («donatrice» e «accettrice»).
Avviene sia nei Gram+ che Gram- ma con meccanismi differenti:
pilo sessuale (Gram-negativi)
ferormoni (Gram-positivi)
Plasmidi coniugativi: plasmidi che possono essere trasferiti tra cellule
mediante coniugazione
Plasmide F – plasmide della “fertilità” (F – fertility)
geni rep – codificano per la replicazione
geni tra - codificano per il trasferimento
geni mob - codificano per la mobilizzazione
4 elementi IS – mediano l’integrazione nell’endogenote
Meccanismi di trasferimento genico orizzontale
Coniugazione: tipi cellulari
Pilo sessuale (pilo F): codificato dal plasmide F, è una struttura
superficiale prodotta da cellule F+ che riconoscendo un recettore
sulla cellula F-, consente la formazione di una “coppia coniugativa”
tra cellule F+ e F- e, in tal modo, il trasferimento del plasmide.
Sulla base della presenza o meno del pilo, si riconoscono 3 tipi
cellulari:
Cellula F+ : cellula contenente un plasmide F (cellula donatrice o
“maschile”)
Cellula F- : cellula non contenente un plasmide F (cellula ricevente
o “femminile”)
Cellula Hfr (high frequency of recombination): cellula contenente
un plasmide F integrato nel cromosoma (cellula donatrice o
“maschile”)
Meccanismi di trasferimento genico orizzontale
Coniugazione: F+ x F-
Nella coniugazione F+ x F- non si assiste a trasferimento di DNA cromosomico
Meccanismi di trasferimento genico orizzontale
Coniugazione: F+ x F-
Meccanismi di trasferimento genico orizzontale
Coniugazione: Hfr x F-
Nella coniugazione Hfr x F-:
viene trasferito un segmento di DNA
cromosomico. Questo potrà andare
incontro a:
- Degradazione (nessun effetto)
- Circolarizzazione (plasm. coniugativo)
- Integrazione (nuovi caratteri)
la cellula accettrice rimane F-
Meccanismi di trasferimento genico orizzontale
Coniugazione: Hfr x F-
Meccanismi di trasferimento genico orizzontale
Coniugazione nei Gram-positivi
Enterococcus faecalis
Produzione e rilascio di ferormoni da parte della cellula “accettrice” (femminile)
I ferormoni inducono la produzione di una sostanza «aggregante» alla superficie della cellula
“donatrice” (maschile)
Formazione di aggregati cellulari con trasferimento del plasmide coniugativo
Meccanismi di trasferimento genico orizzontale
Coniugazione: significato
Significato clinico:
Principale meccanismo di trasferimento di geni per l’antibiotico-resistenza
Trasferimento di geni codificanti per fattori di virulenza (enterotossine,
adesine, siderofori)
Significato ambientale:
Trasferimento della resistenza ad erbicidi, idrocarburi aromatici, metalli
pesanti
Trasferimento di geni per la fissazione dell’azoto tra Rhizobia
Significato tecnico:
Coniugazione con batteri Hfr in vitro può essere interrotta in tempi diversi
con trasferimento di un progressivo di geni (mappatura dei genomi batterici)
Significato evoluzionistico:
Principale meccanismo evolutivo/adattativo batterico
Meccanismi di trasferimento genico orizzontale
Trasformazione
Meccanismo di trasferimento genetico “evoluto” da una primitiva esigenza nutrizionale
Assunzione di frammenti di DNA solubile dall’ambiente circostante da parte di cellule batteriche
“competenti” (Bacillus, Haemophilus, Neisseria, Pneumococcus)
Osservato sia nei Gram+ che nei Gram Influenzato da:
• dimensioni DNA
• sensibilità DNA a nucleasi
• “competenza” della cellula accettrice (naturale od indotta artificialmente)
Meccanismi di trasferimento genico orizzontale
Trasformazione: scoperta
Avery, McCarty e McLeod (1944) identificarono nel DNA
la “sostanza trasformante”
Meccanismi di trasferimento genico orizzontale
Trasformazione: scoperta
Avery, McCarty e McLeod (1944) identificarono nel DNA
la “sostanza trasformante”
Meccanismi di trasferimento genico orizzontale
Trasformazione: competenza
La cellula accettrice deve, per poter essere trasformata, trovarsi in una particolare condizione che
prende il nome di competenza.
Competenza: capacità cellulare di “catturare” il DNA.
Il raggiungimento di un livello soglia nella densità cellulare attiva la sintesi ed il rilascio di un
“fattore di competenza” (Gram+) che, agendo a livello di membrana, induce:
modificazioni di parete cellulare (autolisina)
sintesi/attivazione di proteine (DNA-binding, nucleasi, sistema RecA)
La competenza può essere:
naturale (Bacillus, Streptococcus, Neisseria, Haemophilus)
indotta artificialmente (P. aeruginosa, E. coli, S. typhimurium), mediante trattamento “a freddo” con CaCl2
(bassa efficienza, utilizzato di routine nel clonaggio di DNA in E. coli) oppure elettroporazione.
Nei Gram- : mancanza del “fattore di competenza”, sostituito da particolari condizioni del mezzo
colturale. Ad esempio, 100% competenza in Haemophilus spp. in condizioni permissive per la sintesi
proteica ma non per la crescita completa.
Meccanismi di trasferimento genico orizzontale
Trasformazione
1. Morte e degradazione del batterio “donatore”.
2. Un frammento di DNA bicatenario (ds) interagisce con
specifiche proteine (DNA-binding protein) alla superficie della
cellula “competente”. Il DNA è reso monocatenario (ss) da una
nucleasi.
3. La proteina Rec A promuove la ricombinazione omologa tra il
DNA ss donatore e quello ss recipiente.
4. Il trasferimento è completato.
Meccanismi di trasferimento genico orizzontale
Trasformazione
Meccanismi di trasferimento genico orizzontale
Trasformazione: significato
Significato clinico:
meccanismo di trasferimento di geni per l’antibiotico-resistenza
trasferimento di geni codificanti per fattori di virulenza
(enterotossine, adesine, siderofori)
Significato biotecnologico:
clonaggio di geni “utili”
Significato evoluzionistico:
meccanismo di evoluzione/adattamento batterico
Meccanismi di trasferimento genico orizzontale
Trasduzione
La trasduzione consiste nel trasferimento di frammenti di DNA cromosomale tra due cellule
batteriche mediante un batteriofago (virus batterico).
Esistono 2 tipi di trasduzione:
Trasduzione generalizzata: qualsiasi gene può, in teoria, essere trasferito
Trasduzione specializzata: specifici geni possono essere trasferiti con maggiore probabilità
Meccanismi di trasferimento genico orizzontale
Trasduzione
La trasduzione consiste nel trasferimento di frammenti di
DNA cromosomale tra due cellule batteriche mediante un
batteriofago (o fago).
Il fago è un virus in grado di infettare elettivamente le
cellula batteriche.
Ha generalmente forma di spillo in cui si riconoscono più
parti: la testa, contenente l'acido nucleico; essa sormonta
un collare, cui è attaccata una coda, la quale si sfrangia
all'estremità in 5 o 6 fibre affatto libere.
Meccanismi di trasferimento genico orizzontale
Fago: ciclo biologico
Il riconoscimento dell’ospite da parte del fago avviene attraverso un legame che
si stabilisce fra le proteine del capside e specifici recettori siti sulla parete del
batterio.
Nella coda del fago è presente un complesso molecolare in grado di iniettare
l’acido nucleico del fago attraverso la parete del batterio ospite. Una volta che
l’acido nucleico è penetrato nella cellula, a seconda del tipo di fago si potrà
osservare:
un ciclo litico: il virus si riproduce immediatamente, uccidendo la cellula
ospite che va incontro a lisi, liberando la progenie fagica. Un virus che si
riproduce esclusivamente attraverso il ciclo litico viene definito virulento.
un ciclo lisogeno: il virus integra il proprio acido nucleico nel genoma della
cellula ospite (profago). I batteri che ospitano particelle virali non litiche sono
detti lisogeni ed i virus vengono definiti temperati. Il profago può rimanere
silente per molto tempo, fino a quando verrà attivato e, abbandonando il
cromosoma batterico, innescherà un ciclo litico.
La capacità di passare dal ciclo lisogeno a quello litico è di grande vantaggio
evolutivo per il fago. Quando la cellula ospite è in fase di rapida crescita e
riproduzione, il profago rimane nello stato lisogeno. Quando, invece, la cellula
ospite viene danneggiata (es. agenti mutageni), il profago interrompe lo stato
quiescente «integrato» ed attiva il ciclo litico per disseminare la propria progenie.
Meccanismi di trasferimento genico orizzontale
Trasduzione
A seconda del tipo fagico coinvolto (virulento o temperato), il meccanismo di trasduzione può
avvenire secondo due differenti modalità:
Trasduzione generalizzata: in cui qualsiasi gene può (teoricamente) essere trasferito
Trasduzione specializzata: in cui solo specifici geni possono essere trasferiti
Meccanismi di trasferimento genico orizzontale
Trasduzione generalizzata
1. Adsorbimento del fago litico alla superficie del batterio sensibile.
2. Penetrazione del genoma fagico nel batterio. Utilizzo dei sistemi
metabolici cellulari per la sintesi e l’assemblaggio delle componenti
virali.
3. In alcuni casi, un frammento di DNA batterico od un plasmide
possono essere erroneamente inseriti in alcuni capsidi virali
(particelle trasducenti).
4. Rilascio dei fagi batterici a seguito di lisi batterica.
5. Il fago trasduttore adsorbe ad un batterio sensibile.
6. Penetrazione del DNA fagico.
7. Il fago trasducente non è in grado di innescare un ciclo litico ma
può permettere al DNA fagico di ricombinare con il DNA della
cellula accettrice.
Nella trasduzione generalizzata, la selezione dei geni trasdotti è
randomizzata. Ogni gene ha la stessa probabilità di essere trasdotto.
Meccanismi di trasferimento genico orizzontale
Trasduzione generalizzata
Meccanismi di trasferimento genico orizzontale
Trasduzione specializzata
1
2
Un fago temperato adsorbe al batterio sensibile e vi inietta il
suo genoma.
Il genoma fagico ricombina con il nucleoide batterico divenendo
un profago.
In presenza di stimoli adeguati, un frammento del DNA batterico
viene escisso come parte del genoma fagico.
Durante la replicazione fagica il DNA batterico viene inserito nel
genoma fagico. Tutti i fagi veicolano il frammento di DNA
batterico.
Il fago adsorbe ad una batterio sensibile iniettandovi il suo
genoma.
3
4
5
6
Il genoma fagico contenente il DNA trasdotto ricombina con il
nucleoide della cellula accettrice.
7
Nella trasduzione specializzata, i geni batterici «fiancheggianti» il profago
sono quelli a più alta probabilità di trasduzione.
Meccanismi di trasferimento genico orizzontale
Trasduzione specializzata
Ricombinazione genica
Ciascuno dei tre meccanismi di trasferimento genico (coniugazione,
trasformazione, trasduzione) può concludersi con la integrazione del DNA
donatore in quello della cellula accettrice. Questo fenomeno è noto come
ricombinazione genica.
Sono coinvolti enzimi responsabili della sintesi e del riparo del DNA.
Possono ricombinare sia singoli geni che gruppi di geni.
La ricombinazione genica è coinvolta in ogni fenomeno generante variabilità
genica: è un processo di riarrangiamento del DNA che porta alla fusione di
frammenti appartenenti a molecole di DNA differenti.
Importante processo evolutivo in quanto promuove la diversità genetica
(formazione di nuove combinazioni di geni), permettendo un rapido
adattamento.
Due tipologie di ricombinazione genetica:
omologa, richiede elevata omologia tra sequenze estese
sito-specifica, riconosce omologia tra sequenze brevi
Ricombinazione tra DNA lineare (a) e plasmidico (b)
Ricombinazione genica OMOLOGA (crossing over)
Necessita di estese regioni di omologia tra DNA ricevente e donatore. Molto
complessa (in E. coli richiede oltre 25 geni).
1. Taglio di una elica del DNA donatore ad opera di una endonucleasi.
2. Separazione del filamento tagliato da quello integro ad opera di una
elicasi e sua associazione a proteine stabilizzatrici (Single-Strand Binding
protein – SSB protein).
3. Legame con proteina RecA che rende possibile l’invasione di catena ed il
conseguente appaiamento del filamento donatore con sequenze
omologhe del DNA ricevente.
4. Formazione di una struttura chiamata heteroduplex, ossia l’intermedio di
ricombinazione.
5. Risoluzione dell’heteroduplex: rottura e successiva risaldatura dei filamenti
mediante DNA-ligasi, con formazione di molecole di DNA ibride.
Ricombinazione genica SITO-SPECIFICA
Avviene in particolari punti del DNA aventi una particolare sequenza
riconosciuta da trasposasi e ricombinasi sito-specifiche.
Necessita di corte sequenze (qualche base) di omologia tra DNA bersaglio e
DNA sequenze invertite e ripetute (IR).
Consente la trasposizione, ossia la traslocazione di sequenze da un sito ad
un altro dello stesso genoma o tra genomi differenti:
integrazione del fago
inversione degli elementi invertibili (es. variazione di fase flagellare H1/H2 in S.
typhimurium)
trasposizione di elementi trasponibili
Conversione lisogenica
Integrazione del genoma fagico mediante ricombinazione sito-specifica
DNA profagico “silente” (anche per lunghi periodi)
Particolari condizioni ambientali (carenza ionica, essiccamento, U.V., radiazioni
ionizzanti, agenti mutageni) inducono la derepressione di parte del DNA profagico
La conversione lisogenica può accrescere la virulenza (patogenicità) di un batterio:
adesine ed antigeni di superficie (antigene O di Salmonella)
produzione di tossine
Adattamento ed evoluzione batterica
Mutazione e selezione “classiche” (selezione naturale ed evoluzione)
Acquisizione di geni da altri batteri:
Trasferimento genico ORIZZONTALE:
Coniugazione
Trasformazione
Trasduzione
Trasferimento genico VERTICALE
Ricombinazione genica (omologa o sito-specifica)
Adattamento ed evoluzione batterica
Quantità (valori percentuali) di DNA “atipico” (trasferito) nei genomi batterici. Circa il 13% del
genoma di E. coli K12 è stato acquisito mediante trasferimento genico orizzontale.
Espressione genica
La maggior parte (>98%) dei geni viene trascritta in mRNA che
viene poi tradotto in proteine. Alcuni geni codificano per le diverse
specie di RNA ribosomale (5S, 16S, 23S); altri in RNA transfer (tRNA) che,
insieme con il ribosoma, partecipano alla decodificazione di mRNA in
proteine funzionali.
La trascrizione inizia a partire dai promotori, sequenze in grado di
legare RNA-pol, che modulano la frequenza di inizio del fenomeno. La
attività dei promotori può essere alterata da proteine regolatrici.
La trascrizione termina con specifici siti di terminazione:
sequenza IR seguita da un poli-Uracile; formano «stem-loop»
incompatibile con attività della RNA-pol
proteina di terminazione (rho)
In alcuni casi, i geni sono disposti singolarmente sul cromosoma: da
questi geni viene trascritta una singola specie di mRNA che è tradotta in
un singolo tipo di proteina (arrangiamento monocistronico)
Espressione genica
In altri casi, più geni che codificano per funzioni correlate possono
trovarsi adiacenti sul cromosoma («clusters») e vengono trascritti, a
partire da un singolo promotore, su una singola molecola di mRNA, dalla
cui traduzione verranno poi formate tante proteine quanti sono i geni
che fanno parte del gruppo. Tale gruppo di geni costituisce un operone
(arrangiamento policistronico).
L’arrangiamento in operoni dei geni è tipico di molti batteri e
vantaggioso perché permette di economizzare sui meccanismi di
regolazione: il raggruppamento in operoni di geni con funzioni
correlate, che richiedono quindi una regolazione dell’espressione simile,
riduce il numero di sistemi di regolazione richiesti.
Molte delle proteine responsabili della virulenza batterica sono codificate
da operoni:
tossina colerica (V. cholerae)
fimbrie (pili) di E. coli uropatogeni
Regolazione dell’espressione genica
I batteri possono regolare in maniera «fine» la
espressione dei propri geni. La capacità di «attivare»
o «disattivare» geni selezionati consente loro di:
adattarsi facilmente ai cambiamenti dell’ambiente
(ricerca di nuove sorgenti di C/N; sintesi de novo di
una molecola)
regolare il proprio livello di virulenza. Esempio:
batteri enteropatogeni: passaggio dall’ambiente
«acqua» (25°C, carenza di elementi nutritivi)
all’ospite (37°C, carenza di O2, riduzione di Fe libero).
Geni ed operatori controllati da uno stesso regolatore
costituiscono un regolone