Scheda ECTS – SUA
Descrizone delle singole attività formative (Quadro B1 e sotto quadri)
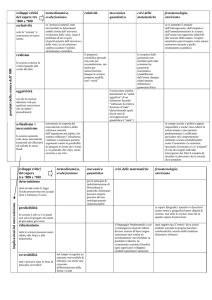
ECTS
(in Italiano)
Corso di Laurea dell’Insegnamento (specificare se triennale, magistrale o a
ciclo Unico): Farmacia, corso di laurea a ciclo unico
ECTS
(in Inglese)
Degree Course (specify if 1st Cycle, 2nd Cycle, or one-tier, degree ect.):
Pharmacy, one-tier degree
Classe di Laurea: LM-13 Farmacia e farmacia industriale
SSD (Settore scientifico disciplinare): CHIM/02 Chimica Fisica
Dipartimento competente: Scienze Farmaceutiche
Nome del/dei docente/i: Fiore Pasquale Nicoletta
Riferimenti del docente (e-mail, ecc.): [email protected],
http://www.unical.it/portale/strutture/dipartimenti_240/dfssn/areastudenti
/avvisi_docenti/nicoletta/
Orario di ricevimento: mercoledì 15.30-17.30
Eventuali altri docenti coinvolti: Dott.ssa Sabrina Manfredi per la parte
esercitazionale
Titolo dell'unità formativa: Chimica Fisica Biologica
Codice dell'unità formativa: 27005044
Tipo di unità formativa (di base o caratterizzante, affine, a scelta, altro): unità
formativa di base
Degree Class: LM-13 Pharmacy and industrial pharmacy
Scientific disciplinary Sector: CHIM/02 Physical chemistry
Department: Pharmaceutical Sciences
Name of the Teacher: Fiore Pasquale Nicoletta
Contact details on the teacher (e-mail, etc.): [email protected],
http://www.unical.it/portale/strutture/dipartimenti_240/dfssn/areastudenti
/avvisi_docenti/nicoletta/
Meeting schedule for students: Wednesday 15.30-17.30
Any other teachers involved: Dr. Sabrina Manfredi (tutorials)
Propedeuticità: Matematica e Fisica applicate alle scienze della vita,
Chimica generale ed Inorganica (solo frequenza)
Livello dell'unità formativa (es. I, II, o III ciclo; ove pertinente, livello
intermedio): I ciclo
Propaedeutics: Matematica e Fisica applicate alle scienze della vita,
Chimica generale ed Inorganica (solo frequenza)
Anno di studio/corso (ove pertinente): 1° anno
Anno/Semestre/Trimestre ove l'unità formativa viene erogata:
2° semestre
Year of study: 1st year
Year, Semester, trimester in which the teaching unit is provided
2nd semester
Periodo: dal 4 marzo 2013 al 28 giugno 2013
Ore di lezioni frontali: 48
Period: from March 4th 2013 to June 28th 2013
Hours of lectures: 48
Title of the Teaching Unit: Biological Physical Chemistry
Code of the Teaching Unit: 27005044
Type of teaching Unit: basic unit
Level of the Teaching Unit:
I cycle
Ore studio individuali: 102
Ore di laboratorio (ove pertinente): 0
Numero di crediti formativi CFU/ECTS erogati: 6
Lingua di insegnamento: italiano
Organizzazione della didattica (lezioni, esercitazioni, laboratorio, ecc.):
lezioni e esercitazioni
Hours of individual study: 102
Laboratory hours (where applicable): 0
Number of Credits CFU/ECTS awarded: 6
Teaching language: Italian
Organization of teaching (lectures, tutorials, laboratory, etc.): lectures and
tutorials
Modalità di frequenza (obbligatoria, facoltativa): obbligatoria
Frequency mode (compulsory, optional): compulsory
Modalità di erogazione (frontale, a distanza, mista): frontale
Mode of delivery (front, at a distance, mixed): front
Metodi di valutazione (Prova scritta, orale, ecc): Due prove scritte in itinere, Evaluation (Prova scritta, orale, ecc): Two written tests during the course, or
oppure prova scritta seguita da prova orale
a written test followed by an oral one
Obiettivi formativi dell’Unità formativa (risultati d'apprendimento previsti e
competenze da acquisire): Gli studenti acquisiranno una dettagliata
conoscenza di base della termodinamica, della cinetica chimica, e della
meccanica quantistica, che sono fondamentali per il proseguimento dei
loro studi.
Per quello che riguarda la termodinamica, gli studenti alla fine del corso
avranno una conoscenza dettagliata dei gas ideali e reali e dei principi ed
applicazioni della termodinamica. Per quello che riguarda la meccanica
quantistica, gli studenti avranno chiare le limitazioni della meccanica
classica, i fondamenti della teoria quantistica, dell'equazione di
Schrodinger, dell'atomo di idrogeno ed atomi idrogenoidi, e del rotatore
rigido. Sia nel campo della termodinamica che della meccanica
quantistica gli studenti svilupperanno la capacità di risolvere una varietà
di problemi numerici.
Prerequisiti e co-requisiti: Conoscenze di base di calcolo differenziale
ed integrale, elementi di meccanica ed elettromagnetismo
Unità formative opzionali consigliate: 27005122 – Radiofarmaci in
medicina: dalla preparazione allo smaltimento
Contenuti del corso/programma: Le leggi empiriche dei gas e il
modello di gas ideale: Le leggi empiriche (Charles, Gay Lussac, Boyle).
Learning outcomes:
Students will gain a detailed knowledge of basic thermodynamics,
chemical kinetics, and quantum mechanics, which are essential items for
the continuation of their studies.
As for thermodynamics, at the end of the course students will have a
detailed knowledge of the real and ideal gases and the principles and
applications of thermodynamics. As for quantum mechanics students will
have clear the limitations of classical mechanics, the foundations of
quantum theory, the Schrodinger equation, the hydrogen atom and
hydrogen-like atoms, and the rigid rotator. In addition, students will
develop the ability to solve a variety of numerical problems both in the
field of thermodynamics and quantum mechanics.
Prerequisities/Co-requsities: Elements of calculus, mechanics and
electro-magnetism
Other optional Teaching Units: 27005122 – Radiofarmaci in medicina:
dalla preparazione allo smaltimento
Content of the Program/Course: The empirical laws of gases and the
ideal gas model: The empirical laws (Charles, Gay Lussac, Boyle laws).
Concetto empirico di temperatura assoluta. L’equazione di stato per il
gas ideale. Elementi di teoria cinetica dei gas. Derivazione teorica
dell'equazione di stato del gas ideale. Le miscele gassose a
comportamento ideale.
Empirical concept of absolute temperature. The equation of state for an
ideal gas. Elements of the kinetic theory of gases. Theoretical derivation
of the equation of state of an ideal gas. Gaseous mixtures with ideal
behavior.
Il comportamento dei gas reali: Le deviazioni dal comportamento ideale The behavior of real gases: Deviations from ideal behavior and their
e la loro origine. Le isoterme di un gas reale e le costanti critiche. origin. The isotherms of a real gas. The equation of Van der Waals and
its features.
L’equazione di Van der Waals e le sue caratteristiche.
Il 1° principio e la termochimica: Generalità e scopi della termodinamica
chimica. Trasferimento di energia fra un sistema e l'ambiente. Lavoro
associato a variazione di volume. Il calore. Definizione della
temperatura. Prima definizione di funzione di stato. Energia interna di un
sistema. Il 1° principio della termodinamica. La funzione energia interna,
U. La convenzione dei segni. Applicazioni e conseguenze del 1°
principio. Esperienza di Joule. Calore molare a volume costante. La
funzione di stato entalpia, H. Calore specifico e molare a pressione
costante. Relazione fra Cp e Cv. Dipendenza dei calori specifici dalla
temperatura. Concetto di trasformazione reversibile del gas ideale.
Espansione isoterma e reversibile del gas ideale. Espansioni isoterme e
irreversibili del gas ideale. Espansione adiabatica e reversibile del gas
ideale. L’equazione di Kirchoff. Stati di riferimento e stati standard.
Calore di formazione di una specie chimica. La legge di Hess.
The 1st law: Introduction and purposes of chemical thermodynamics.
Energy transfer between a system and the environment. Work associated
with volume change. Heat. Definition of temperature. First definition of
state function. Internal energy of a system. The 1st law of
thermodynamics. Internal energy, U. The sign convention. Applications
and consequences of the 1st principle. Joule’s experiment. Molar heat at
constant volume. Enthalpy, H. Molar heat at constant pressure. Relation
between Cp and Cv. Dependence of the specific heat on the temperature.
Concept of reversible transformation of the ideal gas. Isothermal and
reversible expansion of an ideal gas. Isothermal and irreversible
expansion of an ideal gas. Adiabatic and reversible expansion of an ideal
gas. The equation of Kirchoff. Reference states and standard states.
Formation heat of a chemical species. The Hess law.
Il 2° principio della termodinamica: Prima definizione dell'entropia e 2°
principio. Variazioni entropiche in trasformazioni reversibili e
irreversibili. Il ΔS totale come criterio per stabilire la spontaneità di una
trasformazione. La funzione di stato energia libera, G. Il ΔG come
criterio per stabilire la spontaneità di una trasformazione. Significato
fisico della funzione G. Calcolo dei ΔG di reazioni chimiche. Variazione
dell'energia libera al variare della temperatura: l'equazione di Gibbs-
The 2nd law of thermodynamics: First definition of entropy and 2nd law.
Entropy changes in reversible and irreversible transformations. The total
ΔS as a criterion to determine the spontaneity of a transformation. The
function of state free energy, G. The ΔG as a criterion to determine the
spontaneity of a transformation. Physical meaning of the function G.
Calculation of ΔG of chemical reactions. Variation of the free energy as
a function of temperature: the Gibbs-Helmholtz equation.
Helmholtz.
I potenziali chimici e la legge dell'equilibrio chimico: Il potenziale
chimico. L’espressione del potenziale chimico per il gas ideale e per le
miscele di gas a comportamento ideale. Cenni sul potenziale chimico per
i gas reali e sulla fugacità. La derivazione termodinamica della legge
dell'equilibrio chimico. Relazione fra ΔG e Kp. Influenza della pressione
sulla posizione dell'equilibrio. La costante di equilibrio in funzione delle
concentrazioni, Kc. Relazione fra Kp e Kc. Influenza della temperatura
sulla costante di equilibrio: equazione di Van't Hoff.
Elementi di cinetica chimica: Velocità di reazione. Ordine di reazione.
Costante di velocità. Reazioni del primo ordine. Reazioni del secondo
ordine e successive. Metodi per stabilire l'ordine di una reazione. Il
tempo di dimezzamento. Dipendenza delle costanti di velocità dalla
temperatura.
Fondamenti di meccanica quantistica e spettroscopia: Evidenze
sperimentali non interpretabili in termini di fisica classica. Radiazione
del corpo nero. Effetto fotoelettrico. Diffrazione degli elettroni. Spettri
atomici. Postulati della meccanica quantistica. Equazione di Schrodinger.
Principio di indeterminazione. La struttura degli atomi e delle molecole.
Spettroscopia molecolare. Spettroscopia rotazionale.
Elementi di chimica del nucleo: Il nucleo. Isotopi, isotoni ed isobari. La
radioattività: decadimento α, β e γ. Tempo di dimezzamento.
Attenuazione della radiazione: HVL e TVL. Effetti della radiazione
ionizzante sulla materia vivente: effetti stocastici ed effetti deterministici.
Dosimetria: dose,
dose equivalente, dose efficace, dose letale.
Radioprotezione.
The chemical potential and the law of chemical equilibrium: The
chemical potential. The expression of the chemical potential for the ideal
gas and for gas mixtures with ideal behavior. Notes on the chemical
potential for real gases and transience. The derivation of the law of
chemical equilibrium thermodynamics. Relationship between ΔG and
Kp. Influence of pressure on the equilibrium position. The equilibrium
constant as a function of concentrations, Kc. Relationship between Kp
and Kc. Influence of temperature on the equilibrium constant: Van't Hoff
equation.
Chemical kinetics: Reaction rate. Reaction order. Rate constant.
Reactions of the first order. Reactions of the second order and higher.
Methods to determine the order of a reaction. The half-life. Dependence
of the rate constant on temperature.
Foundations of quantum mechanics and spectroscopy: Experimental
evidences that cannot be interpreted in terms of classical physics. Blackbody radiation. Photoelectric effect. Diffraction of electrons. Atomic
spectra. Postulates of quantum mechanics. Schrodinger equation. The
uncertainty principle. The structure of atoms and molecules. Molecular
spectroscopy. Rotational spectroscopy.
Elements of chemistry of the nucleus: The nucleus. Isotopes, isotones and
isobars. The radioactivity: α, β and γ decay. Half-life. Attenuation of
radiation: HVL and TVL. Effects of ionizing radiation on living matter:
deterministic effects and stochastic effects. Dosimetry: dose, equivalent
dose, effective dose, lethal dose. Radiation protection.
Letture consigliate o richieste: Suggested texts:
Atkins: Elementi di Chimica Fisica 2 ediz.- Ed. Zanichelli, Bologna Atkins: Elementi di Chimica Fisica 2 ediz.- Ed. Zanichelli, Bologna
2000.
2000.
Atkins: Chimica Fisica 3 ediz.- Ed. Zanichelli, Bologna 1997.
Atkins: Chimica Fisica 3 ediz.- Ed. Zanichelli, Bologna 1997.
Vemulapalli, Chimica Fisica – Edises.
Vemulapalli, Chimica Fisica – Edises.
Attività di apprendimento previste e metodologie didattiche:
Didattica frontale con proiezione di slides e svolgimento di esercizi alla
lavagna.
Metodi e criteri di accertamento del profitto: Due prove scritte in
itinere, oppure prova scritta seguita da prova orale. La votazione finale è
in trentesimi.
Tirocinio: Non richiesto
Planned learning activities and teaching methods:
Frontal lessons with slides projection and performing exercises on the
blackboard.
Methods and assessment criteria: Two written tests during the course,
or a written test followed by an oral one. The final score is in thirtieths.
Internships/placements: Not required