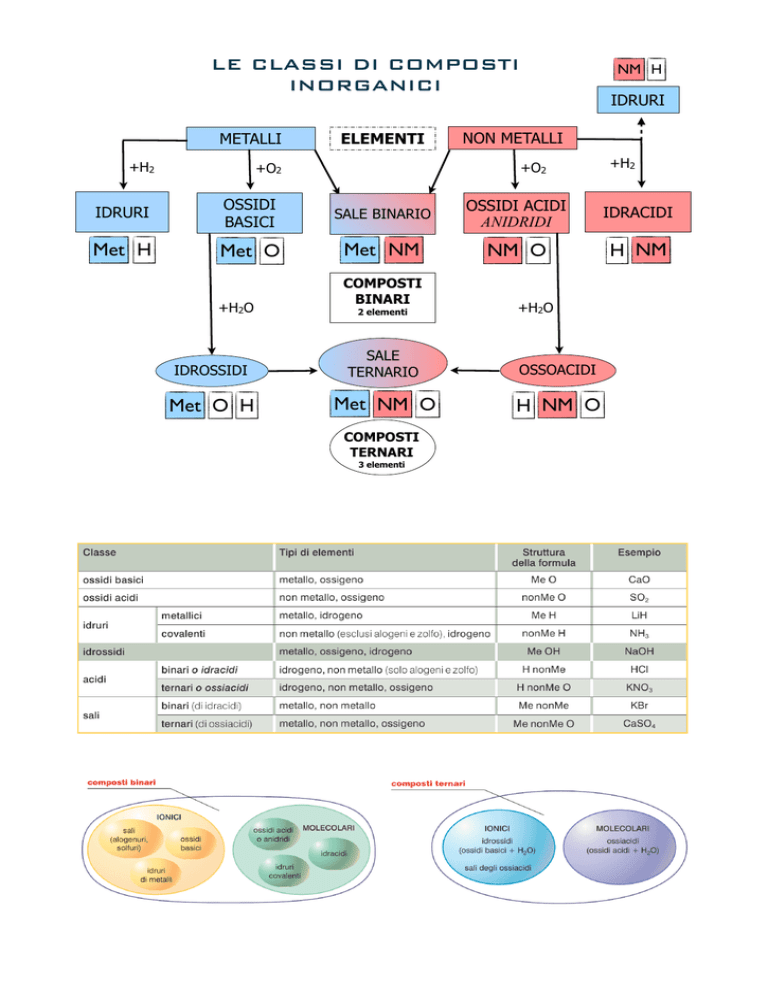
LE CLASSI DI COMPOSTI
INORGANICI
METALLI
+H2
ELEMENTI
NM H
IDRURI
NON METALLI
+O2
+O2
+H2
IDRURI
OSSIDI
BASICI
SALE BINARIO
OSSIDI ACIDI
ANIDRIDI
IDRACIDI
Met H
Met O
Met NM
NM O
H NM
+H2O
COMPOSTI
BINARI
2 elementi
+H2O
IDROSSIDI
SALE
TERNARIO
OSSOACIDI
Met O H
Met NM O
H NM O
COMPOSTI
TERNARI
3 elementi
OSSANIONI
Gli ossanioni, ioni poliatomici con carica negativa, derivano dagli ossiacidi per perdita di ioni idrogeno (H⁺)
Metalli di Transizione
IV
V
VI
VII
Alogeni
H2Cr₂O₇
Acido dicromico
H₂CO₃
Acido carbonico
HNO₃
HNO₂
Ac. Nitrico – Nitroso
H₂SO₄
Acido solforico
HClO₄
Acido perclorico
Cr₂O₇⁻2
Dicromato
HCO₃⁻
Idrogeno carbonato
(bicarbonato)
HSO₄⁻
Idrogeno solfato
ClO₄⁻
Perclorato
H2CrO₄
Acido cromico
CO₃⁻2
Carbonato
H₃PO₄
Acido fosforico
SO₄⁻2
Solfato
HClO₃
Acido clorico
CrO₄⁻2
Cromato
CH₃COOH
Acido acetico
H₂PO₄⁻
Diidrogeno fosfato
H₂SO₃
Acido solforoso
ClO₃⁻
Clorato
HMnO₄
Acido permanganico
CH₃OO⁻
Acetato
HPO₄⁻2
Idrogeno fosfato
HSO₃⁻
Idrogeno solfito
(bisolfito)
HClO₂
Acido cloroso
MnO₄Permanganato
H₂C₂O₄
Acido ossalico
PO₄⁻3
Fosfato
SO₃⁻2
Solfito
ClO₂⁻
Clorito
C₂O₄⁻2
Ossalato
H₃PO₃
Acido fosforoso
S₂O₃⁻2
Tiosolfato
HClO
Acido ipocloroso
H₂PO₃⁻
Diidrogeno Fosfito
S₂O₈⁻2
perossidisolfato
ClO⁻
Ipoclorito
NO₃⁻
Nitrato
-
NO₂⁻
Nitrito
HPO₃⁻2
Idrogeno fosfito
SALI
I sali si possono considerare derivati dagli acidi per sostituzione totale (sali neutri) o parziale degli idrogeni con ioni
metallici
Na⁺+ CO₃2⁻ → Na₂CO₃
Carbonato di sodio
Se gli atomi di idrogeno di un acido poliidrogenato non vengono completamente sostituiti da ioni metallici, questi
composti sono definiti sali acidi
NaHCO₃ → Na⁺ + HCO₃⁻ Sodio idrogeno carbonato (IUPAC) Bicarbonato di sodio (trad.)
I sali che contengono gruppi ossidrili OH⁻ sono chiamati sali basici
Bi(OH)₂NO₃ Nitrato diidrossido di bismuto (III).
I sali si possono ottenere con uno dei seguenti metodi:
Acido + idrossido → sale + acqua
H₂S0₄ + Cu(OH)₂ →CuSO₄ + 2H₂O
Acido + metallo
H₂SO₄ + Cu → CuSO₄ + H₂
Anidride + idrossido → sale + acqua
SO₃ +Cu(OH)₂ →CuSO₄ + H₂O
Acido + ossido basico → sale + acqua
H₂SO₄ + CuO → CuSO₄ + H₂O
Anidride + ossido basico → sale
SO₃ + CuO → CuSO₄
Metallo + non metallo → sale
Acido + sale → sale + acido
Idrossido + sale → sale + idrossido
Sale1 + sale2 → sale3 + sale4 (doppio scambio ionico)
→ sale + idrogeno elementare
In grassetto i numeri di ossidazione dei composti ionici
NOTA BENE
L’elemento più elettronegativo ha il numero di ossidazione negativo.
L’idrogeno ha numero di ossidazione -1 negli idruri metallici. In quelli non metallici (NH3) è normalmente +1 perchè N è più elettronegativo.
L’ossigeno ha numero di ossidazione -1 nei perossidi che hanno lo stesso nome in tutte le nomenclature.
Nella nomenclatura IUPAC il prefisso mono- va specificato solo se necessario, cioè se aiuta a non commettere errori nella formula e generalmente mai
sul nome dell’elemento a sinistra nella formula (che viene per secondo nel nome). Normalmente viene omesso.
•
KBr bromuro di potassio (non monobromuro di monopotassio)
•
CO monossido di carbonio
Nella nomenclatura IUPAC i prefissi possono essere omessi se l’elemento ha un solo numero di ossidazione, quindi non c’è rischio di commettere
errori
•
Na2O si può chiamare ossido di sodio (e non monossido di disodio)
๏
Gli ioni monoatomici negativi (Cl-, Br-, S-2...) si nominano aggiungendo il suffisso -uro al nome del non metallo da cui derivano.
๏
I nomi tradizionali degli ossidi cromo, del manganese e dell’azoto e gli acidi contenenti carbonio non seguono alcuna regola! (è meglio usare sempre
la IUPAC). Gli ossidi del manganese, del cromo e dell’azoto possono avere sia carattere acido (si chiamano anidridi e generano ossiacidi per reazione con
l’acqua) sia basico (si chiamano ossidi e generano idrossidi per reazione con l’acqua).
๏
Il cromo ha 3 stati di ossidazione: +2 ha comportamento metallico, il +3 ha comportamento anfotero (genera sia Cr(OH)3 idrossido sia H3CrO3
ossiacido), +6 che comportamento non metallico e genera cromati e dicromati.
๏
Casi particolari: HCN acido cianidrico, HCNS acido tiocianico, NH4+ ione ammonio
๏
Alcuni ossidi acidi possono combinarsi con un numero variabile di mole-cole di acqua, cioè secondo un rapporto 1 : 1 oppure 1 : 2 oppure 1 : 3
NOMENCLATURA
TRADIZIONALE
IUPAC
Numero di ox. più basso Numero di ox. più alto
ossido di (nome metallo)
ossido di (nome metallo)
OSSIDO BASICO
+ prefissi numerici
desinenza –oso
desinenza –ico
COMPOSTO
STOCK
ossido di (nome metallo)
+ (num. ox.)
Anidride (radice del non metallo) -ica
+1 !
+5 o +6 !
anidride ipo-(radice non anidride (radice non met)- ossido di (nome non metallo)
met)-osa
ica
+ prefissi numerici
+3 o +4!
+7 !
anidride (radice non met)- anidride per-(radice non
osa
met)-ica
OSSIDO ACIDO
(ANIDRIDE)
idruro di (nome elemento)
o nome legato alla consuetudine
IDRURO
desinenza –oso
idruro di (nome elemento)
+ prefissi numerici
desinenza –ico
ossido di (nome non metallo)
+ (num. ox.)
…
(radice del non metallo)-uro di (nome metallo) (radice del non metallo)- uro di (radice del non metallo)- uro di
(nome metallo)
(nome metallo)
+ prefissi numerici
+ (num. ox.)
desinenza –oso
desinenza –ico
SALE BINARIO
IDRACIDO
acido (radice del non metallo)-idrico
(radice del non metallo)- uro di
idrogeno
…
acido + num. atomi di ossigeno
+ osso
+ (radice del non metallo) –ico
+ n.o. del non metallo
…
idrossido di (nome metallo)
+ prefissi numerici
idrossido di (nome metallo)
+ (num. ox.)
(nome dell’anione) + (num. ox.) di
(nome metallo) + (num. ox.)
…
acido (radice del non metallo) -ico
+5 o +6 !
+1 !
acido (radice non met)-ico
acido ipo-(radice non
met)-oso
+7 !
+3 o +4 !
acido per-(radice non
acido (radice non met)-oso
met)-ico
OSSIACIDO
idrossido di (nome metallo)
IDROSSIDO
desinenza –oso
desinenza –ico
(nome dell’anione) di (nome metallo)
SALE TERNARIO
desinenza –oso
desinenza –ico
I nomi degli anioni derivanti da ossiacidi hanno come suffisso:
-ato se l’acido terminava per -ico
-ito se l’acido terminava per -oso
I nomi degli anioni derivanti da ossiacidi hanno come suffisso -ato con il prefisso
numerico indicante il numero di atomi di ossigeno.
NOMENCLATURA
TRADIZIONALE
COMPOSTO
Numero di ox. più basso
OSSIDO BASICO
desinenza –oso
Fe2O3
Numero di ox. più alto
ossido di (nome metallo)
desinenza –ico
OSSIDO FERRICO
IUPAC
STOCK
ossido di (nome metallo)
+ prefissi numerici
TRIOSSIDO DI DIFERRO
ossido di (nome metallo)
+ (num. ox.)
OSSIDO DI FERRO (III)
ossido di (nome non metallo)
+ prefissi numerici
TRIOSSIDO DI DICLORO
ossido di (nome non metallo)
+ (num. ox.)
OSSIDO DI CLORO (III)
idruro di (nome elemento)
+ prefissi numerici
DIIDRURO DI FERRO
…
(radice del non metallo)- uro di (nome
metallo)
+ prefissi numerici
SOLFURO DI RAME
(radice del non metallo)- uro di
(nome metallo)
+ (num. ox.)
SOLFURO DI RAME (II)
(radice del non metallo)- uro di
idrogeno
SOLFURO DI DIIDROGENO
…
acido + num. atomi di ossigeno
+ osso
+ (radice del non metallo) –ico
+ n.o. del non metallo
ACIDO DIOSSOCLORICO (III)
…
idrossido di (nome metallo)
+ prefissi numerici
IDROSSIDO DI POTASSIO
idrossido di (nome metallo)
+ (num. ox.)
IDROSSIDO DI POTASSIO
(nome dell’anione) + (num. ox.) di
(nome metallo) + (num. ox.)
TRIOSSONITRATO (V) DI FERRO
(III)
…
Anidride (radice del non metallo) -ica
+1 ! anidride ipo-(radice
OSSIDO ACIDO non met)-osa
Cl2O3
+3 o +4 ! anidride (radice
non met)-osa
ANIDRIDE CLOROSA
IDRURO
FeH2
SALE BINARIO
CuS
IDRACIDO
H2S
+5 o +6 !
anidride (radice non met)-ica
+7 ! anidride per-(radice
non met)-ica
idruro di (nome elemento)
o nome legato alla consuetudine
desinenza –oso
IDRURO FERROSO
desinenza –ico
(radice del non metallo)-uro di (nome metallo)
desinenza –oso
desinenza –ico
SOLFURO RAMEICO
acido (radice del non metallo)-idrico
ACIDO SOLFIDRICO
acido (radice del non metallo) -ico
OSSIACIDO
HClO2
IDROSSIDO
KOH
+1 !
acido ipo-(radice non met)oso
+3 o +4 !acido (radice non
met)-oso
ACIDO CLOROSO
+5 o +6 !
acido (radice non met)-ico
+7 !
acido per-(radice non met)ico
idrossido di (nome metallo)
IDROSSIDO DI POTASSIO
desinenza –oso
desinenza –ico
(nome dell’anione) di (nome metallo)
SALE TERNARIO
desinenza –oso
desinenza –ico
Fe(NO3)3
NITRATO FERRICO












