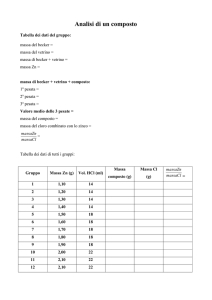
II° argomento: Analisi microscopiche dei campioni prelevati
1) Analisi diretta al microscopio del campione prelevato (su vetrino)
2)Colorazione Gram e Colorazione Acido-resistenza
3) Analisi al microscopio del campione colorato
1. Analisi diretta al microscopio del campione prelevato (su vetrino)
•
•
Da campione SECCO, disperso in mortaio, prelevare una goccia di campione e depositarla
su un vetrino da microscopio, sul quale era già stata depositata una goccia d’acqua. Coprire
con un vetrino copri oggetto ed osservare al microscopio la morfologia del microorganismo
Da campione LIQUIDO disperso in terreno RB o PCA, prelevare una goccia di campione e
depositarla su un vetrino da microscopio, sul quale era già stata depositata una goccia
d’acqua. Coprire con un vetrino copri oggetto ed osservare al microscopio la morfologia del
microorganismo
2. Colorazione Gram e Colorazione Acido-resistenza
2.a Colorazione Gram
i) Teoria
La colorazione Gram fa parte di tecniche di colorazione policromatica (differenziale), cioè in grado
di distinguere diversi tipi di batteri; i coloranti reagiscono con essi e li discriminano in funzione
della diversa composizione delle loro strutture pericellulari.
In particolare, la colorazione Gram consente di discriminare i batteri in base alla differente
composizione della parete batterica, e pertanto in funzione della diversa reattività dei batteri ai
coloranti utilizzati.
Tutti i batteri si colorano di blu-viola, ma quelli con parete dotata di un sottile strato di
peptidoglicano e ricca di lipidi, cioè i Gram negativi (Gram-), vengono decolorati rapidamente da
un solvente organico (alcool etilico e/o acetone), mentre quelli con parete ricca di peptidoglicano e
priva di lipidi, cioè i Gram positivi (Gram +) non vengono decolorati. Le cellule Gram+
risulteranno colorate di viola mentre quelle Gram- di rosa (perché ricolorabili con colorante di
contrasto-vedi dopo).
Tutte le colorazioni policromatiche, e quindi anche quella di Gram, richiedono 4 soluzioni:
- un colorante basico, cioè un colorante il cui colore è nello ione positivo (spesso i coloranti
sono sali di cui uno degli ioni è colorato)
- un mordente, che aiuta a fissare il colorante sulle cellule aumentando l’affinità tra cellula e
colorante. Può essere un acido, una base, un sale metallico, iodio (per colorazione di Gram).
Con l’utilizzo del mordente la cellula si colora più intensamente ed è perciò più difficile lavar
via la colorazione
- un agente decolorante, che toglie il colorante dalla cellula (alcool per colorazione di Gram)
Certe cellule si decolorano più facilmente di altre, consentendo quindi una discriminazione fra
tipi cellulari.
- un colorante di contrasto, un colorante basico caratterizzato da colore diverso dal primo, e che
ha lo scopo di dare alla cellula eventualmente decolorata un colore diverso da quello iniziale.
Pertanto, i microorganismi che risultano resistenti alla colorazione trattengono il colorante
basico iniziale, mentre quelli che non lo sono assumono il colorante di contrasto.
ii) ESPERIMENTO: Colorazione
• Sgrassare il vetrino (uno o più) portaoggetti flamandolo più volte alla fiamma del bunsen
• Depositare sul vetrino una piccola goccia di acqua aiutandosi con la pipetta. Siglare il
vetrino con il nome del campione e del gruppo di lavoro
• Prelevare sterilmente con l’ansa una parte di una colonia (fresca, di 18-24h, o perdono le
differenze in parete) ben isolata, ottenuta dalle piastre seminate il II° giorno, e risospenderla
nella goccia di acqua, stendendo uniformemente sul vetrino la patina batterica
• Asciugare al calore della fiamma, flambando per 3 volte alla fiamma il vetrino con il lato
della sospensione rivolto verso l’alto (fissazione)
• Coprire la patina fissata con violetto di Nicolle SOTTO CAPPA (Cristal violet, colorazione
basica). Attendere 3min.
• Rimuovere il colorante senza lavare (versarlo via su una salvietta)
• Immergere il vetrino in una torretta contenente Lugol (mordenzatura). Attendere 1min.
• Rimuovere il colorante senza lavare (versandolo via su una salvietta)
• Immergere il vetrino in una torretta contenente alcool a 95°C (decolorazione)
• Immergere il vetrino in una torretta contenente acqua (lavaggio)
• Immergere il vetrino in una torretta contenente Safranina (contrasto). Attendere per 3min
• Rimuovere il colorante senza lavare (versarlo via su una salvietta)
• Immergere il vetrino in una torretta contenente acqua. Asciugare all’aria
• Montare il vetrino con elvanoll (soluzione montante): depositare una goccia d montante,
quindi appoggiarvi delicatamete il vetrino da un lato, lasciandolo poi cadere e premendolo in
modo da far uscire le bolle d’aria
• Osservare al microscopio ottico
Parete Gram +
Parete Gram –
2.b Colorazione Acido-resistenza (Colorazione di Ziehl-Nielsen)
i) Teoria
Questa è una colorazione policromatica che misura la resistenza delle cellule batteriche colorate alla
decolorazione con acidi; la capacita’ di certi micobatteri e attinomiceti e’ infatticorrelabile con il
loro alto contenuto di lipidi. Per poter colorare questi batteri occorre riscaldarli dopo averli uniti a
coloranti a loro fortemente affini, per cui risulta difficile la successiva decolorazione.
In questa colorazione si utlizzano:
- carbofucsina a caldo
- una soluzione decolorante a base di acido-alcool
- un colorante di contrasto
I batteri acido resistenti vengono decolorati più lentamente e trattengono la colorazione iniziale
ii) ESPERIMENTO: Colorazione
•
Prelevare sterilmente con l’ansa una parte di una colonia ben isolata, ottenuta dalle piastre
seminate il II° giorno, e stemperare la patina sul vetrino per ottenere cellule isolate. Siglare il
vetrino con il nome del campione e del gruppo di lavoro
•
Far asciugare lo striscio all’aria
•
Fissare il vetrino alla fiamma come descritto per la colorazione di Gram
•
Portare ad ebollizione dell’acqua (pentole comuni)
•
Mettere il vetrino sopra il vapore acqueo
•
SOTTO CAPPA, colorare lo striscio appoggiandovi sopra un pezzo di carta assorbente
imbibito con carbofucsina. Attendere 10min.
•
Immergere il vetrino in una torretta contenente acqua (lavaggio)
•
Immergere il vetrino in una torretta contenente uan miscela di Alcol etilico 95%, 2,5%
HNO3 (decolorazione). Attendere 10-30 sec
•
Immergere il vetrino in una torretta contenente acqua (lavaggio)
•
Immergere il vetrino in una torretta contenente blu di metilene. Attendere 30sec (colorazione
di contrasto)
•
Immergere il vetrino in una torretta contenente acqua (lavaggio) e far asciugare
•
Montare i vetrini con Elvanoll come descritto per la colorazione Gram
•
Esaminare al microscopio ottico con obiettivo ad immersione