- Chimica e Tecnologia Farmaceutiche -
CORSO DI LAUREA SPECIALISTICA
IN CHIMICA E TECNOLOGIA FARMACEUTICHE
10
- Chimica e Tecnologia Farmaceutiche -
INDIRIZZI DIDATTICI DEL CORSO DI LAUREA
SPECIALISTICA IN CHIMICA E TECNOLOGIA
FARMACEUTICHE
(per il Vecchio Ordinamento ad esaurimento rimangono attivati,
per il corrente anno accademico, il IV e V anno).
I laureati nei corsi di laurea specialistica in Chimica e Tecnologia
Farmaceutiche devono essere dotati delle basi scientifiche e della
preparazione teorica e pratica necessarie all’esercizio della professione di
farmacista e ad operare quale esperto del farmaco e dei prodotti per la salute
(presidi medico-chirurgici, articoli sanitari, cosmetici, dietetici, prodotti
erboristici, prodotti diagnostici e chimico-clinici, ecc.), nel relativo settore
industriale. Con il conseguimento della laurea specialistica e con il
conseguimento della relativa abilitazione professionale, il laureato svolge ai
sensi della direttiva 85/432/CEE la professione di farmacista ed é
autorizzato almeno all’esercizio delle seguenti attività professionali previste
dalle lauree specialistiche in Farmacia e Farmacia Industriale e che
rientrano nel campo minimo comune coordinato da detta direttiva come di
seguito riportato:
• Preparazione della forma farmaceutica dei medicinali;
• Fabbricazione e controllo dei medicinali;
• Controllo dei medicinali in laboratorio di controllo;
• Immagazzinamento, conservazione e distribuzione dei medicinali nella
fase di commercio all'ingrosso;
• Preparazione, controllo, immagazzinamento e distribuzione dei
medicinali nelle farmacie aperte al pubblico;
• Preparazione, controllo, immagazzinamento e distribuzione dei
medicinali negli ospedali (farmacie ospedaliere);
• Diffusione di informazioni e consigli nel settore dei medicinali;
• Altre attività professionali svolte nell’unione europea nel campo del
farmaco e dei prodotti per la salute, nel contesto delle molteplici
interazioni con la moderna realtà sanitaria, al fine di consentire pari
opportunità professionali.
Il corso di laurea in Chimica e Tecnologie Farmaceutiche fornisce allo
studente una ben strutturata formazione di base, inerente le discipline e le
metodologie che definiscono l’ambito della produzione, della formulazione,
del metabolismo e dell’analisi del farmaco e che si correla alle conoscenze e
alle regolamentazioni per la distribuzione del farmaco. La realizzazione di
questo obiettivo implica durante il corso di studi la proposta e
l’approfondimento iniziale di discipline di base (chimiche, fisiche e
matematiche) e successivamente l’acquisizione di competenze biologiche,
biochimiche biomediche e farmacologiche nonché farmaceutiche e
11
- Chimica e Tecnologia Farmaceutiche tossicologiche che concorrono tutte a realizzare la formazione complessiva
del laureato. Nell’ambito di questo percorso formativo assume particolare
rilievo l’aspetto inerente la produzione e lo studio del farmaco attraverso
metodologie chimiche, chimico fisiche avanzate, biologiche e biomediche.
Il laureato in Chimica e Tecnologia Farmaceutiche potrà esercitare la
professione di Farmacista, potra’ lavorare nell’industria farmaceutica
nell’ambito della ricerca, della produzione e del controllo del farmaco. Egli
avra’ infine la formazione adeguata per affrontare anche nell’ambito di
strutture laboratoristiche del servizio sanitario nazionale il dosaggio dei
farmaci e dei loro metaboliti anche in funzione del loro monitoraggio nella
pratica clinica. Il laureato in Chimica e Tecnologie farmaceutiche inoltre
potra’ esplicare la propria attivita’ lavorativa nell’ambito di strutture
laboratoristiche di pertinenza delle industrie agroalimentari
e
biotecnologiche per la produzione di alimenti dietetici e speciali. Il Corso di
laurea specialistica in Chimica e Tecnologia Farmaceutiche ha la durata di
cinque anni che comprendono un periodo di sei mesi di tirocinio
professionale presso una farmacia aperta al pubblico, o in un ospedale sotto
la sorveglianza del servizio farmaceutico, per non meno di 15 CFU. Per gli
iscritti al vecchio ordinamento (IV, V anno del corso di Laurea) è previsto
un percorso formativo che prevede 2200 ore di attività didattica assistita
corrispondenti a 28 annualità. La durata del corso è fissata in 5 anni e
comprende un triennio propedeutico comune ed un biennio di
specializzazione professionale articolato in 5 indirizzi: Farmaceutico,
Biochimico applicativo, Biopatologico, Farmacologico, Chimica delle
sostanze organiche di interesse farmaceutico. Per gli iscritti al nuovo
ordinamento didattico (I, II e III anno) il corso di laurea in CTF prevede 2
curricula: Biotecnologico e Innovazione del farmaco entrambi costituiti da
300 crediti formativi. Per il completamento del corso di laurea è previsto
anche un periodo di tirocinio professionale presso una farmacia aperta al
pubblico o ospedaliera o in un servizio farmaceutico territoriale pari a 2
trimestri che devono essere espletati negli ultimi due anni di corso. Lo
studente dovrà superare l’esame di laurea che consisterà nella discussione
della tesi sperimentale o compilativa. Gli studenti, iscritti al vecchio
ordinamento, devono scegliere l’indirizzo all’atto dell’iscrizione al quarto
anno. Per ciascuno anno accademico ogni Consiglio di Corso di Laurea e
Facoltà, nell’ambito della propria autonomia didattica, può deliberare di
attivare uno o più indirizzi, indicando in aggiunta alla disciplina
fondamentale di indirizzo le altre annualità di indirizzo semestrali. Gli
organi accademici propongono la propedeuticità dei corsi fondamentali e di
orientamento. Lo studente, scelto l’orientamento, é tenuto a superare
l’esame del corso fondamentale di indirizzo e gli esami delle altre annualità
dell'indirizzo prescelto. Nel caso di verifiche di profitto contestuale,
accorpamento di più insegnamenti nello stesso anno accademico, il preside
12
- Chimica e Tecnologia Farmaceutiche costituisce le commissioni di profitto utilizzando docenti dei relativi corsi,
secondo le norme dettate dall’art. 160 del testo unico delle leggi
sull’istruzione superiore, approvato con Regio Decreto 321 agosto 1933,
n.1592, e dell’art.42 del regolamento studenti approvato con Regio Decreto
4 giugno 1938, n. 1269.
13
- Chimica e Tecnologia Farmaceutiche -
CORSO DI LAUREA SPECIALISTICA IN CHIMICA E
TECNOLOGIA FARMACEUTICHE
Nuovo Ordinamento
1° Anno
I Trimestre
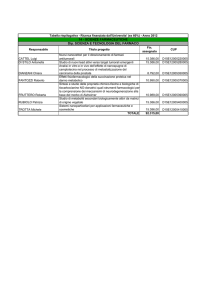
Matematica
Chimica Gen.ed Inorgan.
Fisica
MAT\06
CHIM\03
FIS\07
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
CHIM\01
BIO\13
BIO\16
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
BIO\19
CHIM\02
CHIM\01
1 modulo 4cfu
1 modulo 4cfu
1 modulo 5cfu
CHIM\06
1 modulo 5cfu
BIO\11
CHIM\06
BIO\09
BIO\10
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 7cfu
CHIM\08
CHIM\08
BIO\09
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
II Trimestre
Chimica Analitica I
Lingua Inglese
Biologia Animale
Anatomia Umana
III Trimestre
Microbiologia Generale
Chimica Fisica
Chimica Analitica II
2° Anno
I Trimestre
Chimica Organica I
II Trimestre
Biologia Molecolare
Chimica Organica II
Fisiologia generale I
Biochimica
III Trimestre
Analisi dei Medicinali
Analisi dei Farmaci I
Fisiologia generale II
14
- Chimica e Tecnologia Farmaceutiche -
Curriculum BIOTECNOLOGICO
3° Anno
I Trimestre
Farmacologia e farmacognosia
Chimica Farmac.Toss. I
Patologia generale I
Analisi dei farmaci II
II Trimestre.
Chimica Organica III
Metodi Fisici in Ch.Org. I
Chimica Farmac.Toss.II
Patologia generale II
Fitochimica
BIO\14
CHIM\08
MED\04
CHIM\08
1 modulo 4cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
CHIM\06
CHIM\06
CHIM\08
MED\04
BIO/15
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
CHIM/09
CHIM\08
1 modulo 5cfu
1 modulo 5cfu
III Trimestre
Chimica Farmaceutica applicata
Chimica Farmac.Toss.III
Curriculum INNOVAZIONE DEL FARMACO
3° Anno
I Trimestre
Farmacologia e farmacognosia
Chimica Farmac.Toss. I
Patologia generale I
Stereochimica
Analisi dei farmaci II
II Trimestre
Chimica Farmac.Toss.II
Patologia generale II
Fitochimica
Chimica Organica III
15
BIO\14
CHIM\08
MED\04
CHIM/06
CHIM\08
1 modulo 4cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 4cfu
CHIM\08
MED\04
BIO/15
CHIM\06
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
1 modulo 5cfu
- Chimica e Tecnologia Farmaceutiche -
III Trimestre
Chimica Farmaceutica applicata
Chimica Farmac.Toss.III
CHIM/09
CHIM\08
1 modulo 5cfu
1 modulo5 cfu
CORSO DI LAUREA SPECIALISTICA IN CHIMICA E
TECNOLOGIA FARMACEUTICHE
Vecchio Ordinamento
4° Anno
I Trimestre
Analisi dei farmaci II
Fitofarmacia
Metodologie Biochimiche
Chimica Organica Avanzata
CHIM\08
BIO\15
BIO\10
CHIM\06
II Trimestre
Tecnologia Socioec.e Leg.Farmac.
Farmacologia e Farmacoterapia
III Trimestre
Patologia cell.e Ultrastrutt.
Neuropsicofarmacologia
Biochimica Applicata
CHIM\09
BIO\14
MED\04
BIO\14
BIO\10
5° Anno
I Trimestre
Impianti dell’Industria Farmaceut.
Enzimologia
Biotecnologie farmacologiche
Fisiopatologia generale
Chimica Tossicologica
Chimica delle Macromolecole
Stereochimica
16
CHIM\09
BIO\10
BIO\14
MED/04
CHIM\08
CHIM/05
CHIM/06
- Chimica e Tecnologia Farmaceutiche -
II Trimestre
Biochimica Sistematica Umana
Fitochimica
Biotecnol.Piante Offic.
Biochimica Industriale
Farmacologia Cellulare Molecolare
Metodologia di laboratorio
Fisiopatologia generale
Patologia molecolare
Chimica dei Composti Eteroc.
Biologia Molecolare
BIO\10
BIO\15
BIO\15
BIO\10
BIO/14
MED/05
MED/04
MED/04
CHIM/06
BIO\11
III Trimestre
Tossicologia
Chimica farmaceutica Applicata
Tossicologia Cellulare
BIO\14
CHIM/09
BIO/14
PROPEDEUTICITÀ DI FREQUENZA E DI ESAME PER
IL CORSO DI LAUREA SPECIALISTICA IN CHIMICA
E TECNOLOGIA FARMACEUTICHE.
La frequenza alle lezioni è obbligatoria. In mancanza di essa il docente non
concederà la firma di frequenza necessaria per poter sostenere l’esame. Le
propedeuticità degli esami sono da intendersi come propedeuticità di
frequenza nel senso che per poter sostenere l’esame è necessario aver
frequentato i corsi propedeutici indicati in tabella. La frequenza ai corsi
richiesti è certificata dalla firma del docente sul libretto universitario. La
frequenza ad un corso pluriennale è ammessa solo se lo studente ha ottenuto
almeno la firma di frequenza del corso con numero ordinale minore. (es: per
frequentare le lezioni di Chimica Organica II è necessario avere almeno la
firma di frequenza delle lezioni di Chimica Organica I.) Gli esami
pluriennali devono essere sostenuti nell’ordine numerale previsto.
17
- Chimica e Tecnologia Farmaceutiche -
PROPEDEUTICITA’
Corso di Laurea Specialistica in C.T.F
(Vecchio Ordinamento)
ANNO
INSEGNAMENTI
IV
IV
Biochimica applicata
Farmacologia e
Farmacoterapia
IV
Tecnologia socioeconomia e
legislazione farmaceutiche
PROPEDEUTICITA’
Biochimica
Biochimica; Farmacologia e
Farmacognosia; Tossicologia I;
Fisiologia generale I;
Chimica farmaceutica e
tossicologica I
Corso di Laurea Specialistica in C.T.F.
(Nuovo Ordinamento)
ANNO INSEGNAMENTI
I
I
Microbiologia generale
Chimica fisica
I
Chimica analitica I
II
Analisi dei medicinali
II
Analisi dei farmaci I
II
II
II
Chimica organica I
Biochimica I
Fisiologia generale I
PROPEDEUTICITA’
Biologia animale
Chimica generale ed inorganica;
Fisica
Chimica generale ed inorganica;
Matematica
Chimica generale ed inorganica;
Chimica analitica I
Analisi dei medicinali ; Chimica
analitica II
Chimica generale ed inorganica
Chimica organica II
Fisica; Biochimica I; Anatomia
umana
CURRICULUM BIOTECNOLOGICO
III
III
Chimica farmaceutica e
tossicologica I
Metodi fisici in chimica
organica I
Chimica organica I
Chimica fisica; Chimica
organica II
18
- Chimica e Tecnologia Farmaceutiche III
III
III
III
IV
IV
IV
IV
IV
IV
IV
V
V
V
V
Farmacologia e Farmacognosia Biochimica II, Fisiologia
generale II
Chimica farmaceutica applicata Chimica farmaceutica e
tossicologica II; Chimica
organica III; Tecnologia
socioeconomia e legislazione
farmaceutiche II
Patologia generale I
Microbiologia generale;
Anatomia umana
Fitochimica
Chimica organica I; Biochimica
I
Chimica delle sostanze
Chimica organica II
organiche naturali
Farmacologia e Farmacoterapia Farmacologia e Farmacognosia
Farmacologia cellulare e
Farmacologia e Farmacoterapia
molecolare
Neuropsicofarmacologia
Farmacologia e Farmacoterapia
Oncologia
Patologia generale II
Biochimica applicata
Biochimica II
Tecnologia socioeconomia e
Chimica farmaceutica e
legislazione farmaceutiche I
tossicologica III; Chimica
organica II
Tossicologia
Farmacologia e Farmacoterapia
Fitofarmacia
Metodi fisici in chimica
organica II
Patologia cellulare ed
Patologia generale II
ultrastrutturale
Metodologie biochimiche
Biochimica II
CURRICULUM INNOVAZIONE DEL FARMACO
III
III
III
III
III
Chimica farmaceutica e
tossicologica I
Metodi fisici in chimica
organica I
Farmacologia e Farmacognosia
Chimica organica I
Fisica; Chimica fisica; Chimica
organica II
Biochimica II; Microbiologia
generale; Anatomia umana;
Fisiologia generale II
Farmacologia e Farmacoterapia Farmacologia e Farmacognosia
Chimica farmaceutica applicata Chimica farmaceutica e
tossicologica II; Chimica
organica III; Tecnologia
socioeconomia e legislazione
farmaceutiche II
19
- Chimica e Tecnologia Farmaceutiche III
Patologia generale I
III
Fitochimica
III
Stereochimica
IV
Neuropsicofarmacologia
IV
IV
IV
Oncologia
Biochimica applicata
Tecnologia socioeconomia e
legislazione farmaceutiche I
Tossicologia
IV
V
V
V
V
V
V
V
V
V
Microbiologia generale;
Anatomia umana
Chimica organica II; Biochimica
II
Chimica organica II
Chimica delle sostanze
organiche naturali
Farmacologia cellulare e
molecolare
Metodologie biochimiche
Chimica biorganica
Laboratorio di chimica
organica
Sintesi e tecniche speciali
organiche
Polimeri di interesse
farmaceutico II
Veicolazione e direzionamento
dei farmaci
Farmacocinetica e metabolismo
dei farmaci
20
Farmacologia e Farmacognosia;
Farmacologia e Farmacoterapia
Patologia generale II
Biochimica II
Chimica farmaceutica e
tossicologica III;
Farmacologia e Farmacognosia;
Farmacologia e Farmacoterapia
Chimica organica II
Farmacologia e Farmacognosia;
Farmacologia e Farmacoterapia
Biochimica II
Chimica organica II
Chimica organica II
Chimica organica II
Chimica organica II
Tecnologia socioeconomia e
legislazione farmaceutiche II
Chimica farmaceutica e
tossicologica III; Tecnologia
socioeconomia e legislazione
farmaceutiche II; Farmacologia
e Farmacoterapia
- Chimica e Tecnologia Farmaceutiche -
PIANI DI STUDIO
Ai sensi dell’art. 2 della legge 11 dicembre 1969, n 910 e dell’art. 4 della
legge 30 novembre 1970, n. 924, lo studente può presentare un piano di
studi diverso da quello consigliato dalla Facoltà. Il Consiglio di Corso di
Laurea valuterà la congruità del piano di studi proposto dallo studente con il
raggiungimento degli obiettivi didattico formativi previsti.
TESI ED ESAME DI LAUREA
La preparazione della tesi sperimentale dura tra 1 e 1,5 anni mentre la
preparazione della tesi compilativa dura almeno 6 mesi. Lo studente
produce domanda di accesso in tesi quando possiede i seguenti requisiti:
a) Lo studente ha acquisito almeno 200 crediti previsti dal piano di studio
incluse le attività formative autorizzate dal CCL ed escluse le attività di
tirocinio;
b) I 200 crediti acquisiti devono contenere i crediti relativi alla materia in cui
si chiede di preparare la tesi.
c) Nella domanda per l’accesso in tesi lo studente indicherà: il docente con
cui intende svolgere il lavoro di tesi e la materia nel cui ambito richiede la
tesi.
d) L’accesso alle tesi compilative non richiede l’acquisizione dei crediti del
tirocinio professionale, che viene concordato con il docente relatore della
tesi.
Gli studenti del vecchio ordinamento presentano la domanda per l’accesso
in tesi quando mancano di 4 esami per il completamento del piano di studio
ed hanno superato l’esame fondamentale dell’orientamento prescelto
nonché le materie dell’ambito disciplinare in cui chiedono la tesi. Per essere
ammesso all’esame di Laurea lo studente deve aver superato l’esame di tutti
gli insegnamenti comuni e di quelli previsti dall’orientamento scelto. Lo
studente, inoltre, sarà tenuto a dimostrare di aver appreso l’inglese
scientifico ed una eventuale seconda lingua in accordo a quanto proposto
dal Consiglio di Corso di Laurea. La conoscenza verrà verificata attraverso
un colloquio da tenersi entro il terzo anno. Esso sarà regolarmente
verbalizzato da una commissione che potrà comprendere il lettore di lingua
attribuito alla Facoltà di Farmacia. Il voto finale di Laurea, terrà conto del
curriculum didattico dello studente, della validità del contenuto della tesi
sperimentale e della sua esposizione.
21
- Chimica e Tecnologia Farmaceutiche -
TIROCINIO
Gli studenti del Corso di Laurea Specialistica in Chimica e Tecnologia
Farmaceutiche devono svolgere attività di tirocinio presso una Farmacia
aperta al pubblico o presso una Farmacia delle Aziende Ospedaliere e delle
Aziende Sanitarie Territoriali con cui la Facoltà di Farmacia ha stipulato
convenzioni che regolano l’attività di formazione e di orientamento per gli
studenti. Il tirocinio deve essere espletato per tre mesi durante il quarto anno
e per tre mesi durante il quinto anno del Corso di studio oppure potrà essere
espletato in un’unica soluzione al quarto anno per una durata di sei mesi
anche in funzione della tipologia di tesi prescelta. L’espletamento di tale
attività della durata di 750 ore, comporta l’assegnazione di 30 crediti
formativi universitari necessari per il conseguimento della laurea.
22
- Chimica e Tecnologia Farmaceutiche -
PROGRAMMI DEL
CORSO DI LAUREA SPECIALISTICA
IN CHIMICA E TECNOLOGIA FARMACEUTICHE
23
- Chimica e Tecnologia Farmaceutiche -
MATEMATICA
Obiettivi formativi
Il corso ha lo scopo di: fare acquisire i lineamenti essenziali del pensiero
matematico; in particolare: linguaggio artificiale e rigoroso, chiarezza di
concetti e di esposizione, soluzione di problemi della realtà sensibile,
astrazione, metodo costruttivo e assiomatico deduttivo; introdurre all'uso
consapevole del calcolatore elettronico.
Programma
Parte 1: I numeri naturali. Multipli e divisori in N. Numeri primi e
composti. Il principio di induzione matematica. L’insieme dei numeri
relativi. Le operazioni in Z. Relazioni di uguaglianza e disuguaglianza in Z.
Strutture algebriche. Semigruppi, monoidi, gruppi. Relazione di equivalenza
e di ordine. L’insieme dei numeri razionali. Ordine e densità dei numeri
razionali. I numeri irrazionali. I numeri reali. Potenze ad esponente
razionale. Spazi vettoriali. Lo spazio Rn. Rappresentazione geometrica dello
spazio R2. Riferimento cartesiano nel piano. Piano euclideo. L’equazione
della retta. Parallelismo e perpendicolarità tra rette del piano. Luoghi
geometrici. Matrici e operazioni tra matrici. Il Calcolatore. Il linguaggio
MatCos. Istruzioni di immissione ed emissione dei dati. Istruzioni di
assegnazione. Istruzioni condizionali. Il ciclo. Istruzioni generiche. Il piano
cartesiano in MatCos. Matrici e vettori in MatCos.
Parte 2: Funzioni reali. Lo spazio vettoriale delle funzioni reali. Funzione
composta e funzione inversa. Le funzioni in MatCos: lettura e calcolo. Il
grafico di una funzione con il calcolatore. Funzioni crescenti, decrescenti,
pari, dispari. L’insieme R ampliato. Intervalli. Intorni. Limiti di funzioni
reali e proprietà. Funzioni continue. Il teorema degli zeri. Il metodo di
bisezione in MatCos.. Funzioni ed equazioni razionali intere e fratte.
Funzioni ed equazioni esponenziali. La funzione logaritmica. Equazioni
logaritmiche. Funzioni circolari e loro proprietà. Le funzioni circolari in
MatCos. Sistemi di equazioni. Soluzione dei sistemi lineari. Matrici e
sistemi lineari. Operazioni elementari e matrici elementari. Il metodo di
Gauss.
Parte 3: Derivata di una funzione in un punto e applicazioni. Regole di
derivazione. La derivata in MatCos. Massimi e minimi di una funzione.
Funzioni monotone derivabili. Le derivate successive. Convessità e
concavità. Forme indeterminate. Regole di de L'Hopital. Asintoti. Integrali.
L'integrale delle funzioni non negative. Proprietà dell'integrale definito.
L'integrale di funzioni continue e negative. Integrazione per parti e per
sostituzione. Integrazione delle funzioni razionali. Calcolo approssimato di
24
- Chimica e Tecnologia Farmaceutiche integrali. La formula dei rettangoli.
Parte 4: Unità atistiche. Popolazione. Campione. Fasi di un'indagine
statistica. Rappresentazioni tabellari e frequenze. Rappresentazioni grafiche.
Misure di centralità e di dispersione. Il campo di variazione. Distribuzioni
bivariate di frequenze. Frequenze relative e distribuzioni condizionate.
Rappresentazioni grafiche. Medie e varianze marginali. Dipendenza
statistica. Misure di dipendenza lineare o correlazione. Determinazione
della retta di regressione col metodo dei minimi quadrati.
TESTI CONSIGLIATI
-Francesco Costabile, Lezioni di Istituzioni di Matematiche I, II, III Modulo
Liguori Editore
CHIMICA GENERALE ED INORGANICA
Obiettivi formativi
Il principale obiettivo del corso è quello di fornire una adeguata conoscenza
della chimica generale ed inorganica, cercando in una prima di fase di
ampliare le nozioni di base scolastiche. Attraverso l’approfondimento di
fondamentali argomenti quali la struttura atomica ed il legame chimico, si
intende fornire agli studenti lo strumento concettuale per gettare un ponte
tra ciò che si percepisce e ciò che si immagina succeda. In sintesi, la scelta
dei contenuti è orientata a far sì che gli studenti riescano a comprendere i
fenomeni rifacendosi ad atomi, molecole e reazioni chimiche.
Programma
I parte (atomi, molecole e proprietà periodiche): Stechiometria e
fondamenti della teoria atomica (le origini della teoria atomica,
determinazione di pesi atomici e formule molecolari, concetto di mole,
equazioni chimiche, calcoli stechiometrici, nomenclatura chimica). Struttura
atomica (natura elettrica della materia, la struttura dell'atomo, origini della
teoria quantistica, il modello di Bohr, l'atomo di idrogeno, numeri quantici,
atomi polielettronici). Il legame chimico (parametri della struttura
molecolare, legami ionici, legami covalenti, orbitali atomici e molecolari,
geometria molecolare, polarità dei legami, legami multipli, legame
metallico, legame ad idrogeno). Orbitali atomi, orbitali ibridi, strutture di
Lewis, e teoria VSEPR. Proprietà periodiche (la tavola periodica, potenziali
di ionizzazione, affinità elettronica, elettronegatività, raggi atomici e ionici).
II parte (equilibri in soluzione): L’atmosfera e le leggi dei Gas (gas
ideali e gas reali; forze intermolecolari di Van der Waals). Liquidi e
25
- Chimica e Tecnologia Farmaceutiche Soluzioni (soluzioni ideali e non, proprieta' delle soluzioni, solubilita', unita'
di misura per le concentrazioni). Equilibrio chimico (natura dell'equilibrio
chimico, la costante di equilibrio, principio di Le Chatelier, calcoli con le
costanti di equilibrio). Equilibri ionici in soluzione acquosa (acidi e basi,
sali a carattere acido e basico, sali poco solubili, soluzioni tampone,
titolazioni acido-base). Reazioni di Ossido-Riduzione (stati di ossidazione,
concetto di semireazione redox, bilanciamento di reazione Redox, calcoli
numerici). Gli elementi del blocco d : i metalli di transizione. Proprietà.
Complessi inorganici: teoria del campo cristallino. Geometrie e strutture in
complessi inorganici.
TESTI CONSIGLIATI
-P. Atkins, L. Jones, Chimica Generale, Zanichelli;
-D. A. MacQuarrie, P. A. Rock, Chimica Generale, Zanichelli
-A.M. Manotti Lanfredi, A. Tiripicchio, Fondamenti di Chimica, Casa
Editrice Ambrosiana
-R. Breschi, A. Massagli, Stechiometria, ETS/Pisa
-P. Michelin Lausarot, G. A. Vaglio, Fondamenti di Stechiometria, Piccin
CHIMICA ANALITICA I
Obiettivi formativi
Si affronta in modo sistematico lo studio degli equilibri ionici in soluzione
acquosa che è di importanza fondamentale per le successive applicazioni in
volumetria e gravimetria.
Programma
Unità di concentrazione
Equilibrio chimico: Reazioni reversibili e irreversibili- - Energia libera e
costanti di equilibrio- Espressioni di equilibrio per vari tipi di reazioneFattori che influenzano le costanti di equilibrio- Importanza dei calcoli di
equilibri
Attività e coefficienti di attività: Attività ed espressioni di equilibrioLa forza ionica di una soluzione- Coefficienti di attività degli ioni e dei
soluti molecolari- Attività e calcoli di equilibrio
Teoria dei sistemi acido-base: La forza degli acidi e delle basiConcetto di soluzione neutra- Concetto di pH e calcoli stechiometriciSoluzioni di acidi e basi forti- Grado di dissociazione
Acidi monobasici e basi monoacide: Soluzioni contenenti un acido
debole- Soluzioni contenenti una base debole- Soluzioni contenenti una
26
- Chimica e Tecnologia Farmaceutiche coppia coniugata acido-base- Soluzioni tampone
Acidi polibasici e basi poliacide: Soluzioni contenenti un acido
diprotico- Soluzioni contenenti un acido poliprotico- Composizione di una
soluzione contenente un acido poliprotico in funzione del pH- Soluzioni
contenenti una base poliacida- Soluzioni di anfoliti
Miscele acido base: Miscele di acidi- Miscele di acidi e basi
Equilibri di precipitazione: Fattori che influenzano la solubilità degli
elettroliti- Solubilità e prodotto di solubilità- Fattori che influenzano la il
prodotto di solubilità- Leggi della precipitazione- Precipitazione selettivaPurezza dei precipitati –Adsorbimento
Titolazioni acido-base: Titolazioni di acidi forti con basi fortiTitolazioni di acidi deboli monoprotici con basi forti- Titolazione di basi
deboli monoacide con acidi forti- Titolazioni di acidi deboli con basi debolierrori di titolazione- potere tampone.
TESTI CONSIGLIATI
-Freiser &Fernando,Equilibri ionici nella chimica analitica, Piccin
FISICA
Obiettivi formativi
L’obiettivo formativo che s’intende perseguire è quello di garantire
l’acquisizione e lo sviluppo di una consapevolezza scientifica attraverso lo
studio di diversi fenomeni fisici e la risoluzione di esercizi esplicativi.
Programma
Introduzione e misure: Le grandezze fondamentali, sistemi di unità di
misura, grandezze derivate e loro unità di misura.
Richiami di matematica: Fondamenti di trigonometria, di calcolo
differenziale ed integrale, calcolo vettoriale, operazioni tra vettori,
coordinate polari e cartesiane.
Cinematica: Descrizione sperimentale del moto di un corpo, moto
rettilineo uniforme, moto uniformemente accelerato, velocità ed
accelerazione istantanea, le equazioni del moto in una dimensione, caduta
libera dei gravi, moto di un proiettile in due dimensioni.
Leggi del moto di Newton: Prima legge del moto di Newton, terza legge
del moto di Newton, seconda legge del moto di Newton, il piano inclinato,
attrito.
Moto circolare uniforme: Moto circolare uniforme, accelerazione
27
- Chimica e Tecnologia Farmaceutiche centripeta, forza centripeta, forza centrifuga, legge di gravitazione
universale, moto dei satelliti.
Energia e sua conservazione: Energia, lavoro, potenza, energia
potenziale gravitazionale, energia cinetica.
Quantità di moto e sua conservazione: Quantità di moto, principio di
conservazione della quantità di moto, impulso, urti in una dimensione, urti
perfettamente elastici, urti anelastici, urti perfettamente anelastici, urti in
due dimensioni.
Moto rotatorio: Cinematica del moto rotatorio, energia cinetica di
rotazione, momento d’inerzia, legge di Newton per il moto rotatorio,
dinamica del moto rotatorio, momento della quantità di moto e sua
conservazione, moto rototraslatorio.
Elasticità: Legge di Hooke per una molla, energia potenziale di una molla,
conservazione dell’energia ed oscillazione di una molla.
Fluidi: Massa volumica, pressione, principio di Pascal, legge di Stevino,
principio di Archimede, l’equazione di continuità, teorema di Bernouilli, il
venturimetro, efflusso di un liquido attraverso un orifizio.
Elettrostatica: Separazione della carica elettrica per strofinio, pendolino
elettrostatico, struttura atomica, l’elettroscopio, conduttori ed isolanti,
elettrizzazione per induzione, legge di Coulomb, il campo elettrico, il
campo elettrico di una carica puntiforme, flusso del campo elettrico,
teorema di Gauss, circuitazione del campo elettrostatico, sovrapposizione di
campi elettrici, il campo elettrico di due cariche omonime ed eteronime, il
campo elettrico di una lamina conduttrice, il campo elettrico di due lamine
conduttrici cariche parallele, energia potenziale elettrica e potenziale
elettrico, potenziale di una carica puntiforme, sovrapposizione dei
potenziali, dinamica di una particella carica in un campo elettrico.
Correnti elettriche e circuiti in corrente continua: Corrente
elettrica, legge di Ohm, resistività elettrica, variazione della resistività con
la temperatura, potenza dissipata da un circuito, resistori in serie, resistori in
parallelo, f.e.m. e resistenza interna di una batteria, i principi di Kirchhoff.
Capacità: Il condensatore piano, energia accumulata in un condensatore,
condensatori in serie, condensatori in parallelo, condensatori con un
dielettrico tra le armature.
Magnetismo: Forza agente su una carica elettrica in un campo magnetico,
definizione dell’induzione magnetica, forza agente su un conduttore
percorso da una corrente elettrica ed immerso in un campo magnetico, forza
agente tra conduttori paralleli percorsi da corrente, legge di Biot-Savart,
teorema di Ampere, solenoide, campo magnetico all’interno di un
solenoide, magneti permanenti e magneti atomici.
Induzione elettromagnetica: Flusso magnetico, teorema di Gauss per il
magnetismo, f.e.m. mozionale e legge di Faraday-Neumann dell’induzione
28
- Chimica e Tecnologia Farmaceutiche elettromagnetica, legge di Lenz.
TESTI CONSIGLIATI
-Peter J. Nolan: Fondamenti di Fisica 2 ediz.- Ed. Zanichelli, Bologna .
-J.P. Hurlay e C. Garrod: Fisica.- Ed. Zanichelli, Bologna.
BIOLOGIA ANIMALE
Obiettivi formativi
Fornire un’introduzione allo studio della Biologia Animale. Conoscenza
delle metodiche di base nell’utilizzo di colture cellulari per trattamenti
farmacologici.
Programma
Diversificazione degli organismi viventi: Organizzazione generale di
eucarioti
Chimica della cellula: Glucidi, lipidi, proteine, acidi nucleici
Problema energetico delle cellula: Metabolismo cellulare, reazioni
anaboliche e cataboliche, respirazione cellulare
Le membrane e la compartimentazione cellulare: Composizione
chimica, organuli cellulari (reticolo endoplasmico liscio e rugoso, apparato
del Golgi), lisosomi
Mitocondri: Struttura, funzione, ciclo di Krebs, catena respiratoria,
fosforilazione ossidativa
Meccanismi di trasporto attraverso le membrane: Diffusione
semplice e facilitata, trasporto attivo, endo ed esocitosi
Citoscheletro: Microtubuli, microfilamenti, filamenti intermedi
Genetica: Mendeliana. Basi cromosomiche e molecolari della ereditarietà
DNA: Replicazione, mutazioni, riparazione
Sintesi proteica: Trascrizione, -mRNA -tRNA -rRNA, ribosomi, codice
genetico, traduzione
Caratteristiche del genoma degli eucarioti: Cromosomi, istoni,
nucleosomi, proteine non istoniche
Meccanismi di controllo dell’espressione genica negli eucarioti:
Fattori e sequenze di controllo della trascrizione, caratteristica dei fattori di
trascrizione, controllo velocità di traduzione dello mRNA
Ciclo cellulare negli eucarioti: Mitosi, meiosi, proto-oncogeni,
oncogeni, oncorepressori
29
- Chimica e Tecnologia Farmaceutiche -
TESTI CONSIGLIATI
-Geoffrey Cooper: La Cellula – Ed. Zanichelli
INGLESE
Obiettivi formativi
Il corso si propone di fornire allo studente uno strumento linguistico ricco e
completo per operare con professionalità e competenza. Il corso prevede un
momento intensivo per Beginners - Pre-Intermediate - Intermediate.
L’insegnamento si avvale delle più aggiornate tecnologie linguistiche:
laboratorio linguistico, internet, audiovisivi. Il corso formativo si compone
di 5 CFU.
Programma
Beginners: Treatment of Grammar. Reading, Writing, Listening,
Speaking. Systematic Vocabulary work with dictionary training. Everyday
Social English.. Activities: Science in the News. Internet. Science
textbooks.
Pre-intermediate: In depth treatment of Grammar, reading, writing,
listening, speaking. Classifying analysing and evaluating information. Every
day. English. Systematic Vocabulary, syllabus.
Intermediate: Detailed Treatment of Grammar for Scientific Purposes
(ESP). Thorough skills syllabus. Useful everyday English.
TESTI CONSIGLIATI
-English Grammar, Zanichelli 1991
-How English Works, Oxford 1997
-English Grammar Practice, MacMillan Heineman 1999
-Basic English Grammar With Exercises, Oxford English 1990
-Science in the News, Rubbettino 2002
-New Headway: Beginners, Pre-intermediate, Intermediate, Oxford 2000
BIOLOGIA VEGETALE
Obiettivi formativi
Il corso si propone di dare le nozioni di biologia vegetale che consentano di
capire quali sono le possibili interazioni fra i prodotti chimici impiegati
dall'uomo ed il mondo vegetale; essendo il mondo vegetale un'entità non
30
- Chimica e Tecnologia Farmaceutiche omogenea, il corso si sviluppa in maniera sistematica, utilizzando i più
modemi schemi di classificazione per evidenziare le affinità e le differenze
che i diversi tipi di organismi presentano nella loro biologia.
Programma
Introduzione alla biologia vegetale: Cosa è la biologia vegetale e di
cosa si occupa; definizione delle unità viventi e delle funzioni essenziali; la
cellula come minima unità vivente: componenti essenziali e funzioni
elementari; elementi di sistematica; introduzione alla tassonomia ed ai
sistemi di classificazione; divisione degli organismi viventi in cinque Regni;
il cielo ontogenetico: elementi essenziali e differenti tipi di cielo; aspetti
generali sulla morfologia, sul nietabolismo, sulla fisiologia, sullo sviluppo e
sulla riproduzione degli organismi vegetali.
Regno prokaryotae: Aspetti generali sulla biologia e sulle interazioni
con le attività umane; la variabilità del metabolismo; caratteri differenziali
rispetto agli altri Regni; classificazione e caratteri differenziali in
Archaebacteria ed Eubacteria; esempi di Prokaryotae utili o dannosi per
l'uomo.
La cellula eucariota vegetale: Caratteri differenziali della cellula
eucariota; il nucleo; la parete primaria e quella secondaria; la membrana
cellulare ed i meccanismi di trasporto; i sistemi di membrane interni: il
reticolo endoplasmatico, l'apparato del Golgi, i vacuoli; il citoplasma e la
glicolisi; i mitocondri e la respirazione cellulare; altri tipi di metabolismo
energetico; il piastidio: genesi e differenziazione nei diversi tipi; la
fotosintesi clorofilliana: il fotosistema, la fase luminosa, la fase oscura,
ciclo C3, ciclo C4, metabolismo CAM.
Regno protoctista: Definizione ed aspetti generali; suddivisione in
autotrofi (alghe) ed eterotrofi (funghi primitivi); aspetti generali di
morfologia e biologia ed esempi di Protoctista eterotrofi: muffe
mucillaginose (Acrasiomycota, Myxomycota, Plasmodiophoromycota),
Chytridiomycota; Oomycota; definizione, aspetti generali ed esempi di
Protoctista autotrofi: monocellulari (Euglenophyta, Haptophyta, Dinophyta,
Cryptophyta);
Rhodophyta;
Chlorophyta;
Heterokontophyta:
Chrysophyceae, Xanthophyceae, Bacillariophyceae; Phaeophyceae.
Regno fungi: Definizione ed aspetti generali dell'organizzazione, del
metabolismo, della riproduzione e dell'importanza per l'uomo;
classificazione; Zygomycota: definizione, aspetti generali di morlogia e
biologia; Ascomycota: caratteri differenziali, ciclo ontogenetico, e
classificazione; Basidionlycota: caratteri differenziali, ciclo ontogenetico e
classificazione.
Regno plantac: Definizione, aspetti generali e classificazione; Bryophyta,
31
- Chimica e Tecnologia Farmaceutiche caratteri differenziali e aspetti del cielo; Tracheophyta: definizione ed
esempi di classi di pteridofitae (piante senza seme: Filicopsida), di
gimnosperme (piante a seme nudo: Coniferopsida) e di angiospenne (piante
a fiore: Magnoliopsida e Liliopsida); fonnazione e maturazione del polline;
macrosporogenesi, somatogenesi ed enibriogenesi; il sente e la
germinazione; tessuti embrionali, tegumentali, parenchimatici, conduttori e
meccanici; radice: apice radicale, ontogenesi, struttura primaria e
secondaria; fusto: apice vegetativo, gemme, ontogenesi del fusto, struttura
primaria, struttura secondaria, legno omoxilo e legno eteroxilo; foglia:
bozze foliari, ontogenesi e struttura; il fiore e le sue componenti; fattori
interni ed estemi nell'ontogenesi delle piante: ormoni vegetali, tropismi,
movimenti delle piante; fisiologia: assorbimento e trasporto dei liquidi e dei
soluti nella pianta, scambi gassosl'con l'ambiente estemo, macro- e
micronutrienti, sostanze fondamentali e sostanze naturali.
TESTI CONSIGLIATI
-Raven P.H., Evert R.F., Curtis H., Biologia delle piante. Ed. Zanichelli.
-Srasburger E., Trattato di botanica. Vol. I-II. Ed. Delfino A.,Roma
-Margulis L., Schwartz K. L., Five kingdoms: an illustrated guide to the
phyla of life on Earth. W.H. Ed. Freeman & Co.
-Maugini E., Manuale di botanica farmaceutica. Ed. Piccin Nuova Libraria.
CHIMICA FISICA
Obiettivi formativi
La scelta degli argomenti di lezione è in sintonia con le peculiari finalità
culturali dei corsi di laurea e con la propedeuticità della Chimica Fisica
rispetto alle discipline di forma professionale. Il criterio pratico a cui ci si è
riferiti è quello di garantire una preparazione adeguata a comprendere gli
argomenti chimico-fisici che hanno maggiore rilevanza nell'esercizio della
professione e nelle attività di ricerca dei settori a cui principalmente guarda
il corso di laurea e cioè quello chimico-farmaceutico di sintesi e
caratterizzazione dei farmaci, quello biochimico e quello farmacologico. In
sintesi, la scelta dei contenuti è orientata a far capire l'importanza della
Chimica Fisica come disciplina propedeutica a quasi tutte le successive che
utilizzano, in ampia misura, concetti, strumenti e metodi chimico-fisici.
Programma
Le leggi empiriche dei gas e il modello di gas ideale: Le leggi
empiriche (Charles, Gay Lussac, Boyle). Concetto empirico di temperatura
32
- Chimica e Tecnologia Farmaceutiche assoluta. L’equazione di stato per il gas ideale. Elementi di teoria cinetica
dei gas. Derivazione teorica dell'equazione di stato del gas ideale. Le
miscele gassose a comportamento ideale.
Il comportamento dei gas reali: Le deviazioni dal comportamento
ideale e la loro origine. Le isoterme di un gas reale e le costanti critiche.
L’equazione di Van der Waals e le sue caratteristiche.
Termodinamica chimica: 1° principio e termochimica: Generalità
e scopi della termodinamica chimica. Trasferimento di energia fra un
sistema e l'ambiente. Lavoro associato a variazione di volume. Il calore.
Definizione della temperatura. Prima definizione di funzione di stato.
Energia interna di un sistema. Il 1° principio della termodinamica. La
funzione energia interna, U. La convenzione dei segni. Applicazioni e
conseguenze del 1° principio. Esperienza di Joule. Calore specifico e molare
a volume costante. La funzione di stato entalpia, H. Calore specifico e
molare a pressione costante. Relazione fra Cp e Cv. .Dipendenza dei calori
specifici dalla temperatura. Concetto di trasformazione reversibile del gas
ideale. Espansione isoterma e reversibile del gas ideale. Espansioni isoterme
e irreversibili del gas ideale. Espansione adiabatica e reversibile del gas
ideale. L’equazione di Kirchoff. Stati di riferimento e stati standard. Calore
di formazione di una specie chimica. La legge di Hess.
Termodinamica chimica: 2°
principio: Prima definizione
dell'entropia e 2° principio. Variazioni entropiche in trasformazioni
reversibili e irreversibili. Il ∆S totale come criterio per stabilire la
spontaneità di una trasformazione. La funzione di stato energia libera, G. Il
∆G come criterio per stabilire la spontaneità di una trasformazione.
Significato fisico della funzione G. Calcolo dei ∆G di reazioni chimiche.
Variazione dell'energia libera al variare della temperatura: l'equazione di
Gibbs-Helmholtz.
Termodinamica chimica: i potenziali chimici e la 1egge
dell'equilibrio chimico: Il potenziale chimico. L’espressione del
potenziale chimico per il gas ideale e per le miscele di gas a comportamento
ideale. Cenni sul potenziale chimico per i gas reali e sulla fugacità. La
derivazione termodinamica della legge dell'equilibrio chimico. Relazione
fra ∆G e Kp. Influenza della pressione sulla posizione dell'equilibrio. La
costante di equilibrio in funzione delle concentrazioni, Kc. Relazione fra Kp
e Kc. Influenza della temperatura sulla costante di equilibrio: equazione di
Van't Hoff.
Equilibrio di fase: Equazione di Clausius-Clapeyron. Applicazione
dell'equazione di Clapeyron ai vari passaggi di stato. La regola delle fasi.
Applicazioni della regola delle fasi.
Equilibri in soluzione: Il modello di soluzione ideale e la legge di
Raoult. I potenziali chimici nell’equilibrio liquido-vapore. Soluzioni diluite
33
- Chimica e Tecnologia Farmaceutiche e legge di Henry. Soluzioni reali: attività e coefficiente di attività. Equilibri
in soluzione. Distillazione. Liquidi parzialmente miscibili. Interpretazione
termodinamica delle proprietà colligative. La pressione osmotica e la
determinazione delle masse molari di enzimi e composti macromolecolari
Elementi di cinetica chimica: Velocità di reazione. Ordine di reazione.
Costante di velocità. Reazioni del primo ordine. Reazioni del secondo
ordine e successive. Metodi per stabilire l'ordine di una reazione. Il tempo di
dimezzamento. Dipendenza delle costanti di velocità dalla temperatura.
Fondamenti di meccanica quantistica e spettroscopica: Evidenze
sperimentali non interpretabili in termini di fisica classica. Radiazione del
corpo nero. Effetto fotoelettrico. Diffrazione degli elettroni. Spettri atomici.
Postulati della meccanica quantistica. Equazione di Schrodinger. Principio
di indeterminazione. La struttura degli atomi e delle molecole.
Spettroscopia molecolare. Spettroscopia vibrazionale e rotazionale. Spettri
elettronici. La risonanza magnetica nucleare.
TESTI CONSIGLIATI
-Peter W Atkins: Elementi di Chimica Fisica 2 ediz.- Ed. Zanichelli,
Bologna 2000.
-Peter W. Atkins: Chimica Fisica 3 ediz.- Ed. Zanichelli, Bologna 1997.
CHIMICA ANALITICA II
Obiettivi formativi
L’obiettivo del corso è quello di fornire allo studente un’introduzione ai
principi fondamentali delle principali tecniche analitiche strumentali, quali
la spettroscopia, l’elettrometria e la cromatografia. Il corso si propone
inoltre di trasmettere l’importanza della strumentazione nel risolvere i
problemi analitici, e a comprendere nello stesso tempo i limiti delle
misurazioni in termini di sensibilità ed accuratezza. Saranno fornite le basi
per l’applicazione delle tecniche studiate all’analisi di campioni reali e per
la valutazione statistica dei dati sperimentali.
Programma
Nozioni di base: La chimica analitica applicata al dosaggio dei farmaci:
obiettivi e suddivisione del corso. Suddivisione dei metodi analitici
strumentali. Trattamento del campione.
Elaborazione dei dati: Analisi replicata. Indici di posizione. Indici di
accuratezza e precisione. Errori casuali e sistematici. Test di significatività.
t-test. F-test. Analisi regressionale.
34
- Chimica e Tecnologia Farmaceutiche -
Analisi chimica strumentale: Trattamento del segnale.
Potenziometria: Forza elettromotrice. Misura della f.e.m. Elettrodi di
riferimento: Elettrodo ad idrogeno, calomelano, calomelano saturo,
Ag/AgCl. Elettrodi indicatori metallici di prima, seconda specie e redox.
Elettrodi indicatori a membrana. Elettrodo a vetro, elettrodo combinato,
errore alcalino. Definizione e determinazione potenziometrica del pH.
Ionometri selettivi. Taratura elettrodi.
Spettrofotometria: Generalità sulle tecniche spettroscopiche. Radiazione
elettromagnetica, teoria ondulatoria e corpuscolare. Spettro lettromagnetico.
Transizioni elettroniche. Trasmittanza e Assorbanza. Legge di LambertBeer. Assorbività. Spettro di assorbimento. Cromofori. Analisi qualitativa.
Analisi quantitativa, scelta della lunghezza d'onda, retta di taratura. Analisi
di miscele. Strumentazione: colorimetri, spettrometri, spettrofotometri.
Sorgenti di radiazione. Monocromatori. Contenitori campione. Rivelatori,
rivelatore a serie di diodi. Spettrofotometri a singolo e doppio raggio.
Cromatografia: Generalità sulle tecniche cromatografiche. Componenti
di un sistema cromatografico, fase stazionaria, fase mobile. Applicazioni
analitiche ed estrattive. Coefficiente di didtribuzione. Velocità di igrazione.
Cromatogramma. Teoria dei piatti cromatografici. Teoria della velocità
cromatografica. Equazione di Van Deemter. Risoluzione. Classificazione
delle tecniche cromatografiche. Meccanismi di separazione: adsorbimento,
ripartizione, scambio ionico, esclusione, affinità. Cromatografia su strato
sottile. Serie eluotropa. Cromatografia su carta. Densitometria.
Cromatografia su colonna. Gascromatografia. Cromatografia isoterma e
programmata. Cromatografia liquida ad alte prestazioni. Eluizione
isocratica e gradiente. Analisi qualitativa e quantitativa in cromatografia
strumentale.
TESTI CONSIGLIATI
-Farmacopea Ufficiale della Repubblica Italiana (IX Ed.)
-D.C. Harrys: Chimica analitica quantitativa - Ed. Zanichelli
-D. Skoog, D. West: Chimica analitica - Ed S.E.S.
-H.H. Bauer et al.: Analisi strumentale - Ed. Piccin
MICROBIOLOGIA GENERALE
Obiettivi formativi
Fornire le conoscenze di base sulle caratteristiche strutturali e funzionali dei
microrganismi. Evidenziare la natura e l’importanza delle tecniche adottate
per isolare, coltivare, osservare, identificare i microrganismi. Descrivere i
metodi utilizzati per il controllo dei microrganismi e la diminuzione dei loro
35
- Chimica e Tecnologia Farmaceutiche effetti dannosi. Studiare le modalità con cui i microrganismi interagiscono
con il loro ambiente e le conseguenze di tali interazioni. Evidenziare le
influenze che i microrganismi e le applicazioni microbiologiche esercitano
sulla vita quotidiana.
Programma
La cellula batterica: Struttura, morfologia e classificazione dei batteri.
Differenze tra cellule procariotiche e eucariotiche. Capsula, Fimbrie. Pili.
Parete Cellulare. Componenti della Parete. Differenze tra batteri Gram
positivi e Gram negativi. Struttura membrana citoplasmatica batterica.
Sistemi di trasporto membranari. I ribosomi. I vacuoli. Struttura dei flagelli
e movimento dei batteri. Chemiotassi. Struttura dell’endospora batterica.
Sporogesi e germinazione
Nutrizione e crescita microbica: Esigenze nutrizionali dei
microrganismi. Classificazione dei microrganismi per tipi nutrizionali.
Composizione dei terreni di coltura. Crescita batterica in un sistema chiuso.
Misurazione della crescita batterica. Determinazione della concentrazione
cellulare. Valutazione della massa cellulare. Accrescimento batterico. Curva
di crescita di una coltura batterica. Colture continue. Fattori che influenzano
la crescita. Microrganismi psicrofili, mesofili e termofili
Tecniche microbiologiche: Crescita batterica su terreno liquido e solido.
Fissazione su vetrino. Colorazioni acide, basiche, di Gram. Colorazione
dell’endospora
Genetica batterica: principi generali: Struttura chimica e
tridimensionale del DNA. Codice genetico. Tipi di RNA. Organizzazione
dei geni procariotici. Le mutazioni e le loro basi chimiche. Mutanti letali,
auxotrofi, condizionali. Mutazioni spontanee. Mutazioni indotte.
Espressione delle mutazioni
Controllo dei microrganismi: Sterilizzazione. Disinfezione.
Sanificazione. Controllo con metodi fisici. Calore. Filtrazione. Radiazione.
Controllo con agenti chimici. Generalità sugli antibiotici. Meccanismo di
azione degli agenti antimicrobici. Farmaci antibatterici. Sulfamidici.
Chinoloni.
Penicilline.
Cefalosporine.
Tetracicline.
Antibiotici
aminoglicosidici.
Sistemi di trasferimento di materiale genetico nei batteri:
Trasformazione: competenza, fasi del processo, specificità. Trasformazione
in Haemophilus influenzae e Neisseria gonhorreae. Trasformazione
plasmidica. Coniugazione. I plasmidi F e F'. Ceppi Hfr. Coniugazione e
mappe genetiche. Plasmidi e resistenze antibiotiche. Trasduzione:
specializzata e generalizzata
Regolazione genetica nei batteri: Regolazione della utilizzazione del
36
- Chimica e Tecnologia Farmaceutiche lattosio in E. coli. L’operone lac. L’attenuazione
I virus: Caratteristiche generali dei virus batterici. Ciclo litico o lisogenico
del batteriofago lambda. Il fago M13. Carattaristiche generali dei virus
animali. Virus a RNA a polarità positiva e negativa. Metodiche per la
rivelazione dei virus. Ciclo biologico dei retrovirus. RSV. Poliovirus e
vaccini antipolio. Virus influenzali: meccanismi di variabilità virale. Ciclo
biologico di SV40. Cellule permissive e non-permissive. Trasformazione
cellulare indotta da virus. Infezioni erpetiche, farmaci antivirali
Ingegneria genetica: Enzimi di restrizione. Vettori fagici e plasmidici.
Clonaggio genico. Genoteche di DNA e di CDNA. Sonde e ibridazioni
molecolari su filtro. Metodica di Southern. Principi di identificazione di
geni clonati
Immunologia: Difese aspecifiche dell’organismo. Antigene aptene.
Determinanti antigeneici. Immunità specifica. Organi e cellule del sistema
immunitario. Linfociti B. Linfociti T helper. Linfociti killer. Cellule APC.
Natural killer. Antigeni di istocompatibilità. Linfochine. Risposta umorale e
risposta cellulare. Attivazione delle cellule B. Ruolo delle cellule T
nell'attivazione dei linfociti B e dei linfociti T killer. La selezione clonale.
La tolleranza immunologica. La memoria immunologica. La maturazione
della risposta B e la produzione di anticorpi. Le immunoglobuline: struttura
e proprietà delle classi isotipiche. Organizzazione dei geni codificanti le
catene leggere e pesanti degli anticorpi. I riarraggiamenti V-J e V-D-J. Lo
switch isotipico. Meccanismi effettori mediati dagli anticorpi. Il
complemento. Saggi immunologici per la ricerca di antigeni e anticorpi
specifici: agglutinazione, fissazione del complemento, RIA, ELISA,
western
blotting.
Immunofluorescenza,
anticorpi
monoclonali.
Vaccinazione e sieroterapia. Gammaglobuline immuni
TESTI CONSIGLIATI
-Polsinelli et al.: Microbiologia - Ed. Boringhieri
-Alberts et al.: Biologia molecolare della cellula - Ed. Zanichelli (II dizione)
-Prescott et al.: Microbiologia - Ed. Zanichelli
ANATOMIA UMANA
Obiettivi formativi
Anatomia umana, comprendere 3 aspetti fondamentali: 1 gli apparati ed i
sistemi soddisfano precise esigenze funzionali; 2 gli apparati ed i sistemi
constano di vari organi fra di loro funzionalmente interconnessi; 3 ’apparato
cardiocircolatorio, il sistema nervoso ed il sistema endocrino presiedono
37
- Chimica e Tecnologia Farmaceutiche all’interconnessione funzionale dei vari apparati e sistemi anatomici. Su
questa base si richiederà la conoscenza dei principali concetti riguardanti:
Struttura macroscopica normale dei principali organi e sistemi con
particolare riguardo ad una impostazione topografica degli stessi. Struttura
istologica correlata con la funzione. Considerazioni funzionali applicate alla
comprensione della struttura.
Programma
Il corso sarà strutturato in Unità Didattiche (U.D.) comprendenti:
U.D. apparato scheletrico: Obiettivo Formativo: comprendere che lo
scheletro è responsabile della forma, rende possibili i movimenti, ospita i
progenitori degli elementi figurati del sangue, costituisce il principale
deposito di calcio, contribuisce a delimitare le regioni e le cavità corporee
dove sono allocati apparati e sistemi. Programma Didattico: conoscere la
posizione e le caratteristiche generali delle principali strutture ossee dello
scheletro (in particolare lo scheletro degli arti, del tronco, della pelvi e del
cranio).
U.D. muscoli scheletrici: Obiettivo Formativo: comprendere i principali
movimenti possibili per gli arti e i principali muscoli che li effettuano.
Programma Didattico: conoscere i compartimenti muscolari degli arti e
l’origine, l’inserzione, vascolarizzazione ed innervazione dei principali
muscoli che vi alloggiano.
U.D. torace: Obiettivo Formativo: comprendere l’anatomia funzionale
della gabbia toracica e degli organi che vi alloggiano con particolare
riferimento alle strutture respiratorie e cardiocircolatorie. Programma
Didattico: nozioni funzionali sulla gabbia toracica e gli spazi intercostali;
pleure; polmoni: anatomia macroscopica, microscopica e funzionale
dell’albero bronchiale e del parenchima polmonare, meccanica respiratoria
ed influenze funzionali del sistema nervoso autonomo; cuore e grossi vasi:
facce e posizione del cuore, anatomia macroscopica e funzionale delle
camere cardiache, meccanismo delle valvole cardiache e scheletro del
cuore, arterie coronarie e loro decorso, aorta e vasi epiaortici, arteria
polmonare, vena cava superiore ed inferiore, vene polmonari; principali
nozioni sul mediastino: divisione, posizione aorta toracica ed esofago.
U.D. diaframma e parete addominale anterolaterale: Obiettivo
Formativo: comprendere le funzioni del diaframma, della parete
addominale anterolaterale e del canale inguinale. Programma Didattico:
principali nozioni macroscopiche del diaframma, iati e centro tendineo;
anatomia macroscopica e posizione dei muscoli obliquo esterno, interno,
trasverso e retti; principali nozioni macroscopiche del canale inguinale e del
suo contenuto.
38
- Chimica e Tecnologia Farmaceutiche -
U.D.
apparato
digerente:
Obiettivo Formativo: comprendere
funzionalmente come l’apparato digerente presiede all’introduzione degli
alimenti, alla loro digestione ed assorbimento e all’eliminazione dei prodotti
solidi di rifiuto. Programma Didattico: conoscenza delle principali
caratteristiche macroscopiche e microscopiche dell’esofago, stomaco,
intestino tenue e crasso; relazioni anatomiche più importanti fra le predette
strutture; peritoneo; cenni sull’irrorazione del sistema gastroenterico
(tripode celiaco, arterie mesenteriche; effetti funzionali dell’innervazione
del sistema gastroenterico; fegato, colecisti e pancreas: aspetti
macroscopici, microscopici e funzionali.
U.D. apparato urinario: Obiettivo Formativo: comprendere come i reni
depurano il sangue dai prodotti idrosolubili del catabolismo, partecipano al
controllo dell’equilibrio acido-base, presiedono alla regolazione
dell’equilibrio idrico-salino, partecipano al controllo della pressione
arteriosa, alla produzione degli eritrociti e all’apposizione di calcio
nell’osso. Programma Didattico: Rene: posizione, principali aspetti
macroscopici e microscopici; il nefrone: aspetti microscopici e funzionali
dell’ultrafiltrazione e del riassorbimento tubulare; uretere: decorso ed
aspetti microscopici; vescica: posizione, principali aspetti macroscopici,
microscopici e funzionali; basi strutturali e nervose della minzione; uretra
maschile e femminile: aspetti macroscopici.
U.D. pelvi e perineo: Obiettivo Formativo: comprensione dei limiti
anatomici e conoscenza degli organi e strutture contenute con le loro
principali relazioni anatomiche. Programma Didattico: apparato genitale
maschile: testicolo, deferente, vescichette seminali, prostata, uretra,
ghiandole bulbouretrali, pene. Apparato genitale femminile: ovaio, utero,
tube uterine, vagina e vulva; retto e canale anale.
U.D. sistema endocrino: Obiettivo Formativo: comprendere come il
sistema endocrino regola le attività metaboliche (anabolismo, catabolismo),
la digestione, l’equilibrio idro-salino, l’equilibrio energetico, la
riproduzione. Programma Didattico: conoscere la struttura macro e
microscopica, gli ormoni prodotti, il loro ruolo funzionale e la regolazione
delle seguenti ghiandole endocrine: ipofisi, tiroide, paratiroidi, surrene, isole
pancreatiche, sistema endocrino gastroenterico, testicolo, ovaio.
U.D. testa e collo: Obiettivo Formativo: comprendere i principali aspetti
macroscopici, con particolare riferimento alla posizione delle ossa craniche
e del faringe e laringe. Programma Didattico: conoscere le ossa dello
splancnocranio e neurocranio, le fontanelle e la loro funzione, principali
muscoli mimici e della masticazione. Cenni sui denti. Compartimenti del
collo, sistema dell’arteria carotide e della vena giugulare interna; aspetti
morfofunzionali della faringe e laringe.
U.D. sistema nervoso: Obiettivo Formativo: comprendere come il
39
- Chimica e Tecnologia Farmaceutiche sistema sensitivo consente la percezione del mondo esterno; come l’attività
motoria si basa sulla interconnessione funzionale di tre grandi sistemi:
piramidale, extrapiramidale e cerebellare; come il sistema nervoso presiede
alle attività cognitive, fondamento della vita di relazione e risultato delle
percezioni sensoriali e della memoria; come il sistema nervoso regola le
attività viscerali indipendentemente dalla nostra volontà. Programma
Didattico: conoscere i principali aspetti riguardanti: il tessuto nervoso
(neuroni e glia); sistema nervoso centrale: posizione ed accenni funzionali
sui lobi cerebrali e sul cervelletto, gangli della base e talamo, tronco,
sistema reticolare e limbico, midollo spinale; poligono del Willis. Sistema
nervoso periferico: radici spinali, gangli sensitivi. Sistema nervoso
autonomo: ortosimpatico e parasimpatico. Principali neurotrasmettitori. Gli
organi di senso: cenni di anatomia funzionale dell’occhio e dell’orecchio.
TESTI CONSIGLIATI
-AA.VV., Anatomia Umana, EdiErmes
-F.H. Netter, Atlante di Anatomia Umana, Novartis Edizioni
-M.J.T. FitzGerald, Neuroanatomia Fondamentale e Clinica, A. Delfino
Editore, Roma M.Rende, Appunti alle lezioni di Anatomia Umana Normale
CHIMICA ORGANICA I
Obiettivi formativi
L’insegnamento fornisce agli studenti le conoscenze e gli strumenti
necessari a correlare la struttura molecolare con la reattività al fine di saper
progettare le interconversioni dei gruppi funzionali nonché semplici
modificazioni dello scheletro molecolare.
Programma
Il legame chimico e la forma delle molecole. Orbitali Molecolari – Teoria
del legame di valenza – Risonanza – Aromaticità. Nomenclatura dei
composti organici. Reazioni acido-base. Isomeria e Stereoisomeria.
Elementi di Chimica Organica Fisica: Termodinamica e Cinetica Chimica.
Sostituzione nucleofila al carbonio saturo. Eliminazioni monomolecolari,
bimolecolari e intramolecolari. Addizioni elettrofile a legami multipli
Carbonio-Carbonio. Sostituzioni elettrofile aromatiche. Sostituzioni
nucleofile aromatiche.
TESTI CONSIGLIATI
-Roger Macomber “Chimica Organica” Zanichelli
40
- Chimica e Tecnologia Farmaceutiche -Seyhan Ege “Chimica Organica” Edizioni Sorbona Milano
BIOLOGIA MOLECOLARE
(Nuovo Ordinamento)
Obiettivi formativi
Il corso si propone di fornire agli studenti una visione d’insieme delle
scoperte e delle tecniche che hanno permesso il grande sviluppo e l’analisi
molecolare di quei processi vitali che permettono la continuazione e la
riproduzione della specie. Di introdurli alla conoscenza delle più moderne
tecniche in uso nell’ingegneria genetica. Di dotarli inoltre, attraverso la
descrizione dei percorsi sperimentali, della capacità di proporre e
interpretare modelli sperimentali d’indagine.
Programma
Struttura del DNA: Trasformazione (esperimento di Griffith ed
esperimento di Avery,Mac Leod e Mc Carty). Esperimento di Hershey e
Chase. Regole di Chargaff. Modello di Watson e Crick. Strutture alternative
(forma A e Z). Concetti di topologia: Numero di legame di avvolgimento e
superavvolgimento.
Replicazione del DNA: Modello semiconservativo (esperimento di
Meselson e Sthal). Direzionalità delle forcine di replicazione. Origini di
replicazione singole e multiple (metilazione). Enzimologia della
replicazione: Polimerasi, Single-strand binding protein (SSB), Elicasi,
Topoisomerasi, Primasi e DNA ligasi. Modelli di replicazione per E. Coli,
M13, G4 e ΦX174. Repliconi lineari: modello del fago λ. Problema della
replicazione delle estremità cromosomiche: Telomerasi e meccanismo di
azione.
Meccanismi biologici che salvaguardano il DNA: Sistemi di
modificazione e restrizione: enzimi di tipo I, II e III e loro meccanismo di
azione. Fotoriattivazione. Riparazione per excisione, via uvr e sistema delle
DNA glicosilasi. Riparazione replicativa: via rec. Sistema SOS.
La ricombinazione del DNA: Ipotesi sulla natura del crossin-over:
modello della scelta di copia, modello per rottura e riunione.
Ricombinazione generale o omologa: assortimento indipendente,
conversione genica, crossing-over, crossing over ineguale. Modello di
Holliday. Riconbinazione dei DNA circolari. Ricombinazione sito specifica:
Processi di integrazione e excisione tra il fago λ ed E. Coli, rotture e
riunioni sfalsate nel core. Trasposizione semplice e replicativa. Regolazione
41
- Chimica e Tecnologia Farmaceutiche genica mediante ricombinazione sito specifica.
Trascrizione dell’informazione genetica: Unità di trascrizione. RNA
polimerasi batterica: enzima “core” e sigma, ciclo del fattore sigma, Regioni
promotori nei batteri: identificazione del sito d’inizio e dei siti di legame
dell’ RNA polimerasi (punto di inizio, Pribnow box, sequenza –35),
regolazione positiva a livello del promotore; modificazioni globali
dell’inizio: sporulazione. RNA polimerasi eucariotiche complesse: RNA
polimerasi I, RNA polimerasi II, RNA polimerasi III: Regioni promotori e
attivatrici per l’ RNA polimerasi II (TATA box regioni CCAAT, elementi
ricchi di G-C, enhancer). Terminazione nei batteri: sequenze di
terminazione, terminotori RHO indipendenti, terminatori RHO dipendenti.
Antiterminazione fagica
Modificazioni post-trascrizionali dei pre-RNA nei procarioti:
Organizzazione dei pre-tRNA, pre-rRNA batterici Meccanismi di
modificazione dei pre-tRNA e pre-rRNA batterici. Enzimologia delle
modificazioni post-trascrizionali (RNAasiP, RNAasiD, Nucleotidil-CCA–
transferasi, RNAasi III) e loro meccanismo di azione. Modificazioni posttrascrizionali dei geni precoci del fago T7 (meccanismo di azione
dell’RNAasiIII).
Modificazioni post-trascrizionali dei pre-RNA negli eucarioti:
Geni interrotti: esoni-introni metodo dell’ansaR, analisi di Norther blot.
Modificazioni del 5’ (CAP metilato) e del 3’ (poliadenilazione)
Meccanismo di modificazione dei pre-tRNA, enzimologia (nucleasi, ligasi).
Auto-splicing di tipo I (pre-rRNA) e di tipo II (geni mitocondriali).
Maturazione dell’hnRNA: sequenze di consenso per lo splicing, ruolo delle
ribonucleoproteine nucleari (snRNP), enzimi e loro meccanismo di azione.
Splicing alternativi.
Sintesi proteica: tRNA: struttura, funzione, formazione dell’aminoaciltRNA, tRNA iniziatore, correzione di bozze. rRNA: struttura, funzione;
Ribosomi: subunità maggiore e minore, componenti proteiche dei ribosomi,
ruolo nella sintesi proteica. Sintesi proteica nei procarioti: fasi d’inizio,
allungamento, e terminazione, fattori proteici, riconoscimento dell’ATG
iniziale, ruolo del GTP. Sintesi proteica negli eucarioti: principali differenze
con i procarioti.
Codice genetico: Metodi per la decifrazione del codice genetico. Codice
genetico: degenerazione, vacillamento dell’anticodone, codoni di inizio e di
terminazione, mutazioni non-senso e di senso, mutazioni a soppressore
(intragenica, intergenica), codice genetico dei mitocondri. Regolazione
dell’espressione genica nei procarioti. Geni strutturali e regolatori. Utilizzo
di mutanti per la caratterizzazione dei geni regolatori e del tipo di operone
(mutanti costitutivi, superrepressori, diploidi parziali). Struttura
dell’operone. Regolazione negativa e positiva: sistemi inducibili e
reprimibili, operone del lattosio, operone del triptofano, attenuazione,
42
- Chimica e Tecnologia Farmaceutiche operone dell’arabinosio.
TESTI CONSIGLIATI
-Watson: Biologia molecolare del gene. Ed. Zanichelli
-Lewin: Il Gene VI. Ed. Zanichelli
ANALISI DEI MEDICINALI
Obiettivi formativi
Il corso avrà il compito di fornire le conoscenze di base relative agli
equilibri in soluzione e alle proprietà degli elementi. Le varie tematiche
verranno affrontate con un approccio problematico, facendole scaturire
dall’osservazione di fenomeni e dall’analisi di dati sperimentali in seguito
ad esperienze che gli stessi studenti effettueranno in laboratorio. Si mirerà
comunque ad un giusto equilibrio tra l’approccio teorico-formale e quello
induttivo sperimentale.
Programma
Parte I :Principi chimici fondamentali: Struttura dell’atomo, soluzioni,
legame chimico e struttura delle molecole, Equazioni chimiche. Equilibri
ionici in soluzioni acquose, acidi e basi forti e deboli, equilibri
eterogenei:Kps, idrolisi di sali, soluzioni tampone, equilibri redox.
Anfoterismo.
Parte II: Introduzione al laboratorio, precipitazione, separazione e reazioni
di riconoscimento dei cationi dei cinque gruppi. Saggi alla fiamma. Aspetti
farmacologici dei cationi.
Parte III : Proprietà ed identificazione degli anioni. Aspetti farmacologici
e tossicologici degli ioni negativi.
Esperienze di laboratorio: Preparazione di soluzioni a concentrazione
nota. Analisi dei cationi del I, II, III, IV, e V gruppo. Saggi alla fiamma e
saggi alla perla. Analisi degli anioni.
TESTI CONSIGLIATI
-Hogness J. Armstrong: Analisi qualitativa ed equilibrio chimico, Piccin.
-P.Barbetti, M.G. Quaglia: L’analisi qualitativa in chimica farmaceutica e
tossicologia inorganica.
-Dispense di laboratorio: Tuccari, Parigi: tabellario operativo della chimica
analitica qualitativa.
43
- Chimica e Tecnologia Farmaceutiche -
CHIMICA ORGANICA II
(Nuovo Ordinamento)
Obiettivi formativi
Il corso, riprendendo i concetti della chimica organica I, si propone di
fornire agli studenti conoscenze specifiche sulla reattività del gruppo
carbonilico e sulle reazioni di ossidazione e trasposizione.
Programma
La reattività del carbonile: Reazioni di addizione – Reazioni di addizione ed
eliminazione – Reazioni di sostituzione nucleofila acilica. Reattività in α al
carbonile: Enoli ed Enolati – Reazioni di condensazione. Applicazione alla
sintesi organica delle reazioni degli enoli e degli enolati. Reazioni di
ossidazione e di riduzione di composti organici. Reazioni di trasposizione
Reazioni radicaliche.
TESTI CONSIGLIATI
-Roger Macomber “Chimica Organica” Zanichelli
-Seyhan Ege “Chimica Organica” Edizioni Sorbona Milano
FISIOLOGIA GENERALE I
Obiettivi formativi
L’itinerario formativo dei corsi di Fisiologia Generale I e II è volto a fornire
un quadro delle conoscenze nel settore della Fisiologia Umana così da
rispondere alle necessità professionali del laureato in Chimica e Tecnologie
Farmaceutiche. Durante lo svolgimento dei due corsi vengono posti in
risalto i principi generali ed i meccanismi fisiologici più importanti, alla
luce delle più recenti acquisizioni fornite dalla ricerca scientifica. Ciò è
arricchito da riferimenti relativi all’utilizzo delle tecniche moderne
impiegate per acquisire le conoscenze fisiologiche. Le funzioni
dell’organismo nel suo insieme sono analizzate a partire dal livello
molecolare e cellulare (Fisiologia Generale I) fino al livello d’organo e di
sistema (Fisiologia Generale II). Il centro del percorso formativo è
rappresentato dai fondamentali concetti di omeostasi e di rapporto strutturafunzione. Durante lo svolgimento di entrambi i corsi la trattazione dei vari
argomenti è affrontata utilizzando le conoscenze della fisica, della chimica,
dell’anatomia umana, della biologia cellulare e della biochimica, parte
integrante della preparazione precedente allo studio della Fisiologia.
44
- Chimica e Tecnologia Farmaceutiche -
Programma
Omeostasi e rapporti struttura-funzione.
Membrana cellulare: Struttura e funzione. Scambi di sostanze attraverso
le membrane. Trasporti passivi, mediati, attivi primari e secondari.
Potenziale di membrana. Caratteristiche ed eventi ionici del potenziale
d’azione. Trasmissione dell’impulso nelle sinapsi elettriche e chimiche.
Secrezione del neurotrasmettitore. Potenziali post sinaptici. Placca motrice.
Contrazione muscolare: Basi biochimico-strutturali. Meccanica e
regolazione della contrazione. Accoppiamento eccitazione-contrazione.
Ruolo del calcio. Differenze nella contrazione muscolare liscia, scheletrica
e cardiaca.
Il sangue: Funzioni e composizione. Gli elementi figurati del sangue.
Emopoiesi. Gruppi sanguigni. La coagulazione. La risposta immune.
L’emoglobina. Il trasporto dell’ossigeno. Scambi gassosi a livello
polmonare e tissutale.
Organizzazione del Sistema Nervoso Centrale. Archi riflessi.
Recettori sensoriali: classificazione e caratteristiche morfofunzionali. Vie
nervose ascendenti. Il midollo spinale ed il controllo della motilità. Riflesso
miotatico. Controllo cerebrale della vasomotilità: vie piramidali ed
extrapiramidali. Struttura e funzione del Sistema Nervoso Autonomo.
Modalità d’azione dei principali tipi di neurotrasmettitori
centrali ed autonomi.
Il concetto di ormone: Interazioni neuro-endocrine.
TESTI CONSIGLIATI
-C. Casella, V. Taglietti. Principi di Fisiologia. Ed. La Goliardica Pavese.
-R. M. Berne, M. N. Levy. Principi di Fisiologia. Ed. Casa Editrice
Ambrosiana.
-R. Klinke, S. Silbernagl. Fisiologia. Ed. Zanichelli.
BIOCHIMICA I
Obiettivi formativi
La Biochimica è lo studio delle reazioni chimiche che permettono la vita sul
pianeta terra. Lo studio della Biochimica ha inizio con la presentazione
delle strutture delle proteine. È descritta quindi la struttura e la funzione
dell'emoglobina con particolare riferimento alle proprietà allostericche di
questa proteina. Si passa allo studio della cinetica delle reazioni catalizzate
dagli enzimi, a determinare le costanti cinetiche (Km e Vmax) e a
45
- Chimica e Tecnologia Farmaceutiche considerare l'effetto degli inibitori sulle costanti cinetiche. Sono presi in
considerazione i principi fisico-chimici e i principi termodinamici che
regolano gli equilibri delle reazioni biochimiche catalizzate dagli enzimi.
Sono trattate le più importanti vitamine solubili come precursori dei
coenzimi. Capitolo importantissimo dello studio della Biochimica è il
metabolismo e la sua regolazione con descrizione delle vie metaboliche che
regolano la degradazione dei macroelementi e la sintesi delle molecole e
macromolecole necessarie per la vita. Di fondamentale importanza sono i
processi catabolici e le reazioni terminali che avvengono nei mitocondri: a)
processo di ossido-riduzione fino ad anidride carbonica (ciclo di Krebs) ed
acqua (catena respiratoria); b) fosforilazione ossidativa accoppiata alla
catena respiratoria con sintesi di ATP. Sono prese anche in considerazione
le reazioni di demolizione delle proteine e degli amminoacidi e
l'eliminazione dell'azoto proteico come urea. Infine si affronta lo studio
dell'informazione genetica cioè degli acidi nucleici (DNA e RNA), del
codice genetico e del meccanismo del processo di sintesi proteica.
Programma
La materia vivente: La cellula e le sue unità di struttura e funzione.
Struttura e caratteristiche chimico-fisiche dell'acqua. Legame idrogeno: sua
importanza nell'acqua e nei composti biologici
Proteine: Amminoacidi: classificazione; proprietà acido-basiche; punto
isoelettrico. Proteine: stuttura primaria; struttura secondaria: legame
peptidico, α elica e struttura ß a foglio pieghettato; struttura terziaria;
struttura quaternaria. Conformazione nativa, denaturazione e rinaturazione.
Purificazione e criteri di purezza. Molecole trasportatrici di ossigeno:
mioglobina ed emoglobina
Enzimi: Natura, proprietà e classificazione. Sito attivo dell'enzima.
Specificità di substrato e specificità di azione. Cinetica enzimatica.
Derivazione analitica di Michaelis e Menten secondo Briggs e Haldane.
Significato e determinazione di Km e Vmax. Diagramma secondo
Lineweaver-Burk e secondo Eadie-Hofstee. Dipendenza della velocità di
una reazione enzimatica dalla concentrazione del substrato, dalla
concentrazione dell'enzima, dal pH, dalla temperatura, dalla presenza di
attivatori ed inibitori. Inibizione reversibile ed irreversibile. Inibitore di tipo
competitivo, non competitivo e incompetitivo. Metodi grafici per la
individuazione della natura della inibizione e per la determinazione della
Km, Vmax e Ki. Meccanismo di reazione enzimatica: meccanismo random,
ordinato e a ping-pong. Enzimi regolatori ed allosterici. Modulazione
positiva e negativa. Effetto omotropico ed eterotropico. Isoenzimi
46
- Chimica e Tecnologia Farmaceutiche -
Vitamine: Vitamine idrosolubili e liposolubili. Coenzimi: struttura e
meccanismo d'azione
Membrane biologiche: Fosfolipidi, glicolipidi, colesterolo e proteine.
Caratteristiche e funzioni delle membrane biologiche
TESTI CONSIGLIATI
-Devlin Biochimica Idelson Gnocchi
-Mathews-Van Holde Biochimica Ambrosiana
-Stryer Biochimica Zanichelli
ANALISI DEI FARMACI I
Obiettivi formativi
Il principale obiettivo del corso è quello di fornire una conoscenza dei
principi applicativi della chimica analitica, sviluppando una capacità critica
nella valutazione statistica dei dati sperimentali. Il contenuto spazia dalla
descrizione dei metodi classici di analisi fino all’utilizzo delle più moderne
tecniche strumentali, includendo l’insegnamento delle comuni pratiche di
laboratorio con le indicazioni per l’analisi di campioni reali.
Programma
Nozioni di base dell’analisi quantitativa: Analisi di composti di
interesse farmaceutico. Farmacopea ufficiale. Impurezze. Codice di
purezza. Fasi tipiche di una analisi e operazioni comuni. Criteri di scelta di
una analisi quantitativa. Campionamento.
La bilancia analitica: Unità di peso: multipli e sottomultipli.. Bilancia a
uno e due bracci. Caratteristiche funzionali. Sensibilità. Metodi di pesata.
Errori di pesata.
Preparazione di soluzioni: Espressioni di concentrazione.
Analisi statistica dei dati: Cifre significative, arrotondamento e
propagazione nei calcoli. Analisi deduttiva. Analisi replicata. Indici di
posizione. Indici di accuratezza. Errori sistematici e casuali. Curva di gauss.
Indici di precisione. Analisi inferenziale. Intervallo di fiducia. Scarto di dati
sospetti. Analisi regressionale, metodo dei minimi quadrati.
Analisi volumetrica: Titolazione diretta e indiretta. Standard primari e
secondari. Peso equivalente, normalità e numero di equivalenti. Vetreria
volumetrica. Curve di titolazione e punto di equivalenza. Errore di
titolazione. Prova in bianco.
Titolazioni di neutralizzazione: Equilibri acido-base. Calcolo del pH di
soluzioni acide, basiche e saline. Soluzioni tampone. Indicatori acido-base,
47
- Chimica e Tecnologia Farmaceutiche intervallo di viraggio. Curve di titolazione. Titolazione di acidi, basi e sali.
Effetti della concentrazione e della forza di acidi e basi. Acidimetria e
alcalimetria.
Titolazioni per precipitazione: Curve di titolazione per gli alogenuri.
Effetti della concentrazione e del valore di Kps. Titolazioni
argentometriche. Metodi di Mohr, Volhard, Fajans: indicatori, effetti del pH
e campi di applicazione. Titolazione di Gay Lussac.
Titolazioni con formazione di complessi: Numero di coordinazione.
Costanti di stabilità. Complessi con EDTA. Influenza del pH. Costante di
formazione condizionale. Curve di titolazione. Indicatori metallocromici.
Tecniche di titolazione con EDTA.
Titolazioni redox: Nozioni basilari su elettricità e reazioni redox.
Elettrodo normale a idrogeno. Potenziali di riduzione standard. Equazione
di Nernst. Agenti ossidanti e riducenti.
Permanganometria: Reazioni del potassio permanganato in varie
condizioni di pH. Stabilità della soluzione acquosa. Preparazione e
standardizzazione della soluzione di potassio permanganato. Titolazioni
permanganometriche.
Iodimetria e iodometria: Stabilità della soluzione di iodio. Preparazione
e standardizzazione della soluzione di iodio. Preparazione di soluzione di
iodato-ioduro. Preparazione e standardizzazione della soluzione di sodio
tiosolfato.
TESTI CONSIGLIATI.
-Farmacopea Ufficiale della Repubblica Italiana, (X Ed.)
-G.C. Porretta: Analisi quantitativa di composti farmaceutici. - Ed. C.I.S.U.
-D.C. Harrys: Chimica analitica quantitativa - Ed. Zanichelli
-Skoog, West, Holler: Chimica analitica. - Ed S.E.S.
-H.H. Bauer et al.: Analisi strumentale - Ed. Piccin
-R.Cozzi, P.Protti, A.Ruaro: Analisi chimica strumentale. Ed. Zanichelli
BIOCHIMICA II
Obiettivi formativi
Fornire le conoscenze approfondite delle reazioni biochimiche con relativi
meccanismi di azione degli enzimi, sul metabolismo proteico. Conoscenza
dei sistemi di comunicazione attraverso le membrane biologiche.
Approfondimento delle interrelazioni metaboliche fra i vari metabolismi e
la loro regolazione cellulare.
48
- Chimica e Tecnologia Farmaceutiche -
Programma
Acidi nucleici: Biosintesi delle basi puriniche e pirimidiniche. Nucleosidi
e nucleotidi. Acidi nucleici: struttura e funzione. RNA ribosomiale, RNA
messaggero e RNA transfer. DNA e struttura a doppia elica
Metabolismo: Metabolismo: concetti generali. Principi di termodinamica
nelle reazioni biochimiche. Costante di equilibrio. Energia libera.
Determinazione del senso di una reazione dal calcolo della variazione di
energia libera. Energia di attivazione
Metabolismo glicidico: La glicolisi: reazioni; enzimi; bilancio
energetico. Glicogenolisi: struttura del glicogeno; reazioni; enzimi;
regolazione ormonale. Glicogenosintesi: reazioni; enzimi; regolazione
ormonale. Gluconeogenesi: reazioni; enzimi; regolazione ormonale. Ciclo
dei pentosi fosfati: reazioni; enzimi. Vie di utilizzazione del glucosio 6fosfato in relazione alla necessità di NADH e ribosio 5-fosfato
Metabolismo lipidico: Lipidi. Acidi grassi. Localizzazione cellulare.
Attivazione e trasferimento degli acidi grassi nei mitocondri. ß-ossidazione:
reazioni; enzimi; bilancio energetico. Sintesi ex novo degli acidi grassi:
reazioni; enzimi. Differenze con le reazioni della ß-ossidazione. Corpi
chetonici. Significato fisiologico della formazione dei corpi chetonici
Metabolismo degli amminoacidi: Vie di ossidazione degli
amminoacidi. Transamminazione, decarbossilazione, deamminazione
ossidativa. Metabolismo di alcuni amminoacidi. Reazioni del glutammato.
Ammoniogenesi. Ciclo dell'urea. Ciclo delle purine.
TESTI CONSIGLIATI
-Devlin Biochimica Idelson Gnocchi
-Mathews-Van Holde Biochimica Ambrosiana
-Stryer Biochimica Zanichelli
FISIOLOGIA GENERALE II
Obiettivi formativi
L’itinerario formativo dei corsi di Fisiologia Generale I e II è volto a fornire
un quadro delle conoscenze nel settore della Fisiologia Umana così da
rispondere alle necessità professionali del laureato in Chimica e Tecnologie
Farmaceutiche. Durante lo svolgimento dei due corsi vengono posti in
risalto i principi generali ed i meccanismi fisiologici più importanti, alla
luce delle più recenti acquisizioni fornite dalla ricerca scientifica. Ciò è
arricchito da riferimenti relativi all’utilizzo delle tecniche moderne
impiegate per acquisire le conoscenze fisiologiche. Le funzioni
49
- Chimica e Tecnologia Farmaceutiche dell’organismo nel suo insieme sono analizzate a partire dal livello
molecolare e cellulare (Fisiologia Generale I) fino al livello d’organo e di
sistema (Fisiologia Generale II). Il centro del percorso formativo è
rappresentato dai fondamentali concetti di omeostasi e di rapporto strutturafunzione. Durante lo svolgimento di entrambi i corsi la trattazione dei vari
argomenti è affrontata utilizzando le conoscenze della fisica, della chimica,
dell’anatomia umana, della biologia cellulare e della biochimica, parte
integrante della preparazione precedente allo studio della Fisiologia.
Programma
Sistema cardiovascolare.
Struttura e funzione del cuore dei mammiferi: Attività elettrica
cardiaca. Parametri cardiaci. Il ciclo cardiaco. Controllo nervoso ed umorale
dell’attività del cuore.
Emodinamica: Basi fisiche e strutturali. Rapporti pressione-flusso.
Regolazione nervosa, ormonale e locale della vasomotilità.
Organi e funzione respiratoria: La meccanica polmonare. Controllo
dell’attività respiratoria.
L’omeostasi idro-minerale: Il rene ed il nefrone: richiami strutturali. La
produzione dell’urina. Controllo della funzionalità renale. Rene ed
equilibrio acido-base. Funzione endocrina del rene.
La digestione: struttura del canale digerente e sua innervazione. Funzioni
gastriche e funzioni intestinali. Regolazione dei processi digestivi.
TESTI CONSIGLIATI
-C. Casella, V. Taglietti. Principi di Fisiologia. Ed. La Goliardica Pavese.
-R. M. Berne, M. N. Levy. Principi di Fisiologia. Ed. Casa Editrice
Ambrosiana.
-R. Klinke, S. Silbernagl. Fisiologia. Ed. Zanichelli.
CHIMICA FARMACEUTICA E TOSSICOLOGICA I
Obiettivi formativi
Il corso consta di una parte generale e una sistematica. La parte generale
iniziale si prefigge di fornire gli strumenti necessari per analizzare, in
generale, la progettazione e sintesi, l’azione, i rapporti struttura-attività, il
metabolismo dei farmaci, in relazione agli aspetti di ricerca, produzione e
controllo degli stessi e si intende propedeutica alla seconda parte
(sistematica) del corso, ed anche ai corsi di chimica farmaceutica degli anni
successivi. Nella seconda parte vengono presi in esame vari aspetti di classi
50
- Chimica e Tecnologia Farmaceutiche selezionate di farmaci deprimenti del sistema nervoso centrale.
Programma
Parte generale
Scoperta e sviluppo dei farmaci: Scoperta di un farmaco senza un
“lead”, scoperta di un “lead”. Modificazioni del “lead”: identificazione del
farmacoforo, modificazione dei gruppi funzionali, relazioni strutturaattività, modificazioni della struttura per aumentare la potenza e l’indice
terapeutico, relazioni quantitative struttura-attività, molecular modeling.
Principi dell’azione dei farmaci: Trasmettitori, enzimi, ormoni,
processi di trasporto.
Interazioni farmaco-recettore: Forze coinvolte, teorie farmacorecettore, considerazioni topografiche e stereochimiche.
Assorbimento, distribuzione ed escrezione dei farmaci: Vie di
somministrazione, fattori che influenzano l’assorbimento dei farmaci, emivita, volume di distribuzione, escrezione renale e biliare.
Metabolismo dei farmaci: Ossidazione dipendente da citocromo P-450,
riduzione, idrolisi, induzione enzimatica, metabolismo di first-pass, fase I,
fase II, escrezione.
Abuso dei farmaci e farmacodipendenza: Deprimenti generali,
oppiodi, stimolanti, allucinogeni, nicotina.
Classificazione e nomenclatura dei farmaci.
Parte sistematica
Anestetici e analgesici
Anestetici generali: Stadi dell’anestesia, premedicazione. Anestetici per
inalazione: a. organici gassosi, a. inorganici, a. organici liquidi. A. per
endovena.
Anestetici locali: Meccanismo d’azione, cocaina e derivati, esteri
dell’acido benzoico, esteri dell’acido p-aminobenzoico, derivati amidici.
Farmaci attivi sulla giunzione neuromuscolare: Inibitori della
acetilcolinesterasi, bloccanti neuromuscolari depolarizzanti e non
depolarizzanti, agenti che riducono la liberazione di Ach.
Analgesici oppiacei: Peptidi endogeni, morfina, prodotti di
complicazione e di semplificazione molecolare della morfina.
Antiinfiammatori non-steroidei: Meccanismo d’azione, derivati
salicilici ed idrossibenzoici vari, derivati dell’acido antranilico, der.
dell’anilina, e del p-aminofenolo, der. pirazolonici e pirazolidindionici, der.
51
- Chimica e Tecnologia Farmaceutiche di acidi arilacetici, oxicam, inibitori selettivi della COX-2
Farmaci deprimenti del sistema nervoso centrale
Ansiolitici ed ipnotici: Caratteristiche delle fasi del sonno, mecanismo
d’azione, barbiturici, analoghi isosterici dei barbiturici, alcoli, aldeidi e
derivati, benzodiazepine ciclopirroloni.
Farmaci antiepilettici: Forme principali dell’epilessia, meccanismo
d’azione, antiep. inorganici, barbiturici, der. idantoinici, der. succinimidici,
benzodiazepine, der. vari.
Farmaci usati nel Parkinsonismo: Eziologia del P., farmaci
anticolinergici (der. benzidrileterei, der. carbinolici trisostituiti, der.
tioxantenici e fenotiazinici, farm. vari), precursori della dopamina, inibitori
della decarbossilasi selettivi extracerebrali, MAOB inibitori, dopamina
rilascianti, agonisti della dopamina.
Rilassanti muscolari centrali sedativi e non sedativi.
Neurolettici: Meccanismo d’azione, alcaloidi della Rauwolfia, der.
fenotiazinici, butirrofenoni, farm. atipici.
TESTI CONSIGLIATI
-Artico: Lezioni di Chimica Farmaceutica e Tossicologica – CISU – Roma
-Gualtieri, Romanelli, Teodori: Chimica Farmaceutica dei Recettori –
CLUEB – Bologna
-Runti: Fondamenti di Chimica Farmaceutica – LINT – Trieste
-Schroeder, Rufer, Schmiechen: Chimica Farmaceutica – EDISES - Napoli
CHIMICA FARMACEUTICA E TOSSICOLOGICA II
Obiettivi formativi
Il corso si propone di trattare alcune classi di farmaci rispettando il carattere
interdisciplinare della materia risultante dal contributo della chimica
organica, della biochimica e della farmacologia. Uno studio approfondito si
riserva all’aspetto chimico dei farmaci mantenendo però sempre collegati il
meccanismo di azione e le applicazioni cliniche. In particolare il corso tratta
farmaci di origine biologica e di sintesi appartenenti alla classe dei
chemioterapici, degli ormoni e farmaci attivi su diversi distretti del corpo
umano.
Programma
Farmaci antibatterici: Considerazioni generali e classificazione.
52
- Chimica e Tecnologia Farmaceutiche Organismi patogeni. Classificazione dei batteri. Struttura, metabolismo,
crescita e moltiplicazione dei batteri. Resistenza batterica. Composti
contenenti alogeni attivi. Composti ammonici quaternari. Fenoli e derivati
dell'acido salicilico. Sulfamidici. Sulfoni. Nitrofurani. Acidi carbossilici.
Antimicobatterici.
Antimicobatterici
derivati
dalla
tiourea.
Antimicobatterici derivati della etilendiammina. Antibiotici β-lattamici,
(Penicilline e cefalosporine). Antibiotici amminoglicosidici. Antibiotici
tetraciclinici. Cloramfenicolo. Antibiotici peptidici. Antibiotici macrolidici.
Antibiotici ad ansa.
Farmaci antiprotozoari: Considerazioni generali e classificazione.
Farmaci antiplasmodici, (antimalarici). Chinina ed alcaloidi correlati 8Ammino-chinoline 4-Ammino-chinoline e 9-ammino-acridine. Guanidinici,
triazinici, pirimidinici. Farmaci antiamebici. 8-Idrossi-chinoline. Emetina e
deidriemetina. Nitroimidazoli. Farmaci antitripanosomici.
Farmaci antimicotici: Considerazioni generali e classificazione.
Griseofulvina. Imidazolici. Antibiotici polienici. Composti ammonici
quaternario. Acidi carbossilici a catena lunga. Derivati dell’acido
tiocarbonico.
Farmaci antielmintici: Considerazioni generali e classificazione.
Farmaci attivi nelle infezioni provocate da nematodi. Piperazina e derivati.
Derivati benzimidazoloci. Nitrotiazolici. Ammidine cicliche. Farmaci attivi
nelle infezioni provocate da cestodi. Farmaci attivi nelle infezioni provocate
da trematodi. Xantoni e tiaxantoni. Nitrotiazoli.
Farmaci antivirali: Considerazioni generali e classificazione. Ammine
cicliche. Tiosemicarbazoni. Derivati pirimidinici e purinici. Interferone e
composti interferon-induttori. AIDS, considerazioni generali. Farmaci anti
AIDS.
Farmaci antitumorali. Forme tumorali, considerazioni generali e
classificazione. Alchilanti. Derivati bis-[2-cloro-etil]-amminici. Aziridine.
Esteri dell'acido metansulfonico. Nitrosouree. Antimetaboliti. Analoghi
dell'acido folico. Derivati Purinici ed analoghi. Derivati pirimidinici ed
analoghi. Asparaginasi. Alcaloidi della Vinca. Antibiotici antitumorali.
Antistaminici
Antistaminici anti H1. Antistaminici anti H2.Derivati del 2-amino-etanolo,
3-amino-propano e etilendiammina.
Farmaci dell’apparato gastro-intestinale
Emetici centrali. Emetici periferici. Antiemetici. Acidi. Antiacidi.
Colagoghi. Lassativi. Antidiarroici.
53
- Chimica e Tecnologia Farmaceutiche -
METODI FISICI IN CHIMICA ORGANICA
Obiettivi formativi
L’insegnamento fornisce conoscenze approfondite delle metodologie
d’indagine strutturale di tipo spettroscopico e spettrometrico. Esso consente
l’acquisizione degli strumenti indispensabili per una agevole interpretazione
dei dati spettroscopici sperimentali e finalizzati alla caratterizzazione
strutturale delle molecole organiche.
Programma
Spettroscopia di risonanza magnetica nucleare protonica:
Generalità: il momento magnetico nucleare; la frequenza di Larmor; gli stati
di spin e le loro energie; il fenomeno della risonanza magnetica nucleare; la
radiofrequenza; il vettore magnetizzazione; l’esperimento NMR;
spettroscopia CW e spettroscopia FT; il FID e lo spettro dei composti
organici; il “chemical shift” ed i campi effettivi risentiti dalle molecole; le
costanti di accoppiamento e l’equazione di Karplus; accoppiamenti spinspin; spettri del primo ordine e di ordine superiore; equivalenza chimica e
magnetica dei protoni di una molecola; spettri di composti organici chinali;
la simmetria delle molecole; protoni enantiotopici e diastereotopici; la
definizione di “spin system” e la classificazione di Pople; accoppiamenti
virtuali ed allilici; i protoni legati ad eteroatomi; sistemi rigidi con tre
costanti di accoppiamento. Metodi di interpretazione degli spettri di
risonanza magnetica nucleare protonica: le correlazioni spettro-struttura e
viceversa; esercitazioni guidate ed esercitazioni pratiche strumentali su
molecole di interesse farmaceutico; brevi cenni sulle tecniche di indagine
strutturale.
Spettroscopia di risonanza magnetica nucleare 13C: Generalità: i
differenti tipi di esperimento e la determinazione della struttura di molecole
organiche. La scala dei “chemical shift” e la relazione con i gruppi
funzionali. Metodi di interpretazione degli spettri di risonanza magnetica
nucleare 13C: le correlazioni spettro-struttura e viceversa; esercitazioni
guidate ed esercitazioni pratiche strumentali su molecole di interesse
farmaceutico.
Spettrometria di massa: Generalità: metodi di ionizzazione delle
molecole organiche; spettrometria di massa in impatto elettronico; altri tipi
di analisi spettrometrica di massa; le reazioni di frammentazione degli ioni
di molecole organiche in fase gassosa. Interpretazione degli spettri di massa
in impatto elettronico di composti organici: le correlazioni spettro-struttura
e viceversa; esercitazioni guidate.
54
- Chimica e Tecnologia Farmaceutiche -
TESTI CONSIGLIATI
-Robert M. Silverstein, Francis X. Webster: “Identificazione spettroscopica
di composti organici”, Casa Editrice Ambrosiana.
PATOLOGIA GENERALE
Obiettivi formativi
Fornire approfondite conoscenze sulle basi biologiche della manifestazioni
patologiche. Consentire la comprensione delle cause determinanti i
meccanismi patogenici delle malattie e l' etiopatogenesi delle alterazioni
fondamentali delle strutture, delle funzioni, e dei fattori di controllo ai vari
livelli di integrazione. Evidenziare la multidisciplinarietà della Patologia
Generale che richiede un approccio culturale globale per lo studio del
fenomeno patologico nell'ambito della ricerca sperimentale.
Programma
Definizione dell'ambito disciplinare: Le malattie ereditarie e
congenite, aberrazioni cromosomiche, mutazioni, patologia molecolare
Gli agenti fisici come causa di malattia: Le radiazioni eccitanti e
ionizzanti, il calore, danni somatici precoci e tardivi, effetti locali e
sistemici, patologia cellulare, la degenerazione grassa, vaculare e amiloidea,
i vari tipi di necrosi
L'infiammazione: Fenomeni cellulari e mediatori chimici, effetti
sistemici, flogosi acuta, l'essudato, farmaci antiflogistici, l'edema
trasudatizio: cause e patogenesi; infiammazione cronica, il tessuto di
granulazione, processi riparativi, sclerosi e cirrosi
Aterosclerosi, ipertensione, trombosi: Patogenesi ed evoluzione dei
trombi, l'embolia L'immunità aspecifica e specifica, antigeni ed apteni,
esotossine ed endotossine, gli organi linfopoietici, marcatori di membrana,
complesso maggiore di istocompatibilità, linfociti T e B, struttura degli
anticorpi, anticorpi policlonali e monoclonali, teoria sulla produzione degli
anticorpi, reazione antigene- anticorpo la reazione di precipitazione e
agglutinazione, la fissazione del complemento, applicazioni delle reazioni
immunitarie, sierodiagnosi e sieroprofilassi, immunoterapia
Ipersensibilità e malattie allergiche: Eziologia e patogenesi; rigetto
dei trapianti, malattie autoimmuni, tolleranza immunitaria specifica e
aspecifica; immunodeficienza, AIDS, i farmaci immunodepressori
La trasformazione neoplastica e le caratteristiche di malignità:
Genetica dei tumori, cancerogenesi da fattori biologici, chimici e fisici virus
55
- Chimica e Tecnologia Farmaceutiche oncogeni, oncogeni ed antioncogeni, tumori ormonodipendenti, i tumori
professionali, difesa immunitaria contro i tumori, farmaci antitumorali e
farmaci antagonisti ormonali, cenni di terapia genica in campo oncologico
ed applicazioni farmacologiche
Elementi di terminologia medica
TESTI CONSIGLIATI
-G. M. Pontieri, Patologia Generale. Piccin
-V. Dionegani, Trattato di patologia Generale, UTET
BIOCHIMICA
Obiettivi formativi
La Biochimica è lo studio delle reazioni chimiche che permettono la vita sul
pianeta terra. Lo studio della Biochimica ha inizio con la presentazione
delle strutture delle proteine. È descritta quindi la struttura e la funzione
dell'emoglobina con particolare riferimento alle proprietà allostericche di
questa proteina. Si passa allo studio della cinetica delle reazioni catalizzate
dagli enzimi, a determinare le costanti cinetiche (Km e Vmax) e a
considerare l'effetto degli inibitori sulle costanti cinetiche. Sono presi in
considerazione i principi fisico-chimici e i principi termodinamici che
regolano gli equilibri delle reazioni biochimiche catalizzate dagli enzimi.
Sono trattate le più importanti vitamine solubili come precursori dei
coenzimi. Capitolo importantissimo dello studio della Biochimica è il
metabolismo e la sua regolazione con descrizione delle vie metaboliche che
regolano la degradazione dei macroelementi e la sintesi delle molecole e
macromolecole necessarie per la vita. Di fondamentale importanza sono i
processi catabolici e le reazioni terminali che avvengono nei mitocondri: a)
processo di ossido-riduzione fino ad anidride carbonica (ciclo di Krebs) ed
acqua (catena respiratoria); b) fosforilazione ossidativa accoppiata alla
catena respiratoria con sintesi di ATP. Sono prese anche in considerazione
le reazioni di demolizione delle proteine e degli amminoacidi e
l'eliminazione dell'azoto proteico come urea. Infine si affronta lo studio
dell'informazione genetica cioè degli acidi nucleici (DNA e RNA), del
codice genetico e del meccanismo del processo di sintesi proteica.
Programma
La materia vivente: La cellula e le sue unità di struttura e funzione.
Struttura e caratteristiche chimico-fisiche dell'acqua. Legame idrogeno: sua
importanza nell'acqua e nei composti biologici
56
- Chimica e Tecnologia Farmaceutiche -
Proteine: Amminoacidi: classificazione; proprietà acido-basiche; punto
isoelettrico. Proteine: stuttura primaria; struttura secondaria: legame
peptidico, α elica e struttura ß a foglio pieghettato; struttura terziaria;
struttura quaternaria. Conformazione nativa, denaturazione e rinaturazione.
Purificazione e criteri di purezza. Molecole trasportatrici di ossigeno:
mioglobina ed emoglobina
Enzimi: Natura, proprietà e classificazione. Sito attivo dell'enzima.
Specificità di substrato e specificità di azione. Cinetica enzimatica.
Derivazione analitica di Michaelis e Menten secondo Briggs e Haldane.
Significato e determinazione di Km e Vmax. Diagramma secondo
Lineweaver-Burk e secondo Eadie-Hofstee. Dipendenza della velocità di
una reazione enzimatica dalla concentrazione del substrato, dalla
concentrazione dell'enzima, dal pH, dalla temperatura, dalla presenza di
attivatori ed inibitori. Inibizione reversibile ed irreversibile. Inibitore di tipo
competitivo, non competitivo e incompetitivo. Metodi grafici per la
individuazione della natura della inibizione e per la determinazione della
Km, Vmax e Ki. Meccanismo di reazione enzimatica: meccanismo random,
ordinato e a ping-pong. Enzimi regolatori ed allosterici. Modulazione
positiva e negativa. Effetto omotropico ed eterotropico. Isoenzimi
Vitamine: Vitamine idrosolubili e liposolubili. Coenzimi: struttura e
meccanismo d'azione
Membrane biologiche: Fosfolipidi, glicolipidi, colesterolo e proteine.
Caratteristiche e funzioni delle membrane biologiche
Acidi nucleici: Biosintesi delle basi puriniche e pirimidiniche. Nucleosidi
e nucleotidi. Acidi nucleici: struttura e funzione. RNA ribosomiale, RNA
messaggero e RNA transfer. DNA e struttura a doppia elica
Metabolismo: Metabolismo: concetti generali. Principi di termodinamica
nelle reazioni biochimiche. Costante di equilibrio. Energia libera.
Determinazione del senso di una reazione dal calcolo della variazione di
energia libera. Energia di attivazione
Metabolismo glicidico: La glicolisi: reazioni; enzimi; bilancio
energetico. Glicogenolisi: struttura del glicogeno; reazioni; enzimi;
regolazione ormonale. Glicogenosintesi: reazioni; enzimi; regolazione
ormonale. Gluconeogenesi: reazioni; enzimi; regolazione ormonale. Ciclo
dei pentosi fosfati: reazioni; enzimi. Vie di utilizzazione del glucosio 6fosfato in relazione alla necessità di NADH e ribosio 5-fosfato
Metabolismo lipidico: Lipidi. Acidi grassi. Localizzazione cellulare.
Attivazione e trasferimento degli acidi grassi nei mitocondri. ß-ossidazione:
reazioni; enzimi; bilancio energetico. Sintesi ex novo degli acidi grassi:
reazioni; enzimi. Differenze con le reazioni della ß-ossidazione. Corpi
chetonici. Significato fisiologico della formazione dei corpi chetonici
Metabolismo degli amminoacidi: Vie di ossidazione degli
57
- Chimica e Tecnologia Farmaceutiche amminoacidi. Transamminazione, decarbossilazione, deamminazione
ossidativa. Metabolismo di alcuni amminoacidi. Reazioni del glutammato.
Ammoniogenesi. Ciclo dell'urea. Ciclo delle purine
Metabolismo terminale: Decarbossilazione ossidativa del piruvato.
Ciclo dell'acido citrico (ciclo di Krebs): localizzazione mitocondriale;
reazioni; enzimi. Reazioni anaplerotiche. Processi di ossido-riduzione.
Variazione di energia libera nei processi di ossido-riduzione. La catena
respiratoria: componenti; substrati; inibitori. Fosforilazione ossidativa.
Trasporto elettrico nella catena respiratoria. Siti di conservazione
dell'energia: ipotesi chimica, ipotesi conformazionale, ipotesi
chemiosmotica. Gradiente protonico transmembrana. Disaccoppianti e
ionofori. Controllo respiratorio, effetto dei disaccoppianti, effetto degli
ionofori e degli inibitori della catena respiratoria e della fosforilazione
ossidativa
Trasporto mediato da carrier: Diffusione e trasporto mediato da
carrier attraverso le membrane biologiche. I carrier. Metodi diretti e metodi
indiretti per lo studio dei fenomeni di trasporto. Carrier mitocondriali del
fosfato, degli adenin nucleotidi, dei dicarbossilati, dei tricarbossilati, del
chetoglutarato, del glutammato/aspartato e dell'acilcarnitina. Trasporto di
equivalenti di riduzione: shuttles malato-ossalacetato, glicerofosfato,
malato-aspartato
Fotosintesi: Generalità sulla fotosintesi. Reazioni alla luce e reazioni al
buio. Produzione di potere riducente. Fotofosforilazione ciclica e non
ciclica; meccanismo chemiosmotico della fosforilazione fotosintetica. Ciclo
di Calvin
Replicazione, trascrizione e sintesi proteica: Modello di Watson e
Crick del DNA. Replicazione semiconservativa ed esperimento di Meselson
e Stahl. RNA messaggero e la trascrizione. Il codice genetico:
caratteristiche generali, rapporti tra gene e proteina. RNA ribosomiale.
Amminoacidi e RNA transfer. Meccanismo di sintesi proteica. Controllo
dell'espressione genica
Tecnica del DNA ricombinante: Generalità. Applicazioni in ingegneria
genetica e in biotecnologia
Esercitazioni: Metodi elettrochimici. Metodi polarografici: ossigrafo.
Metodi di separazione e purificazione di proteine. Centrifugazione.
Precipitazione frazionata. Cromatografia: ripartizione e adsorbimento.
Cromatografia su strato sottile (TLC), a scambio ionico, per gel-filtrazione,
per affinità. HPLC. Elettroforesi. Spettroscopia. Legge di Lambert-Beer.
Fotometri, spettrofotometri e spettrofotofluorimetri. Tecniche isotopiche.
Isotopi stabili. Isotopi radioattivi. Misura delle radiazioni. Dosaggi
enzimatici. Determinazione dell'attività enzimatica. Determinazione di
substrati.
58
- Chimica e Tecnologia Farmaceutiche -
TESTI CONSIGLIATI
-L. Lehninger, D. L. Nelson, M. M. Cox: Principi di Biochimica - Ed.
Zanichelli, Bologna
-J. D. Rawn: Biochimica - Ed. Mc Graw, Milano
-L. Stryer: Biochimica (IV edizione) - Ed. Zanichelli, Bologna
-M. van Holde: Biochimica - Casa Editrice Ambrosiana, Milano
-D. Voet e J. D. Voet: Biochimica - Ed. Zanichelli, Bologna
-K. Wilson e J. Walker: Metodologia Biochimica. Le Tecniche Biochimiche
in Laboratorio - Raffaello Cortina Editore, Milano
FISIOLOGIA GENERALE
Obiettivi formativi
L’itinerario formativo dei corsi di Fisiologia Generale I e II è volto a fornire
un quadro delle conoscenze nel settore della Fisiologia Umana così da
rispondere alle necessità professionali del laureato in Chimica e Tecnologie
Farmaceutiche. Durante lo svolgimento dei due corsi vengono posti in
risalto i principi generali ed i meccanismi fisiologici più importanti, alla
luce delle più recenti acquisizioni fornite dalla ricerca scientifica. Ciò è
arricchito da riferimenti relativi all’utilizzo delle tecniche moderne
impiegate per acquisire le conoscenze fisiologiche. Le funzioni
dell’organismo nel suo insieme sono analizzate a partire dal livello
molecolare e cellulare (Fisiologia Generale I) fino al livello d’organo e di
sistema (Fisiologia Generale II). Il centro del percorso formativo è
rappresentato dai fondamentali concetti di omeostasi e di rapporto strutturafunzione. Durante lo svolgimento di entrambi i corsi la trattazione dei vari
argomenti è affrontata utilizzando le conoscenze della fisica, della chimica,
dell’anatomia umana, della biologia cellulare e della biochimica, parte
integrante della preparazione precedente allo studio della Fisiologia.
Programma
Omeostasi e rapporti struttura-funzione.
Membrana cellulare: Struttura e funzione. Scambi di sostanze attraverso
le membrane. Trasporti passivi, mediati, attivi primari e secondari.
Potenziale di membrana. Caratteristiche ed eventi ionici del potenziale
d’azione. Trasmissione dell’impulso nelle sinapsi elettriche e chimiche.
Secrezione del neurotrasmettitore. Potenziali post sinaptici. Placca motrice.
Contrazione muscolare: Basi biochimico-strutturali. Meccanica e
regolazione della contrazione. Accoppiamento eccitazione-contrazione.
Ruolo del calcio. Differenze nella contrazione muscolare liscia, scheletrica
59
- Chimica e Tecnologia Farmaceutiche e cardiaca.
Organizzazione del sistema nervoso centrale: Archi riflessi.
Recettori sensoriali. Vie nervose ascendenti. Il midollo spinale ed il
controllo della motilità. Riflesso miotatico. Controllo cerebrale della
vasomotilità: vie piramidali ed extrapiramidali. Struttura e funzione del
Sistema Nervoso Autonomo.
Meccanismo d’azione dei principali tipi di neurotrasmettitori
centrali ed autonomi.
Il concetto di ormone. Interazioni neuro-endocrine.
Il sangue: Funzioni e composizione. Gli elementi figurati del sangue.
Emopoiesi. La coagulazione. Il concetto di risposta immunitaria.
L’emoglobina. Emodinamica: basi fisiche e strutturali. Rapporti pressioneflusso. Regolazione nervosa, ormonale e locale della vasomotilità.
Struttura e funzione del cuore dei mammiferi: Attività elettrica
cardiaca. Parametri cardiaci. Il ciclo cardiaco. Controllo nervoso ed umorale
dell’attività del cuore.
Organi e funzione respiratoria: Trasporto dei gas respiratori e loro
scambi a livello polmonare e tissutale. La meccanica polmonare. Controllo
dell’attività respiratoria.
L’omeostasi idro-minerale: Il rene ed il nefrone: richiami strutturali. La
produzione dell’urina. Controllo della funzionalità renale. Rene ed
equilibrio acido-base. Funzione endocrina del rene.
La digestione: Struttura del canale digerente e sua innervazione. Funzioni
gastriche e funzioni intestinali. Regolazione dei processi digestivi.
TESTI CONSIGLIATI
-C. Casella, V. Taglietti. Principi di Fisiologia. Ed. La Goliardica Pavese.
-R. M. Berne, M. N. Levy. Principi di Fisiologia. Ed. Casa Editrice
Ambrosiana.
-R. Klinke, S. Silbernagl. Fisiologia. Ed. Zanichelli.
FARMACOLOGIA E FARMACOGNOSIA + TOSSICOLOGIA
(Esame integrato, I Modulo)
Obiettivi formativi
Il corso ha come scopo la trattazione degli effetti farmacologici delle
droghe. A tal fine il corso è strutturato in una sezione di farmacologia
generale propedeutica alla trattazione sistematica delle droghe ed in una in
cui verranno trattate le proprietà farmacologiche di ormoni ed autacoidi.
60
- Chimica e Tecnologia Farmaceutiche -
Programma
Cenni di storia della farmacologia
Recettori farmacologici: Interazioni farmaco-recettore, ipotesi di Clark,
Ariens, Stephenson. Agonisti ed antagonisti recettoriali. Metodi di studio di
recettori: binding recettoriale, purificazione dei recettori
Recettori come molecole: Classificazione e struttura dei recettori,
accoppiamento con i sistemi di trasduzione del segnale. Regolazione dei
recettori: desensitizzazione, up regolazione, down regolazione. Azioni
farmacologiche non mediate da recettori
Meccanismi alla base della trasduzione del segnale postrecettoriale: Sistema della adenilato-ciclasi, protein-chinasi e fosfatasi,
metabolismo dei fosfatidil-inositoli ed omeostasi del calcio, monossido
d’azoto e sistema della guanilato-ciclasi. Canali ionici di membrana (per
sodio, potassio, calcio). Pompe e trasportatori. Secrezione costitutiva e
regolata
Vie di somministrazione ed assorbimento dei farmaci: Proprietà
delle membrane cellulari, meccanismi di diffusione passiva, trasporto attivo
e facilitato. Fagocitosi e pinocitosi. Vie di somministrazione dei farmaci
Processi di distribuzione e biotrasporto: Fattori che influenzano il
legame con le proteine plasmatiche. Volume di distribuzione, emivita,
clearance plasmatica, biodisponibilità. Diffusione dei farmaci in distretti
particolari: sistema nervoso centrale, fegato, rene, placenta
Metabolismo dei farmaci: Enzimi responsabili del metabolismo dei
farmaci, reazioni di biotrasformazione, induzione ed inibizione degli enzimi
metabolizzanti i farmaci. Fattori fisiologici e patologici atti a modificare il
metabolismo dei farmaci
Processi di eliminazione dei farmaci: Eliminazione fecale, urinaria,
polmonare, altre vie di eliminazione dei farmaci. Eliminazione presistemica
ed effetto di primo passaggio
Tossicità dei farmaci: Concetti generali sulla tossicità dei farmaci,
valutazione e trattamento. Farmacogenetica ed idiosincrasia farmacologica.
Farmacologia della risposta immune e meccanismi di base della farmacoallergia
Fattori che modificano la risposta ai farmaci: Interazioni a livello
farmacocinetico e farmacodinamico. Tachifilassi, tolleranza metabolica e
cellulare, dipendenza
Come si studia un nuovo farmaco: Saggi biologici prescritti dalla
Farmacopea Ufficiale per lo studio dei farmaci
Principali proprietà farmacotossicologiche delle seguenti droghe
vegetali: Droghe contenenti carboidrat. Droghe contenenti derivati di acidi
grassi. Droghe contenenti saponine. Droghe a principi attivi steroidic.
61
- Chimica e Tecnologia Farmaceutiche Droghe contenenti essenze e resine. Droghe a principi fenolici e polifenolici
Droghe contenenti alcaloidi. Antitumorali di origine vegetale. Droghe
contenenti principi allucinogeni. Varie.
Farmacologia del sistema endocrino: Ormoni tiroidei, paratiroidei,
ipofisari, estrogeni, progestinici, androgeni e anabolizzanti, corticosteroidei,
glucagnone,insulina.
Farmacologia degli autacoidi: Istamina, bradichinina, serotonina,
chinine, eicosanoidi, Paf
TESTI CONSIGLIATI
-Clementi F., Fumagalli G.: Farmacologia Generale e Molecolare Ed.
UTET, Torino, 1999
-Fassina G., Ragazzi E.: Lezioni di Farmacognosia, Droghe Vegetali Ed.
CEDAM, Padova, 1995
-Bruni A. Farmacognosia generale applicata – Ed. PICCIN, Padova,1999
FARMACOLOGIA E FARMACOGNOSIA +TOSSICOLOGIA
(Esame integrato, II Modulo)
Obiettivi formativi
Il corso si propone di illustrare gli effetti sfavorevoli che scaturiscono dalla
interazione di molecole biologiche o xenobiotiche con gli organismi
superiori. Il programma consta di una parte generale riguardante i metodi
sperimentali per la valutazione della tossicità e di una parte speciale in cui
sono analizzati gli effetti specifici ed i meccanismi d’azione di singoli
agenti tossici.
Programma
Parte generale: Curve dose-effetto, DL50, indice terapeutico. Metodi per
la valutazione della tossicità in vitro ed in vivo, tossicità acuta, subacuta,
subcronica e cronica. Mutagenesi, carcinogenesi e teratogenesi. Reazioni
allergiche ed anafilattiche. Assorbimento, distribuzione ed escrezione delle
sostanze xenobiotiche. Metabolismo ed attivazione di sostanze xenobiotiche
Parte speciale: Tossicità da droghe animali. Tossicità da droghe vegetali.
Tossicità da prodotti chimici di impiego corrente. Tossicità organo-specifica
di farmaci appartenenti ai diversi gruppi terapeutici. Tossicità dei farmaci
soggetti ad abuso
62
- Chimica e Tecnologia Farmaceutiche -
TESTI CONSIGLIATI
-Casarett and Doull’s Tossicologia: I fondamenti dell’azione delle sostanze
tossiche - Ed. EMSI, 2000
CHIMICA ORGANICA II
Obiettivi formativi
L’insegnamento fornisce agli studenti le conoscenze e gli strumenti
necessari a correlare la struttura molecolare con la reattività al fine di saper
progettare sintesi di molecole organiche di natura complessa.
Programma
Alchilazione del carbonio nucleofilo. Enolati ed enammine. Reazioni di
nucleofili al carbonio con composti carbonilici. Riduzione del carbonile.
Reazioni di riduzione di altri gruppi funzionali. Reazioni di sostituzione
elettrofila aromatica. Reazioni di sostituzione nucleofila aromatica.
Reazioni di ossidazione in chimica organica
TESTI CONSIGLIATI
-Francis A. Carey and Richard J. Sundberg “Advanced Organic Chemistry”
Plenum Publishing Corporation
CHIMICA ORGANICA III
Obiettivi formativi
Il corso si divide in due parti. Nella prima parte vengono approfondite
alcune importanti tematiche della Chimica Organica sintetica, quali la
stereochimica delle reazioni organiche, l’interconversione di gruppi
funzionali mediante sostituzione nucleofila, la sostituzione nucleofila al
carbonio insaturo. Nella seconda parte, viene invece descritta brevemente la
chimica di alcuni importanti composti eterociclici aromatici, quali furani,
pirroli, tiofeni e piridine.
Programma
Stereochimica delle reazioni organiche: Definizione ed esempi di:
reazione
stereospecifica;
reazione
stereoselettiva;
reazione
diastereoselettiva; reazione enentiospecifica; reazione enantioselettiva;
sintesi enantioselettiva o asimmetrica.
63
- Chimica e Tecnologia Farmaceutiche -
Interconversione di gruppi funzionali mediante sostituzione
nucleofila al carbonio saturo SN2: Meccanismo, stereochimica e
cinetica della reazione SN2. Metodi moderni di sintesi di solfonati e
alogenuri alchilici. Nucleofili al carbonio: sintesi di nitrili, alchilazione di
enolati, enammine, metalloenammine. Nucleofili all’azoto: sintesi di azidi;
alchilazione di ammine; alchilazione di ammidi, immidi e sintesi di Gabriel.
Nucleofili al fosforo: sintesi di sali di fosfonio e preparazione e reattività di
ilidi al fosforo; preparazione di esteri alchilfosfonici mediante reazione di
Michaelis-Arbuzov e preparazione e reattività dei carbanioni fosfonato.
Nucleofili all’ossigeno: sintesi di Williamson degli eteri; alchilazione dei
carbossilati e reazione di Mitsunobu. Nucleofili allo zolfo: alchilazione dei
tiolati: alchilazione dei solfuri e preparazione e reattività delle ilidi allo
zolfo; alchilazione dei solfossidi. Apertura nucleofilica del legame C-O in
eteri ed esteri.
Sostituzione nucleofila al carbonio insaturo: Reattività dei composti
vinilici e arilici nei confronti della sostituzione nucleofila. Sostituzione
nucleofila vinilica: meccanismi di addizione-eliminazione e di addizioneeliminazione. Sostituzione nucleofila aromatica: chimica degli intermedi
arildiazionio; meccanismo SRN1; meccanismo di addizione-eliminazione;
meccanismo di eliminazione-addizione. Reazioni di acilazione:
preparazione di agenti acilanti; metodi moderni di sintesi di esteri e di
ammidi.
Furani, pirroli e tiofeni: Struttura e aromaticità. Reazioni di sostituzione
elettrofila aromatica. Chimica degli anioni e dei derivati organometallici.
Metodi di sintesi.
Piridine: Struttura, basicità e aromaticità. Reazioni di sostituzione
elettrofila aromatica. Reazioni di sostituzione nucleofila. Chimica dei
derivati organometallici. Metodi di sintesi.
TESTI CONSIGLIATI
-Per il Capitolo 1: G. Procter, Stereoselectivity in Organic Synthesis,Oxford
University Press, Oxford, 1998
-Per i capitoli 2 e 3: F. A. Carey, R. J. Sundberg, Advanced Organic
Chemistry, 4th Edition; Kluwer Academic/ Plenum Publishers, New York,
2000.
-Per i Capitoli 4 e 5: D. T. Davies, Aromatic Heterocyclic Chemistry
Oxford University Press, Oxford, 2002
64
- Chimica e Tecnologia Farmaceutiche -
FARMACOLOGIA E FARMACOTERAPIA
Obiettivi formativi
Il corso di Farmacologia e Farmacoterapia è finalizzato allo studio del
meccanismo d’azione dei farmaci e, quindi, degli effetti collaterali, al fine
di fornire le basi razionali per il loro corretto impiego in terapia.
Programma
Cenni di Farmacologia generale: Vie di somministrazione ed
assorbimento dei farmaci. Processi di distribuzione e biotrasporto.
Metabolismo dei farmaci. Processi di eliminazione dei farmaci. Interazioni
tra farmaci. Abitudine.
Farmaci del sistema nervoso centrale e periferico: Anestetici
generali e locali; barbiturici; ansiolitici; antipsicotici; antidepressivi;
inibitori delle MAO; antiepilettici; antiparkinson; analgesici stupefacenti e
loro antagonisti; analgesici non stupefacenti; psicostimolanti ed analettici;
farmaci del sistema colinergico; farmaci del sistema adrenergico; farmaci
del sistema dopaminergico; farmaci del sistema serotoninergico; farmaci del
sistema GABAergico; farmacologia della neurotrasmissione peptidergica
Farmaci del sistema cardiovascolare: Cardiotonici, antiaritmici,
antianginosi, antiipertensivi, farmacologia del sistema renina-angiotensina,
fisiofarmacologia
dell’endotelio
vascolare,
farmaci
delle
iperlipoproteinemie
Farmaci della funzione renale: Diuretici
Farmaci della muscolatura liscia: Antispastici, procinetici, farmaci
attivi sulla motilità uterina
Farmaci della muscolatura striata: Farmaci della placca
neuromuscolare
Farmaci del sangue e degli organi ematopoietici: Antianemici,
anticoagulanti, trombolitici, antipiastrinici
Farmaci del sistema gastrointestinale: Antiacidi, antiulcera, digestivi,
purganti, lassativi.
Farmaci ad azione topica: Disinfettanti, antimicotici, ectoparassiticidi
Chemioterapici: Antimicrobici, antivirali, antineoplastici, antiprotozoari,
antielmintici
Farmaci del sistema immunitario: Immunosoppressori ed
immunostimolanti
Farmaci antiflogistici ed antipiretici: Antinfiammatori steroidei e non
steroidei; antireumatici, antigottosi
Farmaci del metabolismo: Dimagranti, anoressizzanti. Ingrassanti.
65
- Chimica e Tecnologia Farmaceutiche Farmaci antigottosi. Farmaci antidiabetici. Farmaci ipocolesterolemizzanti.
Ipolipidemizzanti
Vitamine: Aspetti farmacoterapeutici e tossicologici (es. shock tia-minico,
indicazioni extraematologiche della vit.B12, etc.)
Ormoni e farmaci delle ghiandole endocrine: Aspetti
farmacodinamici, farmacoterapeutici e tossicologici degli ormoni
corticosurrenalici (mineralo-attivi e glucoattivi, naturali e di sintesi);
inibitori della sintesi dei corticosteroidi ed antagonisti recettoriali. Ormoni
tiroidei e farmaci antitiroidei. Tireocalcitonina. Testosterone e steroidi
anabolizzanti. Antiandrogeni. Estrogeni, Antiestrogeni. Progestinici.
Steroidi usati a scopo anticoncezionale. Insulina, glucagone. Ormoni
ipofisari e ipotalamici.
TESTI CONSIGLIATI
-Goodman and Gilman: Le Basi Farmacologiche delle Terapia, IX edizione
Ed. McGraw-Hill Libri Italia Srl
-Katzung B.: Farmacologia generale e clinica - Ed. Piccin, Padova, 1999
-Munson: Principi di Farmacologia - Ed. Piccin, Padova, 1999
METODOLOGIE BIOCHIMICHE
Obiettivi formativi
Fornire gli strumenti per avvicinarsi alla biochimica sperimentale sia da un
punto di vista teorico sia da un punto di vista sperimentale. Ci si propone di
fornire agli studenti le basi per cogliere i principi e le strategie pratiche delle
tecniche analitiche e preparative per lo studio e la com-prensione della
Biochimica. Importante è l’uso degli isotopi radioattivi sia nella Biochimica
classica sia nella Biologia Molecolare e nell’Ingegneria Genetica. Sono
studiate le tecniche cromatografiche per la separazione e la purificazione di
substrati, di proteine e di acidi nucleici; tecniche cromatografiche
preparative di uso generale (per ripartizione e per adsorbimento), tecniche
prettamente biochimiche (per gel filtrazione e per affinità) e tecniche
analitiche (HPLC). L’elettroforesi è uno importante strumento per separare,
purificare e determinare il peso molecolare di macromolecole di interesse
biochimico come proteine ed acidi nucleici. Sono prese in considerazione le
tecniche per la produzione di anticorpi policlonali e monoclonali e le
metodiche analitiche qualitative e quantitative per mettere in evidenza la
presenza e la produzione di anticorpi. In questo ultimo ventennio particolare
rilievo hanno assunto le tecniche delle biologia molecolare con l’uso degli
enzimi di restrizione, dei plasmidi e dei cosmidi per i processi di
clonazione, e ancora gli enzimi di restrizione per produrre librerie geniche.
66
- Chimica e Tecnologia Farmaceutiche La tecnica della ibridazione su colonia è utilizzata per isolare un gene di
interesse da una libreria genica. Di estrema importanza (anche nelle
indagini poliziesche e nei processi di rico-noscimento di paternità) è la
recente tecnica della reazione di polimerizzazione a catena (PCR) che
permette di moltiplicare in maniera esponenziale piccolissime quantità di
DNA.
Programma
Metodi
di
separazione
e
purificazione:
Centrifugazione.
Precipitazione frazionata e cristallizzazione. Dialisi. Cromatografia:
cromatografia di ripartizione; cromatografia di adsorbimento; cromatografia
su carta e su strato sottile (TLC); gel filtrazione; cromatografia su resine
scambiatrici di ioni; cromatografia liquida ad alta risoluzione (HPLC).
Elettroforesi: Principi generali. Elettroforesi in fase libera. Elettroforesi
zonale. Focalizzazione isoelettrica.
Purificazione e determinazione delle proteine: Metodi per la
determinazione delle proteine totali: Metodo di Kjeldahl. Metodo del
biureto. Metodo di Lowry. Metodo dell'assorbimento della luce ultravioletta
a 280 nm. Omogeneizzazione. Dialisi. Metodi per concentrare le proteine:
Liofilizzazione. Concentrazione per precipitazione. Concentrazione su
resine scambiatrici di ioni
Determinazione del peso molecolare e della struttura di
macromolecole di interesse biologico: Studio del peso molecolare
delle macromolecole: Peso molecolare minimo. Ultracentrifugazione
analitica. Gel-filtrazione. Poliacrilammide gel elettroforesi. Studio della
struttura delle macromolecole: Studio della struttura primaria ( acidi
nucleici, proteine ). Studio della struttura secondaria, terziaria e quaternaria
delle proteine
Studio dell'attività enzimatica: Dosaggio degli enzimi: Metodi ottici
(spettrofotometria, spettrofluorimetria, luminescenza). Metodo radioisotopico. Metodi basati su elettrodi selettivi e a ossigeno. Cinetica enzimatica allo
stato stazionario: velocità iniziale, effetto della concentrazione del substrato,
effetto della concentrazione dell'enzima, effetto della temperatura, effetto
del pH, effetto degli inibitori
Tecniche di biologia molecolare e di manipolazione genetica:
Struttura primaria e secondaria degli acidi nucleici. Funzione degli acidi
nucleici: Classi di RNA. Replicazione, trascrizione e traduzione del DNA.
Isolamento degli acidi nucleici DNA ed RNA. Analisi del DNA:
Elettroforesi ed analisi sequenziale del DNA. Enzimi della manipolazione
genetica: Endonucleasi di restrizione e ligasi. Vettori per il clonaggio:
Plasmidi. DNA virale. Vettori utilizzati negli eucarioti. Isolamento di
67
- Chimica e Tecnologia Farmaceutiche specifiche sequenze di acidi nucleici: DNA complementare. Library di geni.
Ibridizzazione su colonie. Nick translation. Sonde di oligonucleotidi
Tecniche immunochimiche: Produzione di anticorpi policlonali e di
anticorpi monoclinali. Immunoprecipitazione in soluzione: Analisi
qualitativa e quantitativa dell'antigene. Immunoprecipitazione in gel:
Immunodiffusione
sem-plice.
Immunodiffusione
doppia.
Immunoelettroforesi. Dosaggio radioimmunologico (RIA). Dosaggio
immunoenzimatico (ELISA). Dosaggio immunofluorescente (FIA).
Fissazione del complemento
TESTI CONSIGLIATI
-Keith Wilson, Kenneth H. Goulding: Biochimica applicata - Ed. Raffaello
Cortina S. Cantalupi, M. Righi: Biochimica applicata – Ed. CLESAV
CHIMICA FARMACEUTICA E TOSSICOLOGICA III
Obiettivi formativi
Il corso consta di una parte sistematica in cui vengono presi in esame vari
aspetti di classi selezionate di farmaci del sistema nervoso centrale e
periferico, di farmaci dell’apparato cardiovascolare e di ormoni.
Programma
Farmaci del sistema nervoso centrale
Antidepressivi: Meccanismo d’azione, bloccanti la captazione di NA e/o
5HT, inibitori delle MAO, antidepressivi atipici.
Analettici centrali, stimolanti psicomotori, psicodislettici.
Farmaci del sistema nervoso autonomo
Sistema nervoso autonomo.
Farmaci autonomici attivi sulle
sinapsi
colinergiche:
Colinomimetici (agonisti muscarinici, anticolinesterasici, agonisti nicotinici
o ganglio stimolanti) antagonisti muscarinici (alcaloidi della Belladonna,
esteri ed eteri di aminoalcoli, aminoamidi), farm. papaverinici.
Farmaci del sistema simpatico: Simpatomimetici ad azione indiretta,
simpatomimetici ad azione diretta (α-agonisti, β-agonisti), bloccanti il
neurone adrenergico, antagonisti degli adrenocettori (α -bloccanti, βbloccanti).
68
- Chimica e Tecnologia Farmaceutiche -
Farmaci dell’apparato cardiovascolare
Farmaci usati nell’ipertensione: Ad azione centrale, β-bloccanti,
diuretici
tiazidici,
vasodilatatori
(ACE
inibitori,
antagonisti
dell’angiotensina, calcio-antagonisti, α1-bloccanti, attivatori dei canali del
potassio, formazione NO).
Farmaci usati nell’angina: β-bloccanti, calcio-antagonisti, esteri nitrosi,
esteri nitrici.
Farmaci usati nell’insufficienza cardiaca: Eterosidi cardiotonici,
cardiotonici β-adrenergici, cardiotonici inibitori della cAMPfosfodiesterasi.
Antiaritmici: Classi I-V, alcalodi della China, amidi, antiaritm. di classe
III.
Diuretici: Meccanismo d’azione, tiazidi, diuretici dell’ansa, inibitori
dell’anidrasi carbonica, d. risparmiatori di potassio, d. osmotici.
Ipolipidemizzanti: Meccanismo d’azione, statine, fibrati, ac. nicotinico,
resine a scambio anionico, antiaterogenici non ipocolesterolemizzanti.
Ormoni
Ormoni peptidici del pancreas.
Ormoni tiroidei.
Ormoni sessuali femminili: O. steroidei estrogeni e progestinici,
derivati sintetici.
Ormoni sessuali maschili: Androgeni, anabolizzanti.
Glucocorticoidi e mineralcorticoidi.
TESTI CONSIGLIATI
-Artico: Lezioni di Chimica Farmaceutica e Tossicologica – CISU – Roma
-Runti: Fondamenti di Chimica Farmaceutica – LINT – Trieste
-Schroeder, Rufer, Schmiechen: Chimica Farmaceutica – EDISES - Napoli
ANALISI DEI FARMACI II
Obiettivi formativi
Il principale obiettivo del corso è quello di fornire allo studente un quadro
dei metodi chimico-fisici più importanti per una moderna formazione
chimica. Saranno trattati i principali metodi di separazione e purificazione e
le reazioni di identificazione dei principali gruppi funzionali. Il corso
prevede una pratica esercitazionale che include la formazione e
purificazione di alcuni principi attivi, nonché la caratterizzazione chimica e
69
- Chimica e Tecnologia Farmaceutiche fisica di un elevato numero di gruppi funzionali caratteristici.
Programma
Generalità sull’analisi delle sostanze organiche
Esame sistematico di una sostanza organica
Smistamento di una miscela: Solubilità. Estrazione. Sistematica di H.
Staudinger.
Purificazione di sostanze solide: Cristallizzazione. Sublimazione.
Punto di fusione.
Purificazione di sostanze liquide: Definizione di tensione di vapore.
Distillazione. Distillazione frazionata. Distillazione a pressione ridotta.
Distillazione in corrente di vapore.
Cromatografia: Teoria generale. Cromatografia di adsorbimento solidoliquido. Cromatografia di ripartizione liquido-liquido. Cromatografia per
scambio ionico. Cromatografia su colonna. Gas Cromatografia. Rivelatori.
Interpretazione del cromatogramma.
Esame organolettico
Ricerca qualitativa
degli
elementi:
Saggio di Lassaigne.
Riconoscimento dell’azoto, (formazione del Blu di Prussia).
Riconoscimento dello zolfo, (saggio con acetato di piombo).
Riconoscimento degli alogeni . Saggio dell’eosina per il bromo.
Saggi di riconoscimento di carattere generale: Saggi per la ricerca
della struttura aromatica. Formazione di un colorante azoico. Friedel-Crafts.
Saggi per il riconoscimento del doppio legame. Saggio del bromo. Saggio di
Baeyer.
Saggi di riconoscimento dei gruppi funzionali e preparazione dei
derivati cristallini: Acidi carbossilici e riconoscimento. Caratteristiche
chimico-fisiche. Riconoscimento del carattere acido. Reazione di Angeli e
Rimini. Anidridi degli acidi carbossilici e riconoscimento. Composti
carbonilici e riconoscimento. Caratteristiche chimico-fisiche. Formazione di
ossame, (catalisi acida e basica). Formazione di 2,4-dinitrofenilidrazoni.
Reazione di Feeling. Reazione di Tollens. Saggio dello iodoformio
(reazione di Lieben). Esteri degli acidi carbossilici e riconoscimento.
Caratteristiche chimico-fisiche. Reazione di Angeli e Rimini. Preparazione
degli esteri. Esterificazione diretta. Esterificazione con alogenuri.
Esterificazione con metanolo.
Alcoli: Caratteristiche chimico-fisiche. Riconoscimento degli alcoli.
Saggio con il sodio. Reazione di Lucas.
Fenoli: Caratteristiche chimico-fisiche. Riconoscimento dei fenoli. Saggio
al FeCl3. Reazione delle ftaleine.
Ammine: Caratteristiche chimico-fisiche. Riconoscimento delle
70
- Chimica e Tecnologia Farmaceutiche ammine.Saggio Hinsberg. Saggio di diazotazione e copulazione.
Separazione di una miscela costituita da ammine primarie, secondarie e
terziarie. Trattamento con acido nitroso.
Enoli: Riconoscimento degli enoliFormazione di α-bromochetoni
Alogeno derivati: Caratteristiche chimico-fisiche. Alogenuri acilici.
Riconoscimento degli alogenuri acilici. Alogenuri alchilici ed acrilici.
Riconoscimento degli alogenuri alchilici ed acrilici. Saggio con nitrato
d’argento alcolico. Saggio con ioduro di sodio ed acetone
Ammidi, immidi e nitrili: Caratteristiche chimico-fisiche.
Niconoscimento di ammidi e nitrili. Idrolisi ad acidi. Reazione di Angeli e
Rimini.
Nitrocomposti: Caratteristiche chimico-fisiche. Riconoscimento dei
nitrocomposti. Formazione di acidi nitrolici e pseudonitrolici. Formazione
di coloranti azoici.
Eteri: Caratteristiche chimico-fisiche. Riconoscimento degli eteri. Saggio
con lo iodio. Solubilità in H2SO4 conc. e HCl conc.
Carboidrati: Caratteristiche chimico-fisiche. Riconoscimento dei
carboidrati. Saggio di Molisch. Saggio di Feeling.
Idrocarburi: Caratteristiche chimico-fisiche. Riconoscimento degli
idrocarburi paraffinici. Riconoscimento degli idrocarburi olefinici.
Riconoscimento dei dieni coniugati, (reazione di Diel-Alder).
Riconoscimento degli idrocarburi acetilenici. Riconoscimento degli
idrocarburi aromatici.
Amminoacidi: Caratteristiche chimico-fisiche. Saggio con ninidrina.
Sostanze solforate: Caratteristiche chimico-fisiche. Solfati delle basi
organiche. Acidi solforici. Formazione di acidi solfon-idrossamici.
Mercaptani e tiofenoli. Disolfuri.
Polarimetria: Generalità.
Stereochimica: Isomeria ottica. Strutture asimmetriche e dissimetriche.
Entantiomeria e diastereoisomeria. Isomeria ottica nei composti contenenti
atomi di carbonio asimmetrici.
Configurazione relativa e assoluta.
Modificazioni racemiche: Tipi di modificazioni racemiche. Punto di
fusione dei racemi. Metodi di formazione delle modificazioni
racemiche.Risoluzione delle modificazioni racemiche. Purezza ottica.
Analisi conformazionale.
Isomeria geometrica o etilenica: Determinazione della configurazione
degli isomeri geometrici.
Natura della luce polarizzata ed origine dell’attività ottica:
Birifrangenza circolare e rotazione del piano della luce polarizzata.
Produzione della luce polarizzata linearmente: Polarimetria. Dipendenza del
71
- Chimica e Tecnologia Farmaceutiche potere rotatorio specifico da solvente, temperatura e lunghezza d’onda.
Effetto Cotton.
TESTI CONSIGLIATI
-Franco Chimenti – Identificazione sistematica di composti organici –
Editoriale Grasso
FITOFARMACIA
Obiettivi formativi
Gli obiettivi che si intende raggiungere attraverso lo studio dei principi
attivi delle piante medicinali sono quelli di fornire le basi chimiche della
moderna fitoterapia, evidenziando gli steps e le tecniche fondamentali dello
screening fitochimica e le basilari caratteristiche chimiche e chimico-fisiche
delle principali classi di composti naturali usati in terapia.
Programma
Definizioni: Definizioni di pianta officinale e medicinale, droga, principi
attivi e loro utilizzo in Campo officinale e medicinale.
Tecniche: Principali tecniche di estrazione di principi attivi da piante
officinali e medicinali. Principali tecnichedi separazione di principi attivi da
miscele a più componenti. Principali tecniche di riconoscimento a mezzo
saggi chimici. Principali tecniche spettroscopiche di riconoscimento di
composti naturali.
Saponine: Distribuzione botanica, caratteristiche chimico-fisiche
strutturali, biosintesi, estrazione e purificazione, caratterizzazione chimica e
spettroscopica, utilizzo terapeutico.
Terpeni: Distribuzione botanica, caratteristiche chimico-fisiche strutturali,
biosintesi, estrazione e purificazione, caratterizzazione chimica e
spettroscopica, utilizzo terapeutico.
Alcaloidi: Distribuzione botanica, caratteristiche chimico-fisiche
strutturali, biosintesi, estrazione e purificazione, caratterizzazione chimica e
spettroscopica, utilizzo terapeutico.
Flavonoidi: Distribuzione botanica, caratteristiche chimico-fisiche
strutturali, biosintesi, estrazione e purificazione, caratterizzazione chimica e
spettroscopica, utilizzo terapeutico.
Cumarine: Distribuzione botanica, caratteristiche chimico-fisiche
strutturali, biosintesi, estrazione e purificazione, caratterizzazione chimica e
spettroscopica, utilizzo terapeutico.
Steroli: Distribuzione botanica, caratteristiche chimico-fisiche strutturali,
72
- Chimica e Tecnologia Farmaceutiche biosintesi, estrazione e purificazione,
spettroscopica, utilizzo terapeutico.
caratterizzazione
chimica
e
TESTI CONSIGLIATI
-Capasso-Grandolini; Fitofarmacia.
-Morelli; Principi attivi delle piante medicinali, Edagricole.
BIOCHIMICA APPLICATA
Obiettivi formativi
Conoscenza delle tecniche biochimiche e capacità di valutarne
l'applicazione allo studio di sistemi isolati (enzimi, proteine di trasporto,
reattori, ecc.) e di interi processi metabolici cellulari. Acquisizione di una
visione globale del metabolismo, della sua regolazione e delle interrelazioni
fra gli organi. Conoscenza delle basi molecolari e della diagnostica di
alcune malattie causate da difetti biochimici del metabolismo, anche di
origine genetica. Capacità di utilizzare il computer e la rete (internet) per
l'analisi delle macromolecole di interesse biologico.
Programma
Nozioni generali: Interrelazioni metaboliche. Connessioni e regolazioni
delle vie metaboliche. Reazioni vettoriali. Comunicazione dell’ambiente
intra-cellulare con quello extracellulare, compartimentazione della cellula.
Comunicazione fra i compartimenti della cellula. Famiglie di proteine.
Criteri di identificazione. Bioinformatica (vedi tecniche). Proteine di
membrana. Traslocasi, canali, recettori: funzione e struttura. Malattie rare
Tecniche di laboratorio: Spettrofotometria. Legge di Lambert-Beer;
spettrofoto-metro. Microscopia confocale. Dosaggio enzimatico. Utilizzo
della spettrofotometria, Dosaggio del substrato; reazioni accoppiate.
Elettroforesi. Principi generali; elettroforesi su gel; determinazione
quantitativa delle proteine separate su gel (Laser scanning). PCR.
Determinazione della sequenza degil acidi nucleic. Tecniche per lo studio
dell’attività dei canali. Patch clamp. Tecniche per lo studio dell’attività delle
traslocasi. Purificazione delle proteine. Ricostituzione in vescicole
fosfolipidiche artificiali (proteoliposomi). Anticorpi fluorescent. Time lapse
video microscopi. Metodi bioinformatici. Allineamenti di sequenze
amminoacidiche e nucleotidicche. Utilizzo del computer per l’analisi di
sequenze amminoacidiche di proteine. Identificazione di famiglie di
proteine
Trasporto di membrana: Criteri per la distinzione fra trasporto
73
- Chimica e Tecnologia Farmaceutiche catalizzato e diffusione. Traslocasi e canali ionici . Tecniche per lo studio
dell’attività delle traslocasi e dei canali.
Struttura del recettore
dell'acetilcolina Differenze ed analogie fra traslocasi e canali (criteri
sperimentali di distinzione). Trasporto attivo ed attivo secondario;
“uniport”, “antiport” e “symport”. Reazione di trasporto: ∆G. Criteri per
distinguere l’”uniport” dall’”antiport”. Struttura delle traslocasi.
Trasportatori del glucosio.
Metabolismo glucidico: Metabolismo del glucosio. Omeostasi del
glucosio: trasportatori del glucosio Na+-dipendente; trasporto di fruttosio e
galattosio. Ruolo del glucosio-6-fosfato; relazioni fra glicolisi,
gluconeogenesi, sintesi e degradazione del glicogeno e sistemi di trasporto.
Famiglia dei Glut (trasportatori del glucosio), 1-5 (classificazione e
funzione). Insulina. Struttura. Meccanismo di induzione della secrezione di
insulina da parte delle cellule β delle Isole. Meccanismo di azione
dell’insulina : recettore dell’insulina (IRSI-2). Azioni dell’insulina: effetti
sui trasportatori del glucosio, sulle fosfatasi e sulla CPT-1 (carnitinapalmitoiltransferasi I). Diabete. Tipi di diabete: insulino-dipendente ed
indipendente. Complicazioni del diabete e loro cause. Tossicità del
glucosio: effetti sul mio-inositolo e sulla PKC (proteina kinasi C);
glicosilazione delle proteine. Diagnosi del diabete: metodi per il dosaggio
del glucosio e curva da carico. Dieta insulina ricombinante. Dolcificante:
potere dolcificante, differenti tipi dolcificanti
Metabolismo lipidico: Metabolismo dei grassi. Assorbimento intestinale
e trasporto nei tessuti. Estrazione dell’energia dagli acidi grassi.
Regolazione della biosintesi degli acidi grassi (importanza del citrato).
Conversione del glucosio ad acidi grassi. Trasporto di carnitina.
Carnitinatraslocasi della membrana plasmatica CPT. Carnitina,
acilcarnitina-traslocasi mitocondriale: studi strutturali e funzionali sulla
proteina purificata. Patologie da deficienza della traslocasi mitocondriale.
Metabolismo del colesterolo. biosintesi, regolazione e trasporto nel sangue.
Lipoproteine: classificazione e funzione. Trasporto dei grassi: chilomicroni,
VLDL, LDL, IDL, HDL.Recettori delle LDL: struttura, funzione e
regolazione della biosintesi; meccanismo di ingresso delle LDL nella
cellula. Ipercolesterolemia familiare. Ipercolesterolemia acquisita.
Trattamenti farmacologici: risene a scambio ionico ed inibitori
dell’HMGCOA-DH e dieta. Dosaggio di colesterolo e lipoproteine nel
plasma: significato clinico. Obesità. Meccanismi di controllo del peso
corporeo. Gene dell’obesità: funzione, Uncoupling protein 1,2,3.
Trattamento dell’obesità. Diete. Caratteristiche essenziali dei trattamenti
dietetici; diete bilanciate e sbilanciate
Metabolismo dell’azoto: Catabolismo degli amminoacidi. Digestione
enzimatica delle proteine. Assorbimento degli amminoacidi: sistemi di
trasporto. Catabolismo degli amminoacidi. Produzione di ammoniaca.
74
- Chimica e Tecnologia Farmaceutiche Sistemi di rimozione dell’ammoniaca. Sistema periportale e perivenoso del
fegato. Glutammina come trasportatore non tossico di ammoniaca. Idrolisi
della glutammina nel fegato e ciclo dell’urea; ornitina/citrullina traslocasi.
Tossicità dell’ammoniaca. Iperammoniemia. Sindrome iperammonemica.
Sindrome HHH. Dosaggio dell’ammoniaca nel sangue. Amminoacidopatie.
Cenni. Fenilchetoneria. Causa. Metodi di diagnosi. Altri composti azotati.
Creatina e creatinina. Funzione del sistema creatina-creatinafosfato e sua
regolazione. Dosaggio di creatina e creatinina nel plasma: significato clinico
Urea. Dosaggio dell’urea nel sangue (azotemia): significato clinico
Apoptosi: Significato. Geni e prodotti genici (proteina) che regolano il
bilancio tra vita e morte in cellule di Caenorhabditis elegans. Fasi
dell’apoptosi negli organismi superiori Bcl-x, Apaf, Caspasi, CAD, P53,
citocromo c. ruolo dei mitocondri nell’apoptosi: ROS e canali. CAD ed
ICAD. Relazioni tra tumori e apoptosi
AIDS: Virus HIV: composizione del genoma; meccanismo di infezione;
meccanismo di replicazione e sua regolazione: geni “gag, env, pol, tat, rev”
e prodotti proteici. Meccanismo di inattivazione della difesa immunitaria da
parte dell’HIV. Interazione dell’HIV con linfociti T helper, recettori CD4.
Recettori CCR5 dei monociti. Terapie: AZT, inibitori della proteasi, vaccini
contro CCR5. Meccanismo di azione e cause della tossicità dell’AZT
TESTI CONSIGLIATI
-Montgomery et al.: Biochimica: aspetti medico-biologici – Ed. Ermes
-Rabbi, Lenaz: Biochimica metabolica cellulare e dei tessuti – Ed. UTET
-Devlin: Biochimica – Ed. Gnocchi
-Stryer: Biochimica – Ed. Zanichelli
-Watson et al.: DNA ricombinante – Ed. Zanichelli
-Alberts et al.: Biologia molecolare della cellula – Ed. Zanichelli
TECNOLOGIA, SOCIOECONOMIA E LEGISLAZIONE
FARMACEUTICHE
Obiettivi formativi.
Il corso ha lo scopo di fornire allo studente informazioni teorico-pratiche
sulle principali forme farmaceutiche e sulle tecniche utilizzate nelle
preparazioni galeniche e magistrali. Inoltre fornisce informazioni sulla
legislazione vigente in merito alla professione del farmacista.
Programma
Responsabilità professionali del farmacista. Classificazione amministrativa
75
- Chimica e Tecnologia Farmaceutiche delle farmacie. Farmacopea ufficiale. Formulario nazionale. Registri e
documenti obbligatori. Classificazione dei medicinali in base alla
prescrivibilità (medicinali non soggetti a prescrizione medica SOP e OTC,
medicinali soggetti a prescrizione medica, medicinali soggetti a prescrizione
medica da rinnovare volta per volta, medicinali soggetti a prescrizione
medica limitativa, medicinali soggetti a prescrizione medica speciale).
Tabelle delle sostanze soggette a controllo (stupefacenti). Registro di entrata
e di uscita degli stupefacenti. Bollettario buoni-acquisto. Medicinali per uso
veterinario. Classificazione amministrativa dei medicinali: medicinali
prodotti dall’industria (specialità medicinali, farmaci preconfezionati
prodotti dall’industria, farmaci generici, concetto di bioequivalenza).
Medicinali allestiti in farmacia. Etichettatura e tariffazione. Incompatibilità.
Galenici magistrali. Galenici ospedalieri. Galenici multipli. Fasi dello
sviluppo di un farmaco. Farmacovigilanza. Preformulazione. Fasi di
sviluppo di una nuova entità chimica (NCE). Saggi necessari per
caratterizzare i nuovi,farmaci. Stati della materia. Cenni sullo stato gassoso
e liquido, lo stato solido (Stato amorfo e stato cristal1ino. Polimorfismo e
pseudopolimorfismo. Enantiotropia e monotropia. Aspetti pratici del
polimorlismo:dei Farmaci). Lo stato mesomorfico (Cristalli liquidi
termotropici e liotropi). Applicazioni tecnologiche. Analisi termica. Analisi
termica differrenziale e calorimetrica a scansione differenziale. Principali
applicazioni in campo farmaceutico. Sistemi plurifasici. Regola delle fasi.
Sistemi condensati. Sistemi a due componenti contenenti fasi liquide.
Liquidi parzialmente miscibili. Effetto di un additivo sulla miscibilità di due
componenti. Applicazioni Farmaceutiche. Sistemi a due componenti
contenenti fasi solide e fasi liquide. Eutettici: applicazioni farmaceutiche.
Sistemi a tre componenti. Diagramma triangolari, applicazioni
farmaceutiche. La dissoluzione. Basi fisiche del processo di dissoluzione.
Solubilità di gas in liquidi, di liquidi in liquidi e di solidi in liquidi. Aspetti
pratici sulla solubilità dei farmaci. Metodi utilizzati per incrementare la
solubilità dei farmaci (Scelta del sale opportuno per elettroliti deboli; pH
limite di precipitazione. Uso di cosolventi. Utilizzo di micelle dirette ed
inverse. Formazione di complessi, ciclodestrine. Derivatizzazioni
chimiche).Coefficiente dl ripartizione. Effetto dei fenomeni di associazione
e di dissociazione sul coefficiente di partizione.Le proprietà di trasporto. La
diffusione. 1a legge di Fick. Stato stazionario e quasi stazionario. Seconda
legge di Fick sulla diffusione. Diffusione attraverso membrane. Velocità di I
dissoluzione di un solido in un liquido. Legge di Noyes e Witney. Fattori
influenzanti la velocità di dissoluzione. Influenza della velocità di
dissoluzione sulla velocità di assorbimento. Applicazioni farmaceutiche.
Fenomeni interfacciali. Tensione superficiale ed interfacciale. Equazione di
adsorbimento di Gibbs. Tensioattivi. Fenomeni di autoassociazione. La
concentrazione micellare critica. Micelle. Il concetto di HLB e calcolo del
76
- Chimica e Tecnologia Farmaceutiche suo valore. Proprietà dei tensioattivi in relazione ai valori di HLB.
Classificazione dei tensioattivi. Sistemi dispersi. Definizione.
Classificazione. Le soluzioni farmaceutiche (solide e liquide). Solventi e
cosolventi: caratteristiche in relazione alla via di somministrazione della
forma di dosaggio. Isotonia. Come rendere isotonica una soluzione
farmaceutica. Vantaggi e svantaggi dell'uso di soluzioni come forma di
dosaggio. I sistema Colloidali. Colloidi liofili, colloidi liofobi, di
associazione e colloidi protettori. Proprietà dei sistemi colloidali (effetto
Tyndall, moti Browniani, diffusione, sedimentazione). Stabilità dei sistemi
colloidali. Il potenziale zeta. Come influire sulla stabilità dei sistemi
colloidali. Coacervazione. Colloidi protettivi. Impiego in campo
farmaceutico. Emulsioni Farmaceutiche. Agenti emulsionanti. Instabilità
delle emulsioni. Come stabilizzare una emulsione. Metodi di preparazione.
Emulsioni parenterali: caratteristiche, emulsioni multiple. Test di stabilità
per una emulsione. Sospensioni Farmaceutiche. Definizione e
caratteristiche. Sedimentazione. Sospensioni flocculate e deflocculate.
Flocculazione controllata. Instabilità delle sospensioni. Come stabilizzare
una sospensione. Semisolidi farmaceutici. Classificazione. Unguenti.
Creme. Paste. Geli. Definizioni, proprietà, struttura e metodi di
preparazione. Stabilità e stabilizzazione dei Farmaci. Cause di possibili
variazioni strutturali dei Farmaci. Misura della velocità di alterazione.
Reazioni di ordine zero e di ordine superiore. Tempo di emivita.
Determinazione della data di scadenza della forma di dosaggio. Equazione
di Arrhenius. Test accelerati di stabilità. Come preservare da alterazione di
tipo idrolitico le sostanze presenti nelle forme di dosaggio. Alterazioni
ossidative ed autoossidative. Sterilizzazione. Antimicrobici più utilizzati in
campo farmaceutico. Antiossidanti. Sostanze coadiuvanti. Determinazione
dell'indice di idroperossidi. Preparati per uso oftalmico. Fisiologia
dell'occhio (cenni). Preparazione e requisiti. Preparati per uso parenterale.
Vie di somministrazione. Preparazione e requisiti. Polveri per preparati
iniettabili Liquidi perfusionali. Acqua per preparazioni iniettabili. Olii per
preparazioni iniettatili. Contenitori. Prepararti per uso dermatologico.
Apparato tegumentario. La funzione barriera della pelle. Eccipienti per uso
dermatologico. Tecniche di preparazione: Sistemi Terapeutici Transdermici.
Assorbimento percutaneo. Fattori influenzanti l'assorbimento percutaneo.
Promotori di assorbimento. Efficacia di un sistema transdermico.
Progettazione di un sistema transdermico. Prove di cessione del farmaco.
Polveri. Proprietà. Analisi granulometriche. Densità vera ed apparente.
Caratteristiche di scorrimento delle polveri. Compresse. Caratteristiche
tecnologiche. Eccipienti. Granulazione. La copertura delle compresse.
Compresse gastroresistenti. Controllo di qualità sulle compresse. Tempo di
disaggregazione e tempo di dissoluzione. Capsule. Tipi di capsule. La
gelatina. Materiali utilizzati nella copertura delle capsule. Capsule
77
- Chimica e Tecnologia Farmaceutiche gastroresistenti. Controlli di qualità sulle capsule. Aerosol Farmaceutici.
Metodi non convenzionali per somministrare, veicolare, c/o direzionare i
farmaci. Legislazione attuale.
TESTI CONSIGLIATI
-Farmacopea Ufficiale Italiana X Ed.
-Amorosa "Principi di Tecnica Farmaceutica" L. Tinarelli- Bologna V Ed.
1995
-Martin "Phisical Pharmacy" Lea e Febiger-Philadelphia IV Ed. 1993
-A.T. Florence, D. Attwood "Physicochemical: Princles of Pharmacy" 1993
-P. V. Atkins "Chimica Fisica" Zanichelli Bologna
CHIMICA ORGANICA AVANZATA
Obiettivi formativi
Il corso si propone di approfondire lo studio di alcune tra le più importanti
reazioni utilizzate nella sintesi organica moderna.
Programma
Interconversione di gruppi funzionali mediante sostituzione
nucleofila: Conversione di alcoli in agenti alchilanti. Introduzione di
gruppi funzionali mediante sostituzione nucleofila al carbonio saturo.
Apertura nucleofilica di legami carbonio-ossigeno in eteri ed esteri.
Interconversione di derivati degli acidi carbossilici.
Reazioni di cicloaddizione: Definizioni introduttive. Reazioni di DielsAlder: meccanismo, stereochimica, regiochimica, applicazioni sintetiche.
Cenni sulle cicloaddizioni fotochimiche.
Organoborani: Sintesi di organoborani. Reazioni degli alchilborani e
degli alchenilborani. Reazioni degli allilborani con composti carbonilici.
Organostannani: Sintesi di organostannani. Reazioni degli allilstannani
con composti carbonilici.
Composti organorame: Sintesi dei derivati organorame. Reazioni dei
composti organorame con: alogenuri e solfonati; epossidi; composti
carbonilici α,β-insaturi. Reagenti di Normant e loro addizione ad alchini.
Coupling di Ullmann degli alogenuri arilici.
Reazioni che implicano intermedi organopalladio: Formazione e
reattività degli intermedi organopalladio. Reazioni che implicano intermedi
organopalladio: ossidazione di etilene ad acetaldeide (reazione di Wacker) e
di olefine a metilchetoni; allilazione di nucleofili (reazione di Tsuji-Trost);
reazione di alogenuri con alcheni (reazione di Heck) ed 1-alchini (reazione
78
- Chimica e Tecnologia Farmaceutiche di Sonogashira); reazioni di cross-coupling di alogenuri con: reattivi
organometallici di litio e magnesio, reattivi organozinco (reazione di
Negishi), organostannani (reazione di Stille), organoborani (reazione di
Suzuki), enolati; reazioni di carbonilazione di alogenuri e di substrati
insaturi.
TESTI CONSIGLIATI
-F. A. Carey, R. J. Sundberg, Advanced Organic Chemistry, Part B:
Reactions and Syntheses (4th Edition); Kluwer-Plenum, New York, 2001.
PATOLOGIA CELLULARE ED ULTRASTRUTTURALE
Obiettivi formativi
L'obiettivo principale dell'insegnamento è quello di fornire un adeguato
approfondimento delle conoscenze relative alle alterazioni morfologiche e
strutturali delle varie componenti cellulari, in condizioni normali e
patologiche, al fine di permettere una migliore comprensione dei
meccanismi biomolecolari responsabili delle principali patologie esaminate.
Programma
I danni cellulari letali e subletali: Agenti chimici, agenti fisici,
alterazioni genetiche
Lo stress cellulare: Ipossia, iperossia, anossia, ipertrofia, iperplasia,
atrofia, amiloidi
La necrosi anossica: Aterogenesi, ipertensione vascolare
L'invecchiamento
cellulare:
Degenerazione
neurofibrillare,
placcheneuritiche, lipofuscine
L'apoptosi: Ceramidi, calcio,proteasi, alterazioni nucleari e cito scheletriche, geni pro- e anti-apoptotici, modulazione farmacologia
La risposta infiammatoria: Alterazioni endoteliali, mediatori chimici
esogeni ed endogeni, inibitori dei mediatori chimici
La trasformazione neoplastica: Agenti cancerogeni anaplasia,
metapiasia, oncogeni, tumor suppressor genes, interazioni cellula tumoraleospite, ruolo delle integrine, vascolarizzazione, etastatizzazione . Il nucleo.
Alterazioni morfologiche e strutturali, inclusioni e pseudo-inclusioni
I cetrioli: Struttura e funzione in cellule normali e neoplastiche
I mitocondri: Struttura e funzione, alterazioni strutturali e morfologiche
in cellule normali e neoplastiche.
Il complesso dei Golgi: Granuli e degranulazione.
79
- Chimica e Tecnologia Farmaceutiche -
La membrana cellulare: Alterazioni strutturali e morfologiche in cellule
normali e neoplastiche.
La lamina basale: Alterazioni morfologiche e funzionali in condizioni
normali e patologiche
Il glicocalice: Corpi glicocaliccali, microcroparticelle sferiche, cristalli.
Le giunzioni cellulari: Struttura e funzione in cellule normali e in
condizioni. Patologiche.
Esocitosi ed endocitosi: Fagocitosi, pinocitosi, emperipolesi, blebs,
bhsters.
Processi cellulari: Microvilli, uropodi, podociti, ropalociti, vennipodi,
anemone cells, hairy cells.
La matrice extracellulare: Struttura e funzione, patologie causate da
alterazioni della componente fibrosa della matrice
TESTI CONSIGLIATI
-P .Constantinides: GeneraI pathobiology - Ed. Appleton & Lange G. Majno, I. Joris: CelI, tissue and disease - Ed.Biackwell Science
-F.N. Ghadially: Ultrastructural pathology of the celI and matrix Ed.
Nutterworth-Heinemann
NEUROPSICOFARMACOLOGIA
Obiettivi formativi
L’obiettivo del corso è quello di fornire nozioni fondamentali circa il
meccanismo d’azione dei farmaci più comunemente impiegati per la terapia
di patologie del SNC, sia della sfera motoria che cognitiva. Al termine del
corso lo studente avrà consolidato le sue conoscenze neurofisiologiche ed
acquisito nozioni fondamentali di neurofisiopatologia, limitatamente a quei
targets neurobiologici fondamentali per la comprensione dell’azione dei
farmaci. Il corso ha la finalità di fornire nozioni fondamentali circa i
meccanismi neurotrasmettitoriali alla base delle funzioni motorie e
cognitive sia normali che patologiche.
Programma
Catecolamine: Presenza e distribuzione nel SNC, biosintesi, degrada-
zione, recettori
Serotonina: Presenza e distribuzione nel SNC, biosintesi, degrada-zione,
recettori:
Acetilcolina: Presenza e distribuzione nel SNC, biosintesi, degrada-zione,
80
- Chimica e Tecnologia Farmaceutiche recettori
GABA: Presenza e distribuzione nel SNC, biosintesi, degrada-zione,
recettori
Glutammato: Presenza e distribuzione nel SNC, biosintesi, degradazione, recettori
Neuropeptidi (peptidi oppioidi ed altri neuropeptidi): Presenza e
distribuzione nel SNC, biosintesi, degrada-zione, recettori
Istamina: Presenza e distribuzione nel SNC, biosintesi, degradazione,
recettori
Adenosina e derivati purinici: Presenza e distribuzione nel SNC,
biosintesi, degrada-zione, recettori
Strategie terapeutiche nel morbo di Parkinson
Strategie terapeutiche nella malattia di Alzheimer
Controllo farmacologico dell’epilessia
Farmaci usati nel trattamento delle psicosi
Farmaci usati nel trattamento dei disordini affettivi
Farmaci usati nel trattamento dell’ansia e dell’insonnia
TESTI CONSIGLIATI
-Govoni S., Frattola L., Racagni G., Smeraldi E.: Neuropsicofarmacologia
Ed. UTET, Torino, 1999
CHIMICA FARMACEUTICA APPLICATA
Obiettivi formativi
L’ attenzione del corso sarà rivolta allo studio dei vari metodi di sintesi di
molecole otticamente attive (farmaci, pesticidi, proteine , carboidrati etc.)
con particolare riferimento a metodiche di utilizzo a livello industriale con
l’intento di discutere sui fattori che giocano un ruolo rilevante nel
determinare la scelta delle particolari vie sintetiche delle molecole in
questione.
Programma
Introduzione all’isomeria ottica. Chiralità ed attività biologica. Metodologie
di sintesi. Metodiche di fermentazione. Pool chirali. Risoluzione di racemati
via cristallizzazione. Trasformazioni enzimatiche. Sintesi asimmetriche
catalitiche. Tecniche analitiche per la determinazione della purezza ottica.
Processi industriali per la preparazione di: Antiinfiammatori non steroidei,
β-bloccanti, ACE-inibitori, Calcio-antagonisti, carnitina, aspartame,
81
- Chimica e Tecnologia Farmaceutiche antibiotici b-lattamici, amminoacidi, insetticidi, erbicidi.
TESTI CONSIGLIATI
-Roger A. Sheldon, Chirotecnology- Industrial synthesis of optically active
compounds.-C. G. Wermuth : Le applicazioni della Chimica Farmaceutica. Edises
STEREOCHIMICA
Obiettivi formativi
Il corso si propone di approfondire gli aspetti fondamentali della
stereochimica delle molecole organiche, mettendo in evidenza l’importanza
dello studio dell’architettura molecolare in tre dimensioni ai fini della
comprensione delle proprietà e della reattività delle molecole.
Programma
Definizioni fondamentali: Definizione di struttura molecolare e di
coordinate interne. Fattorizzazione della struttura molecolare in costituzione
e stereochimica. Costituzione e isomeri costituzionali. Configurazione e
stereoisomeri
configurazionali.
Conformazione
e
stereoisomeri
conformazionali o conformeri.
Stereoisomerismo: Classificazione degli stereoisomeri in enantiomeri e
diastereoisomeri. Chiralità e classificazione morfologica dei leganti.
Enantiomerismo e chiralità. Diastereoisomerimo. Definizione di centro
stereogenico, asse stereogenico, centro pseudoasimmetrico.
Simmetria molecolare: Definizione di operazione di simmetria ed
elemento di simmetria. Elementi di simmetria di una molecola. Previsione
delle chiralità di una molecola sulla bese delle sue proprietà di simmetria.
Stereoisomerismo residuo: Definizione di stereoisomerismo residuo e
stereoisomeri residui. Stereosiomerismo residuo in molecole acicliche.
Stereosiomerismo residuo in molecole cicliche.
Configurazione: Descrittori della configurazione assoluta di un centro
chirale. Metodo di Bijvoet per la determinazione della configurazione
assoluta. Definizione di configurazione relativa di più centri chirali
all’interno di una molecola e relativa notazione. Nomenclatura per centri
pseudoasimmetrici. Definizione di configurazione relativa di un centro
chirale di una molecola rispetto a quella di un’altra molecola.
82
- Chimica e Tecnologia Farmaceutiche Determinazione della configurazione relativa di composti alifatici saturi.
Proprietà degli stereoisomeri: Definizione introduttive. Importanza
dello studio delle proprietà degli stereoisomeri e differenza tra le proprietà
dei diastereoisomeri e proprietà degli enantiomeri. Concetto di
discriminazione diastereoisomerica. Concetto di discriminazione
enantiomerica. Natura dei racemati cristallini. Discriminazione
enantiomerica e proprietà dei racemati e dei loro componenti enantiomerici.
Determinazione della composizione enantiomerica di un composto chirale.
Separazione degli stereoisomeri: Risoluzione. Racemizzazione.
Definizione di attivazione ottica e risoluzione. Risoluzione di conglomerati
mediante tecniche di cristallizzazione. Trasformazioni asimmetriche di
enantiomeri. Separazione chimica di enantiomeri mediante formazione di
diastereoisomeri. Trasformazioni asimmetriche di diastereoisomeri.
Risoluzione cinetica. Racemizzazione ed epimerizzazione.
Proprietà topologiche dei leganti e delle facce: Prostereoisomerismo.
Classificazione topologica di leganti e facce omomorfici. Relazione tra le
proprietà topologiche di leganti e facce omomorfici e loro proprietà fisiche
e chimiche. Criteri di sostituzione e di simmetria per determinare le
proprietà topologiche dei leganti e delle facce in molecole rigide. Proprietà
topologiche di leganti e facce omomorfici in sistemi conformazionalmente
mobili. Concetto di prostereoisomerismo e prochiralità. Descrittori per
leganti e facce eterotopiche, centri prostereogenici e centri prochirali.
Conformazione di molecole acicliche: Introduzione all’analisi
conformazionale: energia di tensione (“strain energy”) di una molecola e
meccanica molecolare. Analisi conformazionale di alcani semplici e di
molecole sature acicliche con sostituenti o catene polari; effetto anomerico.
Analisi conformazionale di molecole insature acicliche. Conformazione e
reattività: equazione di Winstein-Holness e principio di Curtin-Hammett.
Configurazione
e
conformazione
di
molecole
cicliche:
Stereoisomerismo configurazionale nei composti ciclici e relativa
nomenclatura. Stabilità delle molecole cicliche: teoria della tensione di
Baeyer e suo superamento; concetto di tensione di anello (“ring strain”) e
analisi conformazionale di molecole cicliche. Analisi conformazionale per
cicloesani monosostituiti. Cenni sull’analisi conformazionale per cicloesani
di- e polisostituiti; ciclanoni; cicloesene; eterocicli saturi a 6 membri. Cenni
sulla stereochimica degli anelli fusi e a ponte; regola di Bredt. Facilità delle
reazioni di ciclizzazione.
TESTI CONSIGLIATI
-Eliel, E. L.; Wilen, S. H.; Mander, N. Stereochemistry of Organic
Compounds; Wiley-Interscience: New York, 1994.
83
- Chimica e Tecnologia Farmaceutiche -
ENZIMOLOGIA
Obiettivi formativi
L’obiettivo principale di questo corso è quello di approfondire il
comportamento degli enzimi isolati e purificati dalle cellule degli organismi
viventi. Lo svolgimento di un processo biochimico e la sua regolazione
possono essere studiati secondo due criteri: - criterio termodinamico che ci
permette di seguire la direzione verso la quale i processi chimici avvengono
spontaneamente con produzione di energia in funzione delle concentrazioni
ma indipendentemente dal tempo; - criterio cinetico che considera lo
svolgimento dei processi in funzione del tempo e delle variabili che
influenzano la velocità come catalizzatori, temperatura, pH ed inibitori. I
catalizzatori biologici che regolano i processi, che avvengono negli
organismi viventi, sono molecole di natura proteica, a cui spesso sono
associati ioni metallici o molecole organiche. Caratteristica della loro azione
catalitica è la specificità sia rispetto al tipo di reazione sia rispetto al
riconoscimento, anche da un punto di vista stereochimico, delle molecole
impegnate nella reazione. Questa caratteristica è dovuta ad una particolare
disposizione di un certo numero di residui amminoacidici nel sito attivo di
azione della proteina enzimatica. Di qui l’importanza dello studio delle
strutture delle proteine in particolare la conoscenza dei residui
amminoacidici nel sito catalitico dell’enzima, e il binomio
struttura/funzione che ci permette di spiegare il meccanismo catalitico della
proteina. Cinetica enzimatica e determinazione delle costanti cinetiche (Km
e Vmax), anche in presenza degli inibitori. Cinetica enzimatica di una
particolare classe di enzimi: gli enzimi allosterici. Ancora cinetica
enzimatica in presenza di un solo substrato o in presenza di dueo o più
substrati e determinazione delle varie costanti cinetiche. Sono considerati
anche gli enzimi immobolizzati, che tanta importanza hanno nei processi
biochimici industriali.
Programma
Natura proteica degli enzimi: Generalità e proprietà. Sito attivo.
Specificità di substrato e di azione. Enzimi come proteine semplici e
coniugate. Struttura primaria. Struttura secondaria ad "alfa elica" e "beta a
foglio pieghettato". Struttura terziaria e quaternaria. Denaturazione e
rinaturazione delle proteine. Forze che stabilizzano la struttura delle
proteine: legame idrogeno, forze di van der Waals, legame idrofobico e
legame ionico. Classificazione e nomenclatura internazionale degli enzimi.
Ruolo delle vitamine nella funzione enzimatica. Coenzimi
Meccanismo di azione di alcuni enzimi: Lisozima: struttura
84
- Chimica e Tecnologia Farmaceutiche tridimensionale e sito attivo; meccanismo d'azione; sito di scissione del
substrato. Carbossipeptidasi A: adattamento indotto; modificazioni
strutturali nel sito attivo; modificazioni nella struttura elettronica.
Chimotripsina: struttura tridimensionale; specificità di azione; importanza
della serina e dell' istidina nel sito attivo; relais di cariche e trasporto di
protoni. Tiol-proteasi. Carbossil-proteasi
Principi di termodinamica e di bioenergetica: Costante di equilibrio
delle reazioni biochimiche. Energia libera ed energia libera standard.
Energia di attivazione. Introduzione alla cinetica chimica. Reazioni di
ordine zero, di primo ordine e di secondo ordine
Cinetica enzimatica: Complesso enzima-substrato e conferme
sperimentali della sua esistenza. Teoria di Michaelis-Menten. Equazione di
Michaelis-Menten secondo la derivazione di Briggs-Haldane. Costanti
cinetiche: Km e Vmax; esempi di calcolo. Equazione e grafico di
Lineweaver-Burk e di Headie-Hofstee. Fattori che influenzano l'attività
enzimatica: concentrazione del substrato e dell' enzima, pH, temperatura,
presenza di attivatori e di inibitori. Inibizione enzimatica: reversibile ed
irreversibile. Inibitori competitivi, non competitivi e incompetitivi.
Determinazione delle costanti cinetiche Km e Vmax. Determinazione della
Ki: grafico dei doppi reciproci e grafico di Dixon. Inibizione da substrato e
da prodotto. Cinetica a due o più substrati. Meccanismi di reazione
enzimatica. Reazioni a spostamento singolo: a caso e ordinate. Reazioni a
spostamento doppio a ping-pong. Enzimi regolatori ed allosterici.
Meccanismo di azione degli enzimi allosterici. Costanti cinetiche: K0,5 e
Vmax. Modulatori positivi e negativi. Enzimi K ed enzimi M. Aspartato
transcarbamilasi e isocitrato deidrogenasi. Enzimi modulati covalentemente.
Isoenzimi
Modificazioni covalenti degli amminoacidi del sito catalitico
dell'enzima: Reazioni sul gruppo -NH2 della lisina; reazioni sul gruppo -
SH della cisteina; reazioni sul gruppo -OH della serina e della tirosina,
reazioni sul gruppo -COOH dell'acido glutammico e dell'acido aspartico
Enzimi immobilizzati: Tecniche di immobilizzazione. Metodi fisici:
adsorbimento su supporti solidi; intrappolamento in gel insolubili;
intrappolamento in capsule semipermeabili e liposomi. Metodi chimici:
incorporazione in catene polimeriche in accrescimento; legame covalente
fra enzima e supporto solido. Vantaggi e svantaggi degli enzimi
immobilizati. Esempi di applicazioni di enzimi immobilizzati: industriali,
terapeutiche ed analitiche
Dosaggi enzimatici: Dosaggio dell'attività di alcuni enzimi: glutammatoossalacetato transaminasi, lattato deidrogenasi, malato deidrogenasi,
galattosidasi. Dosaggio di alcuni substrati negli alimenti: piruvato, lattato,
malato, citrato; galattosio e lattosio nel latte
85
- Chimica e Tecnologia Farmaceutiche -
DNA ricombinante: Endonucleasi di restrizione, DNA ligasi, transferasi
terminale, plasmidi, RNA messaggero, transcrittasi inversa, DNA
complementare (cDNA), costruzione del vettore di espressione, produzione
di proteine da parte di cellule di E. Coli o di lievito. Applicazioni pratiche
Immunoenzimologia: Principi di dosaggi immunoenzimatici (EIA).
Dosaggi immunoenzimatici eterogenei (ELISA) ed omogenei. Selezione
degli anticorpi. Scelta dell'enzima. Tecnica di preparazione del coniugato
enzimatico. Vantaggi e svantaggi dell'EIA.
Metodi in enzimologia: Principi di spettroscopia. Spettrofotometria.
Spettri di assorbimento. Legge di Lambert-Beer. Applicazioni. Principi di
cromatografia. Cromatografia su strato sottile, mono e bidimensionale.
Cromatografia
a scambio ionico. Cromatografia per esclusione.
Cromatografia per affinità. Tecniche elettroforetiche e poliacrilammide gel
elettroforesi.
TESTI CONSIGLIATI
-N C. Price, L. Stevens: Fundamentals of Enzymology (second edition) Ed.
Oxford Science Publications
-Simone, E. Quagliariello: Fondamenti di Enzimologia - Ed. Piccin
-Fersht: Struttura e Meccanismi d'Azione degli Enzimi - Ed. Zanichelli
-H. Bergmeyer: Principi di Analisi Enzimatica - Ed. Piccin
-L. Lehninger: Principi di Biochimica - Ed. Zanichelli
-S. Papa: Metodi e Tecniche di Biochimica - Ed. Cacucci
-Appunti dalle lezioni
CHIMICA DEI COMPOSTI ETEROCICLICI
Obiettivi formativi.
Scopo del corso è fornire allo studente conoscenze specifiche sulla reattività
e la sintesi di molecole a struttura eterociclica.
Programma
Nomenclatura degli eterocicli.
L’interpretazione della reattività degli eterocicli: Il metodo degli
orbitali molecolari MO-LCAO; la teoria dell’intermedio di reazione; la
teoria degli orbitali di frontiera FMO; la reattività degli eterocicli secondo la
teoria HSAB;
Analisi della reattività degli eterocicli: La definizione di aromaticità; i
differenti tipi di tautomeria
Le reazioni utili per la formazione degli eterocicli: Reazioni di
86
- Chimica e Tecnologia Farmaceutiche condensazione, reazioni pericicliche, le reazioni di cicloaddizione, le
reazioni di cicloaddizione 1,3-dipolare ed i riarrangiamenti cheletropici e
sigmatropici.
La reattività dei composti eterociclici pentatomici: La
protonazione; le reazioni di sostituzione elettrofila; le reazioni di addizione;
le reazioni di addizione; le reazioni di cicloaddizione; ossidazioni e
riduzioni.
Breve rassegna delle metodologie di preparazione dei composti
eterociclici pentatomici.
La reattività dei composti eterociclici esatomici: Le reazioni che
coinvolgono l’eteroatomo; le rezioni di sostituzione elettrofila; le rezioni di
sostituzione nucleofila: il meccanismo di addizione-eliminazione e quello di
eliminazione-addizione; reazioni di sostituzione nucleofila con apertura
dell’anello e rianellazione.
Breve rassegna delle metodologie di preparazione dei composti
eterociclici esatomici.
TESTI CONSIGLIATI
-G.A. Pagani, A. Abbotto “Chimica eterociclica”, Casa Editrice Piccin
BIOTECNOLOGIE FARMACOLOGICHE
Obiettivi formativi
I recenti sviluppi della biotecnologia del DNA ricombinante hanno reso
possibile l’accesso a geni che controllano un gran numero di patologie. Nel
contempo il rapido progredire della biologia molecolare e cellulare ha
portato alla descrizione di proteine che mediano tali processi patologici. La
migliore comprensione dei processi fisiopatologici ha consentito il disegno
di nuove strategie terapeutiche con possibilità di notevoli progressi nella
prevenzione e nel trattamento di moltissime patologie anche di natura noin
ereditarie. Il corso di biotecnologie farmacologiche, pertanto si prefigge lo
scopo di offrire allo studente una visione completa di tali modalità
terapeutiche sia dal punto di vista metodologico che applicativo.
Programma
Parte I
Principi ed applicazioni farmacologiche delle metodiche di
biologia molecolare
Manipolazione in vitro della molecola di DNA: Struttura del DNA.
87
- Chimica e Tecnologia Farmaceutiche Meccanismi di denaturazione e rinaturazione del DNA. Il DNA
ricombinante. Gli enzimi di restrizione ed altri enzimi per l’ingegneria.
Genetica. Vettori di clonazione (plasmidi, fagi, cosmidi, virus animali,
cromosomi artificiali di lievito)
Metodiche per l’ingegneria genetica: Sonde molecolari. La reazione a
catena della polimerasi (PCR). Anticorpi monoclonali
Principi di ingegneria cellulare: Sistemi di crescita di cellule in
coltura. Introduzione de DNA esogeno in cellule eucariote. Generazione di
cellule geneticamente modificate. Il controllo dell’espressione dei transgeni
e scelta del vettore di espressione. Trasfezione di cellule vegetali.
Applicazioni farmacologiche
Principi di ingegneria animale: I metodi dell’ingegneria animale.
Regolazione dell’espressione genica in animali transgenici. Animali
transgenici come modello di studio in campo biomedico. Fattorie di animali
transgenici per la produzione di biofarmaci.
La bioinformatica: Banche dati e loro utilizzo. La bioinformatica nella
ricerca di nuovi farmaci.
Parte II
I farmaci biotecnologici
Le proteine terapeutiche: Proteine terapeutiche di primo tipo. Proteine
terapeutiche di secondo tipo. Proteine terapeutiche di terzo tipo
I vaccini biotecnologici
Gli oligonucleotidi sintetici: Sintesi e proprietà chimiche. Metodi di
purificazione ed analisi. Farmacocinetica e tossicologia. Strategie
applicative
Gli ODN antisenso: Meccanismo d’azione. Scelta delle sequenze.
Attività antisenso
Gli oligonucleotidi anti-gene: I legami a tripla elica. Attività
biochimica. Attività biologica
I ribozimi
Gli aptameri
I decoy
La terapia genica: Importanza della scelta del vettore per la terapia
genica. I possibili approcci alla terapia genica
TESTI CONSIGLIATI
-Adriana Maggi: Biotecnologie Farmacologiche - Ed. Masson
88
- Chimica e Tecnologia Farmaceutiche -
BIOCHIMICA INDUSTRIALE
Obiettivi formativi
Il corso si propone di presentare la Biochimica Industriale come
un’applicazione della biochimica nella produzione di composti utili in
medicina, nell’ industria chimica ed alimentare. L’obiettivo è quello di
fornire agli studenti le basi biochimiche delle tecnologie, in uso in campo
industriale, sia a scopi di ricerca che produttivi. Di fornirgli inoltre, le
conoscenze biotecnologiche applicabili alla salvaguardia dell’ambiente.
Programma
Introduzione:
Biochimica Industriale e processi biotecnologici.
Definizione di processo biotecnologico: processi a monte,
biotrasformazioni, processi a valle. Sistemi biologici nella Biotecnologia
molecolare: cellule procariotiche ed eucariotiche, organizzazione. Batteri e
Lieviti. Principi di crescita microbica: fermentazioni. Ottimizzazione
dell’efficienza del processo fermentativo. Colture batch e colture continue.
Bioreattori. Fermentazione in due stadi mediante reattore a salita d’aria in
tandem: produzione industriale di T4 DNA ligasi. Materie prime utilizzate
nella fermentazione. Raccolta delle cellule microbiche: centrifugazione e
filtrazione. Lisi delle cellule microbiche: metodi chimici, lisi enzimatica,
metodi fisici. Processi a valle: isolamento delle proteine.
Biotecnologie e industria chimica: Sintesi di prodotti chimici di base:
etanolo. Sintesi di prodotti della chimica fine: enzimi industriali,
amminoacidi, (acido glutammico, lisina, triptofano). Sintesi dell’acido
ascorbico. Sintesi del colorante indaco. Sintesi di antibiotici:
classificazione, resistenza batterica, determinazione dell’attività. Produzione
industriale di antibiotici: penicilline e cefalosporine. Manipolazione
genetica di Streptomyces, clonaggio di geni della biosintesi degli antibiotici,
sintesi di nuovi antibiotici, ingegnerizzazione di antibiotici policheturi,
produzione di antibiotici su larga scala. Sintesi di materie grasse,
biopolimeri e materie plastiche. Sintesi di bioinsetticidi.
La
manipolazione
dell’espressione
genica
nei
procarioti:
Espressione dei geni. Vettori di espressione. Promotori forti e regolabili:
sistemi usati su scala industriale. Proteine di fusione e loro impiego.
Proteine di superficie: proteina pIII del batteriofago M13. Geni tandem
unidirezionali. Miglioramento della stabilità delle proteine. Limitata
disponibilità di ossigeno: impiego di ceppi ospiti deficienti di proteasi,
emoglobina batterica. Integrazione del DNA nel cromosoma della cellula
ospite. Aumento della secrezione di una proteina espressa: batteriocina.
Carico metabolico.
89
- Chimica e Tecnologia Farmaceutiche -
La produzione di proteine ricombinanti nelle cellule
eucaristiche: Sistemi di espressione basati su Saccharomyces cerevisiae.
Sistemi di espressione basati sulle cellule di insetto in coltura. Vettori di
espressione per le cellule di mammifero. La mutagenesi mirata agli
oligonucleotidi, amplificata tramite PCR. Addizione di legami disolfuro.
Produzione industriale di subtilisina.
Biotecnologie e industria farmaceutica: Sintesi di farmaci
antitumorali (interferone, interleuchine e citochine), dei fattori di
coagulazione del sangue e dell’attivatore tissutale del plasminogeno. Sintesi
dei fattori di crescita (EGF e PDGF) e di ormoni peptidici (insulina, ormone
della crescita ed eritropoietina). Metodi convenzionali per la produzione di
vaccini. Nuovi metodi di produzione di vaccini. I vaccini subunità: virus
dell’herpes simplex, virus dell’afta epizootica, il batterio della tubercolosi, i
vaccini peptidici. I vaccini attenuati: vibrio cholerae, la specie salmonella,
la specie leishmania. Vaccinia virus.
Biotecnologie e Industria cosmetica: Produzione industriale di
prodotti per la pelle: produzione di acido ialuronico e di collagene.
Produzione di sostanze idratanti: acido gamma-linolenico acido
arachidonico, gomma xantano, plastein-PM. Produzione di aromi rari dei
profumi mediante l’utilizzo di colture di cellule vegetali. Produzione di
scikonina e cartamina.
Biocorrezione ed utilizzazione della biomassa: I microrganismi e lo
smaltimento dei prodotti di rifiuto. La degradazione microbica degli
xenobiotici. L’ingegneria genetica dei percorsi biodegradativi. La
manipolazione mediante trasferimento di plasmidi. Biorisanamento del
suolo e delle acque inquinate da composti tossici. L’utilizzazione della
cellulosa.
TESTI CONSIGLIATI
-Glick: Biotecnologia Molecolare. Ed. Zanichelli
-Watson: Dna ricombinante. Ed. Zanichelli
-Poli: Biotecnologie Principi ed Applicazioni dell’Ingegneria Genetica. Ed.
UTET
-Alberghina: Biotecnologia e Bioindustria. Ed. UTET
-Appunti di lezione
BIOLOGIA MOLECOLARE
Obiettivi formativi
Il corso si propone di fornire agli studenti una visione d’insieme delle
scoperte e delle tecniche che hanno permesso il grande sviluppo e l’analisi
90
- Chimica e Tecnologia Farmaceutiche molecolare di quei processi vitali che permettono la continuazione e la
riproduzione della specie. Di introdurli alla conoscenza delle più moderne
tecniche in uso nell’ingegneria genetica. Di dotarli inoltre, attraverso la
descrizione dei percorsi sperimentali, della capacità di proporre e
interpretare modelli sperimentali d’indagine.
Programma
Struttura del DNA:Trasformazione (esperimento di Griffith ed
esperimento di Avery, Mac Leod e Mc Carty). Esperimento di Hershey e
Chase. Regole di Chargaff. Modello di Watson e Crick. Strutture alternative
(forma A e Z). Concetti di topologia: Numero di legame di avvolgimento e
superavvolgimento. Replicazione del DNA Modello semiconservativo
(esperimento di Meselson e Sthal). Direzionalità delle forcine di
replicazione. Origini di replicazione singole e multiple (metilazione).
Enzimologia della replicazione: Polimerasi, Single-strand binding protein
(SSB), Elicasi, Topoisomerasi, Primasi e DNA ligasi. Modelli di
replicazione per E. Coli, M13, G4 e ΦX174. Repliconi lineari: modello del
fago λ. Problema della replicazione delle estremità cromosomiche:
Telomerasi e meccanismo di azione.
Meccanismi biologici che salvaguardano il DNA: Sistemi di
modificazione e restrizione: enzimi di tipo I, II e III e loro meccanismo di
azione. Fotoriattivazione. Riparazione per excisione, via uvr e sistema delle
DNA glicosilasi. Riparazione replicativa: via rec. Sistema SOS.
La ricombinazione del DNA:Ipotesi sulla natura del crossin-over:
modello della scelta di copia, modello per rottura e riunione.
Ricombinazione generale o omologa: assortimento indipendente,
conversione genica, crossing-over, crossing over ineguale. Modello di
Holliday. Riconbinazione dei DNA circolari. Ricombinazione sito specifica:
Processi di integrazione e excisione tra il fago λ ed E. Coli, rotture e
riunioni sfalsate nel core. Trasposizione semplice e replicativa. Regolazione
genica mediante ricombinazione sito specifica.
Trascrizione dell’informazione genetica:Unità di trascrizione. RNA
polimerasi batterica: enzima “core” e sigma, ciclo del fattore sigma, Regioni
promotori nei batteri: identificazione del sito d’inizio e dei siti di legame
dell’ RNA polimerasi (punto di inizio, Pribnow box, sequenza –35),
regolazione positiva a livello del promotore; modificazioni globali
dell’inizio: sporulazione. RNA polimerasi eucariotiche complesse: RNA
polimerasi I, RNA polimerasi II, RNA polimerasi III: Regioni promotori e
attivatrici per l’ RNA polimerasi II (TATA box regioni CCAAT, elementi
ricchi di G-C, enhancer). Terminazione nei batteri: sequenze di
terminazione, terminotori RHO indipendenti, terminatori RHO dipendenti.
91
- Chimica e Tecnologia Farmaceutiche Antiterminazione fagica.
Modificazioni post-trascrizionali dei pre-RNA nei procarioti:
Organizzazione dei pre-tRNA, pre-rRNA batterici Meccanismi di
modificazione dei pre-tRNA e pre-rRNA batterici:, enzimologia delle
modificazioni post-trascrizionali (RNAasiP, RNAasiD, Nucleotidil-CCA–
transferasi, RNAasi III) e loro meccanismo di azione. Modificazioni posttrascrizionali dei geni precoci del fago T7 (meccanismo di azione
dell’RNAasiIII).
Modificazioni
post-trascrizionali
dei
pre-RNA
negli
eucariotiGeni interrotti: Esoni-introni metodo dell’ansaR, analisi di
Norther blot. Modificazioni del 5’ (CAP metilato) e del 3’
(poliadenilazione) Meccanismo di modificazione dei pre-tRNA,
enzimologia (nucleasi, ligasi). Auto-splicing di tipo I (pre-rRNA) e di tipo
II (geni mitocondriali). Maturazione dell’hnRNA: sequenze di consenso per
lo splicing, ruolo delle ribonucleoproteine nucleari (snRNP), enzimi e loro
meccanismo di azione. Splicing alternativi.
Sintesi proteica tRNA: Struttura, funzione, formazione dell’aminoaciltRNA, tRNA iniziatore, correzione di bozze. rRNA: struttura, funzione;
Ribosomi: subunità maggiore e minore, componenti proteiche dei ribosomi,
ruolo nella sintesi proteica. Sintesi proteica nei procarioti: fasi d’inizio,
allungamento, e terminazione, fattori proteici, riconoscimento dell’ATG
iniziale, ruolo del GTP. Sintesi proteica negli eucarioti: principali differenze
con i procarioti.
Codice genetico: Metodi per la decifrazione del codice genetico. Codice
genetico: degenerazione, vacillamento dell’anticodone, codoni di inizio e di
terminazione, mutazioni non-senso e di senso, mutazioni a soppressore
(intragenica, intergenica), codice genetico dei mitocondri.
Regolazione dell’espressione genica nei procarioti: Geni strutturali
e regolatori. Utilizzo di mutanti per la caratterizzazione dei geni regolatori e
del tipo di operone (mutanti costitutivi, superrepressori, diploidi parziali).
Struttura dell’operone. Regolazione negativa e positiva: sistemi inducibili e
reprimibili, operone del lattosio, operone del triptofano, attenuazione,
operone dell’arabinosio.
TESTI CONSIGLIATI
-Watson: Biologia molecolare del gene. Ed. Zanichelli
-Lewin: Il Gene VI. Ed. Zanichelli
92
- Chimica e Tecnologia Farmaceutiche -
IMPIANTI DELL’INDUSTRIA FARMACEUTICA
Obiettivi formativi
Il corso vuole offrire una panoramica ampia delle attrezzature industriali
connesse alla realizzazione delle varie forme farmaceutiche. Il corso vuole
anche fornire un quadro delle problematiche correlate a tale realizzazione:
sicurezza farmaceutica e del lavoro, norme ed apparati antunfortunistici,
scelta e disposizione degli impianti, organizzazione dell'industria
farmaceutica.
Programma
L'organizzanone di una industria farmaceutica: Organigramma,
centro elaborazione dati, costi standard, budget, nozioni generali relative
alla produzione farmaceutica. Brevetti I servizi tecnici centralizzati.
Generalità. Vapore. Acqua. Energia elettrica. Gas vari. Aria compressa.
Vuoto. I locali di lavoro. Locali ventilati. L. condizionati. L. deurnidifleati.
L. sterili. Stabulari.
I materiali più in uso nell'industria farmaceutica: Vetro. Metalli.
Materie plastiche. Flastomeri. L'acqua per uso farmaceutico. Deionizzatori.
Distillatori. Bidistillatori. Osmosi inversa. Apparecchiature per acqua
ultrapura. Contenitori per acqua distillata.
La preparazione di forme farmaceutiche liquide: Generalità.
Dissolutori. Agitatori. Filtri
La ripartizione di forme farmacentiche liquide: Generalità.
Apparecchiature per il lavaggio dei contenitori. Apparecchiature per la
ripartizione delle forme liquide. Apparecchiature per il riempimento di
flaconi
La liofilizzazione: Generalità. Schema generale delle operazioni relative
al processo di liofilizzazione, Componenti principali di un impianto di
liofilizzazione. Sistemi frigoriferi. Sistemi di Programma d’impianti dell
industria Farmaceutica. Riscaldamento. Gruppo di aspirazione. Gruppi di
controllo. Componenti accessori.
La sterilizzazione: Generalità. Metodi fisici. Metodi chimici
La preparazione di forme farmaceutiche solide: Generalità.
Macinazione. Setacciatura. Miscelazione. Compattazione e impasto
Granulazione Essiccamento. La ripartizione di forme farmaceutiche solide
La preparazione di forme farmaceutiche fluido-solide: Generalita.
Fusori. Miscelatori. Impastatrici. Emulsionatori. Omogeneizzatori. Molini
colloidali. Raffinatrici
La ripartizione di forme farmacetitiche fluido-solide: La
ripartizione delle pomate. La ripartizione delle supposte
93
- Chimica e Tecnologia Farmaceutiche -
Il confezionamento: Generalità. Composizione di linee per il
confezionamento. Descrizione delle macchine componenti le linee. L'igiene
negli ambienti di lavoro. Generalità.
Microclima.
Illuminazione.
Rumorosità. Presenza di gas o vapori tossici. Presenza di polveri. Mezzi di
protezione individuale
La normativa antinfortunistica: Generalità. Esempi di normativa.
Norme antincendio. Principali operazioni che possono essere causa di
infortuni nell'industria farmaceutica. Sostanze più comuni che possono
rappresentare un pericolo e relativi primi soccorsi. Nozioni elementari di
pronto soccorso
TESTI CONSIGLIATI
-G.C. Ceschel, L. Fabr.is, E. Lencioni, 5. Rigamonti: Impianti per l'industria
farmaceutica - Società Editrice Esculapio –Bologna
TOSSICOLOGIA
Obiettivi formativi
Il corso si propone di illustrare gli effetti sfavorevoli che scaturiscono dalla
interazione di molecole biologiche o xenobiotiche con gli organismi
superiori. Il programma consta di una parte generale riguardante i metodi
sperimentali per la valutazione della tossicità e di una parte speciale in cui
sono analizzati gli effetti specifici ed i meccanismi d’azione di singoli
agenti tossici.
Programma
Parte generale: Curve dose-effetto, DL50, indice terapeutico. Metodi per
la valutazione della tossicità in vitro ed in vivo, tossicità acuta, subacuta,
subcronica e cronica. Mutagenesi, carcinogenesi e teratogenesi. Reazioni
allergiche ed anafilattiche. Assorbimento, distribuzione ed escrezione delle
sostanze xenobiotiche. Metabolismo ed attivazione di sostanze xenobiotiche
Parte speciale: Tossicità da droghe animali. Tossicità da droghe vegetali
Tossicità da prodotti chimici di impiego corrente. Tossicità organo-specifica
di farmaci appartenenti ai diversi gruppi terapeutici. Tossicità dei farmaci
soggetti ad abuso
TESTI CONSIGLIATI
-Casarett and Doull’s Tossicologia: I fondamenti dell’azione delle sostanze
tossiche - Ed. EMSI, 2000
94
- Chimica e Tecnologia Farmaceutiche -
METODOLOGIE DI LABORATORIO
Obiettivi formativi
Fornire principi delle tecniche biochimiche analitiche e preparative. Fornire
descrizioni dettagliate delle principali tecniche utilizzate in biologia
molecolare. Trattare il razionale e la metodologia che sta alla base di ogni
sperimentazione di laboratorio con particolare riferimento alle
problematiche inerenti la variabilità biologica, alla necessità di disporre di
sistemi validi per l’analisi dei dati,nonché alle opportune garanzie di
sicurezza. Consentire conoscenze teorico-pratiche delle principali
tecmniche di laboratorio.
Programma
Principi generali della ricerca biochimica: Soluzioni fisiologiche.
Sperimentazioni su organismi. Sperimentazioni con sezioni sottili di organo
e di tessuto. Colture cellulari e di tessuti. Frazionamento cellulare.
Microscopia
Tecniche centrifugative: Principi di base della sedimentazioni. Tipi di
centrifughe e loro uso. Tipi di rotori e loro manutenzione. Centrifugazione
in gradiente di densità . Centrifugazione preparativa. Ultracentrifugazione
Tecniche cromatografiche : Cromatografia a bassa pressione su
colonna.Cromatografia liquida ad alta pressione (BPLC). Cromatografia di
adsorbimento. Cromatografia di partizione. Cromatografia a scambio ionico
Cromatografia d'affinità. Cromatografia su strato sottile. Cromatografia su
carta. Cromatografia gas-liquido
Tecniche elettroforetiche: Materiali di supporto. Elettroforesi su gel.
Gel in gradiente. Isoelettrofocalizzazione. Elettroforesi su acetato di
cellulosa. Elettroforesi di proteine e di acidi nucleici. Elettroforesi capillare
Tecniche di biologia molecolare: Tecnologia del DNA ricombinante –
lbridizzazione. Sequenziamento del DNA. Analisi fisica dei DNA. Librerie
geniche. Reazione di polimerizzazione a catena (PCR) . Trasferimento di
geni clonati in cellule di mammifero. Prodotti della tecnologia del DNA
ricombinante . Impatto della biologia molecolare in medicina
Tecniche radioisotopiche: Natura della radioattività. Rivelazione e
misura della radioattività. Conteggio della radioattività e analisi dei dati.
Applicazioni dei radioísotopi in biologia
Tecniche immunochimiche: Reazione di precipitazione in gel:
l'immunodiffusione (ID) . Dosaggio radioimmunologico (RIA). Dosaggio
immunoenzimatico (IRMa). Dosaggio ELISA. Dosaggio immunologico in
fluorescenza (FIA)
Tecniche spettroscopiche: Spettroscopia nell'ultravioletto, nel visibile e
95
- Chimica e Tecnologia Farmaceutiche nell'infrarosso . Spettrometria di risonanza magnetica nucleare (NMR).
Spettrofiuorimetria. Spettrometria di massa
TESTI CONSIGLIATI
-Wilson K. & Walker J.: Metodologia biochimica , Le tecniche biochimiche
in laboratorio - Ed. Raffaello Cortina, Milano
-Pasquinelli P.: Dignostica e tecniche di laboratorio – Ed. Rosini, Firenze
TOSSICOLOGIA CELLULARE
Obiettivi formativi
Il corso si prefigge di fornire allo studente le conoscenze fondamentali
riguardo i meccanismi di tossicità a livello cellulare e molecolare, con
particolare attenzione verso i fattori in grado di influenzare la risposta
tossica. Inoltre, il corso fornisce le conoscenze principali sui meccanismi
d’azione alla base della tossicità delle principali classi di farmaci.
Programma
Principio di dose-dipendenza
Meccanismi di tossicità specifici: Blocco della catena mitocondriale,
inibizione enzimatica, antimetabolismo, interazione recettoriale periferica e
centrale, blocco dei canali ionici
Meccanismi di tossicità aspecifici: Destabilizzazione di membrana,
ossidazione, alchilazione, intercalazione, chelazione
Meccanismi dello stress ossidativo
Ruolo del Ca2+ nella tossicità: Omeostasi del Ca2+: canali e pompe per
il Ca2+. Ca2+ e trasduzione del segnale: un bersaglio per le sostanze tossiche
Importanza dei gruppi tiolici e correlazione con l’omeostasi del Ca2+. Il
concetto di morte cellulare: ipotesi Ca2+-dipendente e Ca2+-indipendente
Apoptosi e necrosi: Ruolo delle caspas. Regolazione genetica
dell’apoptosi Apoptosi e “multidrug resistance”. Ruolo di p53, Bcl 2 e CD
95. Nitrossido ed apoptosi: ruolo del nitrossido come attivatore e repressore
dell’apoptosi. Ruolo dell’apoptosi nelle malattie neurodegenerative.
Apoptosi nell’eccitotossicità e nelle malattie da prioni
Principi generali di cancerogenesi: Geni oncogeni, virus ed
oncogenesi, inibizione dell’apoptosi
Meccanismi molecolari alla base della tossicità dei farmaci:
Farmaci del sistema nervoso centrale e periferico, antibiotici e
chemioterapici,
farmaci
dell’apparato
cardiovascolare,
farmaci
96
- Chimica e Tecnologia Farmaceutiche antiinfiammatori ed antireumatici, farmaci antineoplastici etc.
Tossicità dei farmaci
e polimorfismo genetico: Tossicità da
organofosforici e biodiversità delle isoforme di colinesterasi, etc.
TESTI CONSIGLIATI
-Casarett and Doull’s: Tossicologia: I fondamenti dell’azione delle sostanze
tossiche - Ed. EMSI, 2000
-Cantelli Forti G., Galli C.L.: Tossicologia cellulare e molecolare – Ed.
UTET, Torino, 2000
-Rassegne di sintesi o articoli originali sui vari argomenti
BIOCHIMICA SISTEMATICA UMANA
Obiettivi formativi
Conoscenza delle radici storiche della materia. Studio differenziato e
distinto di vari organi e tessuti sotto il profilo biochimico. Modelli di studio
delle interrelazioni e regolazioni metaboliche, basati sui diversi aspetti
dinamici ed integrati.
Programma
Generalità: Metabolismo basale in varie condizioni. Alimenti e nutrienti.
Criteri di scelta individuali e ambientali degli alimenti. Gli alimenti e i
gruppi alimentari. Prodotti alimentari e dietetici. Basi biochimiche della
dieta e della dietoterapia. Bioenergetica. Fabbisogno alimentare ed
energetico. Indice glicemico degli alimenti. Principi fondamentali del
metabolismo cellulare. Descrizione e distinzione di organi e tessuti sul
piano biochimico. Studio dei profili biodinamici integrati di organi e tessuti
ed interpretazione delle interrelazioni e delle regolazioni molecolari.
Metabolismo dei tessuti durante la fase di alimentazione e di digiuno.
Omeostasi del glucosio. Metabolismo lipidico: lipoproteine plasmatiche.
Metabolismo azotato.
Apparato digerente: Meccanismi biochimici della secrezione di enzimi
ed elettroliti a livello delle cellule della mucosa dell'apparato digerente.
Meccanismi biochimici della digestione degli alimenti. Meccanismi
biochimici dell'assorbimento dei principi alimentari. Gli ormoni
gastroenterici.
97
- Chimica e Tecnologia Farmaceutiche -
Fegato: Il tessuto epatico. Caratteristiche biochimiche dell’epatocita.
Metabolismo glucidico. Metabolismo lipidico: ossidazione degli acidi grassi
nei perossisomi e nei mitocondri, sintesi della carnitina; regolazione della
sintesi del colesterolo; sintesi degli acidi biliari. Metabolismo azotato: ciclo
dell’urea (regolazione dell’attività di Carbammil-Pi sintetasi I, Glutammato
deidrogenasi e Glutammina sintetasi), ciclo intercellulare della glutammina,
trasportatore dell’ornitina. Composizione della bile. Sali biliari. Pigmenti
biliari. Bilirubina. Reazioni di detossificazione: metabolismo degli
xenobiotici e metabolismo dell’etanolo. Altri processi di biotrasformazione
epatica.
Muscolo: Metabolismo glucidico: trasporto di glucosio insulina-
dipendente. Sintesi di creatina e regolazione dell’attività della creatina
chinasi. Attività dell’adenilico deaminasi. Interrelazioni metaboliche
durante l’esercizio fisico. Metabolismo del muscolo cardiaco.
Tessuto
adiposo:
Metabolismo,
caratteristiche
biochimiche
dell’adipocita, lipogenesi e lipolisi. Integrazione con il metabolismo epatico
e muscolare. Tessuto adiposo bianco e bruno. Termogenesi. Tessuto
adiposo come organo secretore: struttura e funzione della leptina.
Sangue: Composizione. Emogramma. Proteine plasmatiche. Enzimi del
plasma: significato diagnostico. Cellule del sangue: eritrociti (struttura della
membrana, metabolismo, sintesi dell’emoglobina, metabolismo del ferro,
stress ossidativo, metabolismo azotato, eritropoiesi); piastrine (struttura,
metabolismo, adesione piastrinica), leucociti (attività della NADPH-ossidasi
e della mieloperossidasi). Processo della coagulazione.
Tessuto nervoso: Biochimica del tessuto nervoso.
TESTI CONSIGLIATI
-C. M. Caldarera: Biochimica Sistematica Umana. Casa Editrice: CLEUB.
-T. M. Devlin: Biochimica con aspetti clinici. Gruppo Editoriale IdelsonGnocchi
98
- Chimica e Tecnologia Farmaceutiche -
CHIMICA TOSSICOLOGICA
Obiettivi formativi
Il corso si prefigge di trattare in modo generale i fenomeni tossicologici
legati all’uso dei farmaci. Verranno anche prese in esame le principali classi
di farmaci responsabili di tali fenomeni. Una trattazione a parte sarà
dedicata alle sostanze d’abuso.
Programma
La ricerca farmaceutica e la sperimentazione dei farmaci. Passaggio di
farmaci attraverso la placenta e nel latte. Tossicità inerente al metabolismo
dei farmaci. Tossicità inerente alla distribuzione dei farmaci. Tossicità
inerente all’induzione o alla inibizione di enzimi farmacometabolizzanti.
Malattie della cute provocate dai farmaci. Tossicità cardiaca ed ematica dei
farmaci. Le malattie gastro-intestinali da farmaci. Lesioni epatiche da
farmaci. Alogeno-derivati alifatici. Insetticidi ed erbicidi. Stupefacenti e
sostanze d’abuso, (Alcool etilico. Barbiturici. Cannabis e fenciclidina.
Allucinogeni. Gli oppiacei. Cocaina. Amfetamina. Allucinogeni.). Farmaci
teratogeni. Metalli tossici. Gas tossici.
TESTI CONSIGLIATI
-Appunti dalle lezioni.
FARMACOLOGIA CELLULARE E MOLECOLARE
Obiettivi formativi
Lo studente alla fine del corso possiederà elementi conoscitivi circa i
meccanismi cellulari e molecolari alla base dell’azione dei farmaci. Per la
natura prevalentemente sperimentale del corso, lo stesso sarà in parte
dedicato allo studio delle più recenti scoperte della ricerca scientifica
relative ai targets farmacologici per lo sviluppo di nuovi approcci
terapeutici.
Programma
Recettori-canale:
Organizzazione molecolare, selettività ionica,
modulazione dell’attività. Organizzazione molecolare dei recettori
accoppiati a proteine G. Organizzazione molecolare e funzione delle
proteine G eterotrimeriche; adenilato ciclasi e AMP ciclico; fosfolipasi C e
99
- Chimica e Tecnologia Farmaceutiche ciclo dei fosfoinositidi; desensitizzazione dei recettori accoppiati a proteine
G.
Le protein chinasi ed il loro ruolo nella trasduzione del segnale:
Protein chinasi A, protein chinasi C, farmaci attivatori ed inibitori. Protein
fosfatasi; ruolo della calcineurina nel sistema nervoso centrale, calcineurina
e farmaci immunosoppressori
Regolazione dell’omeostasi intracellulare del calcio: Depositi di
calcio a rapido scambio, recettori per la rianodina e l’IP3, modulatori
endogeni e farmacologici; sistemi di estrusione del calcio. Na+/K+-ATPasi,
scambiatore Na+/Ca2+ e glicosidi cardioattivi. Canali al calcio voltaggiodipendenti: organizzazione molecolare, sensore del voltaggio, selettività
ionica, classificazione, localizzazione, funzioni; farmaci attivi sui canali al
calcio voltaggio-dipendenti
Canali al sodio voltaggio-dipendenti: Funzioni ed organizzazione
molecolare; tossine e farmaci attivi sui canali al sodio voltaggio-dipendenti.
Potenziale neuroprotettivo di farmaci che bloccano i canali al sodio
voltaggio-dipendenti
Canali al potassio: Classificazione; organizzazione molecolare dei canali
al potassio voltaggio-dipendenti
Glutammato: Sintesi, accumulo vescicolare, trasporto e spegnimento del
segnale. Recettori ionotropi e metabotropi: classificazione, organizzazione
molecolare, funzioni, modulazione fisiologica e farmacologica del
complesso recettoriale NMDA. Eccitotossicità; calcio, nitrossido, radicali
liberi di ossigeno, proteasi neutre calcio-attive (calpaine) ed eccitotossicità;
inibitori della calpaina, inibitori della nitrossido sintasi, scavengers dei
radicali liberi ed inibitori della perossidazione dei lipidi di membrana
Acido gamma-amminobutirrico (GABA): Sintesi, degradazione,
ricaptazione e farmaci che interferiscono con tali processi. Recettori
GABAA: organizzazione molecolare e modulazione da parte di
benzodiazepine, barbiturici e neurosteroidi. Recettori GABAB:
organizzazione molecolare, meccanismi di trasduzione, farmaci agonisti ed
antagonisti
Catecolammine:
Biosintesi,
immagazzinamento
vescicolare,
degradazione metabolica, ricaptazione; farmaci che interferiscono con i
suddetti processi. Recettori α-adrenergici: organizzazione molecolare,
meccanismi di trasduzione, effetti fisiologici, farmaci agonisti ed
antagonisti
Acetilcolina: Organizzazione molecolare del recettore nicotinico
muscolare; recettori nicotinici neuronali, classificazione e meccanismi di
trasduzione dei recettori muscarinici. Farmaci che interferiscono con la
trasmissione colinergica
Nitrossido (NO): Ruoli fisiologici; biosintesi; isoforme della NO sintasi e
100
- Chimica e Tecnologia Farmaceutiche loro regolazione; farmaci inibitori della NO sintasi. Ruolo fisiologico e
fisiopatologico dell’NO nel sistema nervoso centrale: meccanismi di
neurotossicità
TESTI CONSIGLIATI
-Clementi F., Fumagalli G.: Farmacologia generale e molecolare UTET,
Torino, 1999
-Munson: Principi di Farmacologia – Ed. Piccin, Padova, 1999
-Godman and Gilman: Le Basi Farmacologiche delle Terapia, IX edizione
Ed. McGraw-Hill Libri Italia Srl
-Rassegne di sintesi o articoli originali sui vari argomenti
FITOCHIMICA
Obiettivi formativi
Gli argomenti del corso riguardano la biosintesi dei prodotti naturali
cominciando dai principi biogenetici fondamentali e proseguendo con i
meccanismi di reazione coinvolti più frequentemente nei processi catalizzati
da enzimi, il ruolo chiave dei coenzimi e le vie principali che portano
all’ottenimento di suddetti metaboliti. Il corso tratta la maggior parte delle
classi di metaboliti secondari in modo da fornire le basi allo studente per
riconoscere l’origine dei composti naturali dalla loro stessa struttura.
Programma
Introduzione: Metaboliti primari e secondari. Ruoli e funzioni dei metabo
secondari, importanza biologica. Struttura proteica degli enzimi: sito attivo,
specificità degli enzimi, cofattori, coenzimi, vitamine, classificazione degli
enzimi, esempi di meccanismi reazioni enzimatiche. Difesa chimica:
Feromoni ed allelomoni. Allelopatia. Composti post-infezione: postinibitine ed inibitine. Composti post-in zione: post-inibitine e fitoalessine.
Coevoluzione
pianta-insetto.
Biochimica
dell’impollinazione.
Composizione delle droghe vegetali. Principali tecniche di essiccamento ed
estrazione. Conservazione delle droghe. Var bilità dell’attività di una droga:
fattori endogeni ed esogeni. Tecniche e metodi per lo studio delle tappe
biosintetiche: analisi sequenziale, uso di mutanti, di inibitori enzimatici
specifici e di isotopi raccianti (radioattivi e stabili).
Terpeni: introduzione, classificazione, biosintesi, formazione di
IPI e DMAPP: Monoterpeni: reazione tra IPP e DMAPP, monoterpeni
aliciclici,rotazione del legame e ciclizzazione a monoterpcni monociclici;
formazione di α-terpenilcatione, monoterpeni biciclici; oli essenziali: usi
101
- Chimica e Tecnologia Farmaceutiche medicinali e commerciali; monoterpeni irregolari e falsi monoterpeni;
iridoidi e seco-iridoidi. Sesquiterpeni: biosintesi, sesquiterpeni aliciclici e
cicli esempi di ciclizzazione (scheletro del bisabolano, acorano,cedrano,
germacrano); sesquiterpeni di particolare importanza biologica (acido
abscisico). Diterpeni: biosintesi di aliciclici, monociclici, biciclici, triciclici
e tctraciclici. Ent-kaureni e formazione di gibberelline. Triterpeni:
classificazione biogenetica; biosintesi dello squalene e del suo 2,3-epossido;
ciclizzazione dello squalene sedia-sedia-sedia-barca e sedia-barca-sediabarca; formazione dammarenedioli, eufolo, tirucallolo, lanosterolo e
cicloartenolo; ciclizzazione non ossidativa; ciclizzazione ad entrambe le
estremità dello squalene. Tetraterpeni: caroteni e xantofille Poliisopreni:
gomma naturale e guttaperca
Steroidi: Steroli: biosintesi, scheletri fondamentali, fitosteroli e colesterolo
Glicosidi cardiotonici: classificazione, biosintesi. Saponine steroidiche:
biosintesi. Ecdisoni: ormoni della muta. Acidi biliari: biosintesi. Ormoni
steroidei: corticosteroidi, gestogeni. androgeni, estrogeni; biosintesi.
Acidi grassi : Introduzione, classificazione, biosintesi. Acidi grassi
poliinsaturi: biosintesi di acido arachidonico e si trasformazione in
prostaglandine, prostacicline, trornbossani e leucotrieni.
Composti acetilenici: Polichetidi: Introduzione, classificazione, regola
biogenetica: reazioni allungamento della catena, ciclizzazioni e
modificazioni su cessive. Chinoni e xantoni. Depsidi, depsidoni e
aflatossine. Tetracicline e biosintesi griseofulvina. Macrolidi e altri derivati
polichetidici di importanza farmacologica
Via dell’acido scichimico: Introduzione, classificazione dei derivati
fenolici, attività biologica, biosintesi: acido scichimico, corismico,
prefenico, fenilpiruvico, fenilalanina, tirosina, acidi cinnamici..
Naftochinoni e chinoni di origine scichimica. Metabolismo dell’acido
cinnamico: forrmazione di compo della classe C6 (acidi benzoici), C6-C1
(acidi gallici e tannini idrolizzabili), C6-C2 (stireni), C6-C3 (acidi cinnamici,
cumarine, furanocumarine). Meccanismo di idrossilazione via NIH shift.
Lignani e lignine
Composti C6-C3-(C2)n:
cenni
sugli
stilbenoidi:
Flavonoidi:
classificazione e biosintesi. Equilibrio calcone-flavanone. Ipotesi di
formazione degli derivati flavonoidici. Catechine, proantocianidine e
tannini condensati. Isoflavonoidi: biosintesi, meccanismo dipendente da
citocromo P450, attività biologica.
Alcaloidi: Introduzione, definizioni di alcaloidi e protoalcaloidi,
classificazione chimica e biochimica, attività biologica, ruolo biogenetico
nella pianta.. Alcaloidi del tropano: biosintesi di iosciamina, atropina e cc
caina. attività biologica. Alcaloidi feniletilamminici: biosintesi di
papaverina e morf na, condensazione di Pictet Spengler, attività biologica;
102
- Chimica e Tecnologia Farmaceutiche biosintesi di boldina ed emetina. attività biologica. Alcaloidi nicotinici:
biosintesi di acido nicotinico e nicotina. Alcaloidi indolici: biosintesi del
nucleo dell’armano, psilocil na e fisostigrnina, attività biologica di
Passiflora, Psilocvbe; caloidi di Rauwolfia, Catharanthus e Noce vomica:
biosinh ed attività biologica. Alcaloidi a nucleo steroidico: esempi e
biosintesi.
TESTI CONSIGLIATI
-Manitto: Biosyinthesis of natural Products
-B P. Manitto — Biosynthesis of Natural Products- E shorwoc)Ltd
Pbublishers, Chichester, England
-K .B .G. Torssell-Natural Product Chemistry- Apotekarsoci te;1.
Stockholm
BIOTECNOLOGIE DELLE PIANTE OFFICINALI I
Obiettivi formativi
Gli argomenti del corso riguardano la produzione dei prodotti naturali
mediante colture cellulari vegetali; lo studente alla fine del corso deve
conoscere le caratteristiche della cellula vegetale in relazione alla
produzione di metaboliti secondari, i metodi per la loro produzione da
colture in laboratorio e i meccanismi chimici, biochimici e biologici
coinvolti nella loro biosintesi.
Programma
Introduzione: Metaboliti primari e secondari. Ruoli e funzioni dei
metaboliti secondari, importanza biologica. Struttura proteica degli enzimi,
sito attivo, specificità degli enzimi, cofattori, coenzimi, vitamine,
classificazione degli enzimi; inibitori enzimatici: inibizione competitiva,
incompetitiva e non competitiva. Difesa chimica: feromoni ed allelomoni.
Allelopatia. Composti pre-infezione: proibitine ed inibitine. Composti postinfezione: post-inibitine e fitoalessine. Coevoluzione pianta-insetto.
Tecniche e metodi per lo studio delle tappe Biosintetiche: analisi
sequenziale, metodi che impiegano mutanti, uso di inibitori specifici di
alcuni processi enzimatici e uso di isotopi traccianti (radioattivi e stabili).
Tecniche di marcature 13C per lo studio delle vie biosintetiche degli
isoprenoidi (via del mevalonato e via dell’1-deossi-D-xilulosio-5-fosfato).
La cellula vegetale: plastidi, perossisomi, mitocondri, apparato del Golgi,
reticolo endoplasmatico liscio e rugoso, ribosomi, parete cellulare e
vacuolo; concetti di totipotenza e plasticità. Colture di cellule e tessuti
103
- Chimica e Tecnologia Farmaceutiche vegetali come risorsa alternativa di metaboliti secondari.
Produzione di sostanze naturali da colture cellulari in
laboratorio: L’espianto: definizione, caratteristiche dei meristemoidi,
prerequisiti delle piante da mettere in coltura. Mezzi di coltura: fattori che
determinano la ormulazione del mezzo (zuccheri, azoto, zolfo, potassio,
fosforo, calcio, magnesio, ferro, vitamine, altri composti organici), ormoni
(auxine, citochinine, gibberelline, acido abscissico, etilene), grandezza
dell’inoculum, fattori ambientali (luce, temperatura, ossigenazione e pH).
Mezzi semi-solidi e mezzi liquidi. Esempi di terreni di coltura (Murashige
& Skoog). Colture di calli e colture in sospensione: colture in fase solida e
liquida, colture ad immersione periodica e permanente, colture discontinue,
continue e sincronizzate. Sistemi di coltura di massa per cellule in
sospensione: bioreattori per colture su vasta scala, sistemi chiusi (a carica),
semicontinui e continui. Micropropagazione: colture di protoplasti: fusione,
ibridi somatici; embriogenesi somatica; organogenesi.. Esempio di coltura
differenziata: colture di radici “Hairy root” . Immobilizzazione di cellule
vegetali: tecniche e uso di tali sistemi per la produzione di metaboliti
secondari. Crioconservazione di colture vegetali. Elicitazione come metodo
per aumentare la produzione di sostanze di impiego terapeutico. Tecniche di
selezione e screening di colture vegetali
TESTI CONSIGLIATI
-Colture di cellule vegetali - Quaderni di Biologia diretti da De Carli, Parisi,
Sala, serie verde: Biologia vegetale – Piccin, Padova.
-Chimica, biosintesi e bioattività delle sostanze naturali - Dewick P.M. –
Piccin, Padova, 2001.
-Metabolismo e prodotti secondary delle piante – Maffei M. – UTET,
Torino, 1999.
-Plant Tissue Culture as a Source of Biochemicals - Editor E. John StabaCRC Press, Florida, 1980.
-Laboratory culture - Editor J.E.A. Seabrook- CRC Press, Florida, 1990.
-Biotechnology in Agriculture and Forestry 4. Medicinal and Aromatic
Plants I- Edited by Y.P.S. Bajaj- Springer Verlag, Berlin, 1988.
-Secondary Products from Plant tissue culture.- Edited by B.V. Charlwood
and M.J.C. Rhodes- Clarendon Press, Oxford, 1990.
-Plant tissue culture- J.H. Dodds- Cambridge University Press, 1992.
-Biotechnology Secondary metabolites-Editors K.G. Ramawat, J.M.
Merillon- Science Publishers Inc., Enfield (NH) USA
104
- Chimica e Tecnologia Farmaceutiche -
BIOTECNOLOGIE DELLE PIANTE OFFICINALI II
Obiettivi formativi
Gli argomenti del corso sono strettamente correlati a quelli del corso di
Biotecnologie delle Piante Officinali I e riguardano principalmente la
produzione mediante colture cellulari vegetali di prodotti naturali ad azione
terapeutica ma riguardano anche argomenti più specifici; lo studente alla
fine del corso deve conoscere le tecniche in vitro ed in vivo che portano
all’ottenimento di metaboliti secondari di interesse farmacologico, oltre alla
loro produzione e liberazione nei mezzi di coltura.
Programma
Produzione di metabolti secondari da colture vegetali e loro
impatto nell’industria farmaceutica: Stabilimento di sistemi cellulari
produttivi. Sintesi ex-novo di farmaci noti da colture cellulare. Colture di
cellule vegetali come risorsa di nuovi composti attivi. Potenzialità
enzimatica delle colture cellulari
Produzione tramite colture cellulari di sostanze naturali ad
azione terapeutica: Alcaloidi indolici: Catharanthus roseus. Alcaloidi
del Papaver somniferum: morfina e codeina . Diterpeni: Taxus ssp..
Glicosidi cardioattivi: Digitalis ssp.
Metodi per incrementare la produzione di metaboliti secondari
da cellule vegetali: Trasporto e conservazione dei metaboliti secondari
nel vacuolo: permeabilizzazione.
Biologia molecolare e metaboliti secondari: Piante transgeniche.
Manipolazione genetica e regolazione dell’espressione genica. Ingegneria
molecolare e produzione di metaboliti secondari. Agricoltura molecolare.
Espressione differenziata di geni
TESTI CONSIGLIATI
-Metabolismo e prodotti secondary delle piante – Maffei M. – UTET,
Torino, 1999.
-Laboratory culture - Editor J.E.A. Seabrook- CRC Press, Florida, 1990.
-Biotechnology in Agriculture and Forestry 4. Medicinal and Aromatic
Plants I- Edited by Y.P.S. Bajaj- Springer Verlag, Berlin, 1988.
-Secondary Products from Plant tissue culture.- Edited by B.V. Charlwood
and M.J.C. Rhodes- Clarendon Press, Oxford, 1990.
-Plant tissue culture- J.H. Dodds- Cambridge University Press, 1992.
-Biotechnology Secondary metabolites-Editors K.G. Ramawat, J.MerillonScience Publishers Inc., Enfield (NH) USA
105
- Chimica e Tecnologia Farmaceutiche -
CHIMICA DELLE MACROMOLECOLE
Obiettivi formativi.
Il corso si prefigge di fornire agli studenti nozioni di base sulla chimica e
sulle proprietà delle macromolecole. Inoltre, saranno trattate le più
importanti applicazioni dei polimeri in campo farmaceutico. Gli obiettivi
che lo studente deve raggiungere sono: nozioni di base sulla chimica e le
proprietà dei materiali polimerici, applicazione avanzate dei sistemi
macromolecolari in tecnologia farmaceutica.
Programma
Concetto di polimero: Forze molecolari e legami chimici nei polimeri.
Peso molecolare e sua distribuzione. Reazioni di polimerizzazione:
policondensazione, polimerizzazione radicalica, polimerizzazione ionica,
polimerizzazione
Ziegler-Natta,
copolimerizzazione.
Condizioni
sperimentali delle reazioni di polimerizzazione.
Caratterizzazione dei polimeri: Polimeri in soluzione, misura dei pesi
molecolari (medio numerico e ponderale) e delle dimensioni della
macromolecola in soluzione. Proprietà chimico-fisiche dei polimeri:
reologia, viscosità, studi calorimetrici.
Polimeri per preparazioni farmaceutiche: Idrogeli, drug delivery
system, profarmaci, matrici polimeriche sensibili a stimoli esterni, polimeri
con imprinting molecolare.
TESTI CONSIGLIATI
-F. W. Billmeyer “ Textbook and Polymer Science”, J. Wiley.
-J. W. Nicholson “ The Chemistry of Polymers” RSC Paperbacks.
-F. Ciardelli “ Macromolecole: Scienza e Tecnologia” Pacini Editore.
FISIOPATOLOGIA GENERALE
Obiettivi formativi
Fornire allo studente approfondite conoscenze sui meccanismi
etiopatogenetici dei principali quadri morbosi e sulle alterazioni
fisiopatologiche fondamentali degli organi e degli apparati.
106
- Chimica e Tecnologia Farmaceutiche -
Programma
Meccanismi generali delle alterazioni fisiopatologiche delle
cellule e dei tessuti.
Le malattie ereditarie e congenite.
Fisiopatologia delle ghiandole a secrezione interna: Ipofisi, tiroide,
paratiroide, surrene, testicolo, ovaio.
Fisiopatologia generale del sangue.
Fisiopatologia dell’apparato cardio-vascolare: Ciclo cardiaco;
alterazioni della funzione del cuore; malattie del pericardio, del miocardio e
dell’endocardio; aterosclerosi; shock; ischemia; trombosi; embolia;
ipertensione arteriosa.
Fisiopatologia dell’apparato respiratorio: Regolazione della
respirazione; insufficienza respiratoria; ipossia; cianosi; principali
alterazioni anatomo-funzionali del parenchima polmonare.
Fisiopatologia del rene: Funzioni del glomerulo e del tubulo renale;
nefropatia interstiziale; insufficienza renale acuta e cronica.
Fisiopatologia dell’apparato gastrointestinale: Regolazione dei
meccanismi della digestione; patologie da reflusso gastro-esofageo; ulcera
peptica; malattia celiaca; patologia infiammatoria cronica intestinale.
Fisiopatologia del metabolismo: Meccanismi di omeostasi metabolica;
alterazioni del metabolismo glucidico, lipidico e protidico.
Fisiopatologia generale del sistema nervoso: Funzioni di senso e di
moto; patologia delle funzioni associative.
TESTI CONSIGLIATI
-Dianzani M.U. Trattato di Patologia Generale (II Volume) Ed. UTET
-Robbins S., Cotran R., Kumar V. Le basi patologiche delle malattie Ed.
Piccin
PATOLOGIA MOLECOLARE
Obiettivi formativi
Il corso si prefigge di fornire allo studente le conoscenze approfondite
riguardo le alterazioni delle molecole biologiche che danno luogo a sintomi
o insieme di sintomi. In particolare alla luce delle recenti conoscenze
accumulate sulla struttura e sulla funzione degli acidi nucleici, sulla natura
e sull'organizzazione dei geni e sulla struttura e funzione delle proteine,
verrà analizzato il ruolo delle fini alterazioni delle singole molecole nella
genesi dei segni e dei sintomi delle malattie. Questo metodo di analisi,
107
- Chimica e Tecnologia Farmaceutiche ultimo gradino della correlazione struttura/funzione permette di descrivere
molte malattie in termini di alterazioni di una singola molecola o anche di
prevedere la presenza di determinati sintomi o di un determinato quadro
clinico in presenza di specifiche alterazioni molecolari. Inoltre nell'ultima
parte del corso saranno presentate le recenti acquisizioni riguardo la
diagnosi e la terapia di alcune patologie ad origine molecolare.
Programma
I parte concetti generali: Patologia del DNA: alterazioni della molecola
e loro effetti. Patologia del RNA. Meccanismi generali di danno delle
molecole proteiche e loro effetti.
II parte: Nuove metodologie per la diagnosi e la terapia di patologie
molecolari: Real Time PCR; Terapia genica.
III parte: Esempi di Patologie Molecolari: Emoglobinopatie, Diabete
Mellito, Fibrosi Cistica, Emofilia A, Nanismo, Ipotiroidismo, Alterazioni
del Recettore androgenico
TESTI CONSIGLIATI
-Molecular Pathology di Jonathan Salisbury, Editori Taylor and Francis
London.
108