Pacemaker e Defibrillatori
Concetti base e guida pratica alla gestione
CONTENUTO
1. Concetti base 2. Modi di stimolazione convenzionali
3. Stimolazione Biventricolare (CRT)
4. La gestione del paziente con device
Appendici:
Algoritmo di scelta del tipo di pacemaker
Algoritmo di selezione del candidato all’ ICD ed alla CRT
Riferimenti bibliografici
1. Concetti base
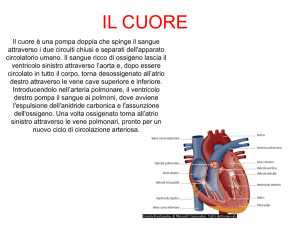
Perchè usare un Pacemaker o un Defibrillatore
Diversi tipi di patologie (ad es. infarto, scompenso cardiaco,
ipertensione…) possono causare disturbi del ritmo cardiaco che
possono manifestarsi sia con episodi di rallentamento (bradicardia) che
di accelerazione (tachicardia) della frequenza cardiaca.
Una soluzione efficace per aiutare il cuore a mantenere un ritmo regolare,
in particolare in caso di bradicardia, è l’impianto di un Pacemaker (PM).
Simile come forma ma non come funzionalità e scopi, è il Defibrillatore
Impiantabile (ICD), dispositivo in grado di mantenere il cuore ad
un ritmo regolare in caso di bradicardia (esattamente come un PM)
oppure di riportarlo al ritmo sinusale in caso di tachicardie, che sono
potenzialmente fatali.
Cos’è il Pacemaker e come si impianta
Il sistema è composto da un generatore di impulsi (in inglese,“Pacemaker”)
e da uno o due fili (detti “elettrocateteri”) che lo connettono al cuore.
Se il cuore batte troppo lentamente il pacemaker emette deboli segnali
elettrici che vengono trasmessi al cuore attraverso gli elettrodi e lo
fanno battere più velocemente. Le impostazioni del pacemaker possono
essere modificate utilizzando un dispositivo di programmazione. La
comunicazione tra il pacemaker ed il dispositivo di programmazione
avviene appoggiando una testina magnetica sulla cute in prossimità
del pacemaker stesso. Grazie al costante sviluppo tecnologico esistono vari tipi di
PM disponibili per le diverse esigenze dei pazienti. Una distinzione fondamentale
è quella tra i dispositivi monocamerali e quelli bicamerali: nei pacemaker
monocamerali la punta dell’elettrodo è collocata nell’atrio o nel ventricolo destro (a
seconda del tipo di patologia); nei pacemaker bicamerali gli elettrodi sono collocati
uno nell’atrio destro e uno nel ventricolo destro (vd. figura).
Tale distinzione comporta anche una differenza in termini di durata del dispositivo:
infatti un dispositivo monocamerale, dovendo stimolare una sola camera
cardiaca, dura generalmente 9-10 anni, invece un dispositivo bicamerale
mediamente 7-8 anni.
L’impianto del pacemaker richiede un intervento in anestesia locale. Con
una piccola incisione cutanea fatta immediatamente sotto la clavicola
il medico introduce l’elettrodo nel cuore passando attraverso la vena
succlavia o cefalica. La procedura viene monitorata attraverso raggi X.
Una volta identificata la corretta collocazione, l’elettrodo viene fissato alla parete
del cuore e connesso al PM. Il PM viene poi inserito in una tasca sottocutanea nella
zona del muscolo pettorale.
A seconda del metodo di fissaggio alla parete
intracardiaca, gli elettrodi si distinguono in elettrodi
“a barbe” o “a vite”: i primi presentano sulla punta del
catetere delle alette che consentono di stabilizzare
il catetere fissandolo sulle trabecole della parete
cardiaca, i secondi presentano invece una vite di 2-3
mm che si fissa direttamente avvitandosi alla parete
cardiaca. Normalmente tale vite è retrattile, cioè è
contenuta all’interno del corpo del catetere e viene
fatta fuoriuscire nel momento in cui l’elettrocatetere
è all’interno del cuore.
Un’ ulteriore distinzione tra gli elettrocateteri è quella tra “monopolare” e “bipolare”.
I primi erogano l’impulso di stimolazione facendo circolare una corrente elettrica
tra la punta dell’elettrodo e la cassa del dispositivo stesso. I secondi hanno invece
un dipolo sulla punta del catetere e quindi la corrente di stimolazione circola tra la
punta e un anello conduttore posto a circa 10mm dalla punta. I cateteri bipolari
possono essere utilizzati anche come monopolari attraverso un’opportuna
programmazione del dispositivo.
In passato i cateteri monopolari (contenendo un solo filo conduttore) risultavano
più sottili di quelli bipolari e venivano quindi preferiti; oggi la tecnologia permette
di costruire cateteri bipolari sottili e di conseguenza l’utilizzo di cateteri monopolari
sta via via scomparendo.
La differenza principale tra i due modi di stimolazione si nota all’ECG di superficie:
la stimolazione monopolare presenta degli impulsi (“spikes”) visibili sul tracciato,
viceversa gli impulsi bipolari si presentano di ampiezza molto ridotta e talvolta non
risultano visibili (in particolar modo all’Holter).
Cos’è il Defibrillatore e come si impianta
La funzionalità più importante del defibrillatore è quella di interrompere aritmie
ventricolari sostenute che altrimenti potrebbero essere fatali per il paziente.
Per fare ciò, il defibrillatore può erogare due tipologie di terapie:
• stimolazione ad alta frequenza (ATP): l’ICD cerca di stimolare il cuore ad una
frequenza più alta di quella della tachicardia che è in corso, in modo da
“catturarla” e quindi interromperla;
• shock/cardioversione: l’ICD rilascia una forte scarica di corrente elettrica
attraverso il cuore del paziente che interrompe la tachicardia.
Tali terapie sono intrinsecamente legate ad un’altra funzione basilare del
defibrillatore che è il riconoscimento della presenza di tachicardie. Per fare ciò, l’ICD
monitorizza ogni battito cardiaco ventricolare attraverso gli elettrocateteri e ne
controlla la frequenza: quando tale frequenza supera un limite stabilito dal medico,
limite che è personalizzabile paziente per paziente,
il defibrillatore interviene con una delle terapie
descritte in precedenza. In termini di impianto il
Defibrillatore è praticamente analogo al Pacemaker:
i cateteri vengono introdotti attraverso la vena
succlavia o, più raramente, cefalica in ventricolo
destro e in atrio destro (in caso di monocamerale,
solo in ventricolo destro) e successivamente connessi
al dispositivo posizionato in una tasca sottocutanea
pettorale.
Anche gli elettrocateteri da defibrillazione si distinguono in cateteri a barbe e a
vite. Tali cateteri presentano però anche una o due spirali di filo conduttore (detti
in inglese “coil”) che servono ad erogare lo shock elettrico (in maniera analoga alle
piastre dei defibrillatori esterni).
La spirale principale è quella situata vicino alla punta del catetere; tale spirale al
termine dell’impianto si troverà all’interno del ventricolo destro.
Nel momento in cui il defibrillatore dovesse erogare uno shock per
interrompere un’aritmia ventricolare, la corrente elettrica verrebbe
fatta circolare tra questa spirale e la cassa stessa del defibrillatore
passando attraverso il cuore del paziente.
La maggioranza dei cateteri attualmente in uso prevede anche una
seconda spirale che viene situata all’imbocco della vena cava superiore.
In presenza di tale spirale aggiuntiva, la corrente di shock viene fatta
circolare contemporaneamente tra la spirale in ventricolo destro la
cassa dell’ICD e la spirale in vena cava.
Scopo di questo diverso percorso della corrente è quello di“coinvolgere”
la maggiore massa possibile del tessuto cardiaco e quindi facilitare la
scomparsa della tachicardia in atto ed il ritorno ad un ritmo normale.
Al termine dell’impianto, salvo controindicazioni, il defibrillatore viene normalmente
testato per assicurare il suo corretto funzionamento. Tale test, detto Test di Induzione
di FV, consiste nell’induzione di un aritmia ventricolare (fibrillazione ventricolare),
attraverso stimoli ad alta frequenza abbinati ad uno shock di debole entità. Una
volta indotta tale aritmia, si verifica il corretto funzionamento del dispositivo ICD
e cioè il riconoscimento della presenza dell’aritmia, l’erogazione di uno shock
elettrico e la conseguente scomparsa dell’aritmia.
Tale test viene eseguito in anestesia totale per qualche minuto.
Il defibrillatore impiantabile, come detto, è in grado di fornire non solo protezione
dalle aritmie maligne ma anche supporto in presenza di bradicardie.
In tal senso, è da notare che i moderni defibrillatori contengono le stesse
funzioni e caratteristiche dei pacemaker, cui poi si aggiungono le funzionalità
anti-tachicardiche sopra descritte.
Tutte le considerazioni sul funzionamento antibradicardico di un pacemaker che
seguiranno potranno essere quindi traslate sul defibrillatore e viceversa.
2. Modi di stimolazione convenzionali
Classificazione
Pacemaker e defibrillatori possono effettuare diverse modalità di stimolazione.
Tali modalità sono classificate mediante un codice a 4 lettere.
La prima lettera corrisponde alla camera cardiaca che si sta stimolando:
A – atrio, V – ventricolo, D - sia atrio che ventricolo, O - nessuna delle due.
La seconda lettera corrisponde alla camera cardiaca che il PM/ICD “sente”, con le
medesime alternative della prima lettera (A, V, D, O).
Un PM/ICD monocamerale potrà sentire e stimolare unicamente nella camera a cui
è collegato mediante elettrocatetere, quindi, per esempio, un PM monocamerale
collegato in ventricolo potrà avere un modo di stimolazione, come prime due
lettere ,“VV” oppure “VO” ma non “AA”.
La terza lettera corrisponde all’azione che il PM/ICD effettua nel momento in cui
sente l’attività della camera a cui è collegato.
Tale lettera potrà essere:
I- inibizione, T- trigger, D- inibizione e trigger, O- nessuna azione.
Per esempio, se si vuole che un PM monocamerale connesso in atrio stimoli
l’atrio solo quando non c’è un’attività atriale autonoma del cuore, la modalità di
stimolazione dovrà essere AAI: si stimola l’atrio, si sente l’atrio e quando è presente
un’attività intrinseca, il PM non deve stimolare (quindi deve inibirsi). L’analoga
modalità per un PM monocamerale in ventricolo sarà VVI.
I primissimi pacemaker venivano costruiti per stimolare ad una frequenza fissa e
non erano in grado di sentire l’attività della camera cardiaca cui erano connessi,
pertanto i modi di stimolazione possibili erano unicamente VOO (se connesso in
ventricolo) o AOO (se connesso in atrio).
L’azione “T” (trigger) è un modo di funzionamento usato molto raramente nei
PM monocamerali e consiste nella modalità per cui il pacemaker, qualora senta
l’attività intrinseca del cuore, sincronizzi il suo stimolo su quella stessa attività. Per
esempio: modalità VVT, ad ogni contrazione del ventricolo, il pacemaker eroga una
stimolazione che viene quindi a sovrapporsi alla contrazione cardiaca.
I modi di stimolazione monocamerali sono caratterizzati principalmente da un
parametro: la Frequenza minima (o “Lower rate”), cioè quella al di sotto della
quale il PM interviene.
In altre parole, un pacemaker programmato in VVI con frequenza minima a 60
bpm, controlla che ciascun battito sia almeno alla frequenza di 60 bpm rispetto
al precedente, cioè permette che tra un battito ventricolare e l’altro trascorrano al
massimo 1000ms. Al termine di questo intervallo, se non è stata sentita un’attività
ventricolare, il ventricolo viene stimolato.
stimolazione VVI
1000 ms
(freq. 60 bpm)
Battito
intrinseco
sentito
1000 ms
Allo stesso modo per la stimolazione AAI, con la frequenza minima applicata in
atrio invece che in ventricolo...
stimolazione AAI
La quarta lettera della codifica internazionale è opzionale ed è “R” (Rate Response)
qualora il dispositivo sia in grado di variare autonomamente la frequenza di
stimolazione per cercare di mimare le fisiologiche variazioni di frequenza che sono
presenti nel soggetto sano quando compie sforzi o effettua esercizio fisico.
Solo alcuni PM presentano tale modalità di funzionamento: sono quelli che
contengono un sensore (generalmente, accelerometrico) che è in grado di
percepire i movimenti del paziente. In presenza di movimenti aumenterà la
frequenza di stimolazione per fare fronte ai bisogni del paziente, la ridurrà poi
quando il soggetto tornerà ad essere fermo.
L’utilizzo di tali pacemaker (e dei modi di stimolazione Rate-Responsive) è
raccomandato in presenza di insufficienza cronotropa.
Tutti i defibrillatori in commercio sono dotati di tale funzione.
Modi di stimolazione bicamerali: DDD
Quando si utilizzano PM/ICD bicamerali, connessi con un elettrodo all’atrio ed
uno al ventricolo, alle modalità di stimolazione monocamerali che sono ancora
disponibili (un dispositivo bicamerale può essere normalmente programmato in
modalità VVI o AAI) si aggiungono le modalità bicamerali.
Per rendere il funzionamento del PM più fisiologico possibile, le modalità
bicamerali permettono di sincronizzare la stimolazione ventricolare in base a
ciò che avviene in atrio.
In particolare, viene programmato dal medico un opportuno intervallo AV in
modo tale che l’attività ventricolare avvenga sempre con un ritardo prestabilito
rispetto all’attività atriale.
Nella pratica, quando il PM stimola in modalità DDD esso monitora costantemente
sia le attività delle due camere cardiache sia il loro reciproco ritardo:
• controlla l’atrio: se esso non si attiva autonomamente, lo stimola (come in
modalità AAI); tale stimolazione avviene alla frequenza minima programmata
(per es., 60 bpm) oppure alla frequenza imposta dal sensore accelerometrico (in
caso di modo DDDR, se presente il sensore).
• a seguito della contrazione dell’atrio (autonoma o indotta dal pacing), il
PM controlla che avvenga l’attivazione del ventricolo entro l’intervallo AV
programmato, se ciò non avviene, stimola il ventricolo. In questo senso la terza
lettera della sigla è “D” perchè il PM è in grado, a seguito della contrazione
atriale, sia di inibirsi (se appare il ventricolo) sia di triggerare una stimolazione
ventricolare al termine dell’intervallo AV.
Negli esempi successivi sono riportate le quattro possibili combinazioni di
funzionamento del modo DDD.
È fondamentale notare che nei modi monocamerali (VVI, AAI) il pacemaker
varia il suo funzionamento in base alla sola frequenza intrinseca del cuore
del paziente: se la frequenza è elevata (al di sopra della frequenza minima
programmata), il PM non stimola; se invece la frequenza è minore di quella
minima, il paziente avrà un ritmo stimolato dal pacemaker.
Nei modi bicamerali, il pacemaker varia il suo funzionamento non solo
in base alla frequenza del paziente ma anche in base all’intervallo P-R
intrinseco: in presenza di un intervallo P-R corto (minore dell’intervallo
AV programmato) il ventricolo non sarà stimolato ma si contrarrà
autonomamente; in presenza di un intervallo P-R lungo o in presenza di
blocco atrio-ventricolare, il ventricolo sarà sempre stimolato dal PM.
Modo DDD: esempi di funzionamento
L’atrio si attiva
autonomamente;
il PM stimola
il ventricolo al termine
dell’intervallo AV
L’atrio non si attiva e
quindi viene stimolato;
al termine dell’intervallo
AV anche il ventricolo
non si è attivato e quindi
viene stimolato
L’atrio si attiva
autonomamente ed
il ventricolo si attiva
autonomanente entro
il termine dell’intervallo
AV: il PM non interviene
L’atrio non si contrae e
quindi viene stimolato,
il ventricolo invece
si attiva autonomanente
entro il termine
dell’intervallo AV, quindi
non viene stimolato
Modo di stimolazione VDD
Esistono alcuni modelli di Pacemaker che sono in grado di sentire l’atrio ma non di
stimolarlo, perchè utilizzano uno speciale catetere ventricolare che contiene anche
un dipolo in prossimità dell’atrio. Tale dipolo, quando l’elettrodo si trova nella sua
posizione finale, si viene a trovare “flottante” in atrio destro ed è generalmente in
grado di sentire l’attività atriale pur senza essere agganciato alla parete cardiaca.
La modalità di stimolazione è quella VDD: può stimolare cioè solamente il ventricolo
e tale stimolazione avviene quando a seguito dell’attività atriale è trascorso
l’intervallo AV senza comparsa dell’attività ventricolare.
Tale tipologia di pacemaker ha un utilizzo numericamente significativo, pur se
limitato, per il beneficio di poter sincronizzare l’attività ventricolare in base a quella
atriale senza dover impiantare due distinti elettrocateteri.
Dall’altra parte è necessario che il paziente abbia un’attività atriale autonoma
perchè, se ciò non avviene, il PM non sarà in grado di stimolare l’atrio e funzionerà
come se fosse un PM monocamerale (cioè in VVI).
Minimizzazione del Pacing Ventricolare
Alcuni importanti studi (MOST, DAVID, SAVEPACe) hanno inequivocabilmente
dimostrato come la stimolazione in ventricolo destro non necessaria si correli ad
una maggiore incidenza di Scompenso Cardiaco, Fibrillazione Atriale persistente e
conseguenti ospedalizzazioni ed eventi avversi.
Tale effetto è stato in particolare imputato alla dissincronia che il pacing apicale
destro induce sia tra ventricolo destro e sinistro, sia tra il setto e la parete laterale
del ventricolo sinistro.
Gli studi precedentemente citati hanno altresì dimostrato che, in pazienti
con malattia del nodo del seno (indicati quindi ad un PM bicamerale) senza
blocchi AV di II/III grado, minimizzare la stimolazione in ventricolo limitandola
al minimo necessario, permette una riduzione più che significativa di FA
persistente e Scompenso.
Tale minimizzazione si potrebbe ottenere attraverso una modalità di stimolazione
AAI, ma in caso di comparsa di blocchi AV, non sarebbe possibile mantenere la
sicurezza del paziente.
Alternativamente si può pensare di allungare il più possibile l’intervallo AV prima
citato, in modo da favorire la comparsa dell’attività ventricolare, mantenendo la
sicurezza in caso di comparsa di blocco AV.
In passato le varie ditte costruttrici di pacemaker hanno proposto algoritmi che
attuavano in automatico una “ricerca” dell’AV ottimale per favorire la conduzione
intrinseca (ad es. Search AV™).
D’altra parte tale soluzione non è sempre praticabile per motivi tecnici (si rischiano
tachicardie mediate da PM ed altri malfunzionamenti), e inoltre, pur riducendo la %
di pacing in ventricolo (% di battiti stimolati rispetto ai battiti totali), non risolve del
tutto il problema.
Medtronic ha introdotto sul mercato (2005) una nuova modalità di stimolazione
detta MVP (Minimal Ventricular Pacing™) che risolve questo problema: con
questa modalità attiva, il pacemaker è programmato in modalità AAI (quindi stimola
e sente unicamente l’atrio) ma mantiene monitorata anche l’attività ventricolare.
In tal modo, se il paziente ha un’attività ventricolare intrinseca, il pacemaker
permetterà che questa emerga indipendentemente dall’intervallo AV; se invece,
l’attività ventricolare non è presente (compare un blocco AV), il PM cambia
automaticamente modalità da AAI a DDD (oppure da AAIR a DDDR se è attiva la
Rate Response).
Tale cambio automatico di modalità è reversibile, quindi in caso di mancata attività
ventricolare (e quindi cambio AAI-->DDD), il pacemaker si manterrà in DDD
fintanto che, mediante alcune prove ad intervalli di tempo programmati, non
vedrà di nuovo un’attività intrinseca ventricolare.
Esempio
Il PM funziona in AAI (l’intervallo AV non conta) ma monitorizza il ventricolo; se tra un atrio e l’altro non vede l’attività ventricolare cambia modalità in DDD.
La modalità MVP (indicata anche come “AAI<--->DDD”) è stata avallata anche dalle
linee guida AIAC per la Cardiostimolazione (GIAC Dic2005, vol. 8), come la modalità
più efficace per minimizzare il pacing non necessario in pazienti con malattia del
nodo del seno.
In generale, per tutti i pazienti portatori di pacemaker, ma ancor più per quelli con
defibrillatore (che hanno generalmente disfunzione ventricolare sistolica e quindi
sono a maggior rischio di scompenso e possono subire maggiormente gli effetti della
dissincronia indotta) è opportuno monitorare ai follow-up e/o con diagnostiche
dedicate interne ai dispositivi stessi, che la percentuale di battiti stimolati sia la più
bassa possibile, in base alle caratteristiche di ciascun paziente.
I pacemaker Medtronic offrono una diagnostica automatica dedicata a lungo
termine che permette di controllare, nel corso del follow-up, se il ventricolo è o
meno stimolato.
% di battiti stimolati in
ventricolo rispetto al
totale
In tutti i dispositivi non-CRT, il goal della terapia di pacing nei pazienti con
malattia del nodo del seno, dovrebbe essere quello di azzerare la percentuale
di pacing in ventricolo destro, mantenendo inalterata quella in atrio (che risulta
terapeutica per la MNS).
Si noti che tale approccio non si applica, o si applica più limitatamente, qualora
la stimolazione in ventricolo destro non avvenga nel sito convenzionale
(apice) ma in siti alternativi, quali il fascio di His, la zona para-hissiana ed il setto
interventricolare.
Sebbene i vantaggi di questi approcci rispetto a quello convenzionale non siano
ancora stati dimostrati da grossi trials, i presupposti fisiopatologici, le esperienze
monocentriche ed i primi studi mostrano come, in pazienti selezionati, una
stimolazione più fisiologica possa far superare le problematiche illustrate,
permettendo di stimolare il ventricolo evitando o limitando la dissincronia
indotta precedentemente descritta.
NOTA TECNICA: Intervallo AV
Nella programmazione dell’intervallo AV, viene distinto l’intervallo AV successivo
ad un atrio spontaneo da quello successivo ad un atrio stimolato. Il primo
è detto SAV (Sensed AV), il secondo è detto PAV (Paced AV). La regola generale
vuole che l’intervallo PAV sia sempre 30 ms maggior e del SAV. Questo perchè
la conduzione inter-atriale di un impulso stimolato è generalmente più lenta di
quella dell’attivazione spontanea, quindi è necessario più tempo prima di poter
stimolare il ventricolo.
3. Stimolazione Biventricolare (CRT)
Dalla fine degli anni ‘90, si è sviluppata una nuova tipologia di Pacemaker
(e successivamente di Defibrillatori impiantabili) detti “biventricolari”. La Terapia
di Resincronizzazione Cardiaca (CRT), che si ottiene attraverso questi dispositivi,
si applica a pazienti con Scompenso Cardiaco Cronico Sistolico caratterizzato da
un’importante dissincronia ventricolare.
I pazienti indicati a tale terapia hanno infatti una severa disfunzione sistolica
(caratterizzata da una Frazione di Eiezione del ventricolo sinistro inferiore al
35%) cui si accompagna un ritardo di conduzione ventricolare che provoca un
allargamento del complesso QRS all’Elettrocardiogramma di superficie ed una
dissincronia meccanica tra le pareti intracardiache.
Tale dissincronia riduce l’efficienza della contrazione ventricolare e peggiora
conseguentemente lo stroke volume.
Inizialmente, il principale marker di dissincronia era considerata la presenza del
Blocco di Branca Sinistra, a tutt’oggi le linee guida internazionali identificano
più generalmente la presenza di dissincronia con una durata del complesso
QRS maggiore o uguale a 120 ms.
Inoltre, se inizialmente si presupponeva che tale dissincronia fosse deleteria
principalmente perchè creava un ritardo di contrazione tra ventricolo destro
e sinistro (ritardo interventricolare), studi più recenti hanno evidenziato
come in realtà sia il ritardo di contrazione tra le pareti del ventricolo sinistro
stesso (ritardo intraventricolare) a giocare un ruolo primario nella riduzione
dell’efficienza di pompa, in particolare la dissincronia tra il setto (precoce) e
la parete laterale (tardiva).
Funzionamento ed impianto dei dispositivi biventricolari
La Terapia di Resincronizzazione Cardiaca consiste nella stimolazione
contemporanea del ventricolo destro e del ventricolo sinistro attraverso due distinti
elettrocateteri posizionati l’uno in ventricolo destro (spesso in apice ma recentemente
anche sul setto interventricolare) e l’altro sulla parete laterale o postero-laterale del
ventricolo sinistro, che come detto è generalmente la più ritardata.
Questi due elettrodi consentono di sincronizzare tra loro
la contrazione della parete laterale e del setto; inoltre
consentono di temporizzare correttamente queste
contrazioni sulla base dell’attività atriale programmando
opportunamente l’intervallo AV (analogo a quello dei
pacemaker/defibrillatori DDD).
Il posizionamento del catetere sinistro avviene per via
endovenosa percorrendo a ritroso l’albero venoso coronarico:
si incannula cioè il seno coronarico a partire dall’atrio destro,
si percorre il tronco del seno coronarico fino alla zona laterale
da cui di incannula una vena che porti in posizione laterale
media o postero-laterale. La punta dell’elettro-catetere verrà
quindi a trovarsi in una posizione epicardica della parete
libera del ventricolo sinistro. La procedura viene monitorata,
come per i dispositivi tradizionali, mediante raggi X.
L’impianto del catetere sinistro è critico per la riuscita della terapia ed il suo
posizionamento ottimale è condizionato da molteplici fattori anatomici e
non: in primis, la presenza di un seno coronarico accessibile e percorribile
con l’elettrocatetere; secondariamente, la presenza di almeno una vena nella
zona target (laterale/posterolaterale) anch’essa accessibile e percorribile;
infine, l’assenza di tessuto cicatriziale nella zona target per permettere la
stimolazione elettrica.
Per ovviare alle difficoltà di impianto di questo elettrocatetere, la tecnologia ha
sviluppato nuovi prodotti e tools di impianto: in particolare, elettrodi sempre più
sottili (ad oggi il diametro minimo è 4.1 Fr) o cateteri guida più manovrabili che
permettono di selezionare più facilmente le vene laterali dove poi far arrivare
l’elettrocatetere.
Gli studi più recenti, e numericamente più rilevanti, indicano una percentuale di
riuscita dell’impianto tra 89% e 95%.
L’ultimo aspetto, a livello di impianto, riguarda la fissazione dell’elettrocatetere.
La maggioranza degli elettrodi per il ventricolo sinistro hanno una
sorta di fissazione passiva che non si basa sulla presenza di alette di
fissaggio come nei cateteri “destri” (non essendo ovviamente presenti
trabecole all’interno delle vene coronariche), ma su una precurvatura
della parte finale dell’elettrodo, che facendo pressione sulle pareti
della vena, stabilizza il catetere.
Fa eccezione un elettrocatetere specifico (Attain StarFix™) che attua
una fissazione attiva all’interno della vena mediante un sistema di lobi
retrattili.
Tali lobi vengono fatti espandere una volta raggiunta la posizione
desiderata, fissando l’elettrodo mediante pressione sulle pareti della vena.
Indicazioni alla Terapia di Resincronizzazione
Le recenti linee guida comuni dell’European Society of Cardiology (2008) indicano,
in classe I, l’utilizzo della Terapia di Resincronizzazione per pazienti con le seguenti
caratteristiche:
• Scompenso cardiaco cronico nonostante terapia medica ottimale
• Classe funzionale NYHA III-IV
• Frazione di Eiezione del ventricolo sinistro ≤ 35%
• Durata del QRS ≥ 120ms
È da notare come la CRT resti indicata per pazienti che, oltre a queste caratteristiche,
presentino Fibrillazione Atriale oppure la necessità di pacing con elevata percentuale
di stimolazione (indipendentemente dalla durata del QRS e/o dal ritmo atriale).
Quest’ultima indicazione è strettamente correlata a quanto riportato nel precedente
paragrafo “Minimizzazione del pacing ventricolare”: se un paziente con scompenso
cronico avanzato e Frazione di Eiezione depressa viene sottoposto a stimolazione
convenzionale (pacing in apice del ventricolo destro), la dissincronia indotta da
tale stimolazione (simile a quella legata ad un blocco di branca sinistra) ha elevate
probabilità di peggiorare lo stato clinico e di aumentare la ricorrenza di fibrillazione
atriale e ospedalizzazioni per scompenso.
Pertanto, quando per questi pazienti si rende necessaria una stimolazione
ventricolare (per presenza di blocchi AV o bradicardie), è opportuno ricorrere ad
una stimolazione biventricolare e non limitarsi a quella convenzionale.
Alternativamente, come già accennato, moderni approcci risolvono il problema
evitando di stimolare in apice ma posizionando il catetere destro in siti non
convenzionali (quali fascio di His, zona parahissiana, setto).
Tali approcci non sono però ancora stati formalizzati all’interno delle linee guida.
Stimolazione Biventricolare: caratteristiche e particolarità
I dispositivi biventricolari vengono generalmente identificati come CRT-P
(pacemaker biventricolare) o CRT-D (defibrillatore biventricolare). Essi hanno
funzionamento e modi di stimolazione analoghi a quelli dei PM/ICD convenzionali
ed una durata di circa 6 anni (CRT-P) o 4-5 anni (CRT-D).
In particolare, se è presente il ritmo sinusale, sono programmati in DDD o DDDR e
quindi viene posizionato un elettrodo anche in atrio. Se il paziente è in fibrillazione
atriale cronica invece, vengono programmati in VVI o VVIR e quindi non viene
posizionato il catetere atriale.
Per i dispositivi biventricolari, una stimolazione AAI/AAIR non ha senso visto che il
fulcro della terapia è la stimolazione dei due ventricoli.
Programmazione dell’intervallo AV
Nella terapia di resincronizzazione, lo scopo principale è quello di ottenere la
sincronia tra le pareti intracardiache. Tale risultato è strettamente legato all’effettiva
stimolazione dei due ventricoli, in altre parole, per poter resincronizzare
efficacemente è necessario che la percentuale di stimolazione dei ventricoli
sia prossima al 100%.
Tale filosofia è diametralmente opposta a quella vista nella malattia del nodo del
seno per i PM/ICD tradizionali. In quel caso era necessario minimizzare il pacing
(non necessario); per una CRT efficace è invece necessario massimizzarlo.
In tal senso gioca ancora un ruolo fondamentale l’intervallo AV programmato:
esso determina la distanza temporale tra l’attività atriale (stimolata o spontanea) e
la stimolazione dei due ventricoli.
Nei dispositivi CRT tale intervallo deve essere sufficientemente corto per
evitare che la contrazione ventricolare intrinseca (dissincrona) avvenga, ma
anche sufficientemente lungo per massimizzare il riempimento diastolico
ventricolare. Generalmente questo parametro è fissato nominalmente a 100ms.
è però necessario assicurarsi che questa programmazione
sia ottimale e variarla se non lo è.
Tale verifica viene possibilmente effettuata mediante
ecocardiografia verificando al doppler transmitralico la
posizione reciproca dell’onda E e dell’onda A.
È altresì importante verificare che l’intervallo AV ottimale così
stabilito sia tale anche al variare della frequenza cardiaca.
Non è infrequente, infatti, che all’aumentare della frequenza cardiaca (per esempio
in caso di attività fisica), l’intervallo AV spontaneo del paziente si accorci al punto
da diventare più breve dell’AV ottimale programmato.
In tale situazione la stimolazione biventricolare viene inibita dalla comparsa della
contrazione spontanea e, paradossalmente, proprio nel momento di maggiore
necessità vengono persi i benefici della CRT.
E’ necessario verificare che l’intervallo AV sia sufficientemente corto da precedere l’attivazione spontanea (dissincrona) dei
ventricoli (in fig. negli ultimi 3 battiti l’AV programmato è troppo lungo)
Tutti i moderni PM e ICD biventricolari contengono una funzione detta “AV adattabile
alla frequenza” che automaticamente riduce l’intervallo AV programmato al salire
della frequenza in modo da mimare la fisiologica riduzione del P-R spontaneo e
quindi evitare che venga persa la stimolazione biventricolare.
D’altra parte, se il paziente riportasse sintomi durante sforzi fisici, sarebbe
opportuno verificare (per esempio durante un test ergometrico) che la stimolazione
biventricolare sia mantenuta per tutta la durata dello sforzo.
Come per i PM/ICD convenzionali, anche nei dispositivi CRT esistono diagnostiche,
memorizzate dal dispositivo stesso, che prevedono il monitoraggio della % di
pacing a lungo termine. Tale diagnostica permette di verificare che la terapia
di Resincronizzazione venga effettivamente erogata, cioè che la % di pacing
ventricolare sia sempre più vicina possibile al 100%.
Programmazione dell’intervallo VV
I moderni dispositivi CRT-P e CRT-D hanno la possibilità di stimolare con tempistiche
diverse nei due elettrodi ventricolari sinistro e destro.
Per esempio, un dispositivo potrebbe essere programmato in DDDR con un intervallo
AV di 100 ms ed un intervallo VV di 12 ms, anticipando la stimolazione a sinistra.
Questo comporta che la sequenza di stimolazione non sia più Atrio-Ventricoli ma
diventi Atrio-VentricoloSinistro-VentricoloDestro.
Tale funzione ha diverse utilità. La principale è legata alla differenza tra l’attivazione
elettrica delle pareti cardiache e quella meccanica. Può infatti capitare che
un’attivazione simultanea dei due elettrodi ventricolari non si tramuti in una
conseguente contrazione simultanea delle pareti (in particolare setto e parete
libera del ventricolo sinistro), sia per i fisiologici diversi ritardi di attivazione elettromeccanica, sia per le diverse posizioni dei cateteri all’interno del cuore.
Per ottimizzare la contrazione meccanica e massimizzare l’effetto della CRT, è quindi
possibile variare la tempistica con cui i due elettrodi stimolano le relative zone di
impianto, verificando la sincronia delle pareti del ventricolo sinistro. Tale procedura
viene generalmente effettuata mediante guida ecocardiografica, puntando a
massimizzare la gittata cardiaca.
Un altro aspetto inerente l’intervallo VV è legato al posizionamento
dell’elettrocatetere sinistro. Non essendo infatti sempre possibile raggiungere la
zona ottimale di impianto, la possibilità di anticipare la stimolazione sinistra può
permettere di migliorare comunque la contrazione cardiaca variando la sequenza
di attivazione delle varie pareti.
Nominalmente, in ogni caso, la stimolazione dei due ventricoli avviene
simultaneamente (Intervallo VV = 0). E’ poi programmabile, anticipando l’uno o
l’altro canale, fino a 80ms.
Aritmie atriali e loro impatto sulla CRT
La presenza di fibrillazione atriale cronica o parossistica non è di per sè un criterio
di esclusione per la terapia di Resincronizzazione, diversi studi hanno infatti
dimostrato che gli effetti della CRT sono analoghi a quelli che si ottengono su
pazienti in ritmo sinusale.
La problematica principale in questo contesto è legata all’effettiva erogazione
della stimolazione biventricolare: il ritmo caotico atriale, l’irregolare conduzione
in ventricolo dell’attività atriale e l’innalzata frequenza cardiaca possono infatti
ridurre significativamente la percentuale di intervento del dispositivo.
Recenti studi hanno evidenziato come i pazienti in FA cronica ottengano esattamente
lo stesso beneficio di quelli in ritmo sinusale se si riesce a portare la percentuale di
stimolazione biventricolare vicina al 100% mediante Ablazione del Nodo AV.
In generale, un opportuno controllo in frequenza (farmacologico o mediante
ablazione) è assolutamente indispensabile in questa tipologia di pazienti, unito ad
un costante monitoraggio della percentuale di pacing.
In caso di aritmie atriali, il dispositivo si programma automaticamente in VVIR (se
non lo è già) ed il parametro critico è la frequenza minima. Il dispositivo è infatti
generalmente programmato con una frequenza minima di 60 bpm: in caso di FA
condotta in ventricolo, è probabile che la frequenza ventricolare superi spesso tale
soglia e di conseguenza il dispositivo non stimoli.
In passato, l’unica soluzione praticabile era quella di programmare una frequenza
minima più elevata (per es. 75 bpm). Questa soluzione, riduceva il problema solo
in parte e, di contro, impediva al paziente di avere frequenze basse quando era a
riposo o in assenza di aritmia atriale.
I dispositivi attuali sono invece dotati di algoritmi in grado di favorire il pacing anche
in presenza di aritmie atriali condotte in ventricolo. In particolare, l’algoritmo detto
“Risposta alla FA condotta”, per controbilanciare l’innalzamento della frequenza
media, incrementa automaticamente la frequenza di stimolazione in presenza di
aritmie atriali con conduzione in ventricolo. La riduce poi in assenza di conduzione
veloce della FA.
Bisogna comunque tenere presente che l’effetto di questo e di altri algoritmi con lo
stesso scopo è significativo però non elimina completamente il problema. Quindi,
abbinare il funzionamento di tali algoritmi ad un’opportuna terapia medica o
interventistica è necessario per non vanificare l’impianto del dispositivo CRT.
Il ruolo del follow-up nella terapia di resincronizzazione
CONTROLLO E OTTIMIZZAZIONE DELLA TERAPIA MEDICA POST-CRT
• Titolazione Beta-bloccanti
• Ottimizzazione diuretici
• Riabilitazione fisica
RICONOSCIMENTO ARITMIE ATRIALI E RIDUZIONE DEL PACING
• Insorgenza FA e gestione controllo in frequenza (eventuale indicazione ad
ablazione nodo AV)
• Verifica stimolazione biventricolare a riposo e sottosforzo (controllo cattura
ventricolo sinistro e/o programmazione AV ottimale)
VERIFICA DELLA NECESSITA’ DI OTTIMIZZARE LA PROGRAMMAZIONE
• Valutazione risposta ecocardiografica a medio termine
• Valutazione della necessità di ottimizzare gli intervalli programmati AV e VV
Programmazione delle uscite e loro impatto sulla CRT
La programmazione delle uscite atriali e ventricolari, cioè dell’energia erogata nelle
camere cardiache per stimolare attraverso i cateteri, è generalmente semplice nei
dispositivi convenzionali mono e bicamerali perchè si basa unicamente sulla soglia
di stimolazione misurata all’impianto o durante i controlli di routine. A tale soglia
misurata (generalmente inferiore ad 1 Volt, con una durata di impulso di 0.4 ms)
viene applicato un fattore moltiplicativo di sicurezza (di solito x1.5 o x2) e questa
sarà l’uscita programmata per il canale che si sta verificando.
Nei dispositivi CRT, questa procedura si applica in maniera identica agli elettrodi
“destri” (atrio e ventricolo destro) ma può essere differente per l’elettrodo che
stimola il ventricolo sinistro.
In primis, perchè la soglia di stimolazione del ventricolo sinistro, generalmente più
elevata di quelle “destre”, può variare nel breve-medio termine a causa di leggeri
sposizionamenti del catetere o a causa del rimodellamento che la CRT provoca.
In secondo luogo, perchè la posizione finale dell’elettrodo sinistro può essere
vicina al nervo frenico o al diaframma e di conseguenza può dare luogo ad una
stimolazione diaframmatica in particolare nel caso in cui la programmazione
dell’uscita sia elevata.
La corretta programmazione dell’uscita sinistra, che è cruciale per permettere la
stimolazione biventricolare, deve perciò basarsi sul bilanciamento tra l’esigenza
di stimolare in qualsivoglia condizione e quella di limitare l’ampiezza dell’impulso
per evitare la stimolazione diaframmatica.
Bisogna peraltro notare che l’evenienza della stimolazione diaframmatica è limitata
e che, per quanto fastidiosa per il paziente, non ha conseguenze cliniche. Inoltre,
il rimodellamento inverso che spesso avviene a seguito della CRT può contribuire
a ridurla.
Al momento dell’impianto di un elettrodo in ventricolo sinistro, vengono
generalmente testate due soglie: quella di stimolazione vera e propria (sopra la
quale bisogna porsi per ottenere la stimolazione sinistra) e quella diaframmatica
(sotto la quale bisognerà porsi per evitare contrazioni diaframmatiche).
Se tra le due esiste un margine sufficiente, il catetere è in una buona posizione,
altrimenti dovrà essere spostato.
Normalmente la soglia di stimolazione si attesta tra 0.5 e 2 V, quella diaframmatica
al di sopra dei 4-5V, permettendo un sufficiente margine di programazione anche
in caso di successive variazioni nel tempo.
Questi stessi test vengono poi riverificati ai controlli periodici.
Nei più recenti dispositivi, la soglia di stimolazione viene automaticamente
calcolata dal dispositivo giorno per giorno; in base a tale test, il dispositivo varia
autonomamente l’uscita programmata.
Grazie a questa tecnologia, ovvero alla sicurezza di un controllo giornaliero
automatico, non è più necessario avere margini di sicurezza elevati ma è sufficiente
porsi 0.5V o 1 V al di sopra della soglia.
Ciò facilita la gestione della soglia diaframmatica aumentando il margine tra l’uscita
programmata e tale soglia ed inoltre, limitando l’uscita, permette un risparmio
della batteria.
4.1 La gestione del paziente con device
I defibrillatori impiantabili condividono con i Pacemaker le medesime piattaforme
tecnologiche per quanto riguarda la programmazione anti-bradicardica. Pertanto
tutte le informazioni fornite fino ad ora sono applicabili indifferentemente agli uni
ed agli altri (incluse quelle relative alla CRT).
Il seguente capitolo vuole sinteticamente descrivere alcune differenze e peculiarità
di defibrillatori e pacemaker, e fornire una panoramica delle possibilità che i
dispositivi forniscono per una gestione ottimale dei pazienti portatori.
Pacemaker o Defibrillatore?
Per quanto massa e volume dei due dispositivi siano significativamente diverse,
non è sempre possibile distinguere “a vista” un paziente portatore di un pacemaker
da quello portatore di un defibrillatore.
Il cartellino/tessera che il paziente dovrebbe avere sempre con sè permette di
distinguere il tipo ed il modello di dispositivo di cui è portatore.
In linea generale, possono essere utili alcune osservazioni, soprattutto se il paziente
non è cosciente, non ha documenti o in altre situazioni:
• il defibrillatore viene impiantato nella zona pettorale sinistra (salvo particolari
problematiche), quindi un dispositivo impiantato nella zona pettorale destra è
probabilmente un pacemaker;
• i defibrillatori sono muniti di allarmi acustici atti ad allertare medico e paziente
in alcune situazioni (vd. successivo paragrafo); i pacemaker ne sono privi, quindi
se un dispositivo emette un suono è un defibrillatore;
• gli elettrocateteri impiantati con i defibrillatori sono unicamente bipolari
quindi i loro impulsi di stimolazione non sono visibili (o lo sono minimamente)
ad un ECG di superficie, pertanto un ECG che presenti “spikes” di stimolazione
è probabilmente un pacemaker. Fanno eccezione i dispositivi CRT per i quali
l’elettrodo sinistro può essere monopolare anche nei defibrillatori. L’aspetto
dell’ECG però dovrebbe consentire di cogliere la differenza di asse del QRS
(stimolazione convenzionale in apice ventricolo destro --> aspetto da BBS).
Stimolazione DDD in un ICD (cateteri solo bipolari)
Stimolazione DDD in un PM con cateteri monopolari
Effetto Magnete
Pacemaker e Defibrillatori si comportano in maniera diversa se sopra il dispositivo
viene posto un magnete.
I pacemaker si programmano temporaneamente in modalità asincrona, cioè in
AOO/VOO se sono monocamerali, in DOO se sono bicamerali. Inoltre vanno alla
frequenza fissa di 85 bpm se la batteria è carica, a 65 bpm se il PM è a fine vita e
deve essere sostituito.
Tale programmazione rimane attiva fintanto che il magnete è sopra il
pacemaker; alla sua rimozione, viene ripristinata la programmazione
precedente.
I defibrillatori impiantabili, invece, non attuano modifiche
alla
programmazione
anti-bradicardica,
ma
sospendono
temporaneamente quella anti-tachicardica. Pertanto, ponendo un magnete sopra
un defibrillatore, esso non interverrà in caso di aritmie e, se stava erogando terapie
(shock o ATP), si interrompe.
Anche in questo caso, la rimozione del magnete ripristina la programmazione
iniziale, riattivando la programmazione antitachicardica.
Nei defibrillatori impiantabili, il posizionamento del magnete attiva anche l’allarme
acustico che suonerà per alcuni secondi.
Interventi chirurgici ed interferenze
Pacemaker e Defibrillatori sono suscettibili di interferenze elettromagnetiche
dovute a campi elettromagnetici ambientali o a passaggi di corrente di lieve entità
attraverso il corpo del paziente.
In particolare, molti interventi chirurgici possono dare luogo a questo tipo di
interferenze. Esse generalmente possono essere interpretate dal dispositivo come
reali segnali cardiaci (ventricolari o atriali).
In queste situazioni, se il dispositivo è un pacemaker, il rischio è che il PM
“sentendo” un’attività intrinseca (fittizia), si inibisca. Il paziente, quindi, corre rischi
esclusivamente se è pacemaker-dipendente e se l’interferenza, e quindi l’inibizione,
viene prolungata nel tempo (oltre i 3-4 secondi).
Utilizzare un magnete, in questo caso, può risolvere con semplicità il problema,
perchè il dispositivo si programmerà in un modo asincrono e quindi continuerà a
stimolare indipendentemente dai segnali che sente.
Se invece il dispositivo è un ICD, le interferenze non solo possono provocare
inibizione della stimolazione, ma possono essere interpretate anche come aritmie
ventricolari e di conseguenza trattate (con ATP o shock).
Anche in questo caso, il magnete può risolvere in parte il problema perchè la sua
presenza esclude il trattamento antitachicardico evitando shock inappropriati.
Di contro, a causa dell’assenza di effetto sulla stimolazione anti-bradicardica, tale
soluzione non copre il rischio di inibizione del pacing e quindi è sicura solamente
in presenza di pazienti non pacemaker-dipendenti.
Oltre alle precauzioni da adottare durante gli interventi chirurgici, ci sono altre
situazioni in cui la presenza di un device è una eventuale controindicazione, ad
esempio in procedure quali:
• Risonanza Magnetica Nucleare
• Terapie con ultrasuoni (in prossimità del device)
• Radioterapia
• Diatermia
A questo proposito, Medtronic ha per prima introdotto sul mercato (2008)
il pacemaker compatibile con la Risonanza Magnetica Nucleare.
Tramite opportune modifiche ai circuiti interni, alla struttura del
dispositivo e alla geometria del corpo delgi elettrocateteri si sono
eliminati i possibili effetti pericolosi che una scansione MRI può avere sui
pazienti e i loro dispositivi cardiaci impiantabili.
E’ quindi possibile, con questo nuovo pacemaker, sottoporre il paziente
(previa programmazione ad hoc del device) ad una indagine diagnostica con MRI
(esclusa la zona compresa tra le vertebre da C1 a T12).
Nella vita di tutti i giorni i pazienti portatori di device possono venirsi a trovare in
situazioni “a rischio” in cui sono soggetti ad interferenze elettromagnetiche (EMI).
Nella tabella che segue vengono indicate le principali problematiche ambientali e
legate al luogo di lavoro:
Nessun Problema
Distanza > ½ metro
Attenzione!
Lavatrici, asciugatrici,
lavastoviglie, bollitori
Radio amatoriali, CB,
altoparlanti potenti
Aspirapolveri, piccoli
elettrodomestici
Trapani e altri utensili elettrici
da banco
Saldatrici ad arco o
resistenza
Forni a induzione o sistemi
di riscaldamento elettrici per
la fusione di materie plastiche
Sistemi antifurto di banche
e negozi (non sostare)
Attrezzi elettrici
da giardinaggio
Grossi generatori e centrali
energetiche
Telefoni cellulari
(tenere a distanza > 10cm)
Magneti di particolare
intensità
Trasmettitori radio
TV, riproduttori audio-video,
videoregistratori, cuffie
Allarmi acustici
I Defibrillatori impiantabili sono da sempre dotati di allarmi acustici che permettono
al paziente di essere allertato in caso di situazioni problematiche. Alcuni defibrillatori
hanno introdotto anche una funzione di vibrazione, simile a quella dei cellulari, con
il medesimo scopo.
Questi allarmi possono essere principalmente di due tipi:
• allarmi di integrità del sistema
• allarmi clinici
Allarmi di integrità del sistema
• Sospetta rottura catetere
• Esaurimento batteria
• Malfunzionamento
NECESSITANO DELL’INTERVENTO
DELL’ ELETTROFISIOLOGO
Allarmi di utilità clinica
• Insorgenza di FA
• Mancato controllo della frequenza durante FA
• Possibilità di congestione polmonare
POSSONO ESSERE UTILIZZATI NELLA
GESTIONE CLINICA DEL PAZIENTE
I primi suonano in caso di comparsa di problematiche del sistema quali: esaurimento
della batteria, problematiche agli elettrocateteri (possibili rotture), problematiche
ai condensatori (tempi di carica troppo lunghi). E’ necessario gestire questi allarmi
in tempi brevi perchè potrebbero riflettersi sulla sicurezza del paziente.
I secondi, invece, sono allarmi che tendono ad allertare il paziente in caso
di problematiche cliniche quali la comparsa di congestione polmonare o di
fibrillazione atriale oppure il mancato controllo in frequenza di aritmie atriali. Il
grado di urgenza di questi allarmi è pertanto minore rispetto ai primi e potrebbe
essere gestito anche da un medico non elettrofisiologo, in quanto inerente
problematiche cliniche e non tecniche.
E’ possibile programmare l’orario in cui questi allarmi potrebbero suonare
distinguendo gli uni dagli altri (programmando per esempio quello di integrità alle
9.00 e quello clinico alle 15.00).
Si consideri, comunque, che la probabilità che il primo tipo di allarme si verifichi è
molto ridotta.
Dati diagnostici
Gli attuali dispositivi consentono di monitorare a lungo termine (12-14 mesi) vari
dati inerenti sia il funzionamento stesso del dispositivo, sia lo stato clinico del
paziente.
Ad ogni controllo ospedaliero o remoto la disponilità di questi dati consente
di avere un quadro oggettivo dello stato del device e del paziente che aiuti il
medico a valutare correttamente la clinica del paziente e/o a risolvere eventuali
problematiche.
Tipologia di monitoraggio
Chi e quando?
Affidabilità (PPV)
Monitoraggio peso
Paziente, ogni giorno
23%
Monitoraggio telefonico
dei sintomi
Paziente + infermiere,
ogni 1-2 settimane
32 – 83%
Visita clinica
Ambulatorio, al Follow-Up
elevata
Esame Turgore giugulari
Ambulatorio, al Follow-up
42 – 75%
Variazione BNP o NT-proBNP
Ambulatorio, al Follow-Up
~ 70
Impedenziometria total-body
o toracica
Ambulatorio, al Follow-Up
70-90%
Variazione EcoDoppler
Ambulatorio, al Follow-Up
80-95%
Cateterismo (PCWP)
Ospedale, in day-h ~100%
~100%
(transvalvolare, vena cava...)
Le diagnostiche dei device sono infatti dati oggettivi, continui e non dipendono
dalla compliance del paziente e, se integrati con allarmi, permettono la prevenzione
del peggioramento dello stato di congestione.
Nelle pagine seguenti è riportato un esempio di stampa di queste diagnostiche e
una spiegazione di come esse possano essere di aiuto nella gestione del paziente.
In generale, i principali dati forniti dai device a disposizione del medico si possono
suddividere in:
Dati tecnici
• Impedenze, soglie e sensing giornalieri in atrio e in/nei ventricolo/i
• Stima della durata residua della batteria
Dati clinici per il monitoraggio aritmico (trend aritmici)
• Ore/Minuti al giorno di Fibrillazione atriale
• Frequenza ventricolare durante fibrillazione atriale
• Episodi di aritmie ventricolari sostenute e non sostenute e relativi dati
• Percentuale di pacing atriale e ventricolare
Dati clinici per il monitoraggio dello scompenso cardiaco
• Attività del paziente (ore al giorno di movimento, così come individuate dal
sensore accelerometrico)
• Frequenza media giornaliera notturna e diurna
• Heart Rate Variability
• Impedenza intratoracica e stima dei fluidi a livello polmonare (per monitorare il
grado di congestione)
Dalle informazioni alla gestione del paziente
Tutte queste informazioni possono aiutare il medico a raggiungere la terapia più
efficace per il paziente. Ogni singola diagnostica è infatti indicatrice di elementi
importanti sullo stato del paziente e suggerisce provvedimenti terapeutici
possibili. è però fondamentale una valutazione complessiva di tutti i dati che sono
fortemente correlati tra loro.
Nelle prossime pagine, per ognuna delle diagnostiche che saranno prese in
considerazione, si specificheranno le informazioni che esse possono fornire
e si elencheranno una serie di possibili soluzioni terapeutiche da prendere in
considerazione per migliorare lo stato del paziente.
I TREND ARITMICI
Ore/Minuti al giorno di Fibrillazione atriale
AT/AF total hours/day
Antiaritmico
Anticoagulante
Cardioversione
Ablazione
• Riscontro nuove aritmie ( e FA asintomatica)
• Valutazione efficacia terapia di controllo del ritmo
• Valutazione del rischio tromboembolico e gestione dell’anticoagulante
Frequenza ventricolare durante fibrillazione
Beta
V. rate during AT/AF
(bpm)
max/day
avg/day
• Valutazione della efficacia della terapia di controllo
Antiaritmico
P
della frequenza
Adeguare la
programmazione
del device
• Correlazione tra Frequenza Ventricolare e sintomi dei pazienti
Percentuale di pacing atriale e ventricolare
% Pacing/day
Atrial
---- Ventricular
P
• Nei dispositivi CRT... essenziale che la % di
Adeguare la
programmazione
del device
(MVP,AV e VV
timing, algoritmi
per aumentare il
pacing biv)
Ablazione,
cardioversione,
beta bloccanti,
terapia
antiaritmica
pacing(bi)ventricolare sia la più elevata possibile
• Nei dispositivi VR o DR... essenziale che la % di pacing
ventricolare (apicale) sia la più bassa possibile
MONITORAGGIO DELLLO SCOMPENSO CARDIACO
Attività del paziente
Verificare
impedenza
Patient activity
hours/day
Esercizio fisico
• Monitoraggio dello scompenso
• Monitoraggio dell’attività fisica del paziente
P
Risposta del
sensore
di movimento
• Relazione fra cambi di terapia e attività del paziente
Frequenza media
Avg V. ate (bpm)
Day
---- Night
• Monitoraggio degli episodi di scompenso: un’alta
frequenza notturna può essere indicazione di
disfunzione
Beta Bloccante
Ace-I
Diuretici
Verificare
impedenza
Heart rate variability
La HRV è più bassa in pazienti con alta mortalità e alto rischio di ospedalizzazioni
(decrementa parallelamente ad un peggioramento dello stato di compenso)
Beta Bloccante
Heart rate variability
(ms)
Ace-I
Diuretici
• HRV è indice di scompenso e di disfunzione
Verificare
impedenza
autonomica
• Predittore delle ospedalizzazioni
• Controllo delle terapia farmacologica: l’HRV aumenta quando
la terapia è corretta
Monitoraggio dell’impedenza intratoracica
Il paziente con scompenso cardiaco ha un evento acuto che è dovuto nel 55% circa
dei casi a congestione, che è quindi causa di un peggioramento prognostico.
I dispostivi Medtronic per questo tipo di pazienti sono dotati di un sistema di
monitoraggio dell’impedenza intratoracica per controllare l’accumulo di fluidi nei
polmoni (OptivolTM).
Il trend delle impedenze è una diagnostica quotidiana non invasiva che completa
il quadro diagnostico di un paziente difficile da gestire.
L’impedenza intratoracica è strettamente correlata con PCWP, principale predittore
di ospedalizzazione per scompenso e morte per scompenso cardiaco.
L’ Impedenza transtoracica è quindi un valido marker dell’accumulo di fluidi nei
polmoni.
Polmoni più “asciutti” corrispondono
ad impedenze più alte
L’impedenza (Z)
aumenta
Polmoni più “umidi” corrispondono
ad impedenze più basse
L’impedenza (Z)
diminuisce
Il monitoraggio dell’impedenza diventa fruibile prospetticamente perchè
il dispositivo è automaticamente in grado di riconoscere la diminuzione di
impedenza. Inoltre, tramite lo sviluppo di un algoritmo automatico (Fluid Index),
identifica situazioni pericolose di accumulo di liquidi e allerta il paziente/medico
che può adottare la strategia migliore (es. aumentare i diuretici) tenendo comunque
sempre conto del quadro clinico completo fornito da tutte le diagnostiche.
La gestione remota
La telemedicina applicata ai device impiantabili è un potente strumento che porta
vantaggi sia organizzativi che clinici, al paziente e ai medici.
Il telemonitoraggio permette infatti di sfruttare la potenzialità del dispositivo
impiantato quale strumento diagnostico presente 24 ore su 24, 7 giorni su 7,
in grado di controllare dati aritmici e clinici oggettivi, indipendentemente dal
paziente e/o dai famigliari.
Il sistema di monitoraggio a distanza CareLinkTM di Medtronic
il medico stabilisce le date
dei controlli mediante
sito web
il device “scarica” automaticamente i dati
mediante modem su un sito web protetto,
senza intervento da parte del paziente.
Se il dispositivo rileva un potenziale problema
sul funzionamento dello stesso o di natura
fisiologica, può trasmettere automaticamente
alert personalizzabili ai medici (sms, e-mail)
Il medico visiona ed
analizza i dati su Pc tramite
internet, sul Medtronic
CareLink WebSite
Tra i principali benefici per il paziente c’è :
•
il la possibilità di effettuare comodamente i follow-up di routine direttamente
dalla propria casa;
•
il paziente può trasmettere i dati mentre è in viaggio;
•
iI paziente e i suoi familiari possono vivere nella tranquillità di essere sempre
connessi con il proprio ospedale.
I benefici del personale medico si traducono in:
•
una maggiore attenzione verso il paziente con cui si mantiene un contatto
continuo, con una maggior compliance e soddisfazione da parte dello stesso;
•
i dati del device e le diagnostiche sono sempre disponibili;
•
una notevole riduzione dei tempi dei controlli di routine.
Ma il controllo remoto dei device permette soprattutto di ottenere dei vantaggi
clinici. Grazie ai dati (diagnostiche) sempre accessibili e agli allarmi è possibile
prevenire gli eventi acuti e verificare l’appropriatezza delle terapie in atto; i dati
possono essere condivisi in ogni momento ed ovunque tra l’elettrofisiologo,
che verifica il corretto funzionamento del dispositivo, e l’eventuale cardiologo
che gestisce clinicamente il paziente. Per aver accesso ai dati è infatti sufficiente
connettersi da qualsiasi computer con un accesso ad internet standard.
CASO CLINICO
Vediamo un esempio di un paziente con dispositivo CRT con ultimo
controllo ambulatoriale effettuato
a inizio anno:
1
(fine aprile) L’innesco della FA
coincide con l’inizio dell’aumento
dell’indice dei fluidi ed è causa di
FV elevata e di riduzione della % di
stimolazione biventricolare
2
(metà luglio) In un dispositi-
vo comune senza monitoraggio
dell’impedenza e con follow-up
semestrale programmato si ha
una visione retrospettiva e interpretativa dei dati: il paziente può
gia essere in fase acuta
3 (inizio maggio) In un dispositivo
dotato di monitoraggio dell’impedenza (OptivolTM con allarmi e monitoraggio remoto si ha una visione prospettica per la prevenzione
di episodi acuti.
Si possono adottare variazioni terapeutiche con molte settimane di
anticipo.
13
2
Appendice A
Algoritmo di scelta del tipo Pacemaker
Pazienti con Blocco Atrioventricolare
BLOCCO AV
Fibrillazione Atriale Cronica,
impossibilità di riportare a ritmo
NO
Sì
Necessità
di sincronia
NO
Necessità di
rate response
Sì
NO
Necessità di
rate response
NO
PM VVI
Sì
PM VVI
PM VVI-R
Sì
PM VVI-R
Necessità
di pacing atriale
NO
PM VDD
(monocamerale)
Sì
Necessità di
rate response
NO
PM DDD
Sì
PM DDD-R
Epstein A, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac
Rhythm Abnormalities J Am Coll Cardiol 2008
Algoritmo di scelta del tipo Pacemaker
Pazienti con disfunzione del Nodo del Seno
Disfunzione Nodo
del Seno
Conduzione AV compromessa o
possibilità di sviluppare blocchi AV
NO
Sì
Necessità di
rate response
NO
PM AAI
Necessità
di sincronia
Sì
PM AAI-R
NO
Necessità di
rate response
NO
PM VVI
Sì
PM VVI-R
Sì
Necessità di
rate response
NO
PM DDD
Sì
PM DDD-R
Epstein A, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac
Rhythm Abnormalities J Am Coll Cardiol 2008
Appendice B
Algoritmo di selezione del candidato all’ICD
ESC Guidelines for the diagnosis and treatment of acute and chronic Heart Failure
2008. Dickstein et al. Eur Heart J. 2008
Algoritmo di selezione del candidato alla CRT
ESC Guidelines for the diagnosis and treatment of acute and chronic Heart Failure
2008. Dickstein et al. Eur Heart J. 2008
Riferimenti bibliografici
Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, et al Sudden Cardiac Death in Heart
Failure Trial (SCD-HeFT) Investigators.
Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure.
N Engl J Med. 2005 Jan 20;352(3):225-37.
Moss AJ, Zareba W, Hall WJ, et al Prophylactic implantation of a defibrillator in
patients with myocardial infarction and reduced ejection fraction.
N Engl J Med 2002; 346: 877-83.
Sweeney MO, Hellkamp AS, Ellenbogen KA, et al. Adverse effect of ventricular
pacing on heart failure and atrial fibrillation among patients with normal baseline
QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction.
Circulation 2003, 107: 2932-2937.
M Lunati, MG Bongiorni, G Boriani, R Cappato, D Corrado, A Curnis, M Di Biase, S
Favale, L Padeletti, R Pedretti, A Proclemer, R Ricci, M Santini, P Spirito, G Vergara
Linee Guida all’impianto di pacemaker, dispositivi per la resincronizzazione
cardiaca (CRT) e defibrillatori automatici impiantabili (ICD)
GIAC, Volume 8, Numero 4, Dicembre 2005
Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, et al. for the
Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure
(COMPANION) investigators.
Cardiac-resynchronization therapy with or without an implantable defibrillator in
advanced chronic heart failure.
N Engl J Med 2004; 350: 2140-50.
Cleland JG, Daubert JC, Erdmann E, et al.:
The effect of cardiac resynchronization on morbidity and mortality in heart failure.
N Engl J Med 2005;352:1539-49.
Gasparini M, Auricchio A, Regoli F, et al Four-Year Efficacy of Cardiac Resynchronization
Therapy on Exercise
Tolerance and Disease Progression
J Am Coll Cardiol 2006;48:734–43
Lisa J. Anderson, Chinami Miyazaki, George R. Sutherland and Jae K. Oh Patient
Selection and Echocardiographic Assessment of Dyssynchrony in Cardiac
Resynchronization Therapy
Circulation 2008;117;2009-2023
ESC Guidelines for the diagnosis and treatment of acute and chronic Heart Failure
2008. Dickstein et al. Eur Heart J. 2008
www.medtronic.com
www.medtronicconnect.com
www.scompenso-cardiaco.com
Supporto Tecnico-applicativo DIRECTO